Анализ арг-х протеолиза и его ингибирования в негистоновых и гистоновых белках супрамолекулярных структур клеточных ядер растений
Иллюстрации
Показать всеИзобретение относится к области биохимии и молекулярной биологии и может быть применено в разработках и построении компьютерных моделей организации генных и эпигенных сетей управления. Для анализа Арг-Х протеолиза и его ингибирования в негистоновых и гистоновых белках супрамолекулярных структур клеточных ядер растений отделяют зародыши от эндосперма в определенные интервалы времени от начала замачивания. Зародыши консервируют. Экстрагируют ядерные фракции и из ядерных фракций выделяют гистоновые и негистоновые белки с помощью ионообменной хроматографии с амберлитом ИРЦ-50 в прерывистом градиенте гуанидин гидрохлорида. В белках определяют сайты Арг-х протеазо- и ингибитор-трипсиновой активности. 4 ил.
Реферат
Изобретение относится к биохимии и молекулярной биологии эукариотической клетки и может быть применено к анализу молекулярно-генетических механизмов формирования структур клеточного ядра и роли белковых компонентов в их организации, что необходимо для получения дополнительной информации в разработках и построении компьютерных моделей организации генных и эпигенных сетей управления.
Известен способ получения ядерных фракций, обладающих протеиназной и ингибирующей активностью [1], в котором в супраструктурах клеточных ядер растений были определены протеолитическая и ингибиторная активности. Недостатком этого способа является, то что анализ осуществлялся в суммарных фракциях белков, без разделения их на гистоновые и негистоновые белки с помощью ионообменной хроматографии на амберлите ИРЦ-50.
Известен способ препаративного выделения основных белков клеточных ядер растений [2], в котором был описан способ фракционирования гистонов с помощью ионообменной хроматографии на колонке с амберлитом ИРЦ-50. Недостатком способа является то, что в полученных ядерных фракциях не были определены сайты Арг-Х протеиназо- и ингибитор-трипсиновой активности.
Вышеуказанный способ препаративного выделения основных белков клеточных ядер [2] был принят за основу, в котором первоначально в определенные интервалы времени от начала замачивания 0 ч, 3 ч, 6 ч, 9 ч, 12 ч, 15 ч, 18 ч, 21 ч проводят отделение зародышей от эндосперма с последующей консервацией зародышей в забуференном 80-90% глицерине при минус 25°C, выделяют клеточные ядра, проводят экстракцию ядерных фракций возрастающими концентрациями 0,14 М, 0,35 М, 2 М хлористого натрия и 6 М гуанидингидрохлорида с 0,1% (β-меркаптоэтанолом и выделяют из вышеперечисленных фракций основные белки с помощью ионообменной хроматографии с амберлитом ИРЦ-50 в прерывистом градиенте гуанидингидрохлорида: 6%, 8,9%, 10,6%, 13%, 40% на 0,1 М калий-фосфатном буфере, pH 6,8.
Цель изобретения - предлагается способ получения негистоновых и гистоновых белков с сайтами Арг-Х протеазо- и ингибитор-трипсиновой активности из супрамолекулярных структур клеточных ядер растений.
Указанная цель достигается тем, что в способе получения негистоновых и гистоновых белков с сайтами Арг-Х протеазо- и ингибитор-трипсиновой активности из супрамолекулярных структур клеточных ядер растений первоначально в определенные интервалы времени от начала замачивания 0 ч, 3 ч, 6 ч, 9 ч, 12 ч, 15 ч, 18 ч, 21 ч проводят отделение зародышей от эндосперма с последующей консервацией зародышей в забуференном 80-90% глицерине при минус 25°C, выделяют клеточные ядра, проводят экстракцию ядерных фракций возрастающими концентрациями 0,14 М, 0,35 М, 2 М хлористого натрия и 6 М гуанидингидрохлорида с 0,1% β-меркаптоэтанолом, выделяют из вышеперечисленных фракций гистоновые и негистоновые белки с помощью ионообменной хроматографии с амберлитом ИРЦ-50 в прерывистом градиенте гуанидингидрохлорида: 6%, 8,9%, 10,6%, 13%, 40% на 0,1 М калий-фосфатном буфере, pH 6,8, и определяют в них сайты Арг-х протеазо- и ингибитор- трипсиновой активности.
Изобретение иллюстрируется следующим примером.
Пример. Опыты проводили на элитных семенах пшеницы (Triticum aestivum L.) сортов Артемовка, Мироновская 808 и Мироновская яровая (любезно присланных нам из коллекции ГНУ Всероссийского научно-исследовательского института растениеводства им. Н.И.Вавилова). Проращивание зародышей осуществляли в темноте при 22±1°C. В определенные интервалы времени - 0 ч (воздушно-сухое семя) и от начала замачивания семян: 3 ч, 6 ч, 9 ч, 12 ч, 15 ч, 18 ч, 21 ч проводили отделение зародышей от эндосперма. Клеточные ядра выделяли по методу [3]. Надмолекулярные структуры: нуклеоплазму (Нп), хроматин, непрочно-(Хр-I) и прочно-(Хр-II) связанный с ядерным матриксом (ЯМ), а также ЯМ выделяли из очищенных клеточных ядер соответственно при повышении ионной силы раствора: 0,14 М NaCl, 0,35 М NaCl, 2 М NaCl в 0,01 М трис-HCl буфере, pH 6,8. ЯМ извлекали 6 М гуанидингидрохлоридом (Gu·HCl) с 0,004%-ным (β-меркаптоэтанолом в том же буфере. Количество белка в ядрах и ядерных фракциях определяли методом Бредфорда в нашей модификации [1]. Полученные супраструктуры клеточных ядер пропускали через колонку с амберлитом ИРЦ-50 (полиментакриловая синтетическая смола со свободными карбоксильными группами). Смола использовалась в виде порошка, получаемого при размалывании в шаровой мельнице. Размельченная смола просеивалась через сито 200 меш, после чего многократно промывалась водой для удаления мельчайших частиц, высушивалась и промывалась ацетоном. Для достижения большей хроматографической эффективности проводили циклизацию. К 100 г смолы добавляли 500 мл 4 н. NaOH, перемешивали в течение 3 ч с последующим отмыванием на фильтре водой до нейтральной реакции и переводили в кислую форму, пропуская через нее 500 мл 4 М HCl, избыток HCl удаляли промыванием водой. Этой смолой заполняли колонку размером 0,4×4,5 см. На колонку наносили белок в количестве 20-50 мкг, растворенный в 6% гуанидингидрохлориде на 0,1 М калий-фосфатном буфере, pH 6,8. Скорость элюции составляла 6 мл/ч. Препаративное отделение основных белков протеома клеточных ядер проводили в прерывистом градиенте гуанидин гидрохлорида: 6%, 8,9%, 10,6%, 13%, 40% на 0,1 М калий-фосфатном буфере, pH 6,8. Описанным выше методом удалось разделить белки супраструктур клеточных ядер на 5 фракций, которые по концентрации гуанидингидрохлорида в элюате соответствуют фракциям: 0-фракция, обогащенная негистоновыми белками и белками HMG; фракция, обогащенная гистоном H1; фракция, обогащенная гистонами Н2А и Н2В; фракция, обогащенная гистонами Н3 и Н4 и наконец фракция, содержащая остатки гистонов Н3 и Н4 с примесью белков ядерного матрикса. Содержание белка в элюатах определяли методом Бредфорд в нашей модификации [1]. В полученных фракциях негистоновых и гистоновых белков клеточных ядер растений были определены сайты Арг-Х протеазо- и трипсин-ингибиторной активности. Арг-х протеазоактивность определяли по расщеплению низкомолекулярного белка протамина («Calbiochem», США) [1] (молекула которого состоит из 33 аминокислот: 22-х молекул Arg; 4-х молекул Ser; 3-х молекул Pro; по 2 молекулы Glu и Val). Активность выражали в нмоль аргинина·с-1·мг-1 белка.
Ход анализа: 0,02-0,025% раствор протаминсульфата готовили на 0,1 М фосфатном буфере, pH 7,0. К 0,5 мл ферментного раствора (в 0,1 М фосфатном буфере, pH 7,0) добавляли 0,2 мл протаминсульфата, инкубировали при 37°C в течение 20 мин. Реакцию прекращали добавлением 0,7 мл 20% ТХУ (трихлоруксусная кислота). В контрольные пробы протаминсульфат вносили после добавления ТХУ. Мерой активности фермента служило количество растворимых в ТХУ аргининсодержащих пептидов, образующихся из протаминсульфата при его расщеплении трипсином или трипсиноподобными белками клеточного ядра. После добавления холодной 20% ТХУ опытные и контрольные пробы тщательно перемешивали и центрифугировали при 1500 g в течение 15 мин. Все операции проводили при 0-4°C. К 0,5 мл прозрачного центрифугата добавляли 1,25 мл 0,04% раствора 8-оксихинолина ("Реахим") (приготовленного в день опыта путем пятикратного разведения холодной дистиллированной водой 0,2% раствора 8-оксихинолина, растворенного в 96° этаноле), затем в пробу вносили 0,25 мл 10% NaOH, перемешивали и оставляли стоять в течение 2 мин, после этого добавляли 0,05 мл NaBrO (приготовленного путем растворения 1 г брома в 100 мл 5% NaOH) и через 15 с вносили 0,25 мл 40% мочевины, еще через 40 с - 2,75 мл холодной дистиллированной воды. После 5 мин стояния определяли оптическую плотность растворов при А490 (ФЭК-56 М, СССР).
С помощью калибровочной кривой значения оптической плотности при А490 переводили в количество мкмолей аргинина в пробе. В качестве стандарта для калибровочного графика использовали D,L-аргинин (Reanal, Венгрия). Протеолитическую активность рассчитывали по формуле
Обозначения в формуле:
V - объем (мл) ТХУ фильтрата, взятого для диализа;
ΔС - количество аргинина в нг (в ТХУ фильтрате);
1,4 - общий объем (мл) реакционной смеси;
Т - время инкубации (с);
V1 - объем (мл) ядерного экстракта, взятого для инкубации;
174,2 - молекулярная масса аргинина;
Б - количество белка (мг) в 1 мл ядерного экстракта.
Анализ по определению трипсин-ингибиторной активности отличался от вышеизложенного анализа по определению Arg-X протеолитической активности тем, что в инкубационную среду добавлялся 0,0002% трипсин (СПОФА, ЧССР) в объеме 0,2 мл, приготовленный на 0,1 М фосфатном буфере, pH 7,0. В связи с тем, что партии трипсина отличались по ферментативной активности, для каждой партии концентрация искомой активности трипсина (показания оптической плотности реакционной смеси должны находиться в пределах 0,02-0,05 (ФЭК-56М)) подбиралась индивидуально. Активность ингибиторов трипсина выражали в нмоль аргинина·с-1·мг-1 белка. Определение активности ингибиторов трипсина рассчитывали по формуле
ΔСк - нг аргинина, образующегося при инкубации (в течение 20 мин при 37°C) протаминсульфата и трипсина; нг аргинина находили по калибровочной кривой;
ΔСо - нг аргинина, образующегося при инкубации (в течение 20 мин при 37°C) протаминсульфата, трипсина и ингибитора ядерной фракции трипсина, последний получен из ядерного экстракта; нг аргинина находили по калибровочной кривой;
V - объем (мл) реакционной смеси;
V1 - объем (мл) ТХУ фильтрата, взятого для анализа;
Т - время инкубации в с;
V2 - объем (мл) ядерного экстракта;
174,2 - молекулярная масса аргинина;
Б - количество белка (мг) в 1 мл ядерного экстракта.
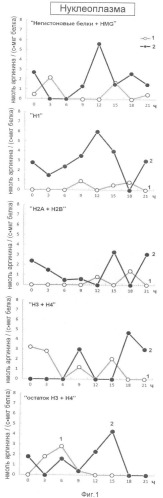
Эффективность последовательной ступенчатой экстракции гистоновых и негистоновых белков из нуклеоплазмы, обладающих Арг-Х протеазо- и ингибитор-трипсиновой активностью показана на фиг.1. На оси ординат показана активность протеаз (1) и ингибиторов трипсина (2) выраженная в нмоль аргинина на 1 мг белка/с. На оси абсцисс показано время прорастания зародышей пшеницы.
На фиг.2 представлена эффективность последовательной ступенчатой экстракции гистоновых и негистоновых белков из хроматина, непрочно связанного с ядерным матриксом (Хроматин-I), обладающих Арг-Х протеазо- и ингибитор-трипсиновой активностью. На оси ординат показана активность протеаз (1) и ингибиторов трипсина (2) выраженная в нмоль аргинина на 1 мг белка/с. На оси абсцисс показано время прорастания зародышей пшеницы.
На фиг.3 представлена эффективность последовательной ступенчатой экстракции гистоновых и негистоновых белков из хроматина прочно связанного с ядерным матриксом (Хроматин-II), обладающих Арг-Х протеазо- и ингибитор-трипсиновой активностью. На оси ординат показана активность протеаз (1) и ингибиторов трипсина (2), выраженная в нмоль аргинина на 1 мг белка/с. На оси абсцисс показано время прорастания зародышей пшеницы.
На фиг.4 представлена эффективность последовательной ступенчатой экстракции гистоновых и негистоновых белков из ядерного матрикса (ЯМ), обладающих Арг-Х протеазо- и ингибитор-трипсиновой активностью. На оси ординат показана активность протеаз (1) и ингибиторов трипсина (2), выраженная в нмоль аргинина на 1 мг белка/с. На оси абсцисс показано время прорастания зародышей пшеницы.
Анализ фиг.1-4 показывает, что в период перехода G1 в S фазу клеточного цикла активно происходят процессы Арг-Х протеолиза и его ингибирования как в негистоновых так и гистоновых белках клеточного ядра. Известно, что аргинин в составе белков активно участвует в процессах, структурирующих упаковку ДНК, особенно при модификации гуанидиновой группы. Сжатие или растяжение нуклеопротеидных супраструктур клеточного ядра способно экранировать гидрофобные или гидрофильные поверхности белка для межмолекулярных взаимодействий и тем самым влиять на плотность упаковки ДНК и ее транскрипционную активность.
Данное изобретение рекомендуется для анализа молекулярно-генетических механизмов происходящих на разных уровнях пространственно-временной реорганизации интерфазного хроматина, которая способна выполнять важную роль в функционировании эпигенетических механизмов, работающих не на уровне триплетного кода ДНК, а на уровне N-концевых аргининовых и лизиновых участков, выступающих из нуклеосомной глобулы.
Источники информации
1. Иванова Э.А., Вафина Г.Х. Способ получения ядерных фракций, обладающих протеиназной и ингибирующей активностью. Авторское свидетельство №1733471 // БИ 1992. Т.18, С.96.
2. Иванова Э.А.. Вафина Г.Х. Способ препаративного выделения основных белков из супраструктур клеточных ядер растений. Патент №2408602 // Опубликовано 10.01.2011. Бюл. №1.
3. Иванова Э.А., Вафина Г.Х. Способ выделения растительных клеточных ядер. Авторское свидетельство 1701747 // БИ №48. 1991. С.98.
Способ анализа Арг-Х протеолиза и его ингибирования в негистоновых и гистоновых белках супрамолекулярных структур клеточных ядер растений, в котором первоначально в определенные интервалы времени от начала замачивания 0 ч, 3 ч, 6 ч, 9 ч, 12 ч, 15 ч, 18 ч, 21 ч проводят отделение зародышей от эндосперма с последующей консервацией зародышей в забуференном 80-90%-ном глицерине при минус 25°C, выделяют клеточные ядра, проводят экстракцию ядерных фракций возрастающими концентрациями 0,14 М, 0,35 М, 2 М хлористого натрия и 6 М гуанидин гидрохлорида с 0,1%-ным β-меркаптоэтанолом, выделяют из вышеперечисленных фракций гистоновые и негистоновые белки с помощью ионообменной хроматографии с амберлитом ИРЦ-50 в прерывистом градиенте гуанидин гидрохлорида: 6%, 8,9%, 10,6%, 13%, 40% на 0,1 М калий-фосфатном буфере pH 6,8 и определяют в них сайты Арг-х протеазо- и ингибитор-трипсиновой активности.