Химерные пептидные молекулы с противовирусными свойствами в отношении вирусов семейства flaviviridae
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, генной инженерии и вирусологии. Описаны химерные пептиды, способные ингибировать или аттенуировать вирусную инфекцию. Пептиды содержат первичную структуру, которая содержит, по меньшей мере, один сегмент, который замедляет активацию протеазы NS3 вируса семейства Flaviviridae, и сегмент, проникающий в клетку. Также раскрыта фармацевтическая композиция, содержащая такие химерные пептиды. Изобретение может быть использовано в медицине. 2 н. и 3 з.п. ф-лы, 6 ил., 3 табл., 4 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к фармацевтической промышленности, а именно к химерным пептидам, первичная структура которых содержит по меньшей мере сегмент, который ингибирует протеазу NS3 вируса семейства Flaviviridae, они также включают в себя сегмент, проникающий в клетку, и они способны ингибировать или ослаблять вирусную инфекцию. Изобретение также относится к фармацевтическим соединениям, которые содержат химерные пептиды, для профилактики и/или лечения инфекции, вызываемой вирусами семейства Flaviviridae.
Описательная часть
Семейство Flaviviridae составлено оболочечными позитивными одноцепочечными РНК-содержащими вирусами, которые принадлежат к одному из трех родов: Flavivirus, Hepacivirus и Pestivirus. Род Flavivirus включает в себя более 70 вирусов, многие из них вызывают серьезные заболевания у людей и у других видов. В этот род входят вирус желтой лихорадки (YFV), вирус денге (DV), вирус японского энцефалита (JEV), вирус клещевого энцефалита (TBE), вирус Западного Нила (WNV), вирус энцефалита Сент-Луис (SLEV) и другие. Вирус гепатита C (HCV) является прототипом Hepacivirus. К членам рода Pestivirus авторы относят вирус бычьей вирусной диареи (BVDV), вирус классической лихорадки свиней (CSFV), вирус пограничной болезни (BDV) и другие.
Вирусы, относящиеся к другим родам семейства Flaviviridae, не проявляют перекрестную антигенную реактивность и показывают другие биологические свойства, однако они демонстрируют очевидные сходства в таких аспектах, как морфология вириона, организация генома и стратегия репликации (Leyssen, P., De Clercq, E., Neyts, J. 2000 Perspectives for the treatment of infections with Flaviviridae. Clin Microbiol Rev., 3: 67-82; Rice, C. M. 1996. Flaviviridae: the viruses and their replication, p. 931-960. In B. N. Fields, D. M. Knipe, and P. M. Howley (ed.), Fields virology, 3 rd ed., vol. 1. Lippincott-Raven Publishers, Philadelphia, Pa.; Westaway, E. G. 1987. Flavivirus replication strategy. Adv. Virus Res. 33: 45-90).
HCV представляет важную проблему для здравоохранения во всем мире. Согласно данным ВОЗ, приблизительно 3% населения земного шара инфицированы вирусом, что свидетельствует о том, что более 170 миллионов хронических носителей имеют риск развития цирроза и/или рака печени (Consensus Panel. EASL International Consensus Conference on Hepatitis C, Paris, 26-28 февраля 1999 года, Consensus Statement. J. Hepatol., 1999, 30, 956). Каждый год в мире отмечается приблизительно 3-4 миллиона новых случаев инфицирования HCV (Tan, S. L., Pause, A., Shi, Y. & Sonenberg, N. (2002) Nat. Rev. Drug Discov. 1,867-881). Не менее чем у 85% инфицированных пациентов развивается хроническая инфекция (Alter, M. J., E. E. Mast, L. A. Moyer, and H. S. Margolis. 1998. Hepatitis C. Infect. Dis. Clin. North Am. 12: 13-26). Хронический гепатит C часто заканчивается циррозом и/или раком, несмотря на то, имеет ли заболевание симптоматику или является бессимптомным. Катамнестические исследования, проводившиеся в течение 10-20 лет, показали развитие цирроза у 20-30% пациентов, и у 1-5% этих пациентов мог развиться рак в последующие 10 лет (Dutta, U., J. Kench, K. Byth, M. H. Khan, R. Lin, C. Liddle, and G. C.Farrell. 1998. Hepatocellular proliferation and development of hepatocellular carcinoma: a case-control study in chronic hepatitis C. Hum. Pathol. 29: 1279-1284; Pontisso, P., C. Belluco, R. Bertorelle, L. De Moliner, L. Chieco Bianchi, D. Nitti, M. Use, and A. Alberti. 1998. Hepatitis C virus infection associated with human hepatocellular carcinoma: lack of correlation with p53 abnormalities in Caucasian patients. Cancer 83: 1489-1494). Установлено, что число смертей за год, вызываемых HCV, к 2008 году может достигнуть в Соединенных Штатах 35000 (Dutta, U., J. Kench, K. Byth, M. H. Khan, R. Lin, C. Liddle, and G. C.Farrell. 1998. Hepatocellular proliferation and development of hepatocellular carcinoma: a case-control study in chronic hepatitis C. Hum. Pathol. 29: 1279-1284; Pontisso, P., C. Belluco, R. Bertorelle, L. De Moliner, L. Chieco Bianchi, D. Nitti, M. Use, and A. Alberti. 1998. Hepatitis C virus infection associated with human hepatocellular carcinoma: lack of correlation with p53 abnormalities in Caucasian patients. Cancer 83: 1489-1494).
В настоящее время, одобренными FDA способами лечения, направленными против HCV, являются монотерапия интерфероном и комбинированная терапия интерфероном и рибавирином (Dymock, B. W. Emerging Drugs 2001, 6(1), 13 и приведенные там ссылки). Недавно было одобрено применение пегилированных вариантов интерферона, которые увеличивают терапевтическую эффективность этих способов лечения, но они все еще далеки от идеала. Из-за серьезности этого заболевания, необходимы новые и более эффективные способы лечения.
Инфицирование людей Flavivirus опосредовано членистоногими, такими как клещи и москиты, которые являются причиной того, что эти заболевания так сложны для излечения (Monath, T. P., and F. X. Heinz. 1996. Flaviviruses, p. 961-1034. In B. N. Fields, D. M. Knipe, and P. M. Howley (ed.), Fields virology, 3rd ed., vol. 1. Lippincott-Raven Publishers, Philadelphia, Pa.). Neurophysiol. 106: 238-243.; Kaluzova, M., E. Eleckova, E. Zuffova, J. Pastorek, S. Kaluz, O. Kozuch, and M. Labuda. 1994. Reverted virulence of attenuated tick-borne encephalitis virus mutant is not accompanied with the changes in deduced viral envelope protein amino acid sequence. Acta Virol. 38: 133-140).
Желтая лихорадка по-прежнему является важной причиной геморрагической лихорадки, с показателями летальности до 50%, несмотря на то что вакцина уже доступна.
Вирус денге является пандемическим в тропических областях, и его появление является возрастающей проблемой для здравоохранения во всем мире. Установлено, что ежегодно отмечается приблизительно 100 миллионов случаев инфицирования вирусом лихорадки, а в эндемических областях проживают 2,5 миллиарда людей (Gubler, D.J. 1998. Clin. Microbiol. Rev. 11, 480-496.; Monath, T.P. (1994) Proc. Natl. Acad. Sci USA 91, 2395-2400). За период с 1990 по 1998 год среднее число случаев геморрагической лихорадки денге (DHF), о которых сообщалось в ВОЗ, ежегодно составляло 514139, включая 15000 смертельных случаев, хотя полагается, что реальный показатель заболеваемости в несколько раз выше. Однако ни вакцины, ни специфичные противовирусные способы лечения не являются коммерчески доступными. Комплекс вируса денге образован из четырех различных вирусов или серотипов (VD1-VD4), которые имеют генетическое и антигенное родство. DV передается человеку через москитов, главным образом Aedes aegypti. Инфекция вызывает разнообразные клинические проявления, варьирующие от бессимптомного и доброкачественного к недифференцированному лихорадочному заболеванию или более тяжелым проявлениям, таким как DHF и потенциально смертельный Денге-шок синдром (DSS). Наиболее тяжелые клинические проявления часто связаны с последовательным инфицированием двумя различными серотипами (Halstead, S.B. Neutralization and antibody-dependent enhancement of dengue viruses. Adv. Virus Res. 60: 421-67., 421-467, 2003. Hammon WMc. New haemorragic fever in children in the Philippines and Thailand. Trans Assoc Physicians 1960; 73: 140-155). Проведены эпидемиологические исследования, которые предоставили доказательства того, что последовательное инфицирование различными серотипами является фактором риска развития тяжелого заболевания (Halstead, S.B. Neutralization and antibody-dependent enhancement of dengue viruses. Adv. Virus Res. 60: 421-67., 421-467, 2003. Hammon WMc. New haemorragic fever in children in the Philippines and Thailand. Trans Assoc Physicians 1960; 73: 140-155). Объяснение этим феноменам доступно благодаря теории "антителозависимого усиления (ADE)", которая устанавливает, что это усиление инфекционности является следствием более эффективного проникновения вируса в клетку, опосредованного FC-рецептором инфицированных клеток (Halstead SB. Pathogenesis of dengue: challenges to molecular biology. Science 1988; 239: 476-481).
Другим Flavivirus является JEV, который является основной причиной вирусного энцефалита во всем мире. В Азии ежегодно встречается приблизительно 50000 случаев с высокой смертностью 30% и развитием продолжительных неврологических расстройств в 30% случаев (Kalita, J., and U. K. Misra. 1998. EEG in Japanese encephalitis: a clinicoradiological correlation. Electroencephalogr. Clin. Neurophysiol. 106: 238-243.; Kaluzova, M., E. Eleckova, E. Zuffova, J. Pastorek, S. Kaluz, O. Kozuch, and M. Labuda. 1994. Reverted virulence of attenuated tick-borne encephalitis virus mutant is not accompanied with the changes in deduced viral envelope protein amino acid sequence. Acta Virol. 38: 133-140).
Тяжелый энцефалит также вызывается другим Flavivirus, таким как TBEV, имеющим два подтипа: восточный тип с сопутствующей смертностью 20% и западный тип с 1-2% (Heinz, F. X., and C. W. Mandl. 1993. The molecular biology of tick-borne encephalitis virus. APMIS 101: 735-745.); энцефалит долины Мюррея (MVE) в Австралии (Mackenzie, J. S., and A. K. Broom. 1995. Australian X disease, Murray Valley encephalitis and the French connection. Vet. Microbiol. 46: 79-90); SLEV на западе Соединенных Штатов и WNV, который является эндемичным в Африке, Ближнем Востоке и Средиземноморье и который также вызвал недавние вспышки инфекции в Соединенных Штатах. Поскольку он появился в Соединенных Штатах в 1999 году, он распространился очень быстро, инфицировав приблизительно 15000 человек, и привел к более чем 600 смертельным случаям. Однако в настоящее время нет доступных вакцин или лекарственных средств, которые защищали бы от WNV (van der Meulen, K. M., Pensaert, M. B. and Nauwynck, H. J. (2005) West Nile virus in the vertebrate world. Arch. Virol. 150, 637-657).
Геморрагические проявления вызываются другими Flavivirus, такими как вирус омской геморрагической лихорадки (OHFV) в России, с показателем летальности в интервале от 0,5 до 3%, и вирус киасанурской лесной болезни (KFDV) в Индии (Monath, T. P., and F. X. Heinz. 1996. Flaviviruses, p. 961-1034. In B. N. Fields, D. M. Knipe, and P. M. Howley (ed.), Fields virology, 3rd ed., vol. 1. Lippincott-Raven Publishers, Philadelphia, Pa.).
Другой Flavivirus, вирус энцефаломиелита овец (LIV), инфицирует главным образом овец, хотя также сообщалось о случайных инфекциях человека (Davidson, M. M., H. Williams, and J. A. Macleod. 1991. Louping ill in man: a forgotten disease. J. Infect. 23: 241-249).
Pestivirus BVDV, CSFV и BDV вызывают серьезные заболевания у животных. У их соответствующих носителей они вызывают тяжелые повреждения, которые обычно приводят к смерти, несмотря на то что эти вирусы могут перекрещиваться с видами, вызывающими более легкие заболевания у других носителей. Часто инфекции передаются носо-ротовым или трансплацентарным путем. Последний ответственен за персистентные инфекции, которые угрожают остальной части домашнего скота (Edwards, S., P. M. Roehe, and G. Ibata. 1995. Comparative studies of border disease and closely related virus infections in experimental pigs and sheep. Br. Vet. J. 151: 181-187).
Предполагается, что члены семейства Flaviviridae совместно используют сходную стратегию репликации. Цикл вирусной репликации начинается с адгезии вируса к поверхности клетки-носителя. Показано, что в случае вируса денге, вирус связывается с гликозаминогликанами, которые могут являться начальным сайтом взаимодействия с клетками. Также показано, что вирус связывается c DC-SIGN, хотя вероятно, что роль этих молекул связана с концентрацией вируса на клеточной поверхности или с распространением вируса по вторичным сайтам репликации in vivo. После начального связывания вирус взаимодействует с высокоаффинными рецепторами и/или сорецепторами, которые опосредуют проникновение вируса в клетку с помощью эндоцитоза. В случае WNV, было установлено, что для этих целей может служить интегрин αvβ3 (Chu, J. J-H., and Ng, M.-L, 2004. Interaction of West Nile Virus with α v β 3 Integrin Mediates Virus Entry into Cells. J. Biol. Chem 279, 54533-54541). Также показано, что HCV связывается с клеточным рецептором CD81 (Pileri, P., Y. Uematsu, S. Campagnoli, G. Galli, F. Falugi, R. Petracca, A. J. Weiner, M. Houghton, D. Rosa, G. Grandi, and S. Abrignani. 1998. Binding of hepatitis C virus to CD81. Science 282: 938-941). После того как вирус локализуется во внутриклеточных пространствах, снижение уровня pH в пространстве индуцирует процесс слияния между вирусом и клеточной мембраной и этот процесс опосредуется структурными изменениями слитого белка оболочки вируса. Этот процесс приводит к опорожнению вирусного капсида в цитоплазму, куда позже высвобождается вирусная РНК.
В цитоплазме геномная РНК вируса взаимодействует посредством ее некодирующей 5' области (5'UTR) с рибосомой, приводя к трансляции вирусной уникальной открытой рамки считывания. Таким образом, синтезируется предшественник вирусного полипротеина, который в случае Flavivirus включает в себя три структурных белка (C, preM и E) и пять неструктурных белков (NS1-5). Затем этот полипротеин модифицируется со- и посттрансляционно, давая начало самостоятельным зрелым функциональным белкам вируса. РНК-зависимая РНК-полимераза вируса с соответствующими кофакторами продуцирует копии негативной-одноцепочечной РНК, которые затем используются в качестве матрицы для синтеза геномной позитивной-одноцепочечной вирусной РНК. Вирусные белки, участвующие в репликации, связаны с мембранными структурами, по-видимому, относящимися к эндоплазматическому ретикулуму (ЭР).
После того как репликация закончена, геномные ассоциаты РНК с нуклеокапсидом, незрелые вирионы почкуются в просвет ЭР (почкование происходит на мембране ЭР или родственных мембранных структурах, индуцированных вирусом), покрываясь липидной оболочкой, содержащей вирусные белки. Проходя по экзоцитозному пути, оболочечные белки гликозилируются и становятся зрелыми, приводя к результирующему высвобождению зрелых вирионов во внеклеточное пространство.
Репликация Flaviviridae требует протеазы NS3pro (локализующейся приблизительно в первых 180 остатках неструктурного белка NS3) для правильного процессинга полипротеина-предшественника, этот путь представляет собой привлекательную потенциальную мишень для разработки противовирусных лекарственных средств (Chappell, K. J., Nail, T. A., Stoermer, M. J., Fang, N. X., Tyndall, J. D., Fairlie, D. P. and Young, P. R. (2005) Site-directed mutagenesis and kinetic studies of the West Nile Virus NS3 protease identify key enzyme-substrate interactions. J. Biol. Chem. 280, 2896-2903. Shiryaev, S.A., Ratnikov, B.I., Chekanov, A.V., Sikora, S., Rozanov, D.V., Godzik,A., Wang, J., Smith, J.W., Huang, Z., Lindberg, I., Samuel, M.A., Diamond, M.S. and Alex Y. Strongin, A.Y., 2006. Cleavage targets and the D-arginine-based inhibitors of the West Nile virus NS3 processing proteinase. Biochem. J. 393, 503-511. Kolykhalov, A. A.; Mihalik, K.; Feinstone, S. M.; Rice, C. M. J. Virol. 2000, 74, 2046; Bartenschlager, R.; Lohmann, V. J. Gen. Virol. 2000, 81, 1631. Matusan, A. E., Kelley, P. G., Pryor, M. J., Whisstock, J. C., Davidson, A. D. and Wright, P. J. (2001) J. Gen. Virol. 82, 1647-1656).
В Flavivirus эта протеаза ответственна за протеолитическое расщепление в области связей NS2A/NS2B, NS2B/NS3, NS3/NS4A и NS4N/NS5, а также за внутреннее расщепление в области C, NS3 и NS4A (Chambers, T. J., Nestorowicz, A., Amberg, S. M. and Rice, C. M. (1993) Mutagenesis of the yellow fever virus NS2B protein: effects on proteolytic processing, NS2B-NS3 complex formation, and viral replication. J. Virol. 67, 6797-6807. Jan, L. R., Yang, C. S., Trent, D. W., Falgout, B. and Lai, C. J. (1995) Processing of Japanese encephalitis virus non-structural proteins: NS2B-NS3 complex and heterologous proteases. J. Gen. Virol. 76, 573-580. Lobigs, M. (1993) Flavivirus premembrane protein cleavage and spike heterodimer secretion require the function of the viral proteinase NS3. Proc. Natl. Acad. Sci. U.S.A. 90, 6218-6222. Yamshchikov, V.F. and Compans, R. W. (1994) Processing of the intracellular form of the west Nile virus capsid protein by the viral NS2B-NS3 protease: an in vitro study. J. Virol. 68, 5765-5771).
В HCV, NS3pro опосредует протеолитический процессинг вирусного полипротеина на сегменте, находящемся между белками NS2-NS5B (R. Bartenschlager, 1999, The NS3/4A proteinase of the hepatitis C virus: unravelling structure and function of an unusual enzyme and a prime target for antiviral therapy. J. Viral Hepat. 6, 165-).
Помимо центральной роли, осуществляемой протеазой NS3pro в цикле вирусной репликации, осуществляющем процессинг вирусных белков, этот белок может также осуществлять процессинг клеточных субстратов, и, следовательно, он может быть задействован в различных механизмах клеточного повреждения и патогенеза (Shiryaev, S. A., Ratnikov, B. I., Chekanov, A. V., Sikora, S., Rozanov, D. V., Godzik, A., Wang, J., Smith, J. W., Huang, Z., Lindberg, I., Samuel, M. A., Diamond, M. S. and Strongin, A. Y. (2005) The cleavage targets and the (D)-arginine-based inhibitors of the West Nile virus NS3 processing proteinase. Biochem. J. 393, 503-511).
Таким образом, показано, что протеаза NS3 из WNV продуцирует протеолитическое расщепление в нейрональном основном миелиновом белке (MBP). В отношении DV и WNV предполагалось, что NS3 задействован в индукции вирус-опосредованного апоптоза (Ramanathan, M. P., Chambes, J. A., Pankhong, P., Chattergoon, M., Attatippaholkun, W., Dang, K., Shah, N. and Weiner, D. B. (2005) Virology doi:10/1016/j. virol. 2005.08.043).
Для оптимального функционирования, протеаза NS3 должна взаимодействовать с другим вирусным белком или кофактором, белком NS2B в Flavivirus и NS4A в Hepacivirus и Pestivirus. В присутствии DV, NS2B индуцирует увеличение протеолитической активности NS3 от 3300 до 6600 раз (Yusof, R., Clum, S., Wetzel, M., Murthy, H.M. & Padmanabhan, R., 2000. J. Biol. Chem. 275, 9963-9969).
В HCV, связывание NS3 с NS4A необходимо для протеолитического расщепления в области NS3/4A, NS4A/B и NS4B/5A, и это увеличивает эффективность процессинга в области NS5A/B (Bartenschlager R, Ahlborn LL, Mows J, Jacobsen H. Kinetic and structural analyses of hepatitis C virus poly protein processing. J Virol 1994; 6: 5045-5055. Failla C, Tomei L, De Francesco R. Both NS3 and NS4A are required for proteolytic processing of hepatitis c virus nonstructural proteins. J Virol 1994; 6: 3753-3760. Lin C, Pragai BM, Grakoui A, Xu J, Rice CM. Hepatitis C virus NS3 serine proteinase: trans-cleavage requirements and processing kinetics. J Virol 1994; 6: 8147-8157. Tanji Y, Hijikata M, Satoh S, Kaneko T, Shimotohno K. Hepatitis C virus-encoded nonstructural protein NS4A has versatile functions in viral protein processing. J Virol 1995; 6: 1575-1581). Добавление фрагмента NS4A в NS3pro в 10-кратном молярном избытке увеличивает коэффициент каталитической эффективности Kcat/Km в приблизительно 40 раз (Shimizu, Y., Yamaji, K., Masuho, Y., Yokota, T., Inoue, H., Sudo, K., Satoh, S. и Shimotohno, K. 1996. Identification of the Sequence on NS4A Required for Enhanced Cleavage of the NS5A/5B Site by Hepatitis C Virus NS3 Protease. J. Virol 70, 127-132).
Кристаллические структуры NS3pro и комплекс NS3pro-NS2B из DV и комплекс, образованный NS3pro-NS2B, из WNV с пептидным ингибитором были выявлены экспериментально (Murthy, H.M., Clum, S. & Padmanabhan, R., 1999. J. Biol. Chem. 274, 5573-5580. Murthy, H.M., Judge, K., DeLucas, L. & Padmanabhan, R., 2000. J. Mol. Biol. 301, 759-767. Erbel P, Schiering N, D'Arcy A, Renatus M, Kroemer M, Lim SP, Yin Z, Keller TH, Vasudevan SG, Hommel U., 2006. Structural basis for the activation of flaviviral NS3 proteases from dengue and West Nile virus. Nat. Struct Mol. Biol.). Подобным образом, также были выявлены кристаллические структуры NS3pro и комплекс NS3pro/NS4A из HCV (Love, R.A., Parge, H.E., Wickersham, J.A., Hostomsky, Z., Habuka, N., Moomaw, E.W., Adachi, T., Hostomska, Z., 1996. The crystal structure of hepatitis C virus NS3 proteinase reveals a trypsin-like fold and a structural zinc binding site. Cell. 87, 331-342. Kim, J.L., Morgenstern, K.A., Lin, C., Fox, T., Dwyer, M.D., Landro, J.A., Chambers, S.P., Markland, W., Lepre, C.A., O'Malley, E.T., Harbeson, S.L, Rice, C.M., Murcko, M.A., Caron, P.R., Thomson, J.A., 1996. Crystal structure of the hepatitis C virus NS3 protease domain complexed with a synthetic NS4A cofactor peptide. Cell. 87, 343-535. Erratum in: Cell, 89: 159, 1997).
Протеаза NS3pro принимает подобную химотрипсину укладку цепи, которая включает в себя две бета-баррели и каталитическую триаду His51-Asp75-Ser135, локализующуюся в щели, образованной между этими доменами. Связывание белка NS2B индуцирует большие изменения в трехмерной структуре NS3pro, влияющие на оба N- и C-концевых домена и включающие изменения локализации и протяженности вторичных структурных сегментов.
Структура комплекса, образованного под воздействием активной протеазы NS3pro-NS2B с пептидным ингибитором, показывает, что NS2B образует пояс вокруг NS3pro, принимая, главным образом, удлиненную структуру и включая в себя пять бета-цепей.
Первые три цепи связаны с бета-цепями белка NS3: цепь Trp53-Ala58 (нумерация WNV) проходит антипараллельно к бета-цепи NS3, соответствуя Gly21-Met26 N-терминальной бета-барреле, а бета-цепи Glu67-Ile68 и Arg74-Asp76 параллельны бета-цепям B2a и B2b в C-концевой бета-барреле NS3.
Цепи 4 и 5 образуют бета-шпильку, которая взаимодействует со связывающим субстрат сайтом, контактирующим с петлей E1b-F1 N-терминальной бета-баррели. Упаковка NS2B ниже бета-шпильки E2b-F2 C-концевой баррели индуцирует конформационное изменение в этой области NS3, которое приводит к расположению остатков, важных для распознавания субстрата (Gly151, Gly153 и Tyr161). Остаток Tyr161 осуществляет пи-катионные взаимодействия с аргинином в положении P1. Отрицательный электростатический потенциал, связанный с карбонильными группами основных цепей остатков Asp82-Gly83, и атом Od1 Asn84 из NS2B делает благоприятным взаимодействие с положительным зарядом гуанидиновой группы аргинина в положении P2. Таким образом, они вносят свой вклад в конформацию сайта S2. Таким образом, связывание NS2B с NS3 дополняет жизненно важные элементы ферментативно-активного сайта, и это также вносит свой вклад в термодинамическую устойчивость упаковки белка. Эти факты обеспечивают структурную основу для понимания процесса активации этой протеазы. В случае HCV, активация NS3 опосредуется связыванием бета-цепи Thr20-Leu31 из NS4A, которая является структурно эквивалентной цепи 1 из NS2B у Flavivirus (Shimizu, Y,, Yamaji, K., Masuho, Y., Yokota, T., Inoue, H., Sudo, K., Satoh, S. and Shimotohno, K. 1996. Identification of the Sequence on NS4A Required for Enhanced Cleavage of the NS5A/5B Site by Hepatitis C Virus NS3 Protease. J. Virol 70, 127-132).
Среди существующих в настоящее время подходов, используемых для получения противовирусных молекул, активных в отношении Flaviviridae, подходы, основанные на ингибировании NS3, сфокусированы главным образом на разработке ингибиторов, направленных на активный сайт. По-видимому, эти подходы являются весьма многообещающими, что подтверждается недавними результатами, полученными в разработке лекарственных средств против HCV. Однако эти данные также ясно показали затруднения, характерные для этих подходов. Одним из наиболее очевидных является генерация "ускользнувших" мутантов. Полимеразы вирусов РНК имеют относительно низкую точность, и, в случае HCV, они включают мутацию в копию вирусного генома. Это приводит к факту, что молекулы, созданные с помощью этого способа, несмотря на их высокую активность, могут иметь ограниченный срок службы. Это приводит к внедрению терапевтических вмешательств, основанных на смесях лекарственных средств, ввиду потребности в противовирусных лекарственных средствах. Также установлено, что "ускользнувшие" мутанты, появившиеся в ответ на применение одного лекарственного средства, могут часто избегать противовирусной активности других лекарственных средств, нацеленных на тот же активный сайт.
В настоящем изобретении описаны новые способы, направленные на разработку антивирусных агентов против Flaviviridae, которые основаны на концепции ингибирования процесса активации протеазы NS3. Ключевой подход этой концепции состоит в разработке пептидных молекул и/или лекарственных средств, способных блокировать взаимодействие между NS3 и его кофактором (NS2B или NS4A), и, следовательно, способных препятствовать правильной упаковке активной протеазы NS3. Такие молекулы способны связываться с областями протеазы NS3, которые участвуют во взаимодействии с кофактором, и конкурируют с ним и/или стабилизируют структуру неактивной протеазы.
Преимущество настоящего изобретения состоит в том, что, как ожидается, вероятность генерации "ускользнувших" мутантов, в отношении которых активны эти молекулы, будет гораздо меньшей, по сравнению с теми ингибиторами активной протеазы, которые конкурируют с субстратом за активный сайт. Молекулы согласно настоящему изобретению связываются со связывающими сайтами NS3, которые участвуют во взаимодействиях белок-белок, необходимых для цикла вирусной репликации, поэтому мутации, генерируемые в этих областях NS3, должны иметь дополнительные компенсаторные мутации в кофакторе.
Другое преимущество состоит в высокой специфичности ингибирующей активности, проявляемой этими молекулами. Это наблюдается вследствие того, что сайты их связывания на NS3 в основном специфичны для вирусной протеазы и они не присутствуют на сериновых протеазах носителя. Кроме того, сериновые протеазы носителя имеют активные сайты, проявляющие специфичность, значительно подобную NS3, и, следовательно, они могут быть потенциальными мишенями для токсичности лекарственных средств, блокирующих активный сайт.
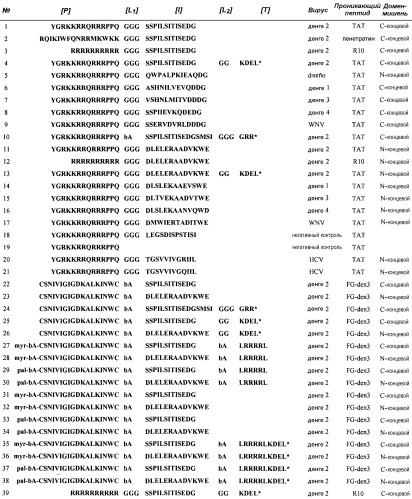
В настоящем изобретении авторы описывают химерные пептидные молекулы, которые ингибируют инфекции, вызванные Flaviviridae, и первичная структура которых может быть описана согласно следующей формуле:
[P]-[L1]-[I]-[L2]-[T] или [I]-[L3]-[P]-[L4]-[T],
где [P] является аминокислотной последовательностью "проникающего в клетку пептида", обычно из 10-30 аминокислот, которая обладает способностью допускать интернализацию целой пептидной молекулы в цитоплазму клетки и получать доступ к контактированию с гранулярной эндоплазматической сетью (ШЭР); [L1, L2, L3, L4] являются линкерными последовательностями из 0-6 остатков; [I] является последовательностью ингибитора активации NS3pro, включающей остатки, которые устанавливают контакты по меньшей мере с одной аминокислотой из бета-цепей B2a и B2b C-концевой бета-баррели или из бета-цепи A1 N-терминальной бета-баррели белка NS3pro из Flavivirus (или соответствующими структурно эквивалентными областями Pestivirus или Hepacivirus) в его активной или неактивной конформации; [T] является аминокислотной последовательностью из 0-10 остатков, которая является обычно одним или двумя сигналами задержки в ЭР (подобно последовательностям KDEL, KKXX и LRRRRL), или последовательностью XRR со способностью связывать субстрат-связывающие сайты P1 и P2 протеазы NS3pro Flavivirus.
В частности, авторы показали, что пептиды, которые были разработаны согласно настоящему изобретению, способны ингибировать вирусную инфекцию, вызываемую DV.
Катионные пептиды, проникающие в клетку
В настоящем изобретении описана разработка химерных пептидов, которые способны ингибировать вирусную инфекцию, вызванную вирусами семейства Flaviviridae. Разработанные пептиды содержат сегмент [I], который ингибирует активацию вирусной протеазы NS3pro. Однако в настоящем изобретении авторы показали, что синтетические пептиды с аминокислотными последовательностями, соответствующими сегменту [I], не способны проникать через клетки-мишени, и следовательно, они не ингибируют вирусную инфекцию в линиях клеток и in vivo. Ингибирование вирусной инфекции достигается с помощью комбинирования сегмента [I] с сегментом [P], проникающим в клетку.
Множество пептидов, полученных из некоторых белков, обладает способностью проникать в клетки и получать доступ в цитоплазму и ядро. Эти пептиды известны как проникающие в клетку пептиды или домены трансдукции белка (PTD) (Joliot, A., and Prochiantz, A. (2004) Transduction peptides: from technology to physiology. Nat. Cell Biol. 6, 189-96. Snyder, E. L., and Dowdy, S. F. (2004) Cell penetrating peptides in drug delivery. Pharm. Res. 21, 389-93. Deshayes, S., Morris, M. C., Divita, G., and Heitz, F. (2005) Cellpenetrating peptides: tools for intracellular delivery of the Papeutics. Cell. Mol. Life Sci. 62, 1839-49). К наиболее изученным PTD относятся катионные пептиды, полученные из белков, таких как фактор транскрипции ВИЧ TAT, homeobox antennapedia (пенетратин) Drosophila melanogaster и белок VP22 вируса простого герпеса. К этим пептидам раскрылся большой интерес в качестве потенциальных носителей для введения транспортируемых молекул в клетки, для усиления их биологической активности, притом что эти транспортные грузы очень разнообразны в природе как малые подобные лекарственным средствам молекулы или гены и белки. Потенциал PTD в качестве векторов для молекул с терапевтическим интересом был показан в системах клетки, а также в животных моделях (Beerens, A. M., Al Hadithy, A. F., Rots, M. G., and Haisma, H. J. (2003) Protein transduction domains and their utility in gene therapy. Curr. Gene Ther. 3, 486-94. Wadia, J. S., and Dowdy, S. F. (2003) Modulation of cellular function by TAT mediated transduction of full length proteins. Curr. Protein Pept. Sci. 4, 97-104. Wadia, J. S., and Dowdy, S. F. (2005) Transmembrane delivery of protein and peptide drugs by TAT-mediated transduction in the treatment of cancer. AdV. Drug Delivery ReV. 57, 579-96. Rudolph, C., Schillinger, U., Ortiz, A., Tabatt, K., Plank, C., Muller, R. H., and Rosenecker, J. (2004) Application of novel solid lipid nanoparticle (SLN)-gene vector formulations based on a dimeric HIV-1 TAT-peptide in vitro and in vivo. Pharm. Res. 21, 1662-9).
Проведено значительное число исследований для объяснения механизмов, с помощью которых эти пептиды могут получать доступ в цитоплазму и ядро, проходя через биологические барьеры, образованные системами клеточных мембран, такие как плазматическая мембрана, мембраны внутриклеточных пространств и ядра. Недавно было показано, что множество ранее зарегистрированных наблюдений в культурах клеток относительно клеточной локализации и проникновения в клетки PTD при низкой и физиологической температуре было обусловлено артефактами, вызванными процедурами фиксации и неспецифичным связыванием пептидов с плазматической мембраной (Richard, J. P., Melikov, K., Vives, E., Ramos, C., Verbeure, B., Gait, M. J., Chernomordik, L. V., and Lebleu, B. (2003) Cellpenetrating peptides. A reevaluation of the mechanism of cellular uptake. J. Biol. Chem. 278, 585-90. Vives, E., Richard, J. P., Rispal, C., and Lebleu, B. (2003) TAT peptide internalization: seeking the mechanism of entry. Curr. Protein Pept. Sci. 4, 125-32).
Новые результаты позволяют предположить, что важную роль в проникновении PTD в клетки играет эндоцитоз. Однако подробное и общепризнанное описание внутриклеточного транспорта этих пептидов все еще не появилось.
Изначально сообщалось, что слитые с пептидом TAT белки проникают в клетки, проходя к нейтральным кариосомам через кавеолу плазматической мембраны, но более поздние исследования показали, что нет необходимости в наличии кавеолы и проникновение пептида TAT осуществляется посредством макропиноцитоза (Ferrari, A., Pellegrini, V., Arcangeli, C., Fittipaldi, A., Giacca, M., and Beltram, F. (2003) Caveolae-mediated internalization of extracellular HIV-1 tat fusion proteins visualized in real time. Mol. Ther. 8, 284-94. Wadia, J. S., Stan, R. V., and Dowdy, S. F. (2004) Transducible TAT-HA fusogenic peptide enhances escape of TAT-fusion proteins after lipid raft macropinocytosis. Nat. Med. 10, 310-5). Согласованно с постулируемым проникновением в клетку, опосредованным эндоцитозом, PTD обнаруживались в ранних и рециркулирующих эндосомах. Однако биологическая активность, проявляемая молекулами, ассоциированными с PTD, указывает, что эти пептиды должны по меньшей мере частично выводиться из внутриклеточных пространств с помощью все еще неизвестного механизма, получая доступ в цитозоль. Сообщалось о солокализации интернализованного пептида TAT с маркером Golgi BODIPY-ceramide согласованно с недостатком его обнаружения в более поздних эндосомах и лизосомах, маркированных Lysotracker (Fischer, R., Kohler, K., Fotin-Mleczek, M., and Brock, R. 2004. A stepwise dissection of the intracellular fate of cationic cellpenetrating peptides. J. Biol. Chem. 279, 12625-35).
Эти данные позволяют предположить, что эти пептиды способны транспортироваться к Golgi непосредственно из ранних эндосом, что совместимо с потенциальным проникновением пептида в цитозоль из ЭР, которому предшествует ретроградный транспорт пептидов из Golgi. Однако в других исследованиях сообщается о солокализации пептидов в кислых поздних внутриклеточных структурах и в лизосомах. О подобных результатах сообщалось для пептида TAT, октааргинина, TAT белка и конъюгатов липосом с пептидом TAT (Al-Taei, S., Penning, N. A., Simpson, J. C., Futaki, S., Takeuchi, T., Nakase I., and Jones, A. T. 2006. Intracellular Traffic and Fate of Protein Transduction Domains HIV-1 TAT Peptide and Octaarginine. Implications for Their Utilization as Drug Delivery Vectors. Bioconjugate Chem. 17, 90-100. Fretz, M. M., Koning, G. A., Mastrobattista, E., Jiskoot, W., and Storm, G. (2004) OVCAR-3 cells internalize TAT-peptide modified liposomes by endocytosis. Biochim. Biophys. Acta 1665, 48-56. Vendeville, A., Rayne, F., Bonhoure, A., Bettache, N., Montcourrier, P., and Beaumelle, B. (2004) HIV-1 Tat enters T cells using coated pits before translocating from acidified endosomes and eliciting biological responses. Mol. Biol. Cell 15, 2347-60).
Однако возможно, что PTD способны использовать различные механизмы проникновения в клетки и внутриклеточного транспорта, в зависимости от нескольких факторов, таких как тип клетки, природа PTD, температура, транспортируемый груз и т.д.
Подробное описание изобретения
В настоящем изобретении описано два топологических варианта химерных пептидов, которые ингибируют вирусную инфекцию, вызываемую Flaviviridae:
[P]-[L1]-[I]-[L2]-[T] или [I]-[L3]-[P]-[L4]-[T].
В качестве проникающего пептида [P] предпочтительно выбирают, но не ограничивась ими, катионные пептиды со способностью переносить транспортируемые молекулы в клетки. По-возможности выбирают такие катионные пептиды, как пенетратин, полиаргинины из 7-10 остатков, такие как нонапептид R9 или декапептид R10, или пептид TAT, хотя может быть выбрана любая другая пептидная последовательность между остатками с 10 по 30, показывающая подобную способность проникновения. Эти проникающие катионные пептиды обладают способностью проникать в цитоплазму клетки посредством эндоцитоза, который может включать в себя транспорт через ЭР. Это свойство благоприятно для биологической активности таких пептидов, поскольку оно гарантирует локализацию пептида вблизи ШЭР, в месте, где осуществляется синтез и процессинг полипротеина предшественника, и определяет мишень для противовирусной активности пептида.
В альтернативном варианте, в качестве сегментов [P] могут быть использованы другие проникающие в клетку пептиды, такие как катионные дендримерические пептиды или пептиды, включающие D-аминокислоты, которые являются очень устойчивыми к протеолитическому разложению. Катионные пептиды также гарантируют хорошее биораспределение пептидов согласно настоящему изобретению in vivo, позволяя достичь их благоприятной эффективной концентрации в органах и тканях, инфицированных Flaviviridae, до более высокого уровня в сравнении с большими молекулами, такими как моноклональные антитела. Одним из примеров может служить использование пептидов, проникаемых через гематоэнцефалический барьер (BBB), для лечения инфекций Flaviviridae, вызывающих энцефалит, таких как TBE, WNV, JEV, SLEV и КВ. Молекулярный транспорт через BBB является значительной проблемой даже для малых лекарственных средств, предназначенных для лечения внутримозговых заболеваний (Temsamani, J. and Vidal, P. 2004. The use of Cell-penetrating peptides for drug delivery. Drug Discov. Today 9, 1012-1019).
Последовательность [I], ингибирующая протеазу NS3pro, обладает способностью ингибировать или модифицировать взаимодействие между белками NS3 и NS2B из Flavivirus (или между NS3 и NS4A из Hepacivirus и Pestivirus), и, таким образом, она воздействует на правильную упаковку NS3pro, что является необходимым для процесса активации протеазы. В одном варианте осуществления настоящего изобретения [I] состоит из последовательности Asp50-Glu62 белка NS2B из DV2 или его гомологичных последовательностей из другого Flavivirus. Эта последовательность включает в себя остатки, соответствующие бета-цепи 1 белка NS2B, который устанавливает контакты с остатками, расположенными в N-терминальной бета-барреле активного белка NS3pro. Таким образом, пептиды согласно топологии, описанной в настоящем изобретении, комплектуют с нативной последовательностью белка кофактора NS2B во время упаковки белка NS3pro для принятия им активной конформации. Это приводит к образованию неактивных комплексов NS3pro-пептид, поскольку полная активация требует структурных перестановок не только в N-концевом домене, но также и в бета-барреле два C-конца. Протеазная активация будет нуждаться в дополнительном связывании области Glu66-Ile86 белка NS2B с C-концевым доменом NS3pro. Кроме того, связывание сегмента [I] служит в качестве якоря для пептидов согласно настоящему изобретению к белку NS3 таким образом, чтобы N- или C-концы этих пептидов были способны изменять поверхностную топографию NS3 и препятствовать его взаимодействиям с белками вируса и/или носителя. Такие взаимодействия включают в себя распознавание субстрата и/или другие взаимодействия, относящиеся к конформации и/или функционированию вирусного комплекса репликации. Таким образом, в одном варианте осуществления настоящего изобретения сегмент [P], соответствующий первому топологическому варианту, является поли-D-аргинином, который, помимо того что обладает свойством проникать в клетку, также является ингибитором NS3pro протеазы Flavivirus (Shiryaev, S.A., Ratnikov, B.I., Chekanov, A.V., Sikora, S., Rozanov, D.V., Godzik.A., Wang, J., Smith, J.W., Huang, Z., Lindberg, I., Samuel, M.A., Diamond, M.S. and Alex Y. Strongin, A.Y., 2006. Cleavage targets and the D-arginine-based inhibitors of the West Nile virus NS3 processing proteinase. Biochem. J. 393, 503-511). Таким образом, связывание сегмента/якоря [I] с NS3pro улучшает соответствие пептидов полиArg с субстрат-связывающим сайтом протеазы, хорошо соответствуя той же цепи, закрепленной с помощью пептида (цис-ингибирование) или другой цепи (транс-ингибирование). Аналогичным образом, пептиды, ингибирующие Hepacivirus и Pestivirus, включают в себя в качестве [I] последовательности сегмент, соответствующий области Thr20-Leu31 белка NS4A (нумерация HCV), который является структурно эквивалентным бета-цепи 1 белка NS2B из Flavivirus.
Во втором варианте осуществления, который относится к Flavivirus, сегмент [I] не относится ни к какому специфичному сегменту последовательности NS2B, но заключен в последовательности пептида со способностью связывать белок NS3pro и стабилизировать N-концевую баррель в ее неактивной конформации. В этом случае последовательность пептида устанавливает контакты с сегментом, соответствующим Tyr23-Tyr33 белка NS3pro из DV2, или гомологичной областью, соответствующей другому Flavivirus. Кроме того, сегмент [I] также устанавливает стабилизирующие структурные контакты с остатками сегментов Ala1-Gly14 и Ala56-Met59 белка NS3pro. Таким образом, эти пептиды стимулируют их ингибирующий эффект, препятствуя нативной упаковке белка NS3, индуцируя путь упаковки, приводящий к неактивной конформации протеазы.
Такие [I] последовательности можно получить с помощью теоретических способов и/или экспериментальных способов, в которых используются комбинаторные библиотеки. В случае разработки с помощью теоретических способов, изобретение предполагает применение одного или различных способов компьютерного молекулярного моделирования и использование трехмерных структурных моделей белка NS3pro в его неактивной конформации. Используя способ(ы) компьютерного моделирования и пространственные координаты модели трехмерной структуры неактивного белка NS3pro, возможно моделирование основной цепи полипептида в растянутой конформации, которая образует антипараллельную бета-цепь с сегментом, соответствующим бета-цепи A1 N-терминальной бета-баррели. Кроме того, также возможно моделирование боковых цепей в цепи полипептида таким образом, что химическая идентичность этих боковых цепей и ее конформеры будут приводить к энергетически благоприятным атомным контактам. Настоящее изобретение включает в себя комбинированное исследование, с помощью компьютерных средств, последовательности и конформационного пространства пептида, ротамерного пространства боковой цепи пептида, а также протеазы и выбора наиболее благоприятных вариантов пептида согласно энергетической оценке полученных моделей, которая показывает потенциально более высокое сродство взаимодействия пептид-белок.
Координаты, соответствующие неактивным структурным моделя