Композиции и способы получения слаборастворимых в воде лекарственных средств с увеличенной стабильностью
Иллюстрации
Показать всеНастоящее изобретение представляет композиции и способы получения стабильных фармацевтических композиций доцетаксела. В одном варианте осуществления изобретение представляет фармацевтическую композицию, содержащую наночастицы доцетаксела, где доцетаксел, используемый для получения композиции, находится в безводной форме. Наночастицы имеют средний диаметр не более чем 200 нм. Композиция дополнительно включает биосовместимый полимер, представляющий собой белок-носитель, который является альбумином. Во втором варианте фармацевтическая композиция включает наночастицы доцетаксела и дополнительно содержит цитрат. Композиция применяется для получения лекарственного средства для лечеия рака. Композиции по изобретению являются физически стабильными и не проявляют признаков осаждения или выпадения в осадок в течение, по меньшей мере, 8 часов после повторного восстановления или повторной гидратации. 9 н. и 107 з.п. ф-лы, 7 ил., 6 табл., 39 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Эта заявка испрашивает приоритет предварительной заявки на патент США № 60/712865, поданной 31 августа 2005 г, предварительной заявки на патент США № 60/736962, поданной 14 ноября 2005 г, и предварительной заявки на патент США № 60/736931, поданной 14 ноября 2005 г, все из которых приведены здесь в качестве ссылки в полном объеме.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Существует постоянно увеличивающееся число получаемых фармацевтических лекарственных средств, которые являются слаборастворимыми или нерастворимыми в водных растворах. Такие лекарственные средства порождают сложные проблемы при доставке их в инъецируемой форме, такой как путем парентерального введения. Хорошо подобранная композиция должна как минимум обеспечивать терапевтически эффективное количество слаборастворимого лекарственного средства в желаемом участке абсорбции в абсорбируемой форме. Кроме того, эти композиции проявляют тенденцию к нестабильности с образованием осадка и/или осаждением, происходящим меньше чем за 24 часа после повторной гидратации или повторного восстановления.
Таксаны, в частности, два пригодных в настоящее время таксановых лекарственных средства, паклитаксел и доцетаксел, являются сильнодействующими противоопухолевыми агентами. Паклитаксел очень слабо растворим в воде (менее чем 10 мкг/мл) и в результате не может быть практически получен в водной среде для внутривенного введения. В настоящее время паклитаксел получен для внутривенного введения пациентам с раком в растворе с полиоксиэтилированным касторовым маслом (Polyoxyl 35 или Cremophor®) как исходным растворителем/поверхностно-активным веществом с высокими концентрациями этанола, используемого как вспомогательный растворитель. Одной из больших трудностей при введении паклитаксела является проявление аллергических реакций. Эти реакции, которые включают тяжелые кожные сыпи, крапивницу, прилив крови к лицу, одышку, тахикардию и другие, могут быть объяснены, по крайней мере частично, высокими концентрациями этанола и Cremophor, используемыми как растворители в композиции. Доцетаксел, аналог паклитаксела, полусинтетически получают из 10-деацетилбаккатина III, нецитотоксического предшественника, экстрагированного из хвои Taxus baccata и этерифицированного с химически синтезированной боковой цепью (Cortes и Pazdur, 1995, J. Clin. Oncol. 13(10):2643-55). Подобно паклитакселу доцетаксел очень слабо растворим в воде. В настоящее время наиболее предпочтительный растворитель/поверхностно-активное вещество, используемое для растворения доцетаксела, представляет собой полисорбат 80 (Tween 80) (Bissery с сотр. 1991. Cancer Res. 51(18):4845-52; Tomiak с сотр. 1992). Подобно Cremophor Tween часто вызывает аллергические реакции у пациентов. Далее, Tween 80 не может быть использован с устройством для доставки PVC вследствие его тенденции к обесцвечиванию диэтилгексилфталата, который является высокотоксичным.
Очистка полусинтетического паклитаксела и доцетаксела является сложной проблемой вследствие формирования ряда продуктов деградации по ходу синтетического способа. Кроме того, обнаружено, что очищенные таксаны подвергаются деградации даже в контролируемых условиях хранения. Поэтому становится ясным желание разработать стабильные формы этих молекул, которые сохраняют желаемые противоопухолевые свойства. Предшествующие попытки получения приемлемого доцетаксела были сфокусированы на способах получения тригидратированных форм доцетаксела, которые, можно полагать, имеют существенно большую стабильность, чем таковые безводного продукта. См., например, Патент США № 6022985; 6838569.
Для того чтобы добиться ожидаемых терапевтических эффектов слаборастворимых в воде агентов, таких как паклитаксел и доцетаксел, обычно необходимо, чтобы солюбилизированная форма или нанодиспергированная форма агента была введена пациенту.
Таким образом, был разработан ряд способов, которые основаны на использовании: вспомогательных растворителей; поверхностно-активных веществ; растворимых форм лекарственного средства, например солей и сольватов; химически модифицированных форм лекарственного средства, например пролекарств; растворимых комплексов полимер-лекарственное средство; специальных лекарственных носителей, таких как липосомы; и других. Действительно, использование амфифильных блок-сополимерных мицелл привлекает большое внимание в качестве потенциально эффективного лекарственного носителя, который способен солюбилизировать гидрофобное лекарственное средство в водной окружающей среде.
Проведение каждого из вышеупомянутых способов затруднено одной или несколькими специфическими проблемами. Например, проблемы способа, основанного на использовании поверхностно-активных мицелл с солюбилизацией гидрофобных лекарственных средств, состоят в том, что некоторые поверхностно-активные вещества являются относительно токсичными и осаждение гидрофобных лекарственных средств происходит при их разведении.
Ранее были разработаны основанные на фосфолипидах липосомные композиции для паклитаксела, Taxotere и других активных таксанов (Straubinger с сотр. 1993, J. Natl. Cancer Inst. Monogr. (15):69-78; Straubinger с сотр. 1994; Sharma с сотр. 1993, Cancer Res. 53(24):557-81; Sharma и Straubinger 1994, Pharm. Res. 11(6):889-96; A. Sharma с сотр. 1995, J. Pharm. Sci. 84(12):1400-4) и были изучены физические свойства этих и других таксановых композиций (Sharma и Straubinger 1994, Pharm. Res. 11(6):889-96; США Sharma с сотр. 1995, J. Pharm. Sci. 84(10):1223-30; Balasubramanian и Straubinger 1994, Biochemistry 33(30):8941-7; Balasubramanian с сотр. 1994, J. Pharm. Sci. 83(10):1470-6. Главной полезностью этих композиций является устранение токсичности, ассоциированной с Cremophor EL эксципиентом, и снижение токсичности самого таксана, как продемонстрировано на некоторых животных опухолевых моделях (Sharma с сотр. 1993, Cancer Res. 53(24):557-81; A. Sharma с сотр. 1995, J. Pharm. Sci. 84(12):1400-4; Sharma с сотр. 1996, Cancer Lett. 107(2):265-272). Это наблюдение распространяется на некоторые таксаны в дополнение к паклитакселу (A. Sharma с сотр. 1995, J. Pharm. Sci. 84(12):1400-4). В некоторых случаях противоопухолевая активность лекарственного средства оказывается немного большей в основанных на липосомах композициях (Sharma с сотр. 1993, Cancer Res. 53(24):557-81).
Эти липосомные композиции включают фосфолипиды и другие добавки в дополнение к таксану и могут храниться в высушенном состоянии. При добавлении водной фазы в смесь частицы формируются спонтанно и могут иметь форму липосом (Straubinger с сотр. 1993). Липосомы представляют собой замкнутые везикулярные структуры, состоящие из ограниченной двухслойной мембраны, окружающей водную сердцевину. Предпочтительный состав композиции (Sharma и Straubinger, 1994) содержит нейтральный (цвиттер-ионный) фосфолипид, такой как лецитин (фосфатидилхолин, 80-90% по молярному отношению) наряду с отрицательно заряженным фосфолипидом, таким как фосфатидилглицерин (10-20%). Последний предотвращает агрегацию частиц посредством электростатического отталкивания. Содержание наиболее стабильного таксана находится в диапазоне 3-4 мол.% (относительно общего содержания фосфолипида); такие липосомы могут быть физически и/или химически стабильны в течение 2 месяцев после гидратации. При большинстве условий паклитаксельные композиции, содержащие более высокие (например, 8 мол.%) концентрации лекарственного средства, являются очень нестабильными и могут осаждаться в течение нескольких минут после получения (Sharma и Straubinger, 1994).
Наибольшую озабоченность в этих композициях вызывало относительно низкое содержание таксана в допустимых стабильных композициях (3-5 мол.%), которое вызывает необходимость введения большого количества фосфолипида (5-10 г) пациентам, для того чтобы дать рассчитанную дозу лекарственного средства. Хотя людям часто дают большие количества липидов внутривенно для Полного Парентерального Питания (TPN), главной целью разработки было получение таксановых липосом, имеющих высокое содержание таксана.
Другие подходы к разработке слаборастворимого лекарственного средства для оральной или парентеральной доставки включают, например, композиции, в которых слаборастворимое лекарственное средство представляет собой эмульсию типа масло в воде, микроэмульсию или раствор мицелл, или другие мультиламеллярные переносящие частицы. Так как такие подходы могут быть предназначены для некоторых ионизируемых, а также неионизируемых гидрофобных терапевтических агентов, они не имеют преимущества в виде уникальных кислотно-щелочных химических свойств и ассоциированных растворяющих свойств ионизируемых соединений.
Лекарственные средства, которые являются нерастворимыми в воде, могут иметь достаточные преимущества при получении стабильной суспензии субмикронных частиц. Точный контроль размера частиц является важным для безопасного и эффективного применения этих композиций. Частицы должны быть менее чем семь микрон в диаметре для безопасности прохождения через капилляры без вызывания эмболии (Allen с сотр., 1987; Davis и Taube, 1978; Schroeder с сотр., 1978; Yokel с сотр., 1981, Toxocol. Lett. 9(2):165-70).
Другой подход раскрыт в Патенте США № 5118528, который раскрывает способ получения наночастиц. Способ включает стадии: 1) получение жидкой фазы вещества в растворителе или смеси растворителей, в которую могут быть добавлены один или несколько поверхностно-активных веществ; 2) получение второй жидкой фазы нерастворителя или смеси нерастворителей, нерастворитель смешивается с растворителем или смесью растворителей для вещества; 3) соединение вместе растворов (1) и (2) с перемешиванием и 4) удаление лишних растворителей с получением коллоидной суспензии наночастиц. Патент '528 раскрывает, что получают частицы вещества меньше чем 500 нм без подачи энергии. В частности, патент '528 указывает, что нежелательно использовать высокоэнергетическое оборудование, такое как ультразвуковые аппараты и гомогенизаторы.
Патент США № 4826689 раскрывает способ получения частиц однородного размера из водонерастворимых лекарственных средств или других органических соединений. Сначала приемлемое твердое органическое соединение растворяют в органическом растворителе и раствор может быть разведен в нерастворителе. Затем вливают водную осаждающую жидкость, осаждая неагрегированные частицы с существенно однородным средним диаметром. Частицы затем отделяют от органического растворителя. В зависимости от органического соединения и желаемого размера частиц параметры температуры, отношение нерастворителя к органическому растворителю, скорость вливания, скорость перемешивания и объем могут варьировать в соответствии с патентом. Патент '689 раскрывает, что этот способ формирует лекарственное средство в метастабильном состоянии, которое является термодинамически нестабильным и которое, в конечном счете, превращается в более стабильное кристаллическое состояние. Патент '689 раскрывает систему ловушки лекарственного средства в метастабильном состоянии, в котором свободная энергия сохраняется между таковой исходного лекарственного раствора и стабильной кристаллической формой. Патент '689 раскрывает применение ингибиторов кристаллизации (например, поливинилпирролидон) и поверхностно-активных агентов (например, поли(оксиэтилен-ко-оксипропилен)), делая осадок стабильным даже при выделении путем центрифугирования, мембранного фильтрования или обратимого осмоса.
Другой подход с предоставлением нерастворимых лекарственных средств для парентеральной доставки раскрыт в Патенте США № 5145684. Патент '684 раскрывает влажный размол нерастворимого лекарственного средства в присутствии поверхностного модификатора с предоставлением лекарственной частицы, имеющей в среднем эффективный размер частицы менее чем 400 нм. Патент '684 раскрывает, что поверхностный модификатор адсорбируется на поверхности лекарственной частицы в количестве, достаточном для предотвращения агломерации в большие частицы. Наночастицы нерастворимых лекарственных средств, полученные в условиях интенсивных сдвиговых усилий (например, разрушение ультразвуком, гомогенизация при высоком давлении или подобное) с биосовместимыми полимерами (например, альбумин), раскрыты, например, в Патентах США № 5916596, 6506405 и 6537579 и также в Публикации Патента США 2005/0004002 A1.
С учетом вышеупомянутого существует потребность в фармацевтических композициях, включающих слаборастворимые в воде лекарственные средства с увеличенной физической и химической стабильностью, что устраняет применение физиологически вредных растворителей и эксципиентов, и способах их получения. Желательно, чтобы такие фармацевтические композиции не деградировали, оставались стабильными в условиях хранения и оставались физически и/или химически стабильными после повторной гидратации. Также было бы желательно иметь фармацевтическую композицию, включающую безводную форму слаборастворимого в воде лекарственного средства, которая имеет увеличенную растворимость в традиционно используемых растворителях и эксципиентах, а также в растворителях и эксципиентах, которые не являются физиологически вредными. Настоящее изобретение представляет такие фармацевтические композиции и способы.
Раскрытие всех публикаций, патентов, патентных заявок и ссылки на опубликованные патентные заявки в данном описании настоящим включены в данное описание посредством ссылки во всей своей полноте.
КРАТКОЕ ИЗЛОЖЕНИЕ ИЗОБРЕТЕНИЯ
Изобретение представляет композиции и способы получения стабильных фармацевтических композиций доцетаксела. В одном варианте осуществления изобретения изобретение представляет фармацевтические композиции доцетаксела, включающие цитрат или его производные. Во втором варианте осуществления изобретения изобретение представляет фармацевтические композиции доцетаксела, включающие пирофосфат натрия. В третьем варианте осуществления изобретения изобретение представляет фармацевтические композиции доцетаксела, включающие ЭДТА или его производные. В четвертом варианте осуществления изобретения изобретение представляет фармацевтические композиции доцетаксела, включающие глюконат натрия. В пятом варианте осуществления изобретения изобретение представляет фармацевтические композиции доцетаксела, включающие цитрат и хлорид натрия. В шестом варианте осуществления изобретения изобретение представляет композицию доцетаксела, включающую поверхностно-активное вещество, где доцетаксел, используемый для получения композиции, представляет собой безводную форму перед его включением в композицию.
Соответственно, в одном аспекте изобретение представляет композиции (такие, как фармацевтические композиции), включающие слаборастворимый в воде фармацевтический агент (такой, как доцетаксел) и стабилизирующий агент, где стабильность композиции увеличивается по сравнению с таковой композиции без стабилизирующего агента. В некоторых вариантах осуществления изобретения композиции далее включают биосовместимый полимер (такой, как белки-носители, описанные в данном описании). Стабилизирующий агент включает, например, комплексообразующие агенты (такие, как цитрат, яблочная кислота, эдетат и пентетат), пирофосфат натрия и глюконат натрия.
В другом аспекте представляются различные композиции (такие, как фармацевтические композиции), включающие доцетаксел, где доцетаксел, используемый для получения композиции, представляет собой безводную форму (например, доцетаксел может быть безводным перед включением в композицию). В некоторых вариантах осуществления изобретения композиция далее включает биосовместимый полимер (такой, как белок-носитель, описанный в данном описании). В некоторых вариантах осуществления изобретения композиция далее включает стабилизирующий агент (как, например, стабилизирующие агенты, описанные в данном описании). В некоторых вариантах осуществления изобретения композиция включает биосовместимый полимер (такой, как белки-носители, описанные в данном описании), и стабилизирующий агент. В некоторых вариантах осуществления изобретение предоставляет композиции (такие, как фармацевтические композиции), включающие доцетаксел и поверхностно-активное вещество, где доцетаксел, используемый для получения композиции, представляет собой безводную форму (например, доцетаксел может быть безводным перед включением в композицию). В некоторых вариантах осуществления изобретения композиция далее включает стабилизирующий агент (такой, как стабилизирующие агенты, описанные в данном описании).
Также представляются стандартные лекарственные формы композиций, описанных в данном описании, изделия, включающие композиции согласно изобретению или стандартные лекарственные формы в приемлемой упаковке, и наборы, включающие композиции. Изобретение также предоставляет способы получения и применения этих композиций, как описано в данном описании.
Следует понимать, что один, несколько или все признаки различных вариантов осуществления изобретения, описанные в данном описании, могут быть комбинированы с формированием других вариантов осуществления по настоящему изобретению.
КРАТКОЕ ОПИСАНИЕ ФИГУР
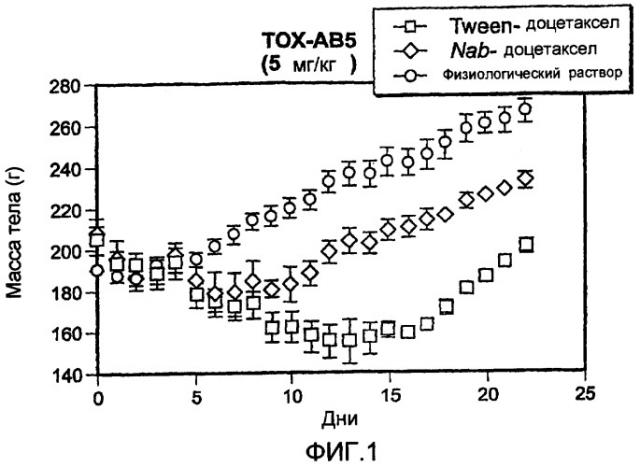
Фиг.1 показывает потерю массы тела крыс в дозе 5 мг/кг доцетаксела для композиции доцетаксела c наночастицами альбумина (Nab-доцетаксел) и Tween 80-доцетаксела (Taxotere®). Введение доз происходило в дни 0, 4 и 8.
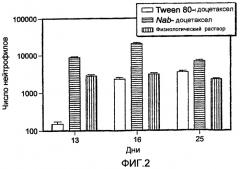
Фиг.2 показывает сравнение нейтропении у крыс в дозе 5 мг/кг для Nab-доцетаксела и Tween 80-доцетаксела(Taxotere®). Введение доз происходило в дни 0, 4 и 8.
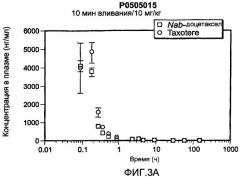
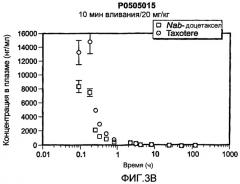
Фиг.3A-3D показывают фармакокинетическое сравнение Nab-доцетаксела и Taxotere. Фиг.3A-3C показывают концентрацию в плазме Nab-доцетаксела и Taxotere® в дозах 10 мг/кг, 20 мг/кг и 30 мг/кг соответственно. Фиг.3D показывает линейную связь между AUC (область под кривой) и дозой Nab-доцетаксела и нелинейную связь между AUC и дозой Taxotere. Nab-доцетаксел показывает линейную связь, соответствующую уравнению AUC=218*Доза; Taxotere показывает экспоненциальную кривую, соответствующую уравнению AUC=722*exp(0,10*Доза).
Фиг.4 показывает ингибирование связывания лекарственного средства с альбумином в присутствии поверхностно-активного вещества Tween 80 и Cremophor EL®/EtOH.
Фиг.5A и 5B показывают противоопухолевую активность (5A) и потерю массы тела (5B) с Nab-доцетакселом у мышей с ксентотрансплантатом H29 рака толстой кишки. Мышам вводили Nab-доцетаксел в дозе 15 мг/кг, q4dx3.
Фиг.6A и 6B показывают противоопухолевую активность (6A) и потерю массы тела (6B) у мышей с ксентотрансплантатом HCT116 рака толстой кишки, которым вводили физиологический раствор, Nab-доцетаксел (22 мг/кг) и Taxotere (15 мг/кг).
Фиг.7A и 7B показывают потерю массы тела (7A) и противоопухолевую активность (7B) у мышей с ксентотрансплантатом PC3 рака предстательной железы, которым вводили физиологический раствор, Nab-доцетаксел (10, 15, 20, 30 мг/кг) и Tween 80-доцетаксел (10 мг/кг).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение в одном из своих вариантов осуществления изобретения предоставляет композиции и способы получения доцетаксела и других слаборастворимых в воде фармацевтических агентов или лекарственных средств, которые сохраняют желательные терапевтические эффекты и остаются физически и/или химически стабильными при выдерживании в определенных условиях, таких как длительное хранение, повышенная температура или разведение для парентерального введения.
Стабильная композиция представляет собой, например, такую композицию, которая остается физически и/или химически стабильной и поэтому не проявляет признаков осаждения или выпадения в осадок в течение по меньшей мере примерно 8 часов, включая, например, по меньшей мере примерно любые из 24 часов, 48 часов или вплоть до примерно 96 часов после повторного восстановления или повторной гидратации. Например, композиции могут оставаться стабильными в течение по меньшей мере 24 часов после повторного восстановления или повторной гидратации.
Стабильность суспензии обычно (но не обязательно) оценивают в обычных условиях транспортировки и хранения в ожидании сбыта продукта (таких, как комнатная температура (такая, как 20-25°C) или в условиях охлаждения (таких, как 4°C). Например, суспензия является стабильной при температуре хранения, если она не проявляет флоккуляции или агломерации частиц, видимой невооруженным глазом или видимой под оптическим микроскопом при увеличении в 1000 раз (или другие приемлемые методики характеристики частиц) в течение примерно пятнадцати минут после получения суспензии. Стабильность может быть также оценена в особо неблагоприятных условиях температуры, влажности, света и/или других с тестированием стабильности композиций в ускоренном тестировании. Например, стабильность может быть оценена при температуре, которая выше чем примерно 40°C. Стабильность композиции также может быть оценена, например, по способности композиции оставаться суспендированной без проявления признаков оседания или расслоения или по способности композиции оставаться без изменения (то есть без видимых различий) цвета или консистенции.
Стабильность сухой (такой, как лиофилизированная) композиции может быть оценена на основе поведения жидкой суспензии, полученной из повторно восстановленной или повторно гидратированной сухой суспензии.
Целью изобретения является предоставление фармацевтических композиций, способных поддерживать физически и/или химически стабилизированные, терапевтически эффективные количества слаборастворимых в воде фармацевтических агентов. Другой целью изобретения является предоставление фармацевтических композиций, способных поддерживать физически и/или химически стабилизированные, слаборастворимые в воде фармацевтические агенты при разведении для введения пациенту. Дальнейшей целью изобретения является предоставление фармацевтических композиций, способных поддерживать физически и/или химически стабилизированные, терапевтически эффективные количества слаборастворимых в воде фармацевтических агентов с уменьшенной токсичностью. Дальнейшей целью изобретения является предоставление стабильных фармацевтических композиций с использованием безводного доцетаксела, а также композиций, полученных при использовании безводного доцетаксела.
Дальнейшей целью изобретения является предоставление усовершенствованных способов получения фармацевтических композиций, способных поддерживать физически и/или химически стабилизированные, терапевтически эффективные количества слаборастворимых в воде фармацевтических агентов. Дальнейшей целью изобретения является предоставление усовершенствованных способов получения фармацевтических композиций, способных поддерживать физически и/или химически стабилизированный слаборастворимый в воде фармацевтический агент при разведении для введения пациенту. Дальнейшей целью изобретения является предоставление усовершенствованных способов получения фармацевтических композиций, способных поддерживать физически и/или химически стабилизированные, терапевтически эффективные количества слаборастворимых в воде фармацевтических агентов с уменьшенной токсичностью.
В одном варианте осуществления изобретение представляет стерильную фармацевтическую композицию для парентерального введения, включающую слаборастворимый в воде фармацевтический агент, который физически и/или химически стабилизирован путем добавления эксципиентов в композицию. До настоящего изобретения относительная стабильность определенных слаборастворимых фармацевтических агентов ограничивалась их использованием в парентеральных фармацевтических композициях вследствие деградации в условиях хранения и/или осаждения при разведении. Множество различных фармацевтических агентов не могут быть удовлетворительно получены как парентеральные средства вследствие отсутствия стабильной композиции.
Настоящее изобретение приводит к удивительному открытию, что обычные эксципиенты, такие как цитрат, способны стабилизировать слаборастворимые в воде фармацевтические агенты, такие как доцетаксел. Поэтому первичной целью изобретения является предоставление композиций, включающих доцетаксел (и другие слаборастворимые в воде фармацевтические агенты) и эксципиенты с получением стабильных парентеральных фармацевтических композиций. Поэтому в одном варианте осуществления изобретение предоставляет фармацевтическую композицию, включающую доцетаксел и цитрат. В другом варианте осуществления изобретение предоставляет фармацевтическую композицию, включающую доцетаксел, цитрат и хлорид натрия.
Различные варианты осуществления по изобретению
Изобретение предоставляет композиции (такие, как фармацевтические композиции), включающие слаборастворимый в воде фармацевтический агент и стабилизирующий агент, где стабильность композиции увеличивается по сравнению с таковой композиции без стабилизирующего агента. Например, композиция может включать доцетаксел и стабилизирующий агент, где стабильность композиции увеличивается по сравнению с таковой композиции без стабилизирующего агента. В некоторых вариантах осуществления изобретения композиции далее включают биосовместимый полимер. В некоторых вариантах осуществления изобретения биосовместимый полимер представляет собой белок-носитель (такой, как альбумин, например человеческий сывороточный альбумин (HSA)). В некоторых вариантах осуществления изобретения стабильность композиции по меньшей мере в 1,5 раза (включая, например, по меньшей мере примерно любой из: 2х, 3х, 4х, 5х, 6х, 7х, 8х, 9х, 10х, 15х, 20х, 25х, 30х или более) больше по сравнению с таковой композиции без стабилизирующего агента. В некоторых вариантах осуществления изобретения слаборастворимый в воде фармацевтический агент является нестабильным в композиции, не включающей стабилизирующий агент.
В некоторых вариантах осуществления изобретения представляется композиция, включающая слаборастворимый в воде фармацевтический агент и стабилизирующий агент, где стабилизирующий агент представляет собой комплексообразующий агент и где стабильность композиции увеличивается по сравнению с таковой композиции без стабилизирующего агента. В некоторых вариантах осуществления изобретения представляется композиция, включающая доцетаксел и стабилизирующий агент, где стабилизирующий агент представляет собой комплексообразующий агент и где стабильность композиции увеличивается по сравнению с таковой композиции без стабилизирующего агента. В некоторых вариантах осуществления изобретения композиция далее включает биосовместимый полимер. В некоторых вариантах осуществления изобретения биосовместимый полимер представляет собой белок-носитель (такой, как альбумин, например HSA). В некоторых вариантах осуществления изобретения стабилизирующий агент представляет собой полидентат комплексообразующий агент. В некоторых вариантах осуществления изобретения стабилизирующий агент включает одну или несколько групп карбоновой кислоты. В некоторых вариантах осуществления изобретения комплексообразующий агент не является дефероксамином (то есть иной, чем дефероксамин). В некоторых вариантах осуществления изобретения комплексообразующий агент представляет собой любой из (и в некоторых вариантах осуществления изобретения выбранный из группы, состоящей из) эдетата, цитрата, яблочной кислоты, пентетата, трометамина, их производных и их смесей. В некоторых вариантах осуществления изобретения стабилизирующий агент представляет собой цитрат или его производное (такое, как цитрат натрия, и в некоторых вариантах осуществления изобретения лимонную кислоту). В некоторых вариантах осуществления изобретения композиция включает цитрат натрия и хлорид натрия. В некоторых вариантах осуществления изобретения композиция включает примерно 200 мМ цитрата и примерно 300 мМ хлорида натрия. В некоторых вариантах осуществления изобретения стабилизирующий агент представляет собой эдетат или его производное (такое, как ЭДТА).
В некоторых вариантах осуществления изобретения предоставляется композиция, включающая слаборастворимый в воде фармацевтический агент и стабилизирующий агент, где стабилизирующий агент представляет собой глюконат натрия и где стабильность композиции увеличивается по сравнению с таковой композиции без стабилизирующего агента. В некоторых вариантах осуществления изобретения представляется композиция, включающая доцетаксел и стабилизирующий агент, где стабилизирующий агент представляет собой глюконат натрия и где стабильность композиции увеличивается по сравнению с таковой композиции без стабилизирующего агента. В некоторых вариантах осуществления изобретения композиция далее включает биосовместимый полимер. В некоторых вариантах осуществления изобретения биосовместимый полимер представляет собой белок-носитель (такой, как альбумин, например HSA).
В некоторых вариантах осуществления изобретения представляется композиция, включающая слаборастворимый в воде фармацевтический агент и стабилизирующий агент, где стабилизирующий агент представляет собой пирофосфат натрия и где стабильность композиции увеличивается по сравнению с таковой композиции без стабилизирующего агента. В некоторых вариантах осуществления изобретения предоставляется композиция, включающая доцетаксел и стабилизирующий агент, где стабилизирующий агент представляет собой пирофосфат натрия и где стабильность композиции увеличивается по сравнению с таковой композиции без стабилизирующего агента. В некоторых вариантах осуществления изобретения композиция далее включает биосовместимый полимер. В некоторых вариантах осуществления изобретения биосовместимый полимер представляет собой белок-носитель (такой, как альбумин, например HSA).
В некоторых вариантах осуществления изобретения композиция включает слаборастворимый в воде фармацевтический агент, альбумин и стабилизирующий агент, где массовое отношение альбумина к слаборастворимому в воде фармацевтическому агенту в композиции составляет от примерно 0,01:1 до примерно 100:1 и где стабильность композиции увеличивается по сравнению с таковой композиции без стабилизирующего агента. В некоторых вариантах осуществления изобретения композиция включает слаборастворимый в воде фармацевтический агент, альбумин и стабилизирующий агент, где массовое отношение альбумина к слаборастворимому в воде фармацевтическому агенту в композиции составляет примерно 18:1 или менее (включая, например, любое из: от примерно 1:1 до примерно 18:1, от примерно 2:1 до примерно 15:1, от примерно 3:1 до примерно 12:1, от примерно 4:1 до примерно 10:1 и примерно 9:1) и где стабильность композиции увеличивается по сравнению с таковой композиции без стабилизирующего агента. В некоторых вариантах осуществления изобретения композиция включает доцетаксел, альбумин и стабилизирующий агент, где массовое отношение альбумина к доцетакселу в композиции составляет примерно 18:1 или менее (включая, например, любое из: от примерно 1:1 до примерно 18:1, от примерно 2:1 до примерно 15:1, от примерно 3:1 до примерно 12:1, от примерно 4:1 до примерно 10:1 и примерно 9:1) и где стабильность композиции увеличивается по сравнению с таковой композиции без стабилизирующего агента. В некоторых вариантах осуществления изобретения стабилизирующий агент представляет собой комплексообразующий агент, такой как любой из: (и в некоторых вариантах осуществления изобретения выбранный из группы, состоящей из) эдетата, цитрата, яблочной кислоты, пентетата, трометамина, их производных и их смесей. В некоторых вариантах осуществления изобретения стабилизирующий агент представляет собой цитрат или его производное (такое, как цитрат натрия). В некоторых вариантах осуществления изобретения композиция включает цитрат натрия и хлорид натрия. В некоторых вариантах осуществления изобретения стабилизирующий агент представляет собой эдетат или его производное (такое, как ЭДТА). В некоторых вариантах осуществления изобретения стабилизирующий агент представляет собой глюконат натрия. В некоторых вариантах осуществления изобретения стабилизирующий агент представляет собой пирофосфат натрия.
В некоторых вариантах осуществления изобретения белок/фармацевтический агент находится в форме(ах) частиц, которые в различных вариантах осуществления изобретения могут быть среднего диаметра, как описано в данном описании.
В некоторых вариантах осуществления изобретения композиция включает белок-ассоциированный слаборастворимый в воде фармацевтический агент и стабилизирующий агент, где стабильность композиции увеличивается по сравнению с таковой композиции без стабилизирующего агента. В некоторых вариантах осуществления изобретения композиция включает белок-ассоциированный доцетаксел и стабилизирующий агент, где стабильность композиции увеличивается по сравнению с таковой композиции без стабилизирующего агента. В некоторых вариантах осуществления изобретения стабилизирующий агент представляет собой комплексообразующий агент, такой как любой из: (и в некоторых вариантах осуществления изобретения выбранный из группы, состоящей из) эдетата, цитрата, яблочной кислоты, пентетата, трометамина, их производных и их смесей. В некоторых вариантах осуществления изобретения стабилизирующий агент представляет собой цитрат или его производное (такое, как цитрат натрия). В некоторых вариантах осуществления изобретения композиция включает цитрат натрия и хлорид натрия. В некоторых вариантах осуществления изобретения стабилизирующий агент представляет собой эдетат или его производное (такое, как ЭДТА). В некоторых вариантах осуществления изобретения стабилизирующий агент представляет собой глюконат натрия. В некоторых вариантах осуществления изобретения стабилизирующий агент представляет собой пирофосфат натрия.
В некоторых вариантах осуществления изобретения композиция включает: 1) частицы (такие, как наночастицы), включающие (в различных вариантах осуществления изобретения состоящие из или состоящие в основном из) слаборастворимый в воде фармацевтический агент и биосовместимый полимер (такой, как белок-носитель, который может быть альбумином, таким как HSA); и 2) стабилизирующий агент, где стабильность композиции увеличивается по сравнению с таковой композиции без стабилизирующего агента. В некоторых вариантах осуществления изобретения композиция включает частицы (такие, как наночастицы), включающие (в различных вариантах осуществления изобретения состоящие из или состоящие в основном из): 1) доцетаксел и биосовместимый полимер (такой, как белок-носитель, который может быть альбумином, таким как HSA); и 2) стабилизирующий агент, где стабильность композиции увеличивается по сравнению с таковой композиции без стабилизирующего агента. В некоторых вариантах осуществления изобретения доцетаксел покрыт биосовместимым полимером (таким, как белок/носитель). В некоторых вариантах осуществления изобретения стабилизирующий агент представляет собой комплексообразующий агент, такой как любой из: (и в некоторых вариантах осуществления изобретения выбранный из группы, состоящей из) эдетата, цитрата, яблочной кислоты, пентетата, трометамина, их производных и их смесей. В некоторых вариантах осуществления изобретения стабилизирующий агент представляет собой цитрат или его производное (такое, как цитрат натрия). В некоторых вариантах осуществления изобретения композиция включает цитрат натрия и хлорид натрия. В некоторых вариантах осуществления изобретения стабилизирующий агент представляет собой эдетат или его производное (такое, как ЭДТА). В некоторых вариантах осуществления изобретения стабилизирующий агент представляет собой яблочную кислоту. В некоторых вариантах осуществления изобретения стабилизирующий агент представляет собой глюконат натрия. В некоторых вариантах осуществления изобретения стабилизирующий агент представляет собой пирофосфат натрия.
В некоторых вариантах осуществления изобретения композиция включает: 1) частицы (такие, как наночастицы), включающие (в различных вариантах осуществления изобретения состоящие из или состоящие в основном из) слаборастворимый в воде фармацевтический агент и альбумин; и 2) стабилизирующий