Композиции гепарина низкой молекулярной массы и их применение
Иллюстрации
Показать всеГруппа изобретений относится к композициям гепаринов низкой молекулярной массы (LMWH). Композиции гепаринов характеризуются средневесовой молекулярной массой от 5500 до 8500 Да, анти-Xa активностью от 170 до 330 МЕ/мг, анти-IIa активностью от 130 до 190 МЕ/мг, соотношением активностей анти-Xa/анти-IIa от 2:1 до 1:1 в течение 30-120 минут после введения пациенту. С помощью данных композиций достигаются лечение и профилактика тромботических заболеваний. Композиции гепаринов обладают улучшенными свойствами, в частности, обеспечивающими клиническое преимущество: обратимостью действия в ответ на протаминсульфат, улучшенной анти-IIa активностью, относительно постоянным соотношением активностей анти-Xa/анти-IIa на протяжении определенного промежутка времени, отслеживаемым уровнем активности, биологической доступностью при подкожном введении, уменьшенной вероятностью развития индуцированной гепарином тромбоцитопении (HIT). 5 н. и 23 з.п. ф-лы, 17 ил., 20 табл., 13 пр.
Реферат
Эта заявка претендует на приоритет предварительных патентных заявок США №№ 60/809136, поданной 25 мая 2006 г., 60/849578, поданной 4 октября 2006 г., и 60/849628, поданной 5 октября 2006 г., содержание которых включено сюда в виде ссылки.
Уровень техники
Коагуляция представляет собой физиологический путь метаболизма, связанный с поддержанием нормального гемостаза у млекопитающих. В тех ситуациях, когда происходит повреждение кровеносных сосудов, метаболический путь коагуляции стимулируется и приводит к формированию сгустка крови, что предотвращает кровопотерю. Немедленно после сосудистого повреждения тромбоциты начинают скапливаться на участке такого повреждения, образуя физическую пробку, приостанавливающую утечку крови. В дополнение к этому, поврежденный сосуд сужается, что ограничивает кровотечение в участке повреждения, а в это время фибрин начинает образовывать скопления, формируя нерастворимую сетчатую структуру, покрывающую разорванный участок сосудистой сети.
Когда в метаболическом пути коагуляции нарушается равновесие, то есть происходит сдвиг в сторону избыточной коагуляции, это приводит к развитию тромботических тенденций, типичными проявлениями которых можно считать сердечные приступы, апоплексические удары, тромбоз глубоких вен и острые коронарные синдромы, такие как инфаркт миокарда и нестабильная стенокардия. Кроме того, от тромба может оторваться его фрагмент (эмбол), который, попав в легкие или головной мозг, способен вызвать эмболию, включая инсульт или кратковременный приступ ишемии. Современные способы терапевтического лечения заболеваний, связанных с дисбалансом в метаболическом пути коагуляции, сопряжены со многими рисками, то есть нуждаются в тщательном контроле.
Гепарин и гепарины низкой молекулярной массы (LMWH), сложные, сульфатированные полисахариды, выделенные из эндогенных источников, являются мощными модуляторами гемостаза. Гепарин, а также высокосульфатированный гепариноподобный гликозаминогликан (HLGAG), вырабатываемый тучными клетками, представляет собой широко используемый в клинической практике антикоагулянт, одно из первых биополимерных лекарств и одно из немногих углеводных лекарств. Гепарин и полученные из него производные молекулы представляют собой мощные антикоагулянты, которые используются в разных клинических ситуациях, особенно при тромбоэмболических заболеваниях, включая профилактику и лечение тромбоза глубоких вен, эмболию сосудов легких, артериальные тромбозы и острые коронарные синдромы, в частности инфаркт миокарда и нестабильную стенокардию. Гепарин и LMWH взаимодействуют со многими компонентами каскада коагуляции, подавляя процесс свертывания крови. Эффект гепарина реализуется, прежде всего, через два механизма, причем оба этих механизма включают связывание антитромбина III (AT-III) со специфической пентасахаридной последовательностью, HNAс/S,6SGHNS,3S,6SI2SHNS,6S, содержащейся внутри полимера. Во-первых, связывание AT-III с пентасахаридом индуцирует конформационное изменение в белке, которое опосредует подавление этим белком фактора Xa. Во-вторых, тромбин (фактор IIa) также связывается с гепарином на участке, прилегающем к сайту связывания пентасахарида с AT-III. Образование тройного комплекса между AT-III, тромбином и гепарином приводит к инактивации тромбина. В отличие от анти-Xa активности гепарина, для реализации которой требуется только сайт связывания AT-III с пентасахаридом, его анти-IIa активность, в дополнение к блоку пентасахарида, ответственному за анти-Xa активность, зависит от размера, обеспечивающего эффективное образование тройного комплекса из AT-III, тромбина и гепарина. Гепарин также опосредует высвобождение ингибитора метаболического пути тканевого фактора (TFPI) из эндотелиальных клеток. TFPI, кофактор гепарина, представляет собой сериновую протеазу, непосредственно связывающуюся с фактором X и ингибирующую его. TFPI, особенно при совместном введении с гепарином, действует как мощный антитромботик.
Хотя гепарин высокоэффективен и имеет широкий потенциал применения в самых разных клинических ситуациях, следует отметить многочисленные и разнообразные побочные эффекты, связанные с гепаринотерапией. Основное клиническое применение нефракционированного гепарина (UFH) более 65 лет заключалось в антикоагуляции. Учитывая такие факторы, как нестабильность внутривенной фармакокинетики и утрата биологической доступности гепарина при подкожном введении, UFH предпочитали вводить посредством внутривенных инъекций. В дополнение к этому, применение UFH в качестве антикоагулянта затрудняли многочисленные побочные эффекты, обусловленные неспецифическим связыванием UFH с белками плазмы.
Это привело к взрыву активности в разработке и применении гепарина низкой молекулярной массы (LMWH) в качестве эффективной альтернативы UFH. LMWH обеспечивает более предсказуемое фармакологическое действие, дает меньше побочных эффектов и обладает лучшей биологической доступностью по сравнению с UFH. Поскольку имеющиеся в продаже препараты LMWH не полностью нейтрализуются протамином, непредсказуемая реакция может сопровождаться крайне тяжелыми побочными эффектами; например, анти-Xa активность эноксапарина и других LMWH нейтрализуется приблизительно лишь на 40% дозами ≤2 мг протамина на 100 МЕ анти-Xa LMWH. Анти-IIa активность нейтрализуется приблизительно лишь на 60% дозами ≤2 мг протамина на 100 МЕ анти-Xa LMWH. (С другой стороны, анти-Xa и анти-IIa активность UFH нейтрализуется почти полностью (>90%) дозами ≤2 мг протаминсульфата на 100 МЕ анти-Xa UFH).
Фармацевтические препараты этих полисахаридов, которые обычно выделяют из слизистой оболочки кишечника свиней, разнородны по длине и составу. По существу антикоагулянтной активностью обладает лишь часть типичного препарата. В лучшем случае бóльшая часть полисахаридных цепей в фармацевтическом препарате гепарина или LMWH неактивна, а в худшем случае эти цепи неспецифически взаимодействуют с белками плазмы, вызывая побочные эффекты, связанные с гепаринотерапией. Таким образом, важно разработать новые LMWH, которые сохраняют антикоагулянтную активность и другие желательные виды активности UFH, но обладают менее выраженными побочными эффектами. LMWH, главным образом, из-за ограниченного размера их цепей и дисперсности, обладают намного меньшей способностью неспецифически связываться с белками плазмы. Однако все LMWH, доступные в настоящее время для клинического применения, также обладают сниженной анти-IIa активностью по сравнению с UFH. В связи с меньшей активностью LMWH требуется увеличивать их дозы (по сравнению с UFH) для достижения сходной анти-Xa и анти-IIa активности, причем стандартные анализы на активность UFH, на активированное частичное тромбопластиновое время (aPTT) или на активированное время свертывания крови (ACT), оказываются бесполезными, поскольку они при считывании данных основаны, прежде всего, на анти-IIa активности. Наиболее широко применяемым тестом для мониторинга уровня LMWH является тест на анти-Xa активность, который зависит от того, имеет ли обследуемый субъект достаточный уровень антитромбина III (ATIII), что бывает далеко не всегда. Этот анализ довольно дорог (значительно дороже 100 USD), а также не относится к общепринятым и широкодоступным, поскольку образцы обычно приходится посылать для анализа в специальную лабораторию. Вследствие этого применение LMWH до сих пор было в значительной степени ограничено профилактикой тромбоза, но не его лечением, кроме того, категории пациентов, которым можно вводить такие препараты, также были ограничены, исключая, среди всего прочего, детей, пациентов с нарушенной функцией почек, определяемой по таким критериям, как RFI, мочевина, креатинин, фосфор, скорость клубочковой фильтрации (GFR) или BUN (азот мочевины в крови) при исследовании крови и мочи пациентов, и контингент пациентов инвазивной (катетеризационной) кардиологии.
Сущность изобретения
Изобретение отчасти основано на разработке препаратов LMWH, имеющих и/или сконструированных с тем расчетом, чтобы иметь улучшенные свойства, например, такие свойства, которые обеспечивают клинические преимущества. Такие функциональные свойства включают, в качестве примера, одно из следующих свойств: обратимость действия в ответ на протаминсульфат, предсказуемая или иным образом улучшенная фармакокинетика, улучшенная анти-IIa активность по сравнению, например, с эноксапарином, относительно постоянное соотношение активностей анти-Xa/анти-IIa на протяжении периода приблизительно от 30 до 180 минут, отслеживаемый уровень активности, биологическая доступность при подкожном введении, а также уменьшенная вероятность развития индуцированной гепарином тромбоцитопении (HIT). Раскрытые здесь LMWH также могут обладать структурными характеристиками, которые отличают их от других поступающих в продажу LMWH. Например, предлагаемый этим изобретением препарат LMWH может обладать одним и более из следующих свойств: по существу отсутствующая область связывания, повышенное количество 3-O сульфатов по сравнению с коммерчески доступными препаратами LMWH, подгруппа цепей с несульфатированной ΔU на нередуцирующем конце, подгруппа цепей, например большинство или почти все цепи, с N-ацетилированным гексозамином на редуцирующем конце, соотношение между ΔUHNAc,6SGHNS,3S,6S и ΔU2SHNS,6SIHNAс,6SGHNS,3S,6S приблизительно от 1:1 до 4:1 (например, приблизительно 1:1, 2:1, 3:1, 4:1), а также в основном не модифицированные структуры на редуцирующем конце. Изобретение включает препараты LMWH, обладающие одним или более из указанных свойств и характеристик, а также способы получения и применения таких препаратов. Изобретение также включает способы анализа исходных материалов, технологического процесса, промежуточных и конечных продуктов при получении таких препаратов LMWH.
В соответствии с этим, в первом аспекте изобретение относится к композиции LMWH, имеющей следующие свойства:
средневесовая молекулярная масса приблизительно от 5000 до 9000 Да, например, приблизительно от 5000 до 8300 Да, приблизительно от 5500 до 8000 Да, приблизительно от 5700 до 7900 Да, приблизительно от 5800 до 6800 Да, а также анти-IIa активность приблизительно от 50 до 300 МЕ/мг, например, приблизительно от 70 до 280 МЕ/мг, приблизительно от 90 до 250 МЕ/мг, приблизительно от 100 до 250 МЕ/мг, приблизительно от 100 до 140 МЕ/мг, приблизительно от 150 до 200 МЕ/мг, приблизительно от 130 до 190 МЕ/мг или приблизительно от 155 до 195 МЕ/мг.
Во втором аспекте изобретение относится к композиции LMWH, имеющей следующие свойства:
средневесовая молекулярная масса приблизительно от 5000 до 9000 Да, например, приблизительно от 5000 до 8300 Да, приблизительно от 5000 до 8000 Да, приблизительно от 5500 до 8000 Да, приблизительно от 5700 до 7900 Да, приблизительно от 5800 до 6800 Да, а также анти-IIa активность, которая нейтрализуется протамином по меньшей мере на 50%, 60%, 70%, 80%, 85%, 90%, 95%, 99% или 100% при измерении по активированному времени свертывания крови (ACT) или активированному частичному тромбопластиновому времени (aPTT). В предпочтительном варианте анти-IIa активность LMWH нейтрализуется по меньшей мере на 50%, 60%, 70%, 80%, 85%, 90%, 95%, 99% или 100% в течение 5, 10, 15, 30 минут после введения протамина.
В третьем аспекте изобретение относится к композиции LMWH, имеющей следующие свойства:
средневесовая молекулярная масса приблизительно от 5000 до 9000 Да, например, приблизительно от 5000 до 8300 Да, приблизительно от 5500 до 8000 Да, приблизительно от 5700 до 7900 Да, приблизительно от 5800 до 6800 Да, и
ΔUHNAc,6SGHNS,3S,6S от 5 до 15%, например, от 7 до 14%, от 9 до 12% композиции при измерении в мол.%. В предпочтительном варианте ΔUHNAc,6SGHNS,3S,6S на нередуцирующем конце молекулы составляет приблизительно от 5 до 15%, например, от 7 до 14%, от 9 до 12%, цепей в композиции при измерении в мол.%.
В четвертом аспекте изобретение относится к композиции LMWH, имеющей следующие свойства:
cредняя длина цепи приблизительно от 9 до 18 дисахаридов, или от 8 до 18 дисахаридов, например, приблизительно от 9 до 16 или от 8 до 16 дисахаридов, и
ΔUHNAc,6SGHNS,3S,6S от 5 до 15%, например, от 7 до 14%, от 9 до 12% композиции при измерении в мол.%. В предпочтительном варианте ΔUHNAc,6SGHNS,3S,6S на нередуцирующем конце молекулы составляет приблизительно от 5 до 15%, например, от 7 до 14%, от 9 до 12%, цепей в композиции при измерении в мол.%.
В пятом аспекте изобретение относится к композиции LMWH, имеющей следующие свойства:
cредневесовая молекулярная масса приблизительно от 5000 до 9000 Да, например, приблизительно от 5000 до 8300 Да, приблизительно от 5500 до 8000 Да, приблизительно от 5700 до 7900 Да, приблизительно от 5800 до 6800 Да, и
cоотношение анти-Xa и анти-IIa активностей 3:1 или менее, например, 2:1, 1,6:1, 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1, 1:1 или 0,5:1.
В предпочтительном варианте соотношение анти-Xa и анти-IIa активностей остается относительно постоянным в течение всего курса введения препарата LMWH, например, отношение анти-Xa активности к анти-IIa активности варьируется в диапазоне не более чем приблизительно ±1,5, ± 1, ±0,5 или ±0,2, на протяжении отрезка времени приблизительно 30, 60, 120, 180, 240, 300 минут. Например, если начальное отношение анти-Xa активности к анти-IIa активности равно 2, то предпочтительно, чтобы при повторном измерении (например, через 30, 60, 120, 180, 240, 300 минут после начального введения препарата) оно составляло менее 3, предпочтительнее, приблизительно 2.
В седьмом аспекте изобретение относится к композиции LMWH, имеющей следующие свойства:
необязательно, средневесовая молекулярная масса приблизительно от 5000 до 9000 Да, например, приблизительно от 5000 до 8300 Да, приблизительно от 5500 до 8000 Да, приблизительно от 5700 до 7900 Да, приблизительно от 5800 до 6800 Да, и
при анализе, основанном на расщеплении гепариназой I, гепариназой II, гепариназой III с капиллярным электрофорезом, представлен каждый из пиков 1-14, указанных в таблице 10A.
В предпочтительном варианте реализации изобретения: при анализе с расщеплением гепариназой I, гепариназой II, гепариназой III с капиллярным электрофорезом количество каждого пика в композиции приблизительно соответствует данным, приведенным в таблице 10A, количество каждого пика не выходит за пределы диапазона, указанного в таблице 10A, количество пиков 10 и 11 не выходит за пределы диапазона, указанного в таблице 10A.
В восьмом аспекте изобретение относится к композиции LMWH, имеющей следующие свойства:
необязательно, средневесовая молекулярная масса приблизительно от 5000 до 9000 Да, например, приблизительно от 5000 до 8300 Да, приблизительно от 5500 до 8000 Да, приблизительно от 5700 до 7900 Да, приблизительно от 5800 до 6800 Да, а также
при анализе методом 2D ядерного магнитного резонанса (ЯМР) представлены протоны каждой из структур, указанных в таблице 11A.
В предпочтительном варианте реализации изобретения количество каждой из структур в композиции LMWH при анализе методом 2D ЯМР приблизительно соответствует указанному в таблице 11A.
В девятом аспекте изобретение относится к композиции LMWH, имеющей одно или более из следующих свойств:
композиция почти не имеет модифицированных структур на редуцирующем конце (например, свободна от таких цепей по меньшей мере на 85%, 90%, 95% или более). По меньшей мере 60%, 70%, 80%, 85%, 90%, 95%, 99% цепей композиции имеют на редуцирующем конце HNAc. Менее чем 90%, 95%, 98%, 99% цепей композиции имеют на нередуцирующем конце сульфатированную ΔU (предпочтительно, чтобы ни одна из цепей не имела такого признака). В композиции, по существу, нет областей связывания (например, менее 0,1%). Композиция имеет больше цепей с 3-O сульфатами, чем поступающие в продажу LMWH, например, эноксапарин или далтепарин. Соотношение между ΔUHNAc,6SGHNS,3S,6S и ΔU2SHNS,6SIHNAc,6SGHNS,3S,6S в композиции составляет приблизительно от 1:1 до 4:1.
В одном из вариантов реализации изобретения композиция обладает двумя, тремя, четырьмя, пятью или всеми указанными свойствами.
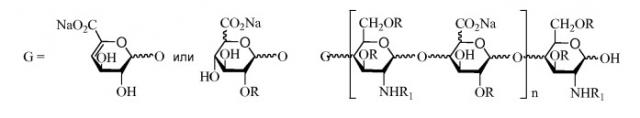
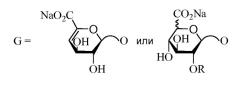
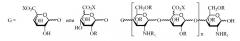
В десятом аспекте изобретение относится к композиции LMWH, имеющей следующую структуру:
где R представляет собой H или SO3X,
R1 представляет собой SO3X или COCH3,
X представляет собой моновалентный или бивалентный катион,
n = 2-50, например, 2-40, и
предпочтительно, чтобы композиция имела среднее значение n 9-16, 8-16 или 8-15.
В одном из вариантов реализации изобретения композиция LMWH имеет следующую структуру:
где
R представляет собой H или SO3X,
R1 представляет собой SO3X or COCH3,
X представляет собой моновалентный или бивалентный катион,
n = 2-50, например, 2-40, и
предпочтительно, чтобы композиция имела среднее значение n 9-16, 8-16 или 8-15.
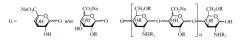
В одиннадцатом аспекте изобретение относится к композиции LMWH, имеющей следующую структуру:
где X представляет собой Na или Ca, R представляет собой H или SO3Na,
R1 представляет собой SO3Na или COCH3,
n = 2-45, например, 2-35, и
предпочтительно, чтобы композиция имела среднее значение n 7-11 или 8-12.
В одном из вариантов реализации изобретения композиция LMWH имеет следующую структуру:
где
X представляет собой Na или Ca, R представляет собой H или SO3Na,
R1 представляет собой SO3Na или COCH3,
n = 2-45, например, 2-35, и
предпочтительно, чтобы композиция имела среднее значение n 7-11 или 8-12.
Такая композиция может представлять собой промежуточный продукт для получения LMWH, например продукт ферментативного расщепления фракции с высокой подвижностью (как это обсуждается здесь).
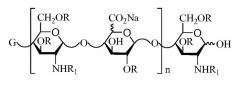
В двенадцатом аспекте изобретение относится к композиции LMWH, имеющей следующую структуру:
где X представляет собой Na или Ca, R представляет собой H или SO3Na,
R1 представляет собой SO3Na или COCH3,
n = 2-50, например, 2-40, и
предпочтительно, чтобы композиция имела среднее значение n от 8 до 15, например, от 10 до 15, либо от 9 до 16, например, от 11 до 16.
В одном из вариантов реализации изобретения композиция LMWH имеет следующую структуру:
где X представляет собой Na или Ca, R представляет собой H или SO3Na,
R1 представляет собой SO3Na или COCH3,
n = 2-50, например, 2-40, и
предпочтительно, чтобы композиция имела среднее значение n от 8 до 15, например, от 10 до 15, либо от 9 до 16, например, от 11 до 16.
Такая композиция может представлять собой промежуточный продукт для получения LMWH, например продукт выпадения в осадок фракции с высокой подвижностью (как это обсуждается здесь).
Любые из описанных здесь LMWH, например, те, что были описаны выше, также могут обладать другими свойствами. Например, какая-либо из описанных выше композиций может дополнительно обладать одним и более функциональных или структурных свойств, которые будут изложены ниже.
Например, в одном из вариантов реализации изобретения композиция LMWH имеет анти-Xa активность приблизительно от 100 до 400 МЕ/мг, например, приблизительно от 120 до 380 МЕ/мг, от 150 до 350 МЕ/мг, от 170 до 330 МЕ/мг, от 180 до 300 МЕ/мг, от 150 до 200 МЕ/мг, от 200 до 300 МЕ/мг, от 130 до 220 МЕ/мг или от 225 до 274 МЕ/мг.
В одном из вариантов реализации изобретения композиция LMWH имеет анти-Xa активность, которая нейтрализуется по меньшей мере на 50%, 60%, 70%, 80%, 85%, 90%, 95%, 99%, 100%, например, при измерении анти-Xa активности по ACT или aPTT. В предпочтительном варианте анти-Xa активность нейтрализуется по меньшей мере на 50%, 60%, 70%, 80%, 85%, 90%, 95%, 99% или 100% в течение 5, 10, 15 минут после введения протамина. Например, анти-Xa активность может быть нейтрализована по меньшей мере на 50%, 60%, 70%, 80%, 85%, 90%, 95%, 99% или 100% в течение 5, 10, 15, 30 минут после выведения протамина, если доза композиции LMWH составляла приблизительно 1, 2, 3 мг на 100 анти-Xa МЕ плазмы.
В другом варианте реализации изобретения композиция LMWH обладает одним или более из следующих свойств: активность композиции можно отслеживать по таким критериям, как aPTT и/или ACT. Полидисперсность композиции составляет менее 1,6, например, приблизительно от 1,6 до 1,1, от 1,5 до 1,1, от 1,4 до 1,1, от 1,3 до 1,1, от 1,2 до 1,1. Менее чем 70%, 60%, 50%, 45%, 40%, 35% или 30% цепей, представленных в композиции, имеют молекулярную массу более 7500 или 8000 Да. Менее чем 40%, 35%, 30%, 25% цепей, представленных в композиции, имеют молекулярную массу менее 5500 или 5000 Да. Композиция включает смесь структур ΔU и I/G на нередуцирующих концах цепей. Сайты связывания с PF4 имеют меньшее число цепей по сравнению с эноксапарином, далтепарином, UFH.
В одном из вариантов реализации изобретения приблизительно 15%, 20%, 25%, 30%, 35%, 45%, 50% цепей в композиции LMWH имеют ΔU на нередуцирующем конце. Предпочтительно, чтобы ΔU на нередуцирующем конце имели приблизительно от 15% до 50% цепей, например, от 15% до 35% или от 20% до 35% цепей.
В одном из вариантов реализации изобретения композиция LMWH имеет более высокую степень сульфатирования по сравнению с эноксапарином и далтепарином. В одном из вариантов реализации изобретения композиция LMWH имеет в своем составе больше трисульфатированных дисахаридов по сравнению с эноксапарином или далтепарином, например, композиция LMWH имеет приблизительно от 50 до 65%, от 55 до 60%, от 55 до 58%, от 57 до 60% трисульфатированных дисахаридов при определении по мол.%.
В одном из вариантов реализации изобретения композиция включает более высокий уровень ΔUHNAс,6SGHNS,3S,6S по сравнению с эноксапарином, далтепарином и/или UFH, например, включает приблизительно от 5 до 15 мол.%, от 7 до 14 мол.%, от 9 до 12 мол.%.
В одном из вариантов реализации изобретения композиция LMWH имеет содержание кальция менее 3%, 2,5%, 2%, 1,5%, 1,0% и/или содержание натрия менее 30%, 25%, 20%, 15%, 10%. В одном из вариантов реализации изобретения композиция LMWH включает менее 1000 нг/мг, 750 нг/мг, 500 нг/мг, 250 нг/мг фермента гепариназы, например, описанного здесь фермента гепариназы, менее 1,0%, 0,5%, 0,3% метанола (масс./масс.), менее 1,0%, 0,5%, 0,3%, 0,1% этанола (масс./масс.), менее 2,0%, 1,75%, 1,25%, 1,0%, 0,5%, 0,3%, 0,15% хлорида, менее 15%, 10%, 5%, 2,5% воды по массе, менее 2000, 1500, 1000, 950, 900, 850, 800, 750, 700, 650, 600, 550, 500, 450, 400, 350, 300 м.д. свободного сульфата.
В одном из вариантов реализации изобретения композиция LMWH обеспечивает усиленное высвобождение TFPI по сравнению с эноксапарином. В одном из вариантов реализации изобретения композиция LMWH обеспечивает высвобождение TFPI, увеличенное по меньшей мере в 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30, 40 раз по сравнению с эноксапарином.
В одном из вариантов реализации изобретения композиция LMWH имеет период полувыведения после внутривенной инъекции приблизительно от 30 минут до 3 часов, например, приблизительно от 1 до 2 часов. В одном из вариантов реализации изобретения композиция LMWH имеет период полувыведения после подкожной инъекции приблизительно от 30 минут до 3,5 часов, например, приблизительно от 1,5 до 2,5 часов или приблизительно 2 часа.
В одном из вариантов реализации изобретения в его первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом и/или десятом аспекте композиция LMWH обладает одним или более из следующих свойств:
композиция почти не имеет модифицированных структур на редуцирующем конце (например, свободна от таких цепей по меньшей мере на 85%, 90%, 95% или более). По меньшей мере, 60%, 70%, 80%, 85%, 90%, 95%, 99% цепей композиции имеют на редуцирующем конце HNAc. Менее чем 90%, 95%, 98%, 99% цепей композиции имеют на нередуцирующем конце сульфатирование ΔU (предпочтительно, чтобы ни одна из цепей не имела такого признака). В композиции, по существу, нет областей связывания (например, менее 0,1%). Композиция имеет больше цепей с 3-O сульфатами, чем поступающие в продажу LMWH, например эноксапарин или далтепарин. Соотношение между ΔUHNAc,6SGHNS,3S,6S и ΔU2SHNS,6SIHNAc,6SGHNS,3S,6S в композиции составляет приблизительно от 1:1 до 4:1 (например, 1:1, 2:1, 3:1 или 4:1). В одном из вариантов реализации изобретения композиция обладает двумя, тремя, четырьмя, пятью или всеми указанными свойствами.
Еще в одном аспекте изобретение относится к композиции LMWH, обладающей следующими свойствами:
средневесовая молекулярная масса приблизительно от 5000 до 9000 Да,
анти-IIa активность приблизительно от 50 до 300 МЕ/мг,
анти-IIa активность, которая по меньшей мере на 50% нейтрализуется протамином, например, при измерении по ACT или aPTT,
ΔUHNAс,6SGHNS,3S,6S составляет от 5 до 15% композиции, предпочтительно, если ΔUHNAc,6SGHNS,3S,6S не только составляет приблизительно от 5 до 15% композиции, но и находится на нередуцирующем конце молекулы,
средняя длина цепи составляет приблизительно от 9 до 16 дисахаридов,
соотношение активностей анти-Xa и анти-IIa составляет 3:1 или менее,
соотношение активностей анти-Xa и анти-IIa остается относительно постоянным в течение всего курса введения препарата LMWH, например, отношение анти-Xa активности к анти-IIa активности варьируется в диапазоне не более чем приблизительно ±1,5, ±1, ±0,5 или ±0,2, на протяжении отрезка времени приблизительно 30, 60, 120, 180, 240, 300 минут. Например, если начальное отношение анти-Xa активности к анти-IIa активности равно 2, то предпочтительно, чтобы при повторном измерении (например, через 30, 60, 120, 180, 240, 300 минут после начального введения препарата) оно составляло менее 3, предпочтительнее, приблизительно 2.
В предпочтительном варианте реализации изобретения композиция LMWH имеет следующую структуру:
где
R представляет собой H или SO3Na,
R1 представляет собой SO3Na или COCH3,
n = 2-50, например, 2-40, и
предпочтительно, чтобы композиция имела среднее значение n от 9 до 16 или от 8 до 15.
В предпочтительном варианте реализации изобретения композиция LMWH обладает следующими свойствами:
анти-Xa активность приблизительно от 100 до 400 МЕ/мг,
анти-Xa активность, которая нейтрализуется по меньшей мере на 50%, например, при измерении по ACT или aPTT,
полидисперсность составляет менее 1,6,
менее 70%, 60%, 50% цепей, представленных в композиции, имеют молекулярную массу более 7500 Да,
менее 40% цепей, представленных в композиции, имеют молекулярную массу менее 5000 Да,
композиция включает смесь структур ΔU и I/G на нередуцирующих концах цепей,
композиция, по существу, не имеет модифицированных структур на редуцирующих концах,
по сравнению с эноксапарином, далтепарином или UFH меньшее число цепей в композиции имеют сайты связывания с PF4,
по меньшей мере, 60%, 70%, 80%, 90% цепей в композиции имеют HNAc на редуцирующем конце,
приблизительно от 15% до 35% цепей в композиции имеют ΔU на нередуцирующем конце,
менее чем 90%, 95%, 98%, 99% цепей в композиции имеют на нередуцирующем конце сульфатированной ΔU (предпочтительно, чтобы ни одна из цепей не имела такого признака).
В предпочтительном варианте реализации изобретения композиция LMWH обладает следующими свойствами:
она имеет более высокую степень сульфатирования по сравнению с эноксапарином и далтепарином,
она имеет в своем составе больше трисульфатированных дисахаридов по сравнению с эноксапарином и далтепарином, например, композиция LMWH имеет приблизительно от 50 до 65% трисульфатированных дисахаридов при определении по мол.%,
она имеет более высокий уровень ΔUHNAс,6SGHNS,3S,6S по сравнению с эноксапарином, далтепарином и/или UFH, например, содержание ΔUHNAc,6SGHNS,3S,6S приблизительно составляет от 5 до 15 мол.%.
В предпочтительном варианте реализации изобретения композиция LMWH обладает следующими свойствами:
она имеет содержание кальция менее 3% и/или содержание натрия менее 20%,
она включает менее 1000 нг/мг фермента гепариназы,
она содержит менее 1,0% метанола (масс./масс.),
она содержит менее 1,0% этанола (масс./масс.),
она содержит менее 2,0% хлорида,
она содержит менее 15% воды по массе,
она содержит менее 2000 м.д. свободного сульфата.
В предпочтительном варианте реализации изобретения композиция LMWH обладает следующими свойствами:
она обеспечивает повышенное высвобождение ингибитора метаболического пути тканевого фактора (TFPI) по сравнению с эноксапарином.
В предпочтительном варианте реализации изобретения композиция LMWH имеет период полувыведения после внутривенной инъекции приблизительно от 30 минут до 3 часов.
Еще в одном аспекте изобретение относится к способу получения LMWH. Указанный способ включает
пропускание UFH через одну стадию или поэтапную серию осаждения водными спиртами, например этанолом (по меньшей мере одним с солью натрия (или другой солью, кроме солей кальция)) для того, чтобы экстрагировать из нефракционированного гепарина фракцию низкой молекулярной массы (например, фракцию с высокой подвижностью) и получить первый промежуточный продукт, причем указанный первый промежуточный продукт в предпочтительном варианте имеет среднюю длину цепи от 10 до 16 дисахаридов,
переваривание первого промежуточного продукта с применением агента, например, ферментативного или химического, который расщепляет гликозидные связи несульфатированных уроновых кислот, например, описанного здесь фермента, например, водного буфера, например, водного солевого буфера, например, буфера с ацетатом натрия, причем указанный агент имеет pH приблизительно 5-9, например, 7-8, температура поддерживается на уровне от 25°C до 52°C, например, 37°C, и в результате такой обработки получается второй промежуточный продукт, который в предпочтительном варианте имеет среднюю длину цепи от 8 до 14 дисахаридов, например 8-12 дисахаридов,
отделение компонентов высокой молекулярной массы (направленных против факторов Xa и IIa) от второго промежуточного продукта, т.е. от материалов с низкой активностью, посредством стадии обработки, основанной на размере молекул, например, гель-хроматографии (SEC), для получения третьего промежуточного продукта, причем третий промежуточный продукт в предпочтительном варианте имеет среднюю длину цепи от 9 до 16 дисахаридов, а также необязательно
растворение третьего промежуточного продукта в очищенной воде, фильтрация, например через фильтр калибра 0,2 пм, с последующей сублимационной сушкой для получения лекарственного вещества.
Еще в одном аспекте изобретение относится к композиции LMWH, полученной описанным здесь способом.
Еще в одном аспекте указанный способ включает промежуточную или реакционную смесь любых способов для получения или анализа описанной здесь композиции LMWH.
Еще в одном аспекте изобретение относится к фармацевтической композиции, которая содержит описанную здесь композицию LMWH.
В одном из вариантов реализации изобретения фармацевтическая композиция дополнительно включает фармацевтически приемлемый носитель.
В одном из вариантов реализации изобретения фармацевтическая композиция имеет форму, пригодную для системного введения. В предпочтительном варианте реализации изобретения фармацевтическая композиция пригодна для подкожного, внутривенного, внутриартериального, внутрисуставного, внутримышечного, внутрибрюшинного, внутриглазного (в стекловидное тело), эпидурального, субдурального или интратекального (внутриоболочечного) введения. В одном из вариантов реализации изобретения фармацевтическая композиция для системного введения может представлять собой изотонический раствор, например изотонический раствор с консервантами или без консервантов. Примеры консервантов включают, но не ограничиваясь ими, бензиловый спирт, маннит и лейцин. Стандартное дозированное количество фармацевтической композиции, предлагаемой изобретением, может находиться в упаковке или в устройстве, предназначенном для введения лекарства. Например, композиция, пригодная для подкожной доставки, может находиться в шприце для подкожной инъекции, композиция, пригодная для внутривенной доставки, может находиться в шприце для внутривенной инъекции или в другом устройстве, предназначенном для той же цели, например, в мешочке или бутылочке для капельного вливания.
В одном из вариантов реализации изобретения фармацевтическая композиция имеет форму, пригодную для местного инвазивного введения, например, покрытие или внутреннее содержимое имплантируемого устройства. Примеры устройств, пригодных для имплантации, включают, но не ограничиваясь ими, стенты и экстракорпоральные замкнутые контуры. В одном из вариантов реализации изобретения фармацевтическая композиция имеет форму, пригодную для подкожной имплантации, для имплантации в ткань или орган (например, в коронарную артерию, сонную артерию, почечную артерию, другие периферические артерии, вены, почку, сердце, роговицу, стекловидное тело (глаза) и головной мозг), либо для имплантации в пространство, окружающее ткань или орган (например, в капсулу почки, перикард, торакальное или перитонеальное пространство).
В одном из вариантов реализации изобретения фармацевтическая композиция имеет форму, пригодную для неинвазивного введения, например, топического, трансдермального (чрескожного), пульмонарного (внутрилегочного), назального, орального, в наружный слуховой проход, ректального или вагинального введения. Стандартное дозированное количество фармацевтической композиции, предлагаемой изобретением, может находиться в упаковке или в устройстве, предназначенном для введения лекарства указанными способами.
В одном из вариантов реализации изобретения композиция LMWH лиофилизирована (высушена сублимационным способом). В другом варианте реализации изобретения композиция LMWH имеет жидкую форму.
В одном из вариантов реализации изобретение относится к контейнеру, например ампуле, шприцу или флакону, где находится фармацевтическая композиция. В одном из вариантов реализации изобретения композиция LMWH представлена в дозе приблизительно 1500 МЕ, 2000 МЕ, 2500 МЕ, 3000 МЕ, 3500 МЕ, 4000 МЕ, 4500 МЕ, 5000 МЕ, 5500 МЕ, 6000 МЕ анти-Xa активности на один миллилитр фармацевтически приемлемого носителя.
В одном из вариантов реализации изобретения фармацевтическая композиция имеет осмотическое давление приблизительно от 200 до 400 мОсм/л, например, приблизительно от 250 до 350 мОсм/л, приблизительно от 280 до 330 мОсм/л. В одном из вариантов реализации изобретения фармацевтическая композиция дополнительно содержит хлорид натрия и воду.
Еще в одном аспекте изобретение относится к способу лечения субъекта, который связан с введением указанному субъекту раскрытого здесь лекарственного препарата LMWH. Лечение может быть терапевтическим, например, таким, которое уменьшает, облегчает или улучшает существующее патологическое состояние или его симптомы, а также профилактическим, например, таким, которое замедляет, например, предупреждает проявление патологического состояния или его симптомов. Описанную здесь композицию LMWH можно применять для лечения заболеваний, которые поддаются лечению UFH или имеющимися в продаже лекарственными препаратами LMWH, например эноксапарином, далтепарином или тинзапарином. Изобретение включает способы лечения субъекта, страдающего заболеванием (патологическим состоянием) или имеющего повышенный риск развития таких заболеваний/состояний, которые могут быть выбраны из группы, в состав которой входят заболевания, связанные с нарушением коагуляции, например, тромбоз глубоких вен (DVT) или эмболия ветвей легочной артерии, сердечно-сосудистый тромбоз или заболевание, например острый коронарный синдром (ACS), стабильная или нестабильная стенокардия, инфаркт миокарда, например инфаркт миокарда с повышением сегмента ST (STEMI) или инфаркт миокарда без повышения сегмента ST (NSTEMI), сосудистая патология или фибрилляция предсердий, мигрень, атеросклероз, воспалительные заболевания, такие как аутоиммунные или атопические болезни, псориаз, артрит, сепсис, диссеминированная внутрисосудистая коагулопатия (DIC), аллергия или респираторное заболевание, например, астма эмфизема, синдром острой дыхательной недостаточности взрослых (ARDS), муковисцидоз или реперфузионное повреждение легких, стеноз или рестеноз, раковое или метастатическое заболевание, ангиогенное заболевание, фиброзное заболевание, например фиброз крупного органа, фибропролиферативные заболевания и рубцовые изменения, связанные с травмой, остеопороз, болезнь Альцгеймера, костные переломы, например перелом бедра