Подкожные имплантанты, содержащие устойчивый к деградации полимер полилактид
Иллюстрации
Показать всеИзобретение относится к области медицины и фармакологии и представляет собой монолитный имплант, содержащий (i) аналог рилизинг-фактора лютеинизирующего гормона (=LH-RH аналог) или его фармацевтически приемлемую соль в количестве менее 25% от общего веса композиции, (ii) гомогенный полимер полилактид, устойчивый к деградации, вызванной гамма-облучением и/или температурным воздействием, где устойчивый к деградации полимер полилактида демонстрирует степень разложения менее чем на 1000 Дальтон относительно среднего молекулярного веса полимера, после гамма-облучения дозой от 25 до 40 кГр ионизирующей гамма-радиации и/или где устойчивый к деградации полимер полилактида демонстрирует степень разложения менее чем на 1000 Дальтон относительно среднего молекулярного веса полимера, после температурного воздействия, при температуре около 30°C в течение периода не менее 24 месяцев, где полимер полилактид, устойчивый к деградации, имеет средний молекулярный вес от 4800 до 8600 Дальтон. Изобретение обеспечивает высокое качество импланта и повышает безопасность для пациентов. 10 з.п. ф-лы, 3 пр., 3 табл., 2 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к композициям, содержащим в низких концентрациях аналог рилизинг-фактора лютеинизирующего гормона (далее аналог LH-RH) и устойчивый к деградации полилактид, пригодный для приготовления подкожных имплантов. Полилактид устойчив в условиях стерилизации и/или температурного воздействия. Стерилизация импланта путем гамма-облучения, так же как температурное воздействие, приводит к незначительному разложению полилактида менее чем 1000 Дальтон.
Аналоги LH-RH применяются для лечения болезней, подобных гормонозависимым опухолям, таким как рак простаты и рак груди.
Коммерчески доступные разработки препаратов пролонгированного высвобождения, содержащих аналоги LH-RH, включают микрочастицы, микрокапсулы или импланты, которые, будучи введены подкожно или внутримышечно, высвобождают аналог LH-RH из рассасывающейся матрицы. В качестве рассасывающегося (биодеградируемого) полимера обычно применяется поли(лактид-ко-гликолид) сополимер. Некоторые из коммерческих продуктов (например, Zoladex®) дополнительно должны содержать обезвоживающее средство для предотвращения деградации полимера.
Микрокапсулы или микрочастицы имеют следующие недостатки:
- микрокапсулы или микрочастицы демонстрируют высокую начальную перфорацию вследствие огромной площади поверхности;
- микрокапсулы или микрочастицы склонны к неравномерному высвобождению;
- они пригодны для доставки аналога LH-RH в течение максимум 3 месяцев. Микрокапсулы или микрочастицы назначаются пациентам как суспензия в жидкой среде. Для более длительного лечения должно быть назначено большое количество микрокапсул в сочетании с большим объемом инъекции. Подобное воздействие очень болезненно для пациентов. Альтернативой могло бы стать высокое наполнение микрокапсул или микрочастиц аналогом LH-RH. Но это может привести к неконтролируемому профилю высвобождения аналога LH-RH;
- вследствие процедуры изготовления микрочастицы содержат остаточные органические растворители как, например, метиленхлорид (дихлорметан).
Другим типом препаратов пролонгированного высвобождения являются импланты. Они обладают следующими преимуществами:
- имплант может непосредственно быть введен в пациента без суспензионной среды, что уменьшает объем инъецируемого материала;
- имплант демонстрирует непрерывный профиль высвобождения;
- имплант нуждается в меньшем количестве активных ингредиентов, чем микрочастицы или микрокапсулы, для достижения той же интенсивности высвобождения;
- производство является менее сложным. Во время изготовления можно избежать применения органических растворителей.
EP 058481 описывает монолитные импланты, содержащие биодеградируемый гетерогенный поли(лактид-ко-гликолид) сополимер и агонист LH-RH.
EP 839525 описывает микрокапсулы, содержащие полимер молочной кислоты со средним молекулярным весом от 25000 до 60000.
WO 98/47489 описывает импланты, содержащие биодеградируемый полимер с логарифмом вязкости между 0,5 дл/г и 1,6 дл/г в CHCl3. Импланты высвобождают активный ингредиент в течение продолжительного периода, до 3 месяцев или более.
WO 03/002092 описывает контролируемую композицию высвобождения, к примеру микрокапсулы, содержащие полимер молочной кислоты со средним молекулярным весом от 15000 до 50000 Дальтон, в которых содержание полимера с молекулярным весом 5000 Дальтон или меньше составляет не более 5%.
WO 03/022297 описывает монолитные импланты, содержащие полимер полилактид со средним молекулярным весом от 12000 до 40000 Дальтон и от 25 до 40% по весу аналога LH-RH от суммарного веса импланта. Эти импланты высвобождают аналог LH-RH в течение как минимум 6 месяцев.
WO 98/09613 описывает процесс изготовления имплантов, содержащих пептид и сополимер молочной кислоты и гликолевой кислоты, имеющий соотношение единиц гликолида к единицам лактида от 0 до 5:1. Сополимер стерилизуется дозой от 1 до 2,5 Мрад ионизирующего гамма-излучения.
WO 93/24150 описывает расширенные композиции высвобождения, содержащие соль пептида с полиэфиром, содержащим на конце карбоксильную группу, например полилактид.
Перед назначением пациенту имплант должен быть стерилизован. Стерилизация нагреванием невозможна, так как большинство полимеров имеют температуру стеклования ниже 100°C. Следовательно, стерилизация достигается гамма-облучением, обычно дозой радиации более 25 кГр. Такая доза провоцирует образование радикалов в полимере. Следовательно, гамма-облучение приводит к деградации полимера, сопровождаемой изменением профиля высвобождения активного ингредиента.
Имплантам следует храниться длительный период времени. В общем, полилактиды склонны к гидролизу в присутствии влажности или воды при повышенных температурах. Зачастую в имплант должно быть добавлено обезвоживающее средство для достижения удовлетворительной стабильности при хранении.
Целью данного изобретения является разработка импланта, устойчивого к деградации гамма-радиацией и/или, вызванной температурным воздействием. Имплант должен содержать аналог LH-RH в малых дозах. Тем не менее, имплант должен быть способен высвобождать аналог LH-RH непрерывно в течение минимум 3 месяцев.
Неожиданно было обнаружено, что композиция, содержащая аналог LH-RH и полилактид, устойчива к гамма-облучению и/или температурному воздействию. Полимер полилактид демонстрирует степень разложения менее 1000 Дальтон относительно среднего молекулярного веса полимера после стерилизации импланта гамма-облучением. Имплант проявляет стабильность при хранении более 24 месяцев при повышенных температурах (около 30°C). Не требует обезвоживающих средств. Следовательно, имплант может применяться в странах 4 климатической зоны (определение согласно постановлению ICH). Эти композиции пригодны для приготовления подкожных имплантов, что позволит высвобождаться малым дозам аналога LH-RH в течение более 3 месяцев.
Было открыто, что устойчивость полилактида к гамма-облучению и/или температурному воздействию имеет место вследствие низкого среднего молекулярного веса полилактида, предпочтительно от 4800 до 8600 Дальтон. Происходит это потому, что радиация и/или температурное воздействие вызывают меньшее дробление короткой полимерной цепи полилактида, чем длинной полимерной цепи. Таким образом, полилактид с низким средним молекулярным весом проявляет меньшее снижение среднего молекулярного веса после радиации и/или температурного воздействия предпочтительно менее чем на 1000 Дальтон. Если снижение среднего молекулярного веса полилактида меньше 1000 Дальтон, интенсивность высвобождения аналога LH-RH из импланта более предсказуема после радиации и/или температурного воздействия. Таким образом, может быть достигнуто высокое качество импланта и повышена безопасность пациентов.
Неожиданно оказалось, что имплант с относительно низким содержанием аналога LH-RH, в частности количеством менее чем примерно 6 мг Лейпрорелина, предоставляет удовлетворительно высокую интенсивность высвобождения для достижения терапевтической суппрессии тестостерона в течение минимум 3 месяцев.
Сущность изобретения
Настоящее изобретение относится к монолитным имплантам, содержащим (i) аналог рилизинг-фактора лютеинизирующего гормона (= аналог LH-RH) или его фармацевтически приемлемую соль в количестве менее 25% от суммарного веса композиции и (ii) гомогенный полимер полилактид, устойчивый к деградации, вызванной гамма-облучением и/или температурным воздействием, где устойчивый к деградации полимер полилактид демонстрирует степень разложения менее 1000 Дальтон относительно среднего молекулярного веса полимера после процедуры гамма-облучения дозой радиации между 25 и 40 кГр ионизирующей гамма-радиации; и/или где устойчивый к деградации полимер полилактид демонстрирует степень разложения менее 1000 Дальтон относительно среднего молекулярного веса полимера после температурного воздействия в течение как минимум 24 месяцев при температуре 30°C.
Описание чертежей
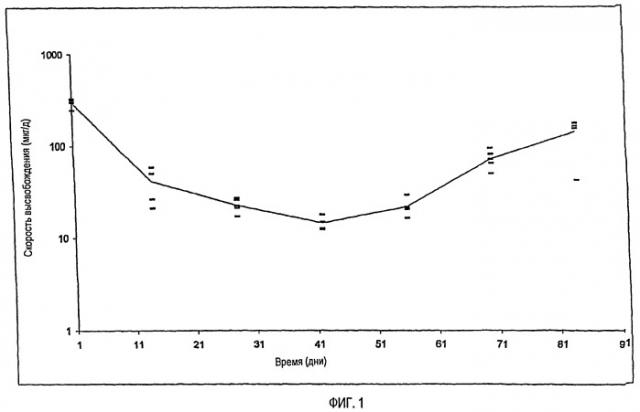
На фиг.1 показан in vitro профиль высвобождения Лейпрорелина из полилактидного импланта при 37°C согласно примеру 2.
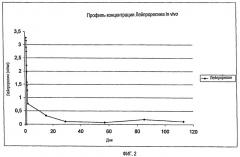
На фиг.2 показан in vitro профиль высвобождения Лейпрорелина из полилактидного импланта при 37°C согласно примеру 3.
Подробное описание изобретения
Настоящее изобретение относится к композициям, содержащим в низких концентрациях аналог LH-RH и устойчивый к деградации полилактид, пригодный для приготовления подкожных имплантов с пролонгированным высвобождением. Полилактид устойчив к деградации, вызванной гамма-облучением и/или температурным воздействием.
Полимер Полилактид
Данное изобретение относится к монолитным имплантам, где устойчивый к деградации полимер полилактид демонстрирует степень разложения менее 1000 Дальтон после гамма-облучения и/или температурного воздействия.
Согласно данному изобретению гамма-облучение проводится дозой между примерно 25 и 40 кГр ионизирующей гамма-радиации.
Согласно данному изобретению температурное воздействие - это воздействие температуры около 30°C в течение не менее 24 месяцев.
Данное изобретение относится к монолитным имплантам, где устойчивый к деградации полимер полилактид имеет средний молекулярный вес от 4800 до 8600 Дальтон, предпочтительно от 5100 до 7800 Дальтон и более предпочтительно от 6700 до 7500 Дальтон.
Настоящее изобретение относится к монолитным имплантам, где устойчивый к деградации полимер полилактид имеет индекс полидисперсности от 1,2 до 2,2, предпочтительно от 1,4 до 1,8.
Настоящее изобретение относится к монолитным имплантам, где устойчивый к деградации полимер полилактид имеет характеристическую вязкость от 0,10 до 0,40 дл/г, предпочтительно от 0,12 до 0,36 дл/г, особенно 0,16-0,24 дл/г.
Настоящее изобретение относится к монолитным имплантам, где устойчивый к деградации полимер полилактид имеет коэффициент кислотности более 10 мг KOH на грамм полилактида.
Данное изобретение относится к монолитным имплантам, где устойчивый к деградации полимер полилактид содержит полимеры с молекулярным весом 2700 Дальтон или менее в количестве более 5 вес.%, предпочтительно более 6 вес.% и наиболее предпочтительно более 8 вес.%.
Устойчивый к деградации полимер полилактид является гомополимером, в котором все повторяющиеся единицы полимера имеют формулу (I)
Формула I
Повторяющиеся единицы могут находиться в L-, D- или смеси L- и D- конфигурации. Предпочтителен Поли(D,L-лактид).
Гамма-облучение может приводить к образованию радикалов в полимере. Таким образом средний молекулярный вес полимера может снижаться из-за гамма-радиации.
Обычно полилактиды склонны к гидролизу при повышенных температурах в присутствии влаги, например остаточная влажность в упаковке при хранении полилактида. Таким образом, средний молекулярный вес полилактида может снижаться из-за температурного воздействия.
Устойчивый к деградации полимер полилактид согласно настоящему патенту определяется снижением среднего молекулярного веса полимера менее чем на 1000 Дальтон после того, как полимер был подвержен гамма-облучению и/или температурному воздействию.
Устойчивый к деградации полимер полилактид демонстрирует степень разложения менее 1000 Дальтон после стерилизации. Стерилизация достигается дозой радиации между 25 и 40 кГр ионизирующей гамма-радиации, предпочтительно между примерно 26 и 35 кГр и более предпочтительно между примерно 26 и 32 кГр ионизирующей гамма-радиации.
Устойчивый к деградации полимер полилактид демонстрирует степень разложения менее 1000 Дальтон после хранения в течение более 24 месяцев при 30°C.
Средний молекулярный вес (Mw) устойчивого к деградации полимера полилактида составляет от 4800 до 8600 Дальтон, предпочтительно от 5100 до 7800 Дальтон и более предпочтительно от 6700 до 7500 Дальтон. Средний молекулярный вес (Mw) полимера измеряется гель-проникающей хроматографией (GPC) с использованием растворов полимера в тетрагидрофуране (THF). Стандартные полилактиды используются для калибровки.
Данное изобретение относится к устойчивому к деградации полимеру полилактиду, который является гомогенным. Под “гомогенным полилактидом” подразумевается полилактид, состоящий только из мономеров молочной кислоты и проявляющий низкую полидисперсность. “Низкая полидисперсность” подразумевает малые изменения в молекулярном весе индивидуальных цепочек полимера.
Индекс полидисперсности гомогенного устойчивого к деградации полимера полилактида составляет от 1,2 до 2,2, предпочтительно от 1,4 до 1,8. Полидисперсность предоставляет показатель распространения/распределения длин цепей и определяется как отношение (Mw)/(Mn) средневесовой молекулярной массы (Mw) к среднечисленной молекулярной массе (Mn).
Устойчивый к деградации полимер полилактид содержит полимеры с молекулярным весом 2700 Дальтон или менее в количестве более 5 вес.%, предпочтительно более 6 вес.% и наиболее предпочтительно более 8 вес.%.
Характеристическая вязкость устойчивого к деградации полимера полилактида предпочтительно составляет от 0,10 до 0,40 дл/г, предпочтительно от 0,12 до 0,36 дл/г, наиболее предпочтительно от 0,16 до 0,24 дл/г. Вязкость измеряется в хлороформе при концентрации 0,1 г/дл (0,1%) при 25°C.
Гидрофильные свойства могут быть охарактеризованы коэффициентом кислотности. Коэффициент кислотности устойчивого к деградации полимера полилактида предпочтительно составляет как минимум 10 мг KOH на грамм полимера, предпочтительно от 10 до 12 мг KOH на грамм полимера.
Устойчивый к деградации полимер полилактид может включать простой полилактидный гомополимер или смесь двух и более полилактидных гомополимеров.
Устойчивый к деградации полимер полилактид может быть приготовлен следующими способами. Подходящими методиками могут быть поликонденсация молочной кислоты или полимеризация лактида с раскрытием кольца (цис-(±)-3,6-диметил-1,4-диоксан-2,5-дион). Полимеризация с раскрытием кольца осуществляется при повышенной температуре и в присутствии подходящего катализатора. Подходящими катализаторами являются, например, цинк, сурьма или органические соли олова как октоат олова II. Температура реакции составляет от 120 до примерно 240°C, предпочтительно от 170 до 190°C. Полимеризация с раскрытием кольца проводится от 1 до 10 часов, предпочтительно от 4 до 6 часов. Полимеризация с раскрытием кольца может осуществляться в присутствии подходящего агента обрыва цепи, таким образом контролируется молекулярный вес получаемого полимера полилактида. Подходящие агенты включают воду, молочную кислоту или спирт. В качестве агента обрыва цепи предпочтительно используется молочная кислота. Вследствие этого, предпочтительный поли(D,L-лактид) преимущественно содержит концевые карбоксильные группы.
Аналог LH-RH
Настоящее изобретение относится к монолитным имплантам, где аналог LH-RH выбран из группы, состоящей из Лейпрорелина, Бусерелина, Гозерелина, Трипторелина, Нафарелина, Гонадорелина, Цетрореликса, Ганиреликса или их фармацевтически приемлемые соли.
Настоящее изобретение относится к монолитным имплантам, где аналог LH-RH - Лейпрорелин.
Настоящее изобретение относится к монолитным имплантам, где аналог LH-RH - Гозерелин.
Настоящее изобретение относится к монолитным имплантам, где количество аналога LH-RH составляет от 15 до 24 вес.%, более предпочтительно от 18 до 23 вес.% от суммарного веса импланта.
Аналог LH-RH может быть агонистом LH-RH или его фармацевтически приемлемой солью, либо антагонистом LH-RH или его фармацевтически приемлемой солью.
Предпочтительные аналоги LH-RH представляют собой пептиды или производные пептидов.
Примерами подходящих агонистов LH-RH являются Лейпрорелин, Бусерелин, Гозерелин, Трипторелин, Нафарелин или Гонадорелин.
Примерами подходящих антагонистов LH-RH являются Цетрореликс или Ганиреликс.
Подходящие соли аналогов LH-RH могут быть образованы с неорганическими кислотами (например, с соляной кислотой, бромистоводородной кислотой, серной кислотой, азотной кислотой, фосфорной кислотой) или с органическими кислотами (например, с уксусной кислотой, пропионовой кислотой, гликолевой кислотой, молочной кислотой, пировиноградной кислотой, щавелевой кислотой, малеиновой кислотой, малоновой кислотой, янтарной кислотой, фумаровой кислотой, яблочной кислотой, виннокаменной кислотой, лимонной кислотой, метансульфокислотой, этансульфокислотой, бензолсульфоновой кислотой, п-толуолсульфокислотой, циклогексан сульфамовой кислотой, салициловой кислотой, парааминосалициловой кислотой и памовой кислотой). Соли могут быть в сольватированной форме. Подобными сольватами являются, к примеру, гидраты или алкоголяты. Примером подходящей соли агониста LH-RH является ацетат Лейпрорелина.
Подходящие соли аналогов LH-RH могут представлять собой соли щелочных или щелочно-земельных металлов, так же как соли аммония, такие как, например, соли калия, натрия, лития, кальция, магния или аммония.
Согласно изобретению имплант может содержать смеси различных аналогов LH-RH, смеси различных солей определенного аналога LH-RH или смеси различных солей разных аналогов LH-RH.
Согласно данному изобретению монолитный имплант содержит аналога LH-RH менее 25%, предпочтительно от 15 до 24%, более предпочтительно от 18 до 23% по весу от суммарного веса импланта.
Предпочтительные аналоги LH-RH это Лейпрорелин или Гозерелин в количестве 22 вес.% от суммарного веса импланта.
Аналог LH-RH или его фармацевтически приемлемая соль, например Лейпрорелин- ацетат, погружен в полилактидной матрице. Предпочтительно, чтобы аналог LH-RH или его фармацевтически приемлемая соль были равномерно внесены в полилактидную матрицу. Аналог LH-RH не образует и не предполагает образования соли с полилактидом. Для целей данного изобретения полилактидная соль аналога LH-RH не предполагается как фармацевтически приемлемая соль аналога LH-RH.
Производство:
Импланты согласно изобретению могут быть произведены с помощью процедуры, включающей следующие этапы:
(i) растворение устойчивого к деградации полимера в растворителе,
(ii) смешивание раствора полимера с водным раствором аналога LH-RH и/или его фармацевтически приемлемой соли,
(iii) удаление растворителя практически полностью, и
(iv) экструдирование продукта этапа (ii) и деление его на порции с целью образования монолитного импланта требуемых размеров.
В качестве растворителя может применяться вода. Удаление растворителя может осуществляться, например, испарением или лиофилизацией.
Импланты также могут быть произведены с помощью процедуры, включающей следующие этапы:
(i) взвешивание аналога LH-RH и/или его фармацевтически приемлемых солей и устойчивого к деградации полимера полилактида,
(ii) измельчение смеси при температуре ниже температуры стеклования полилактида,
(iii) доведение температуры полученной гомогенной смеси до комнатной температуры, и
(iv) экструдирование гомогенизированной смеси и деление ее на порции с целью образования монолитного импланта требуемых размеров.
Для измельчения (диспергирования) смеси может применяться низкотемпературный смеситель.
Экструдирование может осуществляться с помощью экструдера при температуре между 70 и 110°C, чтобы образовывался непрерывный экструдированный стержневой продукт. Цилиндрические стержни нарезаются на кусочки примерно от 8 до 30 мм длиной, предпочтительно от 9 до 11 мм.
Стерилизация
Монолитный имплант должен быть стерилизован перед назначением пациенту. Стерилизация осуществляется, например, дозой между 25 и 40 кГр, предпочтительно между примерно 26 и 35 кГр и более предпочтительно между примерно 26 и 32 кГр ионизирующей гамма-радиации. Облучение импланта дозой свыше 25 кГр приводит к стерилизации продукта, удовлетворяющей требованиям, предъявляемым к стерильности официальными органами, ответственными за утверждение фармацевтической продукции. Радиация в указанном промежутке вызывает критическое разложение аналога LH-RH, но благодаря содержанию включений радиация индуцирует разложение в импланте менее 1% от общего количества аналога. Такая степень разложения допускается регулирующими инстанциями.
Хранение
Монолитный имплант может храниться в выпускной (итоговой) упаковке в течение длительного периода времени. Монолитный имплант может храниться в течение как минимум 24 месяцев при температуре до 30°C, предпочтительно в течение 36 месяцев при температуре до 30°C.
Имплант
Имплант данного изобретения может быть в форме цилиндров, стержней или сфер. Предпочтительны цилиндрические стержни. Цилиндрические стержни могут иметь диаметр от 1 до 2 мм, предпочтительно между 1,4 и 1,7 мм, и длину от 8 до 30 мм, предпочтительно от 9 до 11 мм. Цилиндрические стержни подходят для подкожной имплантации пациенту, например, с применением иглы для внутримышечных или подкожных инъекций, либо подкожной имплантации хирургическим путем. Имплант имеет содержание аналога LH-RH между 3 и 15 мг. Имплант может содержать Лейпрорелин в количестве от 4 до 6 мг, иметь диаметр от 1,45 до 1,65 мм и длину от 9 до 11 мм. Имплант может содержать Гозерелин в количестве от 9 до 12 мг, иметь диаметр от 1,45 до 1,65 мм и длину от 13 до 17 мм.
Профиль высвобождения
Настоящее изобретение относится к монолитным имплантам, где монолитный имплант непрерывно высвобождает аналог LH-RH или его фармацевтически приемлемую соль в течение периода не менее чем 3 месяца, предпочтительно от 3 до 4 месяцев, будучи помещен в водное окружение физиологического типа.
Монолитный имплант непрерывно высвобождает аналог LH-RH в течение периода не менее чем 3 месяца, предпочтительно от 3 до 4 месяцев, будучи помещен в среду физиологического типа на водной основе.
После короткого начального выброса аналог LH-RH высвобождается непрерывно, предпочтительно со скоростью высвобождения не менее 4 мкг/день. 80 вес.% аналога LH-RH высвобождается за период 3 месяца, когда имплант помещен в водное окружение физиологического типа.
Механизм высвобождения препарата из монолитного импланта после подкожной инъекции включает период начального высвобождения, период задержки (лаг-период) и период эрозии. Период начального высвобождения монолитного импланта возникает из-за высвобождения аналога LH-RH, который вымывается с поверхности импланта окружающей средой. В течение лаг-периода скорость высвобождения препарата преимущественно определяется диффузией растворенного препарата через поры матрицы и химической деградацией полилактида. Так как полилактид является полиэфиром, химическая деградация имеет место вследствие контакта с водой путем гидролиза эфирных связей. Длинные полиэфирные цепи гидролизуются с образованием меньших цепей с более гидрофильными свойствами. Период эрозии начинается, когда образуется большое количество растворимых короткоцепочечных продуктов деградации полимера (олигомеров и мономеров). Мономеры, олигомеры и лекарственный препарат вымываются из импланта. По окончании периода эрозии имплант разрушен.
Под термином „водное физиологическое окружение“ автор понимает тело, в частности мускулатуру или систему кровообращения, теплокровного животного. В качестве теплокровного животного могут быть выбраны собака, кролик, крыса или человек. Целесообразен выбор человека. Для in vivo измерения количества высвобождаемого аналога LH-RH после внедрения импланта теплокровному животному определяется концентрация соответствующего аналога LH-RH в пробах сыворотки. Внедрение монолитного импланта человеку приводит к уровню аналога LH-RH в сыворотке как минимум 40 пг/мл за период не менее 3 месяцев, предпочтительно от 3 до 4 месяцев. Относительно Лейпрорелина внедрение монолитного импланта человеку приводит к значению уровня Лейпрорелина в сыворотке как минимум 40 пг/мл, предпочтительно минимум 50 пг/мл, за период не менее 3 месяцев, предпочтительно от 3 до 4 месяцев.
Высвобождение аналога LH-RH из импланта в условиях in vivo может быть смоделировано in vitro путем помещения импланта в водную растворяющую среду, по желанию забуференную до физиологического pH, при температуре от 35 до 40°C. Подходящее приспособление для растворения содержит прецизионный насос (высокоточный), проточную кювету и кассирующий механизм. Предпочтительно, поддерживается температура растворяющей среды в 37°C.
Данное изобретение далее иллюстрируется следующими примерами, которые не должны рассматриваться как ограничивающие.
Пример 1:
Смесь полилактида и ацетата Лейпрорелина взвешиваются одновременно, гомогенизируется растиранием и затем переносится в цилиндр-приемник поршневого экструдера.
После этого смесь нагревается примерно до 70°C для начала процесса экструзии. Затем расплавленная смесь прессуется силой поршневого пресса через литьевое отверстие экструдера и охлаждается до температуры окружающей среды. Полученный непрерывный жгут пошагово нарезается на более мелкие кусочки (импланты) длиной примерно 1 см, они вставляются в прикладное устройство (шприц). Шприц исходно упаковывается в алюминиевый пакет-саше, плотно запечатывается и стерилизуется гамма-стерилизацией дозой между 25 и 32 кГр.
Средний молекулярный вес полилактида определяется до и после стерилизации. Средний молекулярный вес измеряется гель-проникающей хроматографией (GPC). Измерения проводятся на высокоэффективном GPC аппарате согласно центровочным меткам для индустрии Немецкого Института Стандартов (DIN) 55672. Используется комбинация трех колонок с размерами пор 1000, 10000 и 100000 Å, соответственно. Материал колонок основан на сополимере стирол-дивинилбензола (=SDV), имеет размер частиц 5 мкм (поставщик: Polymer Standards Service PSS, Mainz, Germany). Стандарты полилактида (поставщик: Polymer Standards Service PSS, Mainz, Germany) с Mw 144, 1600, 9750, 27800, 727, 2680, 19600, 43100 применяются для калибровки. Тетрагидрофуран применяется в качестве растворителя для полимера. Результаты в Таблице 1 показывают, что деградация полилактида составляет менее 1000 Дальтон после стерилизации.
| Таблица 1 | |||||
| Партия | GPC до стерилизации | GPC послестерилизации | Доза Гамма-Радиации | w/w% Лейпро-релина повесу от веса импланта | Весимпланта |
| 1 | Mw=4520 Дальтон | Mw=4300 Дальтон | 28 кГр | 22,2% | 22,4 мг |
| 2 | Mw=4840 Дальтон | Mw=4540 Дальтон | 28 кГр | 22,2% | 22,6 мг |
| 3 | Mw=7630 Дальтон | Mw=7460 Дальтон | 25 кГр | 22,2% | 22,2 мг |
| 4 | Mw=5680 Дальтон | Mw=5220 Дальтон | 27 кГр | 22,2% | 22,9 мг |
| 5 | Mw=5680 Дальтон | Mw=5610 Дальтон | 13 кГр | 22,2% | 22,9 мг |
| 6 | Mw=6700 Дальтон | Mw=6520 Дальтон | 11,7-12,5 | 22,2% | 22,5 мг |
| 7 | Mw=6700 Дальтон | Mw=6490 Дальтон | 25,3- 7,2 | 22,2% | 22,5 мг |
| 8 | Mw=6700 Дальтон | Mw=6280 Дальтон | 35,5-38,1 | 22,2% | 22,5 мг |
Пример 2:
Высвобождение Лейпрорелина из импланта in vitro
Свойство растворимости импланта определяется следующим методом растворения. Принцип описанного проточного аппарата соответствует Европейской Фармакопее (Chapter 2.9.3., Dissolution test for solid oral dosage forms).
Имплант помещается в цилиндр проточной кюветы, закрытый с обоих концов дисками спеченных фильтров. Среда (изотонический фосфатный буфер (pH 7.4) протекает непрерывно через камеру с имплантом со скоростью протекания приблизительно 0,3 мл/час. Вся кювета помещается в водяную баню при 37°C. Одна проточная кювета предназначена для одного импланта. Среда собирается определенные промежутки времени и анализируется подходящим методом HPLC.
Скорость высвобождения in vitro Лейпрорелина из импланта экспериментальной серии 3 показана в Таблице 2 и на фиг.1.
| Таблица 2In vitro высвобождение Лейпрорелина из полилактидного импланта при 37°C | |||||
| День | Проба 1Высвобождение Лейпрорелина, мкг/д | Проба 2Высвобождение Лейпрорелина, мкг/д | Проба 4Высвобождение Лейпрорелина, мкг/д | Проба 5Высвобождение Лейпрорелина, мкг/д | Проба 6Высвобождение Лейпрорелина, мкг/д |
| 1 | 295,3 | 323,6 | 245,0 | 300,0 | 314,9 |
| 2 | 7,9 | 1,9 | 5,4 | 7,5 | 4,0 |
| 3 | 12,4 | 2,0 | 6,9 | 21,2 | 8,8 |
| 7 | 28,0 | 8,6 | 22,3 | 28,4 | 21,1 |
| 10 | 119,9 | 49,5 | 100,6 | 97,1 | 54,4 |
| 14 | 68,1 | 39,5 | 62,8 | 54,9 | 3,9 |
| 21 | 35,0 | 22,2 | 34,8 | 30,2 | 28,2 |
| 28 | 19,6 | 12,2 | 17,7 | 14,9 | 14,9 |
| 35 | 14,6 | 16,7 | 18,4 | 10,8 | 13,6 |
| 42 | 15,1 | 19,3 | 11,6 | 14,5 | 10,9 |
| 49 | 14,9 | 22,1 | 17,2 | 12,2 | 15,1 |
| 56 | 26,1 | 21,6 | 24,8 | 20,8 | 43,9 |
| 63 | 66,3 | 128,0 | 51,4 | 69,7 | 88,2 |
| 70 | 63,9 | 61,3 | 49,0 | 74,5 | 74,5 |
| 77 | 298,8 | 323,3 | 243,6 | 40,6 | 61,4 |
| 84 | 10,0 | 4,8 | 112,7 | 44,9 | 286,6 |
| 91 | 3,6 | 10,2 | 3,0 | 45,3 | 4,2 |
| 98 | 2,0 | 2,1 | 2,3 | 54,6 | 0,0 |
Пример 3
Высвобождение Лейпрорелина из импланта in vivo
Имплант, состоящий из ацетата Лейпрорелина и полилактида, готовится согласно Примеру 1. Подсчитанное содержание Лейпрорелина составляет 22,2 w/w% по весу от импланта. Средний молекулярный вес полилактида 7380 Дальтон, определен до стерилизации. Индекс полидисперсности полилактида 1,51.
Исследование фармакокинетики этого Лейпрорелинового импланта in vivo проведено со следующими параметрами:
Количество пациентов: 15
Способ применения: подкожная инъекция
Длительность лечения: 16 недель (113 дней)
Фармакокинетика: Образцы крови для анализа на Лейпрорелин отбираются на день 1, 2, 15, 29, 57, 85 и 113
Определение Лейпрорелина в сыворотке человека производится следующим способом:
- LC-MS/MS
- Диапазон значений: 25-10000 пг/мл
- Нижний предел количества: 25 пг/мл
Высвобождение Лейпрорелина из импланта in vivo показано в таблице 3 и на фиг.2.
| Таблица 3Высвобождение Лейпрорелина из полилактидного импланта | ||
| День | Среднее значениесодержания Лейпрорелинав образцах крови [нг/мл] | Количество пациентов |
| 1 | 0 | 15 |
| 1,042 | 2,892 | 15 |
| 1,083 | 3,265 | 15 |
| 1,125 | 3,153 | 15 |
| 1,167 | 2,74 | 15 |
| 1,208 | 2,214 | 15 |
| 1,25 | 1977 | 15 |
| 1,333 | 1,579 | 15 |
| 1,417 | 1,458 | 15 |
| 1,5 | 1,271 | 15 |
| 2 | 0,765 | 15 |
| 15 | 0,326 | 15 |
| 29 | 0,105 | 15 |
| 57 | 0,073 | 15 |
| 85 | 0,186 | 15 |
| 113 | 0,111 | 14 |
1. Монолитный имплант, содержащий(i) аналог рилизинг-фактора лютеинизирующего гормона (=LH-RH-аналог) или его фармацевтически приемлемую соль в количестве менее 25% от общего веса композиции(ii) гомогенный полимер полилактид, устойчивый к деградации, вызванной гамма-облучением и/или температурным воздействием, где устойчивый к деградации полимер полилактида демонстрирует степень разложения менее чем на 1000 Дальтон относительно среднего молекулярного веса полимера после гамма-облучения дозой от 25 до 40 кГр ионизирующей гамма-радиации и/или где устойчивый к деградации полимер полилактида демонстрирует степень разложения менее чем на 1000 Дальтон относительно среднего молекулярного веса полимера после температурного воздействия при температуре около 30°C в течение периода не менее 24 месяцев,где полимер полилактид, устойчивый к деградации, имеет средний молекулярный вес от 4800 до 8600 Дальтон.
2. Монолитный имплант по п.1, где аналог LH-RH выбран из группы, включающей Лейпрорелин, Бусерелин, Гозерелин, Трипторелин, Нафарелин, Гонадорелин, Цетрореликс, Ганиреликс или их фармацевтически приемлемые соли.
3. Монолитный имплант по п.1 или 2, где аналог LH-RH представляет собой Лейпрорелин.
4. Монолитный имплант по п.1 или 2, где аналог LH-RH представляет собой Гозерелин.
5. Монолитный имплант по п.1 или 2, где количество аналога LH-RH составляет от 15 до 24%, более предпочтительно от 18 до 23% от общего веса импланта.
6. Монолитный имплант по п.1 или 2, где устойчивый к деградации полимер полилактид имеет средний молекулярный вес от 5100 до 7800 Дальтон и предпочтительно от 6700 до 7500 Дальтон.
7. Монолитный имплант по п.1 или 2, где устойчивый к деградации полимер полилактид имеет индекс полидисперсности от 1,2 до 2,2, предпочтительно от 1,4 до 1,8.
8. Монолитный имплант по п.1 или 2, где устойчивый к деградации полимер полилактид имеет характеристическую вязкость, измеренную в хлороформе в качестве растворителя в концентрации 0,1 г/дл (0,1%) при 25°C, от 0,10 до 0,40 дл/г, предпочтительно от 0,12 до 0,36 дл/г, наиболее предпочтительно от 0,16 до 0,24 дл/г.
9. Монолитный имплант по п.1 или 2, где устойчивый к деградации полимер полилактид имеет коэффициент кислотности более 10 мг КОН на грамм полилактида.
10. Монолитный имплант по п.1 или 2, где устойчивый к деградации полимер полилактид содержит полимеры с молекулярным весом 2700 Дальтон или менее в количестве более 5 вес.%, предпочтительно более 6 вес.% и наиболее предпочтительно более 8 вес.%.
11. Монолитный имплант по п.1 или 2, где монолитный имплант непрерывно высвобождает аналог LH-RH или его фармацевтически приемлемую соль в течение периода не менее 3 месяцев, предпочтительно от 3 до 4 месяцев, будучи помещен в водное окружение физиологического типа, такое как тело теплокровного животного, предпочтительно человека.