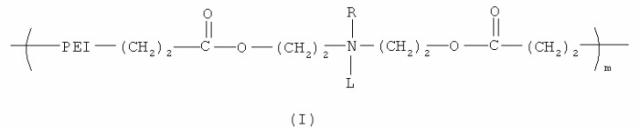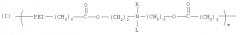Биоразрушаемые катионные полимеры
Иллюстрации
Показать всеИзобретение относится к биоразрушаемым полимерам, пригодным для доставки биологических агентов в клетки. Предложен полимер, содержащий звено формулы (I), где PEI - звено полиэтиленимина с молекулярным весом менее 600 дальтон; R - электронная пара; L выбран из С2-С50 карбоксиалкенила и остатка жирных кислот от C12 до C18; m - целое число от 1 до 30. Предложен также полимерный комплекс с олигонуклеотидом и способ трансфекции клетки эукариот с его использованием. Технический результат - предложенный полимер применим для безопасной и эффективной доставки малой интерферирующей РНК или олигонуклеотидов в клетки. 4 н. и 12 з.п. ф-лы, 2 ил., 1 табл., 5 пр.
Реферат
Настоящая заявка испрашивает приоритет на основании предварительной заявки США №60/789842, поданной 6 апреля 2006, содержание которой в полном объеме включено в настоящее описание в виде ссылки, включая чертежи. Кроме этого настоящая заявка связана с заявкой на патент США №11/216986, поданной 31 августа 2005, которая полностью включена в настоящее описание в виде ссылки, включая чертежи.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Область техники, к которой относится изобретение
Настоящее изобретение относится к композициям и способам доставки биологически активных агентов в клетки. В частности, настоящее изобретение относится к катионным липополимерам, содержащим поли- или олиго-этиленимин (PEI), биодеградируемую группу и относительно гидрофобную группу, и к способам создания и применения таких липополимеров для доставки олигонуклеотидов, таких как малая интерферирующая РНК и антисенс.
Описание предшествующего уровня техники
Для доставки биологически активных агентов доступен ряд методов, таких как доставка плазмидных ДНК в клетки, включая использование вирусных систем трансфекции и невирусных систем трансфекции. Обычно вирусные системы обладают большей эффективностью трансфекции по сравнению с невирусными системами, однако существуют вопросы касательно безопасности вирусных систем. Смотри Verma I.M and Somia N. Nature 389 (1997), p.239-242; Marhsall E.Science 286 (2000), p.2244-2245. Кроме этого получение вирусных векторов обычно бывает сложным и дорогостоящим процессом. Хотя, в основном, невирусные системы трансфекции являются менее эффективными в сравнении с вирусными системами, им уделяют значительное внимание, так как, в основном, считается, что они являются более безопасными и более легкими в получении по сравнению с вирусными системами.
Ряд невирусных систем трансфекции включает использование катионных полимеров, которые образуют комплекс с плазмидными ДНК. Примеры катионных полимеров, которые были использованы в качестве носителей генов, включают поли(L-лизин) (PLL), полиэтиленимин (PEI), хитозан, РАМАМ дендримеры и поли(2-диметиламино)этилметакрилат (pDMAEMA). К сожалению, обычно с PLL эффективность трансфекции является слабой, и высокомолекулярный PLL проявляет значительную токсичность для клеток. В некоторых случаях PEI, молекулярный вес которого находится в диапазоне от 20000 до 25000 дальтон, обеспечивает эффективный перенос генов без необходимости использования эндосомолитических или направляющих агентов. Смотри Boussif О., Lezoualc'h F., Zanta M. A., Mergny M.D., Scherman D., Demeneix В., Behr J.P., ProcNatl Acad Sci USA. Aug. 1, 1995, 92(16) 7297-301. Однако PEI, молекулярный вес которых находится в диапазоне от 400 до 2000 дальтон, являются неэффективными для доставки плазмидных ДНК. В качестве систем для доставки генов был изучен ряд дендримеров полиамидоамина. Смотри Eichman J.D., Bielinska A.U., Kukowska-Latallo J.F., Baker J.R. Jr., Pharm. Sci. Technol. Today 2000 July; 3(7):232-245. К сожалению, было показано, что как PEI, так и дендримеры являются токсичными для клеток, что, таким образом, ограничивает возможность использования PEI в качестве средства доставки генов применительно к пациентам людям. Кроме этого стоимость дендримеров полиамидоамина, обладающих коммерчески эффективным уровнем трансфекции генов, является относительно высокой.
Для доставки генов в клетки млекопитающих были описаны носители для генов, таких как плазмидные ДНК, сделанные с разрушаемыми катионными полимерами с пониженной цитотоксичностью. Смотри Lim Y.B., Kim S.M., Lee W.K., Yang T.G., Lee M.J., Suh H., Park J.S., Am. Chem. Soc., 123 (10), 2460-2461, 2001. К сожалению, данные разрушаемые системы также проявляют низкую эффективность трансфекции плазмидных ДНК по сравнению с неразрушаемыми полимерами. Для улучшения эффективности трансфекции низкомолекулярных PEI, Gosselin и др. показали, что высокомолекулярные PEI могут быть получены посредством использования дисульфид-содержащих линкеров с низкомолекулярным PEI. Смотри Gosselin, Micheal A., Guo, Menjin, and Lee, Robert J. Bioconjugate Chem. 2001. 12:232-245. PEI полимеры, полученные с использованием дитиобис(сукцинимидилпропионата) DSP и диметил-3,3′-дитиобиспропионимидата-2HCl (DTBP), показывали сравнимую эффективность генной трансфекции и пониженную цитотоксичность. Однако дисульфид-содержащие линкеры являются дорогостоящими, что делает крупномасштабное получение данных систем затруднительным и неприемлемым. Полимеры с дисульфид-содержащими линкерами являются разрушаемыми только при восстановительных условиях, что ограничивает применение полимера при других условиях.
Lynn и др. описали способ синтеза биоразрушаемых катионных полимеров с использованием диакрилатов в качестве молекул-линкеров между катионными соединениями. Смотри Lynn, David A.; Anderson, Daniel G.; Putnam, David; and Langer, Robert. J. Am. Chem. Soc. 2001, 123, 8155-8156. Однако синтез данных полимеров для завершения требует дни, и количества эффективного продукта, которые могут быть использованы для доставки генов, являются низкими. Согласно способам Lynn и др. были получены более одной сотни катионных полимеров, однако лишь только два из этих полимеров показали эффективный уровень трансфекции генов.
Для катионных полимеров, таких как PEI, не было показано, что они являются эффективными для доставки малой интерферирующей РНК. Биоразрушаемые катионные полимеры, полученные согласно способам Lynn и др., не были использованы для доставки малой интерферирующей РНК или олигонуклеотидов.
Таким образом, остается потребность в катионных полимерах, которые могут быть использованы для безопасного и эффективного облегчения доставки малой интерферирующей РНК или олигонуклеотидов в клетки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение раскрывает некоторые полимерные композиции, которые способны доставлять олигонуклеотиды в клетки. В некоторых вариантах полимер также может образовывать комплекс с другими остатками, такими как агенты для улучшения доставки, и/или соединениями для диагностической визуализации. Кроме этого авторы открыли способы доставки олигонуклеотидов в клетку(и) с использованием полимерных композиций.
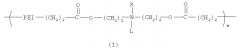
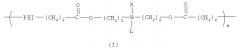
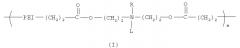
Один из вариантов настоящего изобретения включает полимер, содержащий повторяющееся звено, выбранное из группы, состоящей из формулы (I):
где PEI может быть повторяющимся звеном полиэтиленимина, имеющим молекулярный вес менее чем 600 дальтон. R может быть выбран из группы, состоящей из пары электронов, водорода, С2-С10 алкила, С2-С10 гетероалкила, С5-С30 арила и С2-С30 гетероарила, L может быть выбран из группы, состоящей из С2-С50 алкила, C2-C50 гетероалкила, С2-С20 алкенила, C2-C50 гетероалкенила, C5-C50 арила, C2-C50 гетероарила, С2-С50 алкинила, C2-C50 гетероалкинила, C2-C50 карбоксиалкенила и C2-C50 карбоксигетероалкенила, и m является целым числом, которое может находиться в диапазоне от примерно 1 до примерно 30.
В одном из вариантов PEI может включать, по крайней мере, одно повторяющееся звено, выбранное из группы, состоящей из формулы (IIa) и формулы (IIb):
где x является целым числом в диапазоне от примерно 1 до примерно 12, у является целым числом в диапазоне от примерно 1 до примерно 6 и z является целым числом в диапазоне от примерно 1 до примерно 13.
В некоторых вариантах полимер может быть биоразрушаемым. Подходящие механизмы, посредством которых полимер может разрушаться, включают, но не ограничиваются ими, гидролиз, ферментативное расщепление, восстановление, фоторасщепление и разрушение ультразвуком. В некоторых вариантах L может быть выбран из группы, состоящей из С2-С50 алкила, С2-С50 гетероалкила, C2-C50 алкенила, С2-С50 гетероалкенила, С2-С50 алкинила и C2-C50 гетероалкинила. В некоторых вариантах L может быть выбран из группы, состоящей из жирных кислот от С12 до C18, холестерина и их производных.
В одном из вариантов полимер может иметь средневесовой молекулярный вес в диапазоне от примерно 500 дальтон до примерно 1000000 дальтон. В другом варианте полимер может иметь средневесовой молекулярный вес в диапазоне от примерно 1000 дальтон до примерно 200000 дальтон.
В некоторых вариантах полимер может быть сетчатым полимером с поперечными связями.
Другой вариант настоящего изобретения включает полимер, который также может содержать олигонуклеотид, который образует комплекс с полимером. Примеры подходящих олигонуклеотидов включают, но не ограничиваются ими, олигомеры РНК, такие как малая интерферирующая РНК, и олигомеры ДНК, такие как антисенс.
Помимо олигонуклеотидов полимер также может содержать агент, улучшающий доставку, способный проникать в клетку эукариот. При необходимости полимер также может содержать диагностическое соединение для визуализации, которое может образовывать комплекс с полимером. Агент, улучшающий доставку, может облегчать одну или несколько из следующих функций в клетке эукариот: узнавание рецептором, интернализацию, выход олигонуклеотида из эндосомы клетки, ядерную локализацию, высвобождение олигонуклеотида и стабилизацию системы. Примеры олигонуклеотидов включают, но не ограничиваются ими, малую интерферирующую РНК и антисенс. В других вариантах агент, улучшающий доставку, может быть присоединен к полимеру.
Один из вариантов настоящего изобретения включает способ трансфекции клетки эукариот, включающий контакт клетки с полимером, в результате чего олигонуклеотид доставляется в клетку, где полимер также может содержать олигонуклеотид.
Другой вариант настоящего изобретения включает способ лечения млекопитающего, включающий установление млекопитающего, нуждающегося в генной терапии, и введение полимера, который соединен с олигонуклеотидом, необходимым млекопитающему, где олигонуклеотид включает малую интерферирующую РНК, которая является эффективной для понижения или подавления экспрессии интересующего гена.
В некоторых вариантах полимер также может включать диагностическое соединение для визуализации, которое образует комплекс с полимером. Один из вариантов настоящего изобретения включает способ доставки диагностического соединения для визуализации млекопитающему, включающий введение полимера млекопитающему, где полимер образует комплекс с диагностическим соединением для визуализации.
Один из вариантов настоящего изобретения включает библиотеку полимеров, содержащую множество полимеров, где, по крайней мере, один из параметров, выбранный из группы, состоящей из R, L, PEI и m, отличается от, по крайней мере, двух параметров полимера.
Другой вариант настоящего изобретения включает медицинскую диагностическую систему, содержащую полимер и лиганд, который может распознавать специфический рецептор клетки эукариот. При необходимости полимер может быть соединен с лигандом.
В еще одном варианте настоящего изобретения фармацевтическая композиция может содержать сенсибилизирующий агент и полимер. Сенсибилизирующий агент может быть чувствительным к облучению видимым светом, ультрафиолетовому облучению или к обоим излучениям. В одном варианте фармацевтическая композиция может содержать сенсибилизирующий агент и полимер, где полимер может иметь сродство к олигонуклеотиду.
В одном из вариантов диагностическая композиция для визуализации может содержать контрастирующий агент для визуализации и полимер. При необходимости диагностическая композиция для визуализации также может содержать агент направленной доставки.
Один из вариантов настоящего изобретения включает полимер, содержащий повторяющееся звено, выбранное из группы, состоящей из формулы (I):
где PEI является повторяющимся звеном полиэтиленимина, содержащим, по крайней мере, одно повторяющееся звено формулы (IIb):
где z является целым числом в диапазоне от 1 до 13. R может быть выбран из группы, состоящей из пары электронов, водорода, С2-С10 алкила, С2-С10 гетероалкила, C5-С30 арила и С2-С30 гетероарила. L может быть выбран из группы, состоящей из С2-С50 алкила, C2-C50 гетероалкила, С2-С50 алкенила, С2-С50 гетероалкенила, С5-С50 арила, С2-С50 гетероарила, С2-С50 алкинила, С2-С50 гетероалкинила, С2-С50 карбоксиалкенила и С2-С50 карбоксигетероалкенила; и m является целым числом, которое может находится в диапазоне от примерно 1 до примерно 30.
В одном из вариантов PEI, содержащий, по крайней мере, одно повторяющееся звено формулы (IIb), может иметь молекулярный вес менее чем 600 Дальтон.
В некоторых вариантах PEI также содержит повторяющееся звено формулы IIa:
где x может быть целым числом в диапазоне от примерно 1 до примерно 12 и у может быть целым числом в диапазоне от примерно 1 до примерно 6.
В одном варианте полимер, где PEI содержит повторяющееся звено формулы (IIa), может иметь молекулярный вес менее чем 600 дальтон.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 является фотографией усиленной экспрессии зеленых флуоресцирующих белков (EFFP) в клетках HT-1080EGFP после обработки малой интерферирующей РНК, входящей в комплекс с липополимерами (YT-10, YT-11, YT-22, YT-23, YT-24 и YT-25), липофектамином 2000 (положительный контроль) и без какой-либо обработки (отрицательный контроль).
Фиг.2 является фотографией усиленной экспрессии зеленых флуоресцирующих белков (EFFP) в клетках HeLa-EGFP после обработки малой интерферирующей РНК, входящей в комплекс с липополимерами (YT-10, YT-11, YT-22, YT-23, YT-24 и YT-25), липофектамином 2000 (положительный контроль) и без какой-либо обработки (отрицательный контроль).
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВАРИАНТА ОСУЩЕСТВЛЕНИЯ
Данный вариант обеспечивает катионные полимеры, содержащие полиэтиленимин, биоразрушаемую группу и относительно гидрофобную «липо» группу. Предпочтительные катионные липополимеры содержат повторяющееся звено, выбранное из группы, состоящей из формулы (I):
В формуле (I) PEI является полиэтиленимином, сложноэфирная связь является биоразрушаемой группой и L представляет относительно гидрофобную «липо» группу. Например, в некоторых вариантах L выбран из группы, состоящей из С2-С50 алкила, С2-С50 гетероалкила, C2-C50 алкенила, C2-C50 гетероалкенила, C5-C50 арила, C2-C50 гетероарила, C2-C50 алкинила, C2-C50 гетероалкинила, С2-С50 карбоксиалкенила и С2-С50 карбоксигетероалкенила. В предпочтительном варианте L выбран из группы, состоящей из С2-С50 алкила, C2-C50 гетероалкила, С2-С50 алкенила, С2-С50 гетероалкенила, C2-C50 алкинила и C2-C50 гетероалкинила. В более предпочтительном варианте L выбран из группы, состоящей из жирной кислоты от C12 до C18, холестерина и их производных.
В формуле (I) R может представлять пару электронов или атом водорода. Для специалиста в данной области техники ясно, что если R представляет пару электронов, то повторяющееся звено формулы (I) является катионным при низких pH. Также в формуле (I) R может представлять относительно гидрофобную липогруппу, такую как С2-С10 алкил, С2-С10 гетероалкил, С5-С30 арил и С2-С30 гетероарил, в данном случае будет очевидно, что атом азота несет катионный заряд, как правило, в широком диапазоне pH.
PEI может содержать, по крайней мере, одно повторяющееся звено формулы (IIa) и/или (IIb), в которых x является целым числом в диапазоне от примерно 1 до примерно 12, у является целым числом в диапазоне от примерно 1 до примерно 6 и z является целым числом в диапазоне от примерно 1 до примерно 13.
Очевидно, что используемая здесь «формула II» относится к PEI, который содержит формулу (IIb) и (IIa) по отдельности или вместе.
Катионные липополимеры, содержащие повторяющиеся звенья формулы (I), могут быть получены по реакции мономера диакрилата формулы (III) с полиэтиленимином (PEI), как показано на Схеме А ниже:
Схема А
В формуле (III) R и L имеют такие же значения, как указано выше для катионных липополимеров, содержащих повторяющиеся звенья формулы (I). На Схеме А показано получение полимера, содержащего повторяющееся звено формулы (I).
Показанная на Схеме А реакция может быть проведена посредством перемешивания PEI и диакрилата (III) в общем растворителе, таком как этанол, при перемешивании предпочтительно при комнатной температуре в течение нескольких часов, последующего упаривания растворителя для выделения полученного полимера.
Настоящее изобретение не является связанным с какой-либо теорией, однако считается, что реакция между PEI и диакрилатом (III) включает реакцию Михаэля между одним или несколькими аминами PEI с двойной(ными) связью(ями) диакрилата. Смотри J. March, Advanced Organic Chemistry 3rd Ed., p.711-712 (1985). Приведенный на Схеме А диакрилат может быть получен, как показано в Примерах, описанных далее.
Согласно Схеме А посредством варьирования молекулярного веса и структуры PEI, размера и типа групп R и L в диакрилате (III) и отношения диакрилата (III) к PEI можно получить большое разнообразие полимеров, содержащих повторяющееся звено формулы (I). Могут быть использованы смеси различных диакрилатов и/или смеси различных PEI. PEI могут быть многофункциональными и, таким образом, могут быть способны реагировать с двумя или несколькими диакрилатами. Для получения сетчатых катионных липополимеров могут быть использованы кросс-сшивающие агенты и/или могут подбираться относительные соотношения многофункционального PEI и диакрилата (III) для получения сетчатых катионных липополимеров. Предпочтительно молекулярный вес PEI менее чем 600 дальтон. Предпочтительно мольное отношение PEI к диакрилату находится в диапазоне от примерно 1:0,5 до примерно 1:20. Средне-весовой молекулярный вес катионного липополимера может находиться в диапазоне от примерно 500 дальтон до примерно 1000000 дальтон, предпочтительно в диапазоне от примерно 1000 дальтон до примерно 200000 дальтон. Молекулярный вес может быть определен посредством эксклюзионной хроматографии с использованием ПЭГ стандартов или с помощью электрофореза на агарозном геле. В предпочтительном варианте изобретения обеспечивается библиотека полимеров посредством получения множества катионных липополимеров, в которых R, L, PEI и/или m являются отличными от, по крайней мере, остальных двух параметров полимеров.
Катионный липополимер является разрушаемым, более предпочтительно био-разрушаемым, например разрушаемым посредством механизма, выбранного из группы, состоящей из гидролиза, ферментативного расщепления, восстановления, фоторасщепления и разрушения ультразвуком. Настоящее изобретение не ограничивается теорией, однако считается, что разрушение катионных липополимеров формулы (I) внутри клетки протекает посредством ферментативного расщепления и/или гидролиза сложноэфирных связей.
Катионные липополимеры могут образовывать комплексы с олигонуклеотидами и, таким образом, являться пригодными в качестве носителей для доставки олигонуклеотидов в клетку. Например, полимер может быть использован для лечения млекопитающего, нуждающегося в генной терапии, посредством введения млекопитающему комплекса полимера с олигонуклеотидом, таким как малая интерферирующая РНК, которая эффективна для понижения или подавления экспрессии интересующего гена. Катионные липополимеры, которые содержат олигонуклеотид, входящий в комплекс с полимером, могут быть получены посредством перемешивания катионных липополимеров и олигонуклеотидов в общем растворителе, более предпочтительно посредством способов, описанных далее в примерах.
Катионные липополимеры, которые содержат олигонуклеотиды, присоединенные к полимеру, также могут содержать агенты для улучшения доставки, способные проникать в клетку эукариот. Агенты для улучшения доставки могут быть растворены или смешаны с комплексом или могут быть связаны (например, ковалентно присоединены или образуют комплекс) с катионным липополимером. Агенты для улучшения доставки являются веществами, которые способствуют транспортировке олигонуклеотида в клетку обычно посредством улучшения транспортировки комплекса олигонуклеотид/носитель через мембрану, снижения разрушения во время транспортировки и/или способствуют высвобождению олигонуклеотида из носителя. Предпочтительно транспорт олигонуклеотида, такого как малая интерферирующая РНК, в клетку включает высвобождение олигонуклеотида из носителя после того, как комплекс олигонуклеотид/носитель преодолел клеточную мембрану, мембрану эндосомы и ядерную мембрану. Например, в случае малой интерферирующей РНК комплекс малая интерферирующая РНК/носитель сначала проходит через мембрану клетки. Если это заканчивается эндоцитозом, то комплекс малая интерферирующая РНК/носитель является интернализованным. Носитель, нагруженный малой интерферирующей РНК, окружается клеточной мембраной с образованием пузырька, и затем пузырек отщепляется. В результате образуется клеточная эндосома, которая является большой мембранной структурой, включающей малую интерферирующую РНК и носитель.
В основном агенты для улучшения транспортировки подразделяются на две категории: системы вирусных носителей и системы невирусных носителей. Так как вирусы человека в ходе эволюции разработали пути преодоления вышеуказанных барьеров для транспорта в ядра, вирусы или вирусные компоненты являются пригодными для транспортировки нуклеиновых кислот в клетки. Одним из примеров вирусного компонента, пригодного в качестве агента для улучшения доставки, является белок гемагглютинин (HA-peptide). Данный вирусный белок способствует транспортировке биомолекул в клетки посредством разрушения эндосомы. При кислых значениях pH эндосомы данный белок вызывает высвобождение биологических молекул и носителя в цитозоль. Другие примеры вирусных компонент, пригодных в качестве агентов для улучшения доставки, известны специалисту в данной области техники.
Невирусные агенты для улучшения доставки обычно являются как основанными на полимерах, так и основанными на липидах. В основном они являются поликатионами, которые выступают для сбалансирования отрицательного заряда нуклеиновой кислоты. Поликатионные полимеры показали значительные обнадеживающие результаты в качестве невирусных агентов для улучшения доставки генов, в частности, из-за их способности уплотнять плазмидные ДНК неограниченного размера и из-за соображений безопасности относительно вирусных векторов. Примеры включают пептиды с участками, богатыми основными аминокислотами, такими как олиголизин, олигоаргинин или их комбинациями и PEI. Считается, что данные поликатионные полимеры способствуют транспортировке посредством уплотнения ДНК. Версии поликатионов с разветвленными цепями, такие как PEI и звездообразные дендримеры, могут опосредовать как сжатие ДНК, так и выход из эндосомы. Смотри Boussif и др., (1995) Proc. Natl. Acad. Sci. USA vol.92: 7297-7301. PEI может быть получен в виде сильноразветвленного полимера с терминальными аминогруппами, которые ионизируются при pH 6,9, и внутренними аминами, которые ионизируются при pH 3,9. Вследствие такой организации PEI может создавать изменение в значении pH везикулы, что приводит к набуханию везикулы и, в конечном счете, высвобождению из окружения эндосомы.
Другим путем улучшения доставки для катионных липополимеров является включение лигандов, которые распознаются рецепторами на клетке, которые являются целью для доставки олигонуклеотида. Затем доставка олигонуклеотида в клетку может быть инициирована посредством узнавания рецептором. В данном контексте термин «лиганд» относится к биомолекуле, которая может связываться со специфическим рецепторным белком, локализованным на поверхности клетки мишени или в ее ядре или цитозоле. В варианте изобретения лиганд может быть антителом, гормоном, феромоном или нейромедиатором или любой другой биомолекулой, способной выступать в качестве лиганда, который связывается с рецептором. В предпочтительном примере лигандом является олигонуклеотид. Под антителом имеется в виду любой белок, продуцируемый В лимфоцитом в ответ на антиген. При связывании лиганда с определенным клеточным рецептором стимулируется эндоцитоз. Примерами лигандов, которые были использованы с различными типами клеток для улучшения транспорта олигонуклеотида, являются галактоза, трансферрин, гликопротеин азиалооросомукоид, нить аденовируса, малярийный белок спорозонта, эпидермальный фактор роста, капсид человеческого вируса папилломы, фактор роста фибробластов и фолевая кислота. В случае фолатного рецептора связанный лиганд интернализуется в ходе процесса, называемого потоцитоз, при котором рецептор связывается с лигандом, расположенный рядом участок мембраны отделяется от клеточной мембраны, и затем интернализованное вещество проходит через мембрану везикулы в цитоплазму. Смотри Gottschalk и др. (1994) Gene Ther 1:185-192. В одном варианте полимер формулы (I) и лиганд, который распознается специфическим рецептором клетки эукариот, могут быть использованы в качестве медицинской системы диагностики.
Считается, что для разрушения эндосомы существуют различные агенты, улучшающие доставку. Например, помимо НА-белка, писанного выше, в качестве эндосомолитических агентов также были использованы частицы дефектного вируса. Смотри Cotton и др. (July 1992) Proc. Natl. Acad. Sci. USA, vol. 89: p. 6094-6098. Обычно невирусные агенты являются либо амфифильными, либо липидной природы.
Высвобождение олигонуклеотидов, таких как малая интерферирующая РНК, в цитоплазму клетки может усиливаться агентами, которые опосредуют разрыв эндосомы, уменьшают разрушение или осуществляют данные процессы вместе. Хлорхинон, который повышает pH эндосомы, использовался для снижения степени разрушения вещества, захваченного в ходе эндоцитоза, посредством ингибирования лизосомальных гидролитических ферментов. Смотри Wagner и др. (1990) Proc Natl Acad Sci USA, vol.87: 3410-3414. Поликатионы с разветвленными цепями, такие как PEI, и звездообразные дендримеры также способствуют высвобождению из эндосомы, как описано выше.
Эндосомальное разрушение может протекать посредством включения субъединиц токсинов, таких как Дифтерийный токсин и Синегнойный экзотоксин, в качестве компонентов химерных белков, которые могут быть включены в катионный комплекс липополимер/биомолекула. Смотри Uherek и др. (1998) J Biol. Chem. Vol.273: 8835-8841. Данные компоненты способствуют продвижению нуклеиновой кислоты через мембрану эндосомы и обратно через эндоплазматический ретикулум.
При попадании в цитоплазму транспортировка олигонуклеотида в ядра может быть улучшена посредством включения сигнала ядерной локализации в олигонуклеотидный носитель. Например, может быть использована специфическая аминокислотная последовательность, которая выполняет функцию сигнала ядерной локализации (NLS). Считается, что NLS на комплексе олигонуклеотид/носитель взаимодействует со специфическими белковыми рецепторами ядерного транспорта, находящимися в цитозоле. Считается, что при сборе комплекса олигонуклеотид/носитель белковый рецептор в комплексе образует множественные контакты с нуклеопоринами, в результате чего происходит транспортировка комплекса через ядерную пору. После того как комплекс олигонуклеотид/носитель достигает своего назначения, он диссоциирует, высвобождает груз и другие компоненты. Для транспорта в ядро может быть использована последовательность Pro-Lys-Lys-Lys-Arg-Lys-Val (SEQ ID NO.: 1) из SV40 большого Т-антигена. Считается, что данная короткая последовательность из SV40 большого Т-антигена может обеспечивать сигнал, который вызывает транспортировку ассоциированных макромолекул в ядро.
Также катионные липополимеры могут содержать диагностическое соединение для визуализации, такое как флуоресцентный, радиоактивный или рентгеноконтрастный краситель, который образует комплекс с полимером. Комплекс может быть получен посредством перемешивания катионного липополимера и диагностического соединения для визуализации в совместном растворителе. Затем полимер (комплекс с диагностическим соединением для визуализации) может быть введен млекопитающему и отслежен с использованием хорошо известных способов, таких как PET, MRI, СТ, SPECT и т.д. (Смотри Molecular Imaging of Gene Expression and Protein Function In Vivo With PET and SPECT, Vijay Sharma, PhD, Gary D. Luker, MD and David Piwnica-Worms, MD, Ph.D, JOURNAL OFMAGNETIC RESONANCE IMAGING 16: 336-351 (2002)). Диагностическая композиция для визуализации также может быть получена посредством объединения полимера формулы (I) с контрастным агентом для визуализации (например, 1,4,7,10-Тетраазоциклододекан-1,4,7,10-тетрауксусная кислота (DOTA)-Gd (III) и диэтилентриаминпентауксусная кислота (DTPA) - Gd (III)). При необходимости диагностическая композиция для визуализации может также содержать агент направленной доставки. Подходящие агенты направленной доставки включают, но не ограничиваются ими, RGD пептид и галактозидные группы.
Другой вариант обеспечивает фармацевтическую композицию, содержащую: сенсибилизирующий агент и полимер, где полимер содержит повторяющееся звено формулы (I) и олигонуклеотид, и также может содержать агент, улучшающий доставку, способный проникать в клетку эукариот и/или диагностическое соединение для визуализации, которые образуют комплекс с полимером. Сенсибилизирующий агент может быть соединением, которое подвергается изменениям в свойствах при воздействии света (например, видимого и/или ультрафиолетового излучения) или другого возбуждения, способствуя доставке биомолекулы (например, посредством увеличения скорости разрушения полимера). Сам по себе сенсибилизирующий агент может быть биомолекулой, которая претерпевает изменение активности при возбуждении. Сенсибилизирующий агент может являться лекарством, активируемым светом. Подходящие активируемые светом лекарства включают, но не ограничиваются этим, флуресциин, мероцианин, ксантен и их производные и фотореакционноспособные макроциклы на основе производных пиррола и их производные. Подходящие фотореакционноспособные макроциклы на основе производных пиррола включают, но не ограничиваются ими, природные или синтетические порфирины, природные или синтетические хлорины, природные или синтетические бактериохлорины, синтетические изобактериохлорины, фталоцианины, нафталоцианины и расширенные макроциклические системы на основе производных пиррола, такие как порфицены, сапфирины и тексапфирины.
ПРИМЕРЫ
ПРИМЕР 1
К раствору олеиновой кислоты 1 (10,7 г, 38 ммоль) в дихлорметане (DCM, 200 мл) и N,N-диметилформамиде (DMF, три капли) при 0°С добавляют оксалилхлорид (13 мл, 152 ммоль). Реакционную смесь перемешивают в течение примерно 1 часа и затем нагревают до комнатной температуры. Спустя 1 час раствор разбавляют толуолом и упаривают. Остаток растворяют в дихлорметане (200 мл) и охлаждают до 0°С. К раствору добавляют диэтаноламин (10,9 мл, 114 моль), 4-(диметиламино)пиридин (490 мг, 4 ммоль) и триэтиламин (21 мл, 152 ммоль). Раствор перемешивают при 0°С в течение 30 минут и затем, давая нагреться до комнатной температуры, в течение ночи. Реакционную смесь разбавляют дихлорметаном и промывают 1н. HCl и водным NаНСО3. Органическую фазу сушат (Na2SO4) и концентрируют при пониженном давлении. Затем сырой остаток очищают на колонке с силикагелем (10:1 этилацетат:метанол), получая 13,5 г (99,9%) соединения 2 в виде бесцветного масла.
ПРИМЕР 2
Триэтиламин (8,1 г, 80 ммоль), ДМАП (0,5 г, 4 ммоль) и 2 (7,1 г, 20 ммоль) растворяют в 200 мл дихлорметана при комнатной температуре. Систему продувают аргоном и раствор охлаждают на ледяной бане. По каплям добавляют акриолилхлорид (5,4 г, 60 ммоль) в 25 мл дихлорметана. После добавления реакцию нагревают до комнатной температуры и перемешивают в течение ночи. Реакционную смесь разбавляют дихлорметаном и промывают водой и водным NaHCO3. Органическую фазу сушат (Na2SO4) и концентрируют при пониженном давлении. Затем сырой остаток очищают на колонке с силикагелем (1:3 этилацетат: гексан), получая 7,5 г (81%) соединения 3 (молекулярный вес: 463,65) в виде бесцветного масла.
ПРИМЕР 3
Синтез катионного липополимера проводят согласно Схеме А посредством реакции пентаэтиленгексамина (РЕНА), имеющего молекулярный вес 232 дальтона, с соединением 3, как указано далее. Около 0,1 ммоль (23 мг) РЕНА (Sigma-Aldrich) и около 0,2 ммоль (93 мг) соединения 3 взвешивают и помещают в небольшие сосуды и быстро добавляют и растворяют в 1 мл этанола. Реакционную смесь перемешивают в течение 3 часов при комнатной температуре. Затем реакционную смесь нейтрализуют добавлением 5 мл 2М HCl в эфире. Белый осадок YT-10 собирают центрифугированием, промывают эфиром дважды и сушат при комнатной температуре при пониженном давлении.
Данное описание является общей методикой, которая служит моделью для других синтетических методик, включающих аналогичные соединения, и которая может быть использована для синтеза ряда разрушаемых катионных липополимеров.
Полимер YT-11 получают аналогично, за исключением того, что в реакции используют около 0,3 ммоль (139 мг) соединения 3. Также аналогичным образом используют другие типы PEI для синтеза липополимеров для YT-10, YT-11. Все синтезированные в Примере 3 липополимеры перечислены в Таблице 1. После полимеризации YT-26 являлся плотным гелем и не был нейтрализован.
| ТАБЛИЦА 1 | ||||
| Названиелипополимера | Тип PEI | Молекулярный вес PEI | Количество PEI | Количество соединения 3 |
| YT-26 | Полиэтиленимин 600 (PEI600) | 600 | 0,1 ммоль(60 мг) | 0,8 ммоль(371 мг) |
| YT-10 | Пентаэтилен гексамин( РЕНА) | 232 | 0,1 ммоль (23 мг) | 0,2 ммоль (93 мг) |
| YT-11 | Пентаэтилен гексамин (РЕНА) | 232 | 0,1 ммоль (23 мг) | 0,3 ммоль (139 мг) |
| YT-22 | Тетраэтилен пентамин (ТЕРА) | 189 | 0,1 ммоль (18,9 мг) | 0,2 ммоль (93 мг) |
| YT-23 | Триэтилен тетрамин (ТЕТА) | 146 | 0,1 ммоль (14,6 мг) | 0,2 ммоль (93 мг) |
| YT-24 | Диэтилентетрамин (DETA) | 103 | 0,1 ммоль (10,3 мг) | 0,1 ммоль (46 мг) |
| YT-25 | Этилендиамин (EDA) | 60 | 0,1 ммоль (6,0 мг) | 0,1 ммоль (46 мг) |
ПРИМЕР 4
Стабильная линия клеток EGFP: HT-1080-EGFP и HeLa-EGFP стабильные линии клеток получают из клеток НТ-1080 и HeLa соответственно, со стабильной улучшенной экспрессией гена зеленого флуоресцирующего белка (EGFP), полученного трансфецированием pEGFP-N1 плазмидной ДНК (BD Biosciences Clotech) в клетки НТ-1080 и HeLa. Трансфецированные клетки отбирают и клонируют с использованием способности противостоять неомицину, проводя на pEGFP-N1 плазмидах. Культуры клеток поддерживают в среде Игла, модифицированной по способу Дульбекко (DMEM), содержащей 10% бычей сыворотки, 100 частей/мл пенициллина и 100 µг/мл стрептомицина при 37°С, 5% СО2. Экспрессию EGFP можно наблюдать с использованием флуоресцентного микроскопа (Olympus). Клетки HT-1080-EGFP и HeLa-EGFP проявляют яркую зеленую флуоресценцию при комбинировании возбуждения под действием синего света и установки зеленого фильтра испускания.
ПРИМЕР 5
Исследование доставки малой интерферирующей РНК: EGFP ген для направленной доставки малой интерферирующей РНК синтезируют с помощью Dharmacon Research Inc. EGFP гена для направленной доставки малой интерферирующей РНК и люциферазного гена, являющегося двухцепочечной РНК, состоящей из 21 пары оснований, последовательность ее кодирующей цепи является NNC GAG AAG CGC GAU САС AUG (SEQ ID NO.: 2).
Перед трансфекцией в 96-луночные планшеты рассеивают клетки НТ-1080-EGFP и HeLa-EGFP по 1,5×104 на каждую лунку. Для каждой лунки аликвоту 7,5 µл раствора, содержащего раствор 1,5 µг липополимера, добавляют к раствору 7,5 µл ДНК, содержащего 15 пикомоль малой интерферирующей РН