Клатратный комплекс циклодекстрина или арабиногалактана с 9-фенил-симм-октагидроселеноксантеном, способ его получения (варианты), фармацевтическая композиция и лекарственное средство
Иллюстрации
Показать всеИзобретение относится к новому клатратному комплексу α-, β-, γ- или гидроксипропил-β-циклодекстрина или арабиногалактана с 9-фенил-симм-октагидроселеноксантеном формулы (1)
возможно в виде α-кристаллической формы. Массовое соотношение 9-фенил-симм-октагидроселеноксантен: циклодекстрин составляет от 1:3 до 1:30, или массовое соотношение 9-фенил-симм-октагидроселеноксантен: арабиногалактан составляет от 1:10 до 1:20. Также предложены жидкофазный способ получения комплекса, твердофазный способ получения комплекса, фармацевтическая композиция и лекарственное средство. Изобретение позволяет увеличить растворимость в воде, улучшить биодоступность и уменьшить токсическое воздействие производного симм-октагидроселеноксантена. 5 н. и 11 з.п. ф-лы, 14 ил., 3 табл., 1 пр.
Реферат
Изобретение относится к новым клатратным комплексам циклодекстрина или арабиногалактана с 9-фенил-симм-октагидроселеноксантеном, которые могут найти применение в фармацевтической промышленности, и способам их получения. Изобретение также относится к композициям и лекарственным средствам на основе новых клатратных комплексов циклодекстринов и арабиногалактана с 9-фенил-симм-октагидроселеноксантеном. Для получения комплексов могут быть использованы α-, β- или γ-циклодекстрины, гидроксипропил-β-циклодекстрин, арабиногалактан лиственницы сибирской.
Получение клатратных комплексов в решении проблем транспорта лекарственных средств оказывает существенное влияние практически на каждый способ введения от перорального до инъекционного. Благодаря физико-химическим свойствам клатратные комплексы циклодекстринов и АГ могут быть использованы для повышения всасываемости лекарственных средств, характеризующихся низкой биодоступностью, и тем самым позволяют снизить дозы применяемых лекарственных средств (см., например, Groman E.V., Enriquez P.M., Jung Chu, Josephson L. Arabinogalactan for hepatic drug delivery, Bioconjugate Chem. 1994. №5. P.547-556, Медведева C.A., Александрова Г.П., Дубровина В.И., Четверикова Т.Д., Грищенко Л.А., Красникова И.М., Феоктистова Л.П., Тюкавкина Н.А.). В Butlerov Commun. (2002. №7. P.45-49) описана перспективность АГ как полимерной матрицы для биогенных металлов. Новые формы и пути транспортирования лекарственных средств могут расширить терапевтический потенциал назначаемого лечения, позволяя доставлять новые виды лекарств в ранее недоступные области в организме человека.
Используемые для получения циклодекстрины и арабиногалактан являются известными комплексообразователями. Известно, что молекулы циклодекстринов имеют тороидальную форму, причем ее внутренняя полость гидрофобна. Водорастворимые межмолекулярные комплексы липофильных органических соединений образуются в растворе за счет интеркаляции их молекул в эту полость. Арабиногалактан (далее АГ) является полисахаридным метаболитом эндемиков сибирской лесной флоры лиственницы сибирской (Larix sibirica) и лиственницы Гмелина (Larix Gmelinii) и легко выделяется из древесины указанных деревьев. Химически АГ представляет собой полисахарид гребенчатого строения с м.м. 9-18 кД. Главная цепь состоит из звеньев галактозы, боковые цепи - из звеньев арабинозы и галактозы. Особенность разветвленной структуры и наличие в них многочисленных концевых галактозных и арабинозных групп АГ способствует образованию прочных межмолекулярных комплексов лекарственных препаратов, молекулы которых, вероятнее всего, связываются межмолекулярными водородными связями в пространстве, образованном боковыми цепями. Учитывая конформационную подвижность макромолекул арабиногалактана, это пространство может варьироваться, способствуя образованию межмолекулярных клатратных комплексов с широким кругом веществ. В модельных экспериментах АГ из лиственницы показал высокую мембранотропность (Колхир В.К., Тюкавкина Н.А., Багинская А.И., Минеева М.Ф. и др. К оценке фармакологических свойств арабиногалактана. Тез. докл. III Росс. нац. конгресса «Человек и лекарство». М., 1996. С.27). Известно, что способность ряда веществ к избирательному проникновению через мембранные барьеры обусловлена наличием в их структуре звеньев галактозы (Грищенко Л.А. Гидродинамические и молекулярно-массовые характеристики железопроизводного арабиногалактана. Тез. докл. Молодежн. научн. конф. по органич. химии «Байкальские чтения 2000». Иркутск, 2000. С.26). Показано, что АГ из западной лиственницы может служить целенаправленным носителем для доставки диагностических и терапевтических агентов, а также ферментов, нуклеиновых кислот, витаминов или гормонов к определенным клеткам, в частности к гепатоцитам (паренхимным клеткам печени). При этом образуется комплекс между доставляемым агентом и арабиногалактаном, способным взаимодействовать с асиалогликопротеиновым рецептором клетки (см., например, Groman E.V., Menz Е.Т., Enriquez P.M., Jung С. Delivery of therapeutic agents to receptors using polysaccharides, Pat. 5544386 US. 1996 / CA 1996. V.125. P.284-915z). В Butlerov Commun. (2002. №7. P.45-49) описана перспективность АГ как полимерной матрицы для биогенных металлов.
Перспектива развития систем целевой доставки и систем транспортирования через слизистые оболочки описана в заявке РФ 2005115883, опубл. в 2006. Общий потенциал систем транспортирования лекарственных средств на основе комплексов включения циклодекстринов также оценивался в патенте РФ 2121830, опубл. в 1998. Комплексы активных веществ с циклодекстринами и АГ нашли свое применение не только в фармацевтике, но и в косметологии. Например, существуют и пользуются спросом комплексы фитоаминокислот, включенных в состав циклодекстриновой капсулы. Известны аналогичные комплексы циклодекстрина с моносахаридами, уроновыми кислотами.
В патенте РФ 2121830, опубл. 1998, описана водорастворимая лекарственная композиция и способ ее получения для таких известных препаратов, как Сибазон, Азалептин, Мезапам, Индометацин. Фармакологические испытания полученных комплексов на лабораторных животных показали снижение терапевтической дозы ЛС в несколько раз.
Известны комплексы β-циклодекстрина с нестероидными противовоспалительными средствами (парацетамол, ибупрофен, кетопрофен, флуфенамовая и мефенамовая кислоты и др.), стероидами, простагландинами и простациклинами, барбитуратами, сульфонамидами, сердечными гликозидами и другими препаратами (см., например, патенты US 4524068, US 4727064, патент РФ 2337710, опубл. в 2008, J.Szejtli, Industrial Applications of cyclodextrins. - In Inclusion Compounds, v.3. ed. Atwood J.L., Davies J.E., Mcnicob D.D., Academic Press, N-Y., 1984, p.331-390).
Известно также множество публикаций о соединениях включения (клатратных комплексах) α- или β-циклодекстринов с противовирусными соединениями, способах их получения и применении (см., например, заявку РФ 2005114097, патенты РФ 2288921, 2377243, 2247576, DE 19814815 A1, DE 19814814 A1, US 4956351, US 5221669, заявки US 2005/0209189, US 2005/0281872, US 2009/0286757, JP 10-045319, JP 58-092691, JP-2005-179329, JP-9-015632).
Jung Chu, Enriquez P.M., Palmacci P., Josephson L., Lewis J.M. Arabinogalactan derivatives and uses thereof, Pat. 5478576 USA. 1995, описывает конъюгаты АГ с аденозинмонофосфатом (АМФ) или аденин-9-β-D-арабинофуранозид-5'-монофосфатом, которые обладают антивирусной активностью, и конъюгаты с S-2-(3-аминопропиламино)этилтиофосфорной кислотой с радиозащитными свойствами.
Ehrenfreund-Kleinman Т., Azzam Т., Falk R., Golenser J., Domb A.J. Synthesis and characterization of novel watersoluble amphotericin В - arabinogalactan conjugates // Biomaterials. 2002. V.23. №5. P.1327-1335, описывает водорастворимый комплекс АГ с нерастворимым антибиотиком амфотерицином В, применяющимся для лечения грибковых заболеваний. Использование такого комплекса облегчает его применение, значительно снижает токсичность и повышает эффективность лекарственного средства.
В патенте РФ 2278669 описан жидкофазный метод получения водорастворимого соединения серебра на основе АГ, представляющего собой водорастворимые частицы размером 10-30 нм. В патенте РФ 2337710 описан твердофазный метод получения водорастворимой лекарственной композиции с повышенной фармакологической активностью, состоящей из малорастворимых в воде лекарственных субстанций, таких как Сибазон, Индометацин, Мезапам, Азалептин в виде водорастворимых межмолекулярных комплексов с АГ в соотношении от 1:5 до 1:20 по весу соответственно. В патенте РФ 2128664, опубл. 10.04.1999, описаны соединения включения 9-(2-оксиэтоксиметилгуанина (ацикловиров)) с β-циклодекстрином, обладающего антигерпесной активностью, а также жидкофазный и твердофазный способы их получения.
Жидкофазный способ заключается в поэтапном растворении компонентов при определенном соотношении в воде или водно-спиртовых растворах при нагревании с последующей концентрацией образовавшегося продукта и выделением готового продукта. Твердофазный метод заключается в механическом измельчении смеси кристаллического ацикловира и β-циклодекстрина в вибромельнице. При этом продукт остается кристаллическим в виде мелкодисперсного подвижного порошка. В патентах РФ 2242974, 2357968, 2377243 описаны кристаллические формы и наноформы клатратов циклодекстрина и противовоспалительных средств. Согласно патенту РФ 2377243 описывается твердофазный способ, который включает получение твердых дисперсий компонентов с последующим необязательным размалыванием или растиранием данной дисперсии.
В патентах РФ 2213092, 2239632, 2281007 описаны способы получения замещенных симм-октагидроселеноксантенов, в том числе 9-фенил-симм-октагидроселеноксантена (известный также под названием селенопиран), которые могут быть использованы в медицине, фармакологии, пищевой и косметической промышленности. О.В.Мераленко (Лаборатория БАВ Белгородской сельскохозяйственной академии) было указано на высокую токсичность 9-фенил-симм-октагидроселеноксантена. В патенте РФ 2374238 описана альфа-кристаллическая форма указанного соединения, обладающего низкой токсичностью, а также антиоксидантным, детоксицирующим, иммуномодулирующим, антиатерогенным, антисклеротическим, анаболическим и гиполипедимическим действием.
Задачей настоящего изобретения является изыскание новых клатратных комплексов циклодекстринов или арабиногалактана с 9-фенил-симм-октагидроселеноксантеном, который может находиться в α-кристаллической форме, с целью увеличения растворимости в воде, улучшения биодоступности, уменьшения дозировки, а следовательно, и уменьшения токсического воздействия производного симм-октагидроселеноксантена. Задачей настоящего изобретения также является разработка новых способов получения указанных клатратных комплексов и применения в фармацевтических композициях и лекарственных средствах.
Предлагаемые согласно настоящему изобретению новые соединения представляют собой клатратный комплекс (или соединение включения) 9-фенил-симм-октагидроселеноксантена, соответствующего формуле 1 (который может находиться в α-кристаллической форме), с α-, β- или γ-циклодекстринами, гидроксипропил-β-циклодекстрином или арабиногалактаном лиственницы, преимущественно лиственницы сибирской (АГ) при мольном соотношении от 1:1 до 1:10 (массовые соотношения от 1:3 до 1:30) в случае α-, β- или γ-циклодекстрина или гидроксипропил-β-циклодекстрина и при массовом соотношении от 1:10 до 1:20 в случае арабиногалактана.
Преимущественными клатратными комплексами являются комплексы с β-циклодекстрином, имеющие мольные соотношения 9-фенил-симм-октагидроселеноксантен: β-циклодекстрин 1:3 и 1:5 (массовые соотношения 1:10 и 1:17) и массовые соотношения 9-фенил-симм-октагидроселеноксантен: АГ 1: 10 и 1:15. Такие соотношения позволяют нацело перевести 9-фенил-симм-октагидроселеноксантен в клатратный комплекс, что существенно влияет на его водорастворимость и биодоступность. Так растворимость 9-фенил-симм-октагидроселеноксантена в воде практически нулевая, тогда как растворимость в комплексе с β-циклодекстрином в массовом соотношении 1:10 составляет 0,443 г/л, а в комплексе в массовом соотношении 1:17 составляет 0,395 г/л. Для арабиногалактана эти показатели составляют 0,480 и 0,362 г/л для комплексов 1:10 и 1:15 соответственно.
Изобретение также относится к фармацевтическим композициям, содержащим вышеуказанные клатратный комплекс α-, β- или γ-циклодекстрина, гидроксипропил-β-циклодекстрина или АГ с 9-фенил-симм-октагидроселеноксантеном (который может находиться в α-кристаллической форме) при мольных соотношениях, указанных выше, возможно, в виде наночастиц с размером менее 100 нм, в эффективном количестве и фармацевтически приемлемый наполнитель и/или эксципиент.
Изобретение также относится к лекарственному средству в виде капсул и таблеток в фармацевтически приемлемой упаковке, содержащему клатратный комплекс α-, β- или γ-циклодекстрина, гидроксипропил-β-циклодекстрина или АГ с 9-фенил-симм-октагидроселеноксантеном (который может находиться в α-кристаллической форме) при мольных соотношениях, указанных выше, или фармацевтические композиции на основе указанного комплекса в эффективном количестве.
При этом обнаружено, что клатратные комплексы является пригодными для большинства лекарственных форм и путей введения.
Понятие «эффективное количество», используемое в данной заявке, подразумевает использование такого количества соединения формулы 1, которое вместе с его показателями активности и токсичности, а также на основании знаний специалиста должно быть эффективным в данной фармацевтической композиции или лекарственной форме.
При необходимости фармацевтическая композиция может содержать вспомогательные средства, такие как наполнители, увлажнители, эмульгаторы, суспензирующие агенты, загустители, подсластители, отдушки, ароматизаторы. Фармацевтически приемлемые добавки могут быть выбраны, например, из микроцеллюлозы, лактозы, стеарата кальция, крахмала. Выбор и соотношение указанных компонентов зависит от природы, способа назначения и дозировки.
Содержание активного ингредиента обычно составляет от 1 до 20 вес.%, в сочетании с одной или более фармацевтически приемлемыми добавками, такими как разбавители, связующие, разрыхляющие агенты, адсорбенты, ароматизирующие вещества, вкусовые агенты.
Указанные фармацевтическая композиция и лекарственное средство могут быть получены известными в фармацевтике способами.
Для получения фармацевтической композиции активный ингредиент (соединение формулы 1) смешивают с фармацевтически приемлемым носителем и при необходимости с соответствующими добавками (носителем и/или эксципиентами) для, например, улучшения вкуса, запаха.
Лекарственное средство может быть в жидкой или твердой форме.
Примерами твердых лекарственных форм являются, например, таблетки, пилюли, желатиновые капсулы и др. Примерами жидких лекарственных форм для инъекций и парентерального введения являются растворы, эмульсии, суспензии. Получение указанных лекарственных форм осуществляется традиционными для фармацевтики методами: смешением компонентов, таблетированием, капсулированием и т.д.
Предлагаемые согласно настоящему изобретению клатратные комплексы могут быть получены двумя путями:
1) жидкофазным методом синтеза;
2) твердофазным методом синтеза.
Жидкофазный способ заключается в том, что готовят водный раствор соответствующего исходного циклодекстрина или арабиногалактана и раствор 9-фенил симм-октагидроселеноксантена, возможно в α-кристаллической форме, в органическом растворителе, смешивающемся с водой, например ацетоне. Полученные растворы затем смешивают при перемешивании и нагревании до температуры не выше 70°C при мольном соотношении 9-фенил-симм-октагидроселеноксантен: циклодекстрин от 1:1 до 1:10 (массовое соотношение от 1:3 до 1:30) или массовом соотношении 9-фенил-симм-октагидроселеноксантен: АГ от 1:10 до 1:20 с последующей выдержкой и перемешиванием при указанной температуре полученной смеси до получения однородного раствора. Полученный кристаллический клатратный комплекс выделяют, возможно, в виде твердой суспензии, которую при необходимости дополнительно перемалывают в условиях, указанных ниже, для образования наночастиц получаемого продукта с размером менее 100 нм. Для комплекса 9-фенил-симм-октагидроселеноксантен: β-циклодекстрин преимущественными являются мольные соотношения 1:3 и 1:5 (массовые соотношения 1:10 и 1:17), а для комплекса 9-фенил-симм-октагидроселеноксантен: арабиногалактан 1:10 и 15:15 (по массе).
В качестве растворителя, смешивающегося с водой, могут быть использованы ацетон, этанол, изопропанол, 1,4-диоксан, а также любые растворители, смешивающиеся с водой.
Согласно настоящему способу получают нековалентные клатратные комплексы, стабилизированные водородными связями. Нековалентный комплекс - комплекс, который образуется между молекулами веществ в подходящем растворителе за счет межмолекулярных ван-дер-ваальсовых взаимодействий нековалентной природы, а именно водородного связывания и образования координационно-ионных связей.
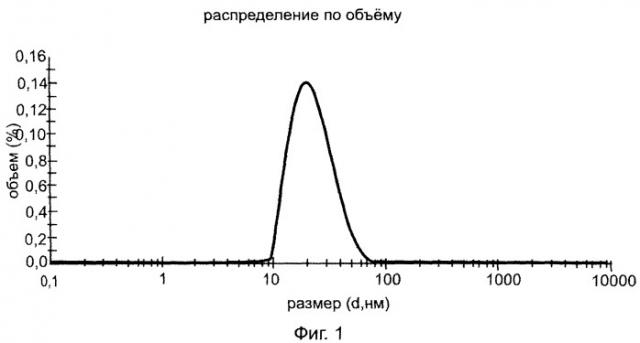
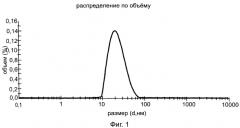
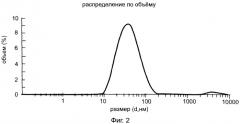
Твердофазный метод заключается в том, что соответствующий циклодекстрин или арабиногалактан и 9-фенил-симм-октагидроселеноксантен перемалывают со скоростью от 100 об/мин до 1000 об/мин в интервале времени от 10 до 60 мин при мольном соотношении 9-фенил-симм-октагидроселеноксантен: циклодекстрин от 1:1 до 1:10 (массовом соотношении от 1:3 до 1:30) или массовом соотношении 9-фенил-симм-октагидроселеноксантен: арабиногалактан от 1:10 до 1:20 при температуре от 20 до 50°C с образованием клатратных комплексов, которые при необходимости могут быть выделены в виде наночастиц с размером менее чем 100 нм, преимущественно размером порядка 24.3 нм для комплекса 9-фенил-симм-октагидроселеноксантен: β-циклодекстрин (рисунок 1) и 32.5 нм для комплекса 9-фенил-симм-октагидроселеноксантен: арабиногалактан (рисунок 2), что подтверждает анализ, проведенный на приборе Zetasizer Nano ZS.
Из теории механосинтеза известно, что пластическая деформация твердого тела обычно приводит не только к изменению формы твердого тела, но и к накоплению в нем дефектов, изменяющих физико-химические свойства, в том числе реакционную способность. Накопление дефектов может быть использовано в химии для ускорения реакций с участием твердых веществ, снижения температуры процессов и других путей интенсификации химических реакций в твердой фазе.
Особенностью процесса активации твердого вещества в результате механической обработки является то, что активация происходит, когда размер частиц по мере измельчения достигнет некоторой критической величины. В ходе механической активации не столько увеличивается поверхность, сколько накапливаются дефекты во всем объеме кристалла. Это резко изменяет многие физико-химические свойства твердых веществ, в том числе и реакционную способность.
Повышение реакционной способности в результате механической активации можно рассматривать как один из методов получения твердых веществ в метастабильной, активной форме. Поскольку химические реакции с участием твердых веществ в зависимости от особенностей их механизма по-разному чувствительны к различным дефектам, которые содержатся в кристалле, задача механической активации состоит не только в том, чтобы произвести накопление дефектов вообще, но и получить именно тот вид дефектов, который необходим для данной реакции. Эта цель может быть достигнута как подбором условий механического воздействия на кристалл (энергия воздействия, длительность, соотношение между давлением и сдвигом, температура обработки, состав окружающей атмосферы), так и учетом особенностей строения кристалла, характера химической связи, его прочностных характеристик и т.д.
Для получения наночастиц обычно вначале получают твердую дисперсию с последующим необязательным размалыванием или растиранием твердой дисперсии до получения соответствующего размера частиц. Тонкое измельчение частиц может быть осуществлено механическим способом путем приложения к частицам силы, под действием которой происходит их размельчение. Такая сила может быть обеспечена при столкновении частиц, которым придана высокая скорость, между собой. Тонкое измельчение с целью получения тонкоизмельченных частиц может быть осуществлено, например, с помощью перемалывания с применением воздушно-струйной микронной коллоидной мельницы, с применением шаровой мельницы или с применением штифтовой мельницы. Размер получаемых наночастиц может быть определен любыми способами, общеизвестными в отрасли. Могут быть использованы, например, следующие способы: просеивание сквозь сита, седиментация, электрозонное сенсирование (с помощью счетчика Каултера), микроскопия, малоугловое лазерное светорассеяние LALLS (аббревиатура от Low-Angle Laser Light-Scattering - малоугловое лазерное светорассеяние).
Более подробно изобретение раскрывается в нижеуказанных примерах, которые, однако, не ограничивают притязания заявителя, а только иллюстрируют возможность его осуществления.
Получаемые соединения обладают улучшенным действием по сравнению с ранее известными близкими по структуре и применяемыми в промышленности препаратами, заключающимся не только в повышении растворимости и биодоступности, что является неожиданным и неочевидным для клатратных комплексов.
Нижеследующие примеры иллюстрируют предлагаемое изобретение.
1 Жидкофазный метод: Рассчитанную навеску 50 г (0.045 моль) β-циклодекстрина растворяли в 0.3 л дистиллированной воды при температуре 55-60°C. Навеску 5 г (0.015 моль) 9-фенил-симм-октагидроселеноксантена растворяли в 0.7 л ацетона при 55°C. При перемешивании и нагревании раствор 9-фенил-симм-октагидроселеноксантена приливали к раствору β-циклодекстрина. После смешения продолжали поддерживать температуру на уровне 55-60°C до получения истинного раствора, после чего в течение 2-х часов понижали температуру до 45°C. Ацетон и часть воды из раствора упаривались, остаток отправляли на лиофильную сушку. В результате был получен комплекс 1:3 (моль) или 1:10 (масс.) в виде кристаллического белого порошка общей массой 55 г. Полученный комплекс дополнительно перемалывают, как указано выше.
Аналогично осуществляли получение клатратного комплекса АГ с 9-фенил-симм-октагидроселеноксантеном с использованием 5 г 9-фенил-симм-октагидроселеноксантена и 50 г арабиногалактана* (* В случае арабиногалактана мы не можем говорить о мольных соотношениях, поскольку он не имеет четкой молекулярной массы). Был получен клатратный комплекс (массовое соотношение 1:10) в виде кристаллического порошка светло-желтого цвета.
2. Твердофазный метод: Испытания проводились на шаровой планетарной мельнице Активатор 2S с материалом помольных стаканов из корунда и шаров из оксида циркония, диаметры 3, 5 и 10 мм, работающей со скоростью от 100 об/мин до 1000 об/мин. Оптимальными оказались режимы 500 об/мин 5 мин, 700 об/мин 10 мин, 500 об/мин 10 мин, а также 600 об/мин 5 мин, 800 об/мин 10 мин, 600 об/мин 10 мин. В случае комплекса 9-фенил-симм-октагидроселеноксантен: β- соответствующий циклодекстрин мольные соотношения варьировались от 1:1 до 1:10 (соответственно массовые соотношения от 1:3 до 1:30), оптимальными оказались мольные соотношения 1:3 и 1:5 (массовые соотношения 1:10 и 1:17). Выделяют полученный клатратный комплекс и при необходимости дополнительно перемалывают, как указано выше. Клатратный комплекс был получен в виде мелкодисперсного подвижного порошка белого цвета (средний размер частиц в случае β-циклодекстрин составляет 24.3 нм (рис.1)). Полученные в аналогичных условиях клатратные комплексы 9-фенил-симм-октагидроселеноксантен: АГ при оптимальных массовых соотношениях 1:10 и 1:15 были также выделены в виде мелкодисперсного подвижного порошка светло-желтого цвета со средним размером частиц 32.5 нм (рис.2). Все полученные комплексы обладали оптимальным набором спектральных данных и растворимостью.
Аналогично были получены комплексы:
9-фенил-симм-октагидроселеноксантен: α-циклодекстрин (мольные соотношения от 1:1, 1:3, 1:5, 1:10).
9-фенил-симм-октагидроселеноксантен: γ-циклодекстрин (мольные соотношения от 1:1, 1:3, 1:5, 1:10).
9-фенил-симм-октагидроселеноксантен: гидроксипропил-β-циклодекстрин (мольные соотношения от 1:1, 1:3, 1:5, 1:10).
9-фенил-симм-октагидроселеноксантен: арабиногалактан (весовые соотношения от 1:10, 11:15, 1:20).
Образование полученных комплексов подтверждено данными ПМР, УФ и ИК-спектроскопии. Также были получены данные по улучшению растворимости комплексов по сравнению с исходными веществами.
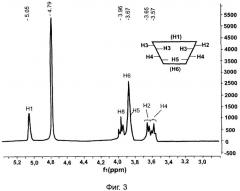
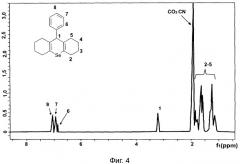
1. Для комплекса 9-фенил-симм-октагидроселеноксантен (в дальнейшем соединение 1, селенокс): β-циклодекстрин (в дальнейшем соединение 2) в мольном соотношении 1:3 был проведен сравнительный анализ ПМР спектров β-циклодекстрина, соединения 1 (селенокс) и соединения 2 (комплекс) (см. рисунки 3, 4 и 5 соответственно), который показал, что в спектре комплекса присутствуют сигналы, отличающиеся от данных ПМР, полученных как при анализе β-циклодекстрина, так и селенокса. Поскольку спектр снимался в дейтерированной воде (селенокс в воде не растворим) можно говорить именно об образовании комплекса включения, а не о механической смеси. Также можно отметить, что сигналы β-циклодекстрина двоятся, это говорит о том, что, по-видимому, в клатрировании селенокса участвуют как минимум две молекулы циклодекстрина.
2. Были получены сравнительные УФ-спектры соединения 1, соединения 2 (соотношения 1:3, 1:5), а также чистого β-циклодекстрина и селенокса. Результаты показаны на рисунках 6, 7, 8 и 9 соответственно. Видно изменение интенсивности показателей при угле 2θ.
Растворитель: этанол: вода = 3:2. Растворение проводят при нагревании.
| Соединение 1 | 0,01 г в 50 мл |
| ЦД: Соединение 2=3:1 | 0,11 г в 50 мл растворителя |
| ЦД: Соединение 2=5:1 | 0,18 г в 25 мл растворителя |
| ЦД (циклодекстрин) | 0,17 г в 50 мл растворителя |
Для снятия спектров данные растворы разбавлены в 20 раз (0,2 мл + 4 мл растворителя).
Навески образцов содержали одинаковое количество соединения 1 (0.01 г), поэтому падение интенсивности поглощения можно отнести за счет экранирования молекулы соединения β-циклодекстрином, т.е. образования комплекса.
Помимо этого проведен сравнительный анализ ИК-спектров β-циклодекстрина, соединения 1 и соединения 2 в мольном соотношении 1:3 (рисунки 10, 11 и 12 соответственно) Перекрывание сигналов характерных групп соединения 1, особенно полосы поглощения в области 2800-2900 см-1, связанной с валентными колебаниями -CH2 групп при насыщенных атомах углерода (напряженных циклических структур), а также полос поглощения 1400-1600 см-1, соответствующих валентным колебаниям связей C-C бензольного кольца, говорит о том, что молекула соединения 1 находится в полости молекулы β-циклодекстрина, за счет чего и происходит перекрывание сигналов и однозначно подтверждает образование клатратных комплексов.
Кроме того, был проведен сравнительный анализ УФ-спектров соединения 1 (рисунок 6), комплекса соединения 1: арабиногалактан (весовые соотношения 1:10 и 1:15), а также чистого арабиногалактана (рисунки 13-15 соответственно). На этих спектрах отчетливо видно отсутствие поглощения в области 240-250 нм, характерного для чистого селенокса. Это подтверждает тот факт, что при образовании комплекса селенокс: арабиногалактан происходит изменение спектральных характеристик за счет экранирования сигналов селенокса молекулами арабиногалактана.
ТАБЛЕТКИ
Клатратный комплекс 55 мг
Соединение 1: β-циклодекстрин
при мольном соотношении 1:3
возможные добавки: микроцеллюлоза, лактоза, стеорат кальция, крахмал. Получают смешением компонентов в смесителе Bectochem и прессованием на таблетирующей машине Rimec.
КАПСУЛЫ
Клатратный нанокомплекс 90 мг
Соединение 1: β-циклодекстрин
при мольном соотношении 1:5
добавки: микроцеллюлоза, лактоза, крахмал.
Получают смешением компонентов в смесителе Bectochem и заполнением желатиновых капсул 3VC.
ТАБЛЕТКИ
Клатратный комплекс 60 мг
Соединение 1: арабиногалактан
при весовом соотношении 1:10
добавки: микроцеллюлоза, лактоза, стеарат кальция, крахмал.
Получают смешением компонентов в смесителе Bectochem и прессованием на таблетирующей машине Rimec.
КАПСУЛЫ
Клатратный нанокомплекс 90 мг
Соединение 1: арабиногалактан
при мольном соотношении 1:15
добавки: микроцеллюлоза, лактоза, крахмал.
Получают смешением компонентов в смесителе Bectochem и заполнением желатиновых капсул 3VC.
ИНЪЕКЦИИ
Клатратный нанокомплекс 100 мг
соединения 1 и β-циклодекстрина
при мольном соотношении 1:2
растворитель (вода: этанол).
Раствор помещают в фармацевтически приемлемую упаковку.
Изучение радиозащитных и цитопротекторных свойств соединения 1 и комплексного соединения 2 (соотношение 1:3) с помощью метода клонирования стволовых кроветворных клеток в селезенках облученных мышей.
1) Формирование селезеночных колоний клетками костного мозга мышей, получивших многократно до облучения в дозе 1,5 Гр соединение 2. Комплексная форма соединения 2 в отличие от соединения 1 является водорастворимой.
Соединение 2 вводили перорально мышам-донорам костного мозга по 5 мг/кг и 2 мг/кг в 0,2 мл физиологического раствора в течение 5 дней. Доза 5 мг/кг - наиболее эффективная при одноразовом введении для возникновения адаптивного ответа к облучению. Контрольные мыши получали по 0,2 мл физиологического раствора в течение 5 дней. Через 7 дней после последнего введения препарата мышей подвергали облучению (1,5 Гр) на установке «Луч-1», через 15 мин после этого их умерщвляли, готовили суспензии клеток костного мозга и вводили их летально облученным мышам-реципиентам для определения колониеобразующей способности. Результаты представлены в таблице 1.
| Таблица 1 | |||||
| Влияние соединения 2 на колониеобразующую способность костного мозга интактных и облученных мышей | |||||
| Группы мышей | Обработка мышей-доноров костного мозга | 1,5 Гр | Количество колоний на 105 клеток костного мозга М+m | ||
| Физраствор | Соединение 2 5 мг/кг×5 | Соединение 2 2 мг/кг×5 | |||
| 1 | + | - | - | - | 9,8±0,6 # |
| 2 | + | - | - | + | 4,4+0,4* ** |
| 3 | - | + | - | - | 11,0±1,0 & |
| 4 | - | + | - | + | 9,3±0,8* & |
| 5 | - | - | + | - | 15,9÷1,1 ^ # |
| 6 | - | - | + | + | 8,1±0,7 л ^ ** |
| * (2 и 4 группы) - Р=0,00004 | |||||
| ** (2 и 6 группы) - Р=0,0002 | |||||
| ^ (5 и 6 группы) - Р=0,00001 | |||||
| # (1 и 5 группы) - Р=0,00012 | |||||
| & (3 и 4 группы) - различия не достоверны |
Из результатов, представленных в таблице 1, видно, что пятикратное введение соединения 2 при ежедневной дозе 5 мг/кг (эффективная разовая доза) к 7 после окончания курса не изменяло количество колоний, формируемых клетками костного мозга интактных мышей - Группа 3, а ежедневная доза 2 мг/кг способствовала достоверному увеличению выхода колоний по сравнению с контролем - Группа 5. Обе схемы обработки мышей перед их облучением (1,5 Гр) были эффективны для формирования адаптивного ответа стволовых кроветворных клеток к облучению, причем количество образовавшихся колоний в группе, получавшей по 5 мг соединения 2 до облучения, было на уровне необлученного контроля.
2) Формирование селезеночных колоний клетками костного мозга мышей, получивших многократно до облучения в дозе 1,5 Гр соединение 1, суспендированное в крахмальном геле.
Во второй серии экспериментов при использовании прежней схемы опыта и доз вводимого препарата суспензию соединения 1 готовили на 2% крахмальном геле. Использовано 90 мышей (СВА×С57 В1/6) F1, самок: 18 доноров и 72 реципиента. Данные представлены в Таблице 2.
| Таблица 2 | |||||
| Влияние соединения 1 на колониеобразующую способность костного мозга интактных и облученных мышей | |||||
| Группы мышей | Обработка мышей-доноров костного мозга | 1,5 Гр | Количество колоний на 105 клеток вводимого костного мозга M±m | ||
| Крахмальный гель 2% 0,2 мл × 5 | Соединение 1 5 мг/кг + Крах. гель 2% | Соединение 1 2 мг/кг + Крах. гель 2% | |||
| 1 | + | - | - | - | 17,9±1,0 |
| 2 | + | + | 9,3±1,0 | ||
| 3 | - | + | - | - | 28,7±1,1* |
| 4 | - | + | - | + | 9,5±0,8 |
| 5 | - | - | + | - | 24±1,3** |
| 6 | - | - | + | + | 9,1±0,3 |
| * (1 и 3 группы) - p=0,00000015 | |||||
| ** (1 и 5 группы) - P=0,003 | |||||
| в группах по 12 мышей |
Как видно из таблицы 2, введение мышам соединения 1 (в обеих испытанных дозах), суспендированного в крахмальном геле, способствует статистически значимому увеличению количества колоний, образуемых клетками их костного мозга, на селезенках облученных мышей-реципиентов - Группа 3 и 5. Радиозащитый эффект соединения 1, суспендированного в крахмале, отсутствует.
Было проведено исследование цитопротекторного действия соединения 1. Полученные данные указаны в таблице 3.
| Таблица 3 | ||||
| Влияние соединения 1 на адаптивный ответ КОЕ-С-8 к цисплатину при однократном воздействии цитостатика на животных | ||||
| Группа | Обработка мышей-доноров костного мозга | Кол-во КОЕ-С-8 на 105 клеток к.м. доноров | ||
| Физраствор 0,2 мл | Соединение 1 5 мг/кг | Цисплатин 5 мг/кг | ||
| Контроль | + | - | - | 12,5±0,6 |
| Соединение 1 | + | + | - | 12,6±0,6 |
| Цисплатин | - | - | + | 6,4±0,6 |
| Соединение 1 + Цисплатин | + | + | + | 9,6±0,3* |
| * - величина p по отношению к группе «Цисплатин» равно 0,004 |
Как видно из результатов, представленных в таблице, соединение 1, введенное за 7 дней до однократной инъекции мышам-донорам костного мозга цисплатина, обеспечивает выраженный адаптивный ответ КОЕ-С-8 к цитостатику.
Выводы:
1. У мышей, получавших до облучения соединение 2 по 5 мг/кг ежедневно в течение 5 дней, к 7 суткам после окончания курса формируется адаптивный ответ стволовых кроветворных клеток к облучению (1,5 Гр) - количество колоний, формируемое клетками костного мозга облученных мышей на уровне интактного контроля. Такая обработка контрольных мышей не изменяла количества экзоколоний, формируемых клетками их костного мозга.
2. У мышей, получавших до облучения соединение 2 по 2 мг/кг в течение 5 дней к 7 суткам после окончания курса введения препарата также формируется адаптивный ответ стволовых кроветворных клеток к облучению (1,5 Гр). Введение контрольным мышам в течение 5 дней соединения 2 по 2 мг/кг способствовало значительному увеличению количества экзоколоний, формируемых клетками их костного мозга.
3. Соединение 1, суспендированное в крахмальном геле, примененное по аналогичному для соединения 2 протоколу, не оказывает радиозащитного действия, но значительно стимулирует выход колоний из интактного костного мозга.
4. Полученные результаты свидетельствуют о том, что соединение 1, суспендированное в крахмальном геле, оказывает влияние на костный мозг мышей. Чтобы исключить возможность отсутствия радиозащитного эффекта у соединения 1 неоптимальной для данной формы препарата схемой введения, проведено исследование по оптимизации схемы, в частности по срокам и дозам введения препарата.
1. Клатратный комплекс α-, β-, γ- или гидроксипропил-β-циклодекстрина или арабиногалактана с 9-фенил-симм-октагидроселеноксантеном формулы (1) возможно в виде α-кристаллической формы, при мас. соотношении 9-фенил-симм-октагидроселеноксантен: циклодекстрин от 1:3 до 1:30 или при мас. соотношении 9-фенил-симм-октагидроселеноксантен:арабиногалактан от 1:10 до 1:20.
2. Клатратный комплекс по п.1, согласно которому он находится в кристаллической форме, возможно в форме наночастиц с размером менее 100 нм.
3. Клатратный комплекс по п.1, согласно которому циклодекстрин представляет собой β-циклодекстрин.
4. Клатратный комплекс по п.1 или 3, где мас. соотношение 9-фенил-симм-октагидроселеноксантен: циклодекстрин, преимущественно β-циклодекстрин, составляет 1:10 и 1:17, возможно в виде наночастиц с размером около 24,3 нм.
5. Клатратный комплекс по п.1 или 2, где мас. соотношение 9-фенил-симм-октагидроселеноксантен:арабиногалактан соответствует 1:10 и 1:15, возможно в виде наночастиц с размером около 32,5 нм.
6. Клатратный комплекс по п.1, обладающий циторадиопротекторной активностью.
7. Жидкофазный способ получения клатратного комплекса α-, β-, γ- или гидроксипропил-β-циклодекстрина или арабиногалактана с 9-фенил-симм-октагидроселеноксантеном формулы (I), возможно в виде α-кристаллической формы, по п.1, отличающийся тем, что смешивают предварительно приготовленный водный раствор соответствующего исходного циклодекстрина или арабиногалактана и раствор 9-фенил-симм-октагидроселеноксантена, в органическом растворителе, смешивающемся с водой, таком как ацетон, при массовом соотношении 9-фенил-симм-октагидроселеноксантен:циклодекстрин от 1:3 до 1:30 или 9-фенил-симм-октагидроселеноксантен:арабиногалактан от 1:10 до 1:20, при перемешивании и нагревании до температуры не выше 70°C, с последующей выдержкой при перемешивании при указанной температуре до получения однородного раствора, с выделением полученного клатратного комплекса, возможно в виде кристаллической твердой суспензии, которую при необходимости дополните