2-(2,5-диметил)пиразолил-3-гидрокси-4(3h)-хиназолинон, обладающий антивирусной, антибактериальной и фунгицидной активностью, и способ его получения
Иллюстрации
Показать всеИзобретение относится к новому средству, обладающему антивирусной, антибактериальной и фунгицидной активностью, представляющему собой 2-(2,5-диметил)пиразолил-3-гидрокси-4(3H)-хиназолинон формулы I
.
Изобретение также относится к способу получения соединения формулы I. Способ заключается в том, что 3-гидрокси-2-тиоксо-4(3H)-хиназолинон подвергают взаимодействию с гидразином с образованием 2-гидразино-3-гидрокси-4(3H)-хиназолинона, который затем подвергают взаимодействию с ацетилацетоном и получают целевой продукт. 2 н.п. ф-лы, 3 табл., 4 пр.
Реферат
Изобретение относится к новому средству, которое представляет собой 2-(2,5-диметил)пиразолил-3-гидрокси-4(3H)-хиназолинон формулы I
которое обладает антивирусной, антибактериальной и фунгицидной активностью, а также к способу получения 2-(2,5-диметил)пиразолил-3-гидрокси-4(3H)-хиназолинона формулы I и может найти применение в медицине, ветеринарии и в сельском хозяйстве.
Известны 2-оксиалкил-3-алкил-4(3H)-хиназолиноны с галоидными заместителями в бензольном кольце, проявляющие фунгицидные свойства (RU 2139862, C07D 239/95, A01N 43/54, опубл. 20.10.1999). Обнаружена противостафилококковая и анальгетическая активность у 2-пропил-3(5-нитрофурфурилиден)амино-4(3H)-хиназолинона (RU 2043352, C07D 239/92, A61K 31/505, опубл. 10.09.1995). Замещенные по бензольному кольцу 2-пиразолил-4(3H)-хиназолиноны предложено использовать в качестве биоцидов (US 4644000, опубл. 17.02.1987).
Заявляемое средство обладает противовирусным действием, превосходящим активность эталонных противовирусных препаратов, и, кроме того, проявляет высокую бактерицидную и фунгицидную активность.
Исходным соединением для получения 2-(2,5-диметил)пиразолил-3-гидрокси-4(3H)-хиназолинона является 3-гидрокси-2-тиоксо-4(3H) хиназолинон формулы II, описанный в патенте РФ №2275362, C07D 239/95, A01N 43/54, опубл. 27.04.2006, который подвергают взаимодействию с гидразином в среде полярного органического растворителя, например спирты, диоксан, с образованием 2-гидразино-3-гидрокси-4(3H)-хиназолинона формулы III
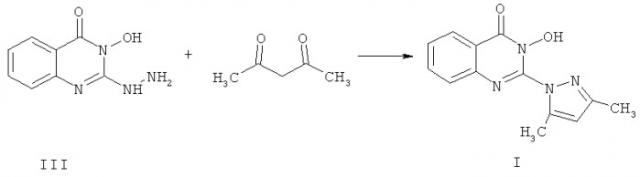
При взаимодействии 2-гидразино-3-гидрокси-4(3H)-хиназолинона (III) с ацетилацетоном в присутствии кислоты, предпочтительно органической, синтезируется 2-(2,5-диметил)пиразолил-3-гидрокси-4(3H)-хиназолинон формулы I
Приводим примеры, подробно раскрывающие сущность предлагаемого изобретения.
Пример 1. Получение 2-(2,5-диметил)пиразолил-3-гидрокси-4(3H)-хиназолинона (I).
а) Получение 2-гидразино-3-гидрокси-4(3H)-хиназолинона (III)
Смесь 19,4 г (0,1 М) 3-гидрокси-2-тиоксо-4(3H) хиназолинона (II), 25 мл гидразингидрата и 40 мл этанола кипятили до прекращения выделения сероводорода (10-20 час), контроль по свинцовой индикаторной бумаге. Затем охлаждали, выпавший осадок отфильтровывали, промывали последовательно 20 мл воды и 20 мл этанола, сушили при 90°C и получали 18 г белого порошка III. Выход 93,8%. Т.пл. 247°C (из этанола).
Спектр ЯМР 1H (ДМСО-d6): 4.27 уш.с (2H, NH2), 7.05 т (1H, Hаром.), 7.25-7.45 м (2H, Hаром.), 7.90 д (1H, Hаром.), 8.18 уш.с (1H, OH).
Масс-спектр |М+, m/z|: 192.
Найдено, %: C 49.95; H 4.10; N 29.19.
C8H8N4O2.
Вычислено, %: C 50.00; H 4.17; N 29.16.
б) Получение 2-(2,5-диметил)пиразолил-3-гидрокси-4(3H)-хиназолинона (I)
К суспензии 3,84 г (20 ммоль) 2-гидразино-3-гидрокси-4(3H)-хиназолинона (III) в 20 мл этанола прибавляют 2,2 г (22 ммоль) ацетилацетона и 2 капли муравьиной кислоты. Затем смесь нагревают при кипении и перемешивании 4 часа до полного растворения осадка. Реакционный раствор охлаждают, выпавший осадок I отфильтровывают. Выход 4,31 г (84,2%). Т.пл. 165-168°C (из этанола).
Спектр ЯМР 1H (ДМСО-d6): 2,90 (с, 3H-CH), 3,12 (с, 3H, CH3), 6.5 (с, 1H CH-пиразола), 12.75 (s, 1H, OH).
Масс-спектр |М+, m/z|: 256.
Найдено, %: C 60.20; H 4.50; N 21.50.
C13H12N4O2.
Вычислено, %: C 60.46; H 4.65; N 21.70.
Пример 2. Исследование антивирусной активности 2-(2,5-диметил)пиразолил-3-гидрокси-4(3H)-хиназолинона (I)
Вирусстатическое (ингибирующее репликацию вируса) действие соединения I исследовано на вирусе миксомы кролика РК-15. С этой целью культуры клеток Vero заражали вирусом в дозе 0.0001-.0.001 ТЦД50 (концентрация вещества, вызывающая 50% деструкцию клеток в культуре). После заражения культуры клеток инкубировали в термостате при 37°C в течение 1-1.5 часов, после чего в культуры клеток вносили соединение I в различных концентрациях и инкубировали в термостате до четкого проявления цитопатогенного действия вируса в контроле. Контролем служили культуры клеток, зараженные вирусом, в которые вместо испытуемого вещества вносили поддерживающую среду. Затем опытные и контрольные образцы титровали в культуре клеток. Вирусстатическое действие определяли по разнице титров в опыте и в контроле, выраженной в lg ТЦД50. Результаты испытаний приведены в таблице 1.
| Таблица 1 | |||
| Антивирусная активность соединения I | |||
| Вариант опыта | Концентрация, мкг/мл | Титр вируса, lg | Вирусстатическое действие, lg |
| Соединение 1 | 500 | <1.5 | 5.0 |
| 250 | <1.5 | 5.0 | |
| 100 | <1.5 | 5.0 | |
| 50 | 1.7 | 4.3 | |
| 25 | 3.0 | 3.5 | |
| 5 | 4.0 | 2.5 | |
| Эталонный препарат (Метисазон) | 100 | 4 | 2.5 |
| 25 | 6 | 0.0 |
Пример 3. Исследование антибактериальной активности 2-(2,5-диметил)пиразолил-3-гидрокси-4(3H)-хиназолинона (I)
Определение антибактериальной активности соединения I проводили на жидких питательных средах с возбудителем сибирской язвы в споровой и вегетационной формах методом двойных серийных разведений при посеянной концентрации 106 КОЕ мл. Результаты испытаний приведены в таблице 2.
| Таблица 2 | |||
| Антибактериальная активность соединения I | |||
| Доза, мкг/мл | |||
| Вегетативная форма возбудителя | Споровая форма возбудителя | ||
| Бактериостатическое | Бактерицидное | Бактериостатическое | Бактерицидное |
| 37.0 | 75.0 | 75.0 | 150.0 |
Пример 4. Исследование фунгицидной активности 2-(2,5-диметил)пиразолил-3-гидрокси-4(3H)-хиназолинона (I)
Оценку фунгицидной эффективности соединения I проводили против гельминтоспорозной гнили (Bipolaris sor.). Для установления фунгицидной активности семена ярового ячменя сорта Зазерский 85 протравливали на установке HEGE-11 (Германия) при норме расхода 10 л/т семян 1% К.С. соединения I. В качестве эталона использовали препараты Премикс 200, Витавакс 200 ФФ, В.С.К., Колфуго супер колор, К.С. Протравленные семена высевали в поле на опытных делянках. Учет проводили в фазу начала колошения (фаза 51 по Задоксу) (искусственный инфекционный фон). Результаты испытаний приведены в таблице 3.
| Таблица 3 | |||||
| Фунгицидная активность соединения I | |||||
| Препарат | Норма расхода препарата, л/т семян | Пораженность, % | Снижение пораженности, % | Развитие болезни, % | Снижение развития болезни, % |
| Контроль без протравливания | - | 91.3 | - | 26.4 | - |
| Соед.I, 1% К.С. | 7.5 | 53.2 | 42 | 15.7 | 41 |
| Премикс 200, К.С., | 0.19 | 59.8 | 36 | 18.6 | 30 |
| Витавакс 200 ФФ, В.С.К | 3.0 | 68.3 | 25 | 22.2 | 16 |
| Колфуго супер колор, К.С. | 2.0 | 71.1 | 22 | 23.0 | 13 |
Таким образом, совокупность результатов проведенных испытаний свидетельствует о широком спектре биологической активности предлагаемого средства, представляющего собой 2-(2,5-диметил)пиразолил-3-гидрокси-4(3H)-хиназолинон (I), а именно о его высокой антивирусной, антибактериальной и фунгицидной эффективности, при этом антивирусная активность заявляемого средства превосходит активность эталонных противовирусных препаратов.
1. Средство, обладающее антивирусной, антибактериальной и фунгицидной активностью, представляющее собой 2-(2,5-диметил)пиразолил-3-гидрокси-4(3H)-хиназолинон формулы I: .
2. Способ получения 2-(2,5-диметил)пиразолил-3-гидрокси-4(3H)-хиназолинона формулы I по п.1, заключающийся в том, что 3-гидрокси-2-тиоксо-4(3H)-хиназолинон подвергают взаимодействию с гидразином с образованием 2-гидразино-3-гидрокси-4(3H)-хиназолинона, который затем подвергают взаимодействию с ацетилацетоном и получают целевой продукт.