Способы in vitro для создания и поддержания линий растительных клеток в виде отдельных клеток в суспензии с интактными клеточными стенками и их трансформации
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описан способ получения отдельной растительной клетки, где способ включает: помещение агрегированных растительных клеток, содержащих интактные клеточные стенки, в среду, содержащую глицерин и разделяющее средство, выбранное из группы, состоящей из фермента, расщепляющего пектин, и соединения, деполимеризующего тубулин; встряхивание агрегированных растительных клеток со стадии (а) при температуре 25-28°С в темноте на орбитальном шейкере при 150 об/мин и перенос одной или нескольких растительных клеток, содержащих интактные клетки, в среду культивирования растения, которая не содержит глицерин и разделяющее средство, выбранное из группы, состоящей из фермента, расщепляющего пектин, и соединения, деполимеризующего тубулин. Раскрыт способ трансформации клетки, полученной описанным способом, при этом указанный способ включает получение изолированной клетки согласно описанному способу, трансформацию указанной клетки гетерологичным полинуклеотидом и отбор трансформированной клетки. Изобретение упрощает и интегрирует способы трансформации, основанные на отдельных клетках. Настоящее изобретение с высокой эффективностью создает не содержащие маркеров и однородные трансгенные линии для удовлетворения различных потребностей при осуществлении программ, связанных со здравоохранением животных, биофармацией и защитой сельскохозяйственных растений. 2 н. и 11 з.п. ф-лы, 15 ил., 2 табл.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Настоящая заявка притязает на приоритет на основании предварительной заявки с регистрационным № 60/878028, поданной 29 декабря 2006.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение отчасти относится к области размножения линий растительных клеток, включая способы размножения растительных клеток в суспензиях в виде отдельных клеток.
УРОВЕНЬ ТЕХНИКИ
На протяжении последних двух десятилетий появилась методика генной инженерии растений наряду с крупными усовершенствованиями в разработке способов крупномасштабного культивирования растительных клеток для получения полезных вторичных метаболитов. С 1995 года (Moffat, 1995; Ma et al., 2003) такие суспензионные культуры растительных клеток все больше и больше использовали в качестве полезной системы клеток-хозяев для экспрессии рекомбинантных белков.
Индуцируемая ауксином каллюсная ткань или суспензии несмотря на происхождение из одной ткани обычно содержат клетки с разными фенотипами. Таким образом, трансгенные линии, создаваемые на основе таких типов клеток, обычно являются высоко гетерогенными с неустойчивыми уровнями экспрессии. Поэтому клоны, продуцирующие многие полезные вторичные метаболиты, получали из отдельных протопластов, например клон клеток с высокой продукцией шиконина, полученный из протопластов Lithospermum erythrorhizon (Maeda et al., 1983).
До настоящего времени было необходимо образование протопластов для того, чтобы дезагрегировать клетки не только в случае селекции клеток, но также в случае электропорации/ПЭГ-опосредованной трансформации культивируемых растительных клеток. Получение протопластов требовалось для выделения отдельных клонов клеток из растительных тканей. Однако обычно в случае протопластов бывает сложно регенерировать их нормальные стенки, поскольку изолированные протопласты обычно задерживают в клеточном цикле, и они плохо делятся (Hahne and Hoffmann, 1984). Во многих исследованиях, проводимых на культивируемых протопластах, показано, что первым и основным образуемым полисахаридом является каллоза, которая состоит из 1, 3-, 8-глюкопираноз (Klein el al., 1981).
Имеющие раны или подвергнутые стрессу растения часто секретируют массу такого глюкана в периплазматические пространства (Currier, 1957). Во время ранних стадий регенерации стенок связывание между целлюлозой и ксилоглюканом является не таким прочным, как связывание в интактных растениях (Hayashi et al., 1986). Так как макромолекулярная организация ксилоглюкана и целлюлозы в первичных клеточных стенках, по-видимому, ответственна за прочность и растяжимость (Hayashi and Maclachlan, 1984), отложение ксилоглюкана, а также целлюлозы вокруг протопластов, по-видимому, является крайне необходимым для их деления и способности к росту. Такое необходимое условие тормозит деление протопласта, таким образом увеличивая время для регенерации в нормальные клетки с клеточными характеристиками, свойственными родительским линиям.
Следовательно, имеющейся в настоящее время технической проблемой в области культивирования растительных клеток является выделение отдельных жизнеспособных клеток, которые можно клонировать, из растительной ткани в культуре (Bourgin, 1983; Tabata et al., 1976). В суспензионной культуре всегда образуются неоднородные агрегаты клеток, и каждый такой агрегат содержит до сотни клеток. Ничего не известно о связи между такими клетками в агрегате, и не было сообщений, в которых бы идентифицировали отдельный фермент, который может диссоциировать агрегаты клеток и поддерживать их в виде отдельных клеток in vitro с интактными клеточными стенками.
В нескольких сообщениях выдвигали предположение о роли пектина в адгезионных свойствах клеток, но такая связь установлена относительно недавно (Bouton et al., 2002). Кроме того, сообщалось о сильном ослаблении адгезионных свойств в клетках (Sterling et al., 2006).
У мутантов qua1-1 наблюдали отдельные обособленные клетки корня (Bouton et al., 2002). Пониженное содержание пектина дополнительно подтверждено в экспериментах по иммунофлуоресценции с использованием антител, вырабатываемых против специфичных эпитопов пектина. Такие наблюдения свидетельствуют о том, что кодируемый фермент может быть вовлечен в синтез пектиновых полисахаридов, и ясно показывают, что пектин вовлечен в адегезионные свойства растительных клеток.
Таким образом, нарушение синтеза пектинов для устранения адгезионных свойств клеток может облегчить разделение клеток. Сообщалось, что изоляция отдельных клеток с использованием однократных обработок ферментами, разрушающими пектин (Naill, 2005), способствовало изоляции отдельных клеток в суспензионных культурах клеток Taxus. Такие отдельные клетки Taxus использовали для скрининга элитных клональных линий с более высоким уровнем продукции таксола. Однако такой способ не применим для поддержания суспензии отдельных клеток в условиях постоянного присутствия фермента в среде. Также самый высокий выход отдельных клеток при такой короткой импульсной обработке ферментом или сочетанием ферментов составлял только от 17,1% до 34,4% (Naill, 2005). Длительная обработка пектиназой в суспензиях клеток риса приводила только к получению суспензии мелких агрегатов при концентрации 0,005%, но не помогала поддерживать суспензию в виде отдельных клеток (Lee et al., 2004). Продолжительные обработки сочетанием ферментов, пектиназой и целлюлазой в течение более чем 8 часов приводили к лизису клеток (Naill, 2005).
Сообщалось об улучшении разделения клеток в суспензионных культурах клеток сои в присутствии колхицина (Umetsu et al., 1975). Для разделения клеток алкалоид добавляли в культуральную среду в более низких концентрациях (0,1-1,0 мМ), чем концентрации (5-20 мМ) для получения хромосомной полиплоидии. Однако колхицин ингибирует митоз в клетках растений и животных (Lewin, 1980). Колхицин связывается с тубулином и препятствует сборке микротрубочек. Поэтому для получения разделения клеток концентрация колхицина и время обработки должны быть как можно более низкими.
Колхициновые алкалоиды использовали для синхронизации роста культивируемых клеток животных, в случае которых алкалоиды обычно добавляют в концентрации 0,5 мМ, когда клетки должны быть задержаны в пределах нескольких часов перед митозом. Хотя морфогенное действие довольно сходно с действием на клетки животных, растительные клетки могут делиться во время роста в присутствии колхицина в концентрации 0,1 мМ (Umetsu et al., 1975). Жизнеспособность клеток снижалась после 4 дней культивирования клеток сои в суспензии в присутствии 1 мМ колхицина. Кроме того, при таких обработках только 44,8% клеток были жизнеспособны, но их можно было поддерживать делящимися, в отличие от клеток животных.
Было исследовано применение ингибиторов деполимеризации тубулина или олигосахаридов для поддержания отдельных клеток в суспензии в культурах растений in vitro. В литературе имеется некоторая информация еще с 1975 года, относящаяся к применению колхицинов для разделения клеток; см. раздел «Ссылки» ниже. Также исследовали ингибиторы тубулина в качестве гербицидов.
Осуществление особых событий трансгеноза и извлечение продуктов в большей степени основано на разработке методик, обеспечивающих такую возможность. Современными способами, используемыми для трансформации агрегатов клеток в суспензии, являются способы, опосредованные Agrobacterium и микроиглами. Способ с использованием Agrobacterium дает степень интеграции остова до 67-90%, что делает такой способ очень неэффективным, при этом опосредованная WHISKERSTM трансформация не может служить в качестве высокопроизводительного способа (HTP). Опосредованный ПЭГ способ всегда используют для протопластов, и показано, что, хотя протопласт табака легко можно трансформировать, сложно осуществить процесс HTP-трансформации вследствие проблем, связанных с регенерацией клеточных стенок.
В данной области, по-видимому, нет информации относительно протоколов трансформации, основанной на суспензионной культуре отдельных клеток. Имеется несколько сообщений о протоколах, основанных на использовании протопластов, но протопласты лишены клеточных стенок в отличие от растительных клеток в суспензиях отдельных клеток, которые обсуждаются ниже.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к простым и совместимым способам разрушения агрегатов клеток в суспензии до отдельных клеток с интактными первичными клеточными стенками. В следующем далее описании обсуждается разделение клеток в суспензии агрегатов клеток, культивируемых в среде, содержащей разрушающие пектины ферменты или соединения, деполимеризующие тубулин, включая колхицин.
Настоящее изобретение также относится к новым применениям соединений для таких целей. Один аспект настоящего изобретения относится к трансформации таких изолированных клеток. Такие способы упрощают и интегрируют способы трансформации, основанной на отдельных клетках, и селекции в технологические процессы осуществления трансгенных и транспластомных событий. Настоящее изобретение также устраняет технические ограничения и с высокой эффективностью создает не содержащие маркеров и однородно экспрессирующие трансгенные линии для удовлетворения различных потребностей при осуществлении программ, связанных со здравоохранением животных, биофармацией и сохранением свойств и защитой сельскохозяйственных растений.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1: Изоляция отдельных клеток в суспензии клеток JTNT1 с интактной клеточной стенкой при постоянных обработках пектолиазой, субкультивируемых в среде в течение 7 суток.
A - нормальная суспензия BY2; B - то же, что и A, но клетки окрашены I2KI, чтобы показать агрегацию клеток; C и D - разделенные клетки после 6 суток непрерывной обработки ферментом; E и F - разделенные отдельные клетки, окрашенные I2KI или без окраски. Обратите внимание на нормальное клеточное деление (F).
Фигура 2: Жизнеспособность клеток BY2 через 6 суток после непрерывной обработки пектолиазой (клетки обработаны FDA и PI) и выход отдельных клеток.
A: агрегаты клеток BY2; B: BY2 в 1 мл инокулята с пектолиазой в среде в течение 5 суток; C: 6 мл инокулята в среде с ферментом на 5 день; D, E и F: фотографии полей микроскопа в случае C; G: контрольные скопления в случае варианта клеток BY2, обработанных BAP и 12% сахарозой; H и I: отдельные клетки в результате 5-дневной непрерывной обработки ферментом клеток из варианта G. Клетки окрашены FDA и PI. Обратите внимание, что мертвые клетки в PI окрашены красным цветом.
Фигура 3: Индукция суспензий, содержащих отдельные клетки, в результате 7-дневных обработок колхицином в среде из суспензий, содержащих агрегаты клеток табака BY2 и Xanthi.
A: Нормальные агрегаты BY2 в суспензии (окрашены Calcafluor). B: Суспензия, содержащая отдельные клетки BY2, в 1 мМ колхицине в течение 7 суток. C: То же, что и B, но увеличено, чтобы показать отдельные клетки с интактными стенками. D: Агрегаты Xanthi в суспензии. E: Агрегаты Xanthi в суспензии, обработанные в течение 7 суток в 0,5 мМ колхицине. Отмечается частичное высвобождение отдельных клеток в 0,5 мМ; и F: Разделенные отдельные клетки Xanthi в 1 мМ колхицине.
Фигура 4: Высвобождение отдельных клеток с интактными клеточными стенками при обработках колхицином суспензий, содержащих агрегаты клеток табака BY2 и Xanthi.
A: Нормальные агрегаты BY2 в суспензии. B: суспензия, содержащая отдельные клетки BY2, в 1 мМ колхицине в течение 7 суток. C и D: Восстановление агрегатов клеток после удаления колхицина (через 4 дня после субкультивирования с использованием 1 цикла культивирования при обработке колхицином). E: Агрегаты Xanthi в суспензии; F: Агрегаты Xanthi в суспензии, обработанные в течение 7 суток 1 мМ колхицином. Обратите внимание на высвобождаемые отдельные клетки в культурах BY2 и Xanthi и наличие интактной клеточной стенки, которая видна в присутствии оптического осветлителя Calcafluor. (Все примеры обрабатывали 0,1% Calcafluor и исследовали в флуоресцентном микроскопе Leica.)
Фигура 5: Высвобождение отдельных жизнеспособных клеток с интактными клеточными стенками при обработках колхицином из агрегатов клеток табака варианта BY2 (адаптированных в среде EP с 12% сахарозой) и агрегатов клеток дурмана в суспензиях.
A: Нормальные агрегаты BY2-V в суспензии. B: Укрупненный вид необработанных агрегатов. C, D и E: Индукция суспензии, содержащей отдельные клетки BY2, в 1 мМ колхицине в течение 7 суток (Клетки при увеличении 10×, 20× и 40×). F: Индукция отдельных клеток в суспензии дурмана при обработке 1 мМ колхицином в течение 7 суток. Все образцы обрабатывали FDA и PI и исследовали в флуоресцентном микроскопе Leica. Отмечается высокая жизнеспособность клеток, наблюдаемая в данном случае при окраске FDA, и очень мало окрашенных красным цветом клеток в PI.
Фигура 6: Влияние DAS-PMTI-1, производного метилиндола, запатентованного Dow AgroSciences (DAS), и эффективного гербицида, ингибирующего микротрубочки, на рост клеток табака NT1. Клетки выращивали в отсутствие или в присутствии 25 или 50 нМ DAS-PMTI-1 в среде NT1B с 3% глицерином в качестве единственного источника углерода. Все значения сырой массы представлены в виде средних ±0,18, полученных для повторов образцов.
Фигура 7: Получение отдельных клеток и колоний из суспензионных линий DAS GAD1762-034.
Фигуры 8A, 8B и 8C: 2-6-недельный рост колоний из отдельных клеток DAS GAD1762-034.
Фигура 9: Образцы собирали на 7 и 13 день на протяжении более чем 4 циклов субкультивирования и осуществляли анализ экспрессии. Полученные данные об экспрессии представлены на графике.
Фигура 10: Отдельные клетки среди клеток BY2, которые выделяли, используя DAS-PMTI-1. Концентрацию 20-50 нМ использовали для получения отдельных клеток после 5 дней субкультивирования. Обратите внимание, что клетки представляют собой отдельные клетки (пара имеет перекрывающиеся края), и изображение получено в дифференциальном интерференционном контрастном микроскопе, соединенном с конфокальной системой визуализации.
Фигура 11: Экспрессия YFP (плазмида Ubi10-YFP) после 72 часов обработки ПЭГ. В одной из небольших дочерних (делящихся) клеток в плоскости фокусировки видна экспрессия GFP, показывающая, что экспрессия может быть стабильной.
Фигура 12: Слева: необработанная контрольная ткань ингибирована 100 мг/л канамицина. Справа: полученный из отдельной клетки предполагаемый транспластомный изолят, растущий на среде для селекции.
Фигура 13: Получение клональных линий из суспензий, содержащих отдельные клетки моркови. Газонный рост на M-среде, засеянной суспензией, содержащей необработанные агрегаты (панель A). Рост дискретных колоний на среде, засеянной отдельными клетками (панель B).
Фигура 14: Обработка 0,5-1 мМ колхицином в жидкой среде, и культуры, которые анализировали на 14 день после закладки субкультуры (конец второго цикла субкультивирования). A: Отдельные клетки высвобождаются из кластеров. B: Агрегаты с плотно упакованными клетками, окрашенные прижизненным красителем FDA. C и D: Окрашенные FDA отдельные клетки, высвобождаемые при обработке 1 и 0,5 мМ соответственно, после фильтрования суспензии (с использованием фильтров с диаметром пор 100 мкм). E и F: Более крупный вид отдельных клеток, показанных на фигуре D.
Фигура 15: Кривая роста отдельных клеток JTNT1 в ответ на MTI.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Возможность выделять и выращивать отдельные клетки имеет многочисленные возможные применения. Например, способы, описанные в настоящей публикации, применимы для усовершенствования способов, связанных с продуктивностью культур растительных клеток, используемых в области здравоохранения животных.
Таким образом, способы согласно настоящему изобретению применимы для повышения эффективности способов, используемых в области здравоохранения животных и получения биофармацевтических продуктов на основе растительных клеток. Варианты осуществления настоящего изобретения могут помогать проводить скрининг элитных клонов трансгенных клеток, например осуществлять закладку суспензионных мини-культур клеток для минимизации разбросов между партиями, чтобы разработать стандартный рабочий протокол (SOP) для систем трансформации, основанной на отдельных клетках, чтобы минимизировать или исключить наличие нетрансгенных клеток в агрегатах. Итак, аспекты настоящего изобретения применимы в HTP (высокоэффективном способе) скрининга в области здравоохранения животных и программах по улучшению линий клеток-хозяев.
Настоящее изобретение также иллюстрирует и обеспечивает возможность для дальнейшей разработки основанных на одиночных клетках анализов и способов сортировки клеток для идентификации стабильно экспрессирующих клеток, на основании экспрессии РНК, связанной с клеточными зондами, используемыми для исследования гашения флуоресценции.
Такие отдельные клетки также применимы для быстрого скрининга сайт-специфичной гомологичной рекомбинации вместо современной основанной на протопластах временной системы. Например, суспензии клеток кукурузы сорта Black Mexican Sweet (BMS) и суспензии клеток канолы могут обеспечивать отдельные системы для таких применений. Таким образом, целенаправленную гомологичную рекомбинацию, например, можно использовать в вариантах осуществления настоящего изобретения. Такой тип методики является, например, предметом заявки WO 03/080809 A2 и соответствующей опубликованной заявки на выдачу патента США (USPA 20030232410), относящейся к применению цинковых пальцев для целенаправленной рекомбинации. В данной области также известно применение рекомбиназ (например, cre-lox и flp-frt).
Растительные системы экспрессии in vitro можно использовать для получения полезных фармацевтических продуктов и рекомбинантных белков для здравоохранения животных. Ключевое преимущество таких растительных систем экспрессии заключается в том, что они являются эукариотическими по природе - обладающими эндомембранными системами и секреторными путями, сходными с системами и путями в клетках млекопитающих. Поэтому сложные белки в основном эффективно подвергаются фолдингу и сборке с соответствующими посттрансляционными модификациями.
Другим преимуществом продуцирующих растительных систем является возможность увеличения масштаба. Фактически неограниченные количества рекомбинантного белка могут быть выращены либо в ограниченной зеленой ткани, либо в увеличенном масштабе на промышленном оборудовании с использованием систем ферментации или биореакторов после скрининга элитных экспрессирующих клонов и увеличения объема таких гомогенно экспрессирующих клеточных линий.
В данном описании приведены примеры двух методик получения отдельных клеток. Обе методики успешно работали для разделения жизнеспособных отдельных клеток. Однако способ с использованием колхицина является более предпочтительным по сравнению со способом расщепления ферментами при получении большого объема суспензии отдельных клеток с интактной клеточной стенкой, по меньшей мере, в двух типах клеток в суспензиях. В случае ферментного способа наблюдали не только ингибирование клеточного роста, но и более высокую степень смертности. Также в том случае, когда жизнеспособные клетки помещали на гелевую среду без удаления или промывки использованной среды, клетки погибали и колонии не были видны. Применение таких суспензий отдельных клеток, полученных с использованием способа расщепления ферментами, может быть рекомендовано, но потребуется дополнительная оптимизация.
Напротив, добавление ингибиторов тубулина, подобных колхицину, тестированных в настоящем исследовании, по-видимому, очень полезно для разделения растительных клеток и отбора отдельных клеток. Такой способ является простым, так как он заключается только в добавлении подходящего объема колхицина в жидкую среду во время стадии субкультивирования. Способ может быть основным инструментом, который будет иметь огромное значение для получения заданной суспензии в таком процессе, как закладка суспензионных мини-культур с использованием в качестве исходных клеток однородного инокулята, состоящего из клеток с высокой жизнеспособностью. Способ может повысить эффективность электропорации, опосредованной WhiskersTM и опосредованной Agrobacterium трансформации. Такой способ получения отдельных клеток также можно использовать для выделения элитных клонов линий, продуцирующих рекомбинантные белки, из трансгенных агрегатов в суспензии.
Хотя для выделения отдельных клеток применяли основанный на протопластах способ, настоящий способ с использованием колхицина является более простым и более эффективным. Отдельные клетки, полученные колхициновым способом, более стабильны, чем протопласты, в результате наличия стенок и не требуют регенерации клеточных стенок. Клетки имеют стенки с каркасом из ксилоглюкана/целлюлозы нормального состава (Hayashi and Maclachlan, 1984). Они не продуцируют каллозу во время размножения и разделения клеток, как видно в исследованиях, в которых клетки сеянцев сосны, растущих в присутствии колхицина, не имеют аномального утолщения стенки, а разрастаются радиально (Itoh, 1976). Рост клеток является нормальным после субкультивирования в среде, не содержащей колхицина, тогда как большинство протопластов подвергаются задержке и плохо делятся (4). Культивируемые с колхицином клетки могут иметь такую же степень полиплоидии, однако концентрации колхицина, используемые в настоящем исследовании (0,1-1,0 мМ), были в 10-100 раз ниже, чем концентрация, требуемая для индукции полиплоидии (5-20 мМ). Извлечение отдельных клеток было намного лучше при использовании колхицинового способа, чем в случае протопластов (Hyashi and Yoshida, 1988). Такие клетки могут быть дополнительно тестированы с использованием проточной цитометрии, чтобы оценить уровень полиплоидии и стабильность генома. Кроме того, повышенные уровни плоидности могут обеспечивать дополнительное преимущество, состоящее в повышении уровня рекомбинантного белка в результате увеличенного количества копий в трансформированных клетках.
Активность галактуронана проявлялась в виде биологических функций в разделении клеток в суспензии клеток сои, и о нем сообщалось как об олигосахариде, который проявлял биологические функции в разделении клеток (Albersheim and Darvill, 1985). Поэтому галактуроновую кислоту также тестировали в таких суспензиях клеток, чтобы добиться разделения клеток без какого-либо изменения плоидности, на тот случай, если имеет место какое-либо индуцированное колхицином изменение плоидности в суспензиях отдельных клеток, о которых сообщается в настоящем описании. Итак, дополнительно оценивается прямое применение галактуронана и других сходных олигосахаридов для сравнения эффективности в разделении клеток посредством нарушения адгезионных свойств клеток. Таким образом, настоящее изобретение относится к простым способам, которые являются воспроизводимыми и совместимыми с несколькими прохождениями клеточного цикла в суспензии при одновременном поддержании стабильности генома клеток.
Одним предпочтительным соединением, приведенным в качестве примера в настоящем описании, является DAS-PMTI-I. Указанное соединение, по-видимому, является очень эффективным (в ~100-1000 раз более эффективным, чем колхицин, по своему влиянию на рост культур). После 7 дней обработки происходит значительная гибель клеток при концентрации 0,5 мМ, но когда такие культуры субкультивировали в отсутствие DAS-PMTI-I, клетки PH в суспензии восстанавливались в виде отдельных клеток с низкой частотой через 2 недели. Может быть осуществлена дополнительная оптимизация, чтобы определить предпочтительные концентрации такого соединения в зависимости от предпочтительных применений (например, от типа клетки и тому подобного) для разделения отдельных клеток. Можно использовать другие ингибиторы MT1, имеющие сходные функции, при разделении данных клеток посредством нарушения синтеза пектина. В свете настоящего описания дополнительные ингибиторы MT1 и их аналоги можно тестировать и подвергать скринингу в отношении их эффективности в получении и поддержании отдельных клеток.
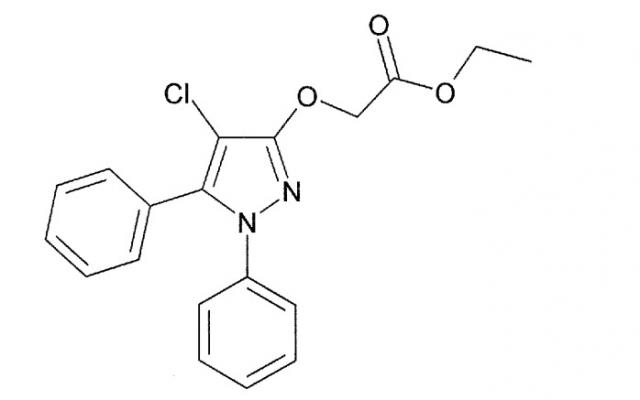
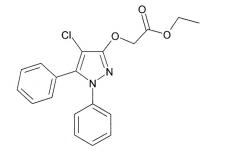
Химическая структура DAS-PMTI-1, также известного как этиловый эфир(4-хлор-1,5-дифенил-1H-пиразол-3-илокси)уксусной кислоты, показана ниже:
Предпочтительный род соединений для применения согласно настоящему изобретению представлен соединениями типа DAS-PMTI-1. Такие соединения могут соответствовать общей структуре, показанной выше, и включают их функциональные (для применения согласно настоящему изобретению) производные и аналоги.
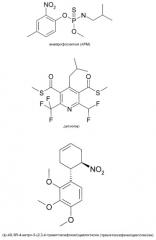
Далее приведена общая химическая формула некоторых известных ингибиторов микротубулина для применения согласно настоящему изобретению. Хотя DAS-PMTI-1 является предпочтительным вариантом, практически любое ингибирующее микротубулин средство можно использовать согласно настоящему изобретению. В некоторых предпочтительных вариантах один или несколько представителей следующего рода диарилпиразола используют в сочетании с колхицином:
где
X = CO2R, CH2CO2R, CH2CH2CO2R, (CH2)3CO2R, OCH2CO2R, OCH(CH3)CO2R, OC(CH3)2CO2R, CH2OCH2CO2R, CH2CH(CO2CH2CH3)CO2R, OCH(CO2CH2CH3)CO2R;
Y = CN, Cl, Br, F, NO2;
Ar1 = незамещенный фенил, незамещенный пиридин, 1-3-замещенный фенил, 1-3-замещенный пиридин, замещенный галогеном или CN;
Ar2 = незамещенный фенил, незамещенный пиридин, 1-3-замещенный фенил, 1-3-замещенный пиридин, замещенный галогеном или CN;
R = H или 1-5-углеродный неразветвленный или разветвленный сложный эфир.
Таким образом, суспензионные культуры из отдельных растительных клеток получали, используя ингибиторы микротрубочек, и их можно было поддерживать в культуре в течение, по меньшей мере, 2 циклов субкультивирования. Такие суспензии из отдельных клеток являются уникальными в том, что они имеют интактную клеточную стенку и, кроме того, они существуют отдельно друг от друга.
«Трансгенное» растение, растительная клетка и тому подобное (если не оговорено особо) представляют собой целое растение, растительную клетку, культуру растительных клеток, линию растительных клеток, культуру ткани растений, низшее растение, культуру клеток однодольного растения, культуру клеток двудольного растения или потомство, полученное из трансформированной растительной клетки (или протопласта или тому подобного), которые содержат чужеродную ДНК, введенную лабораторным способом, исходно не присутствующую в нативной нетрансгенной растительной клетке того же вида. Термины «трансгенное растение» и «трансформированное растение» иногда использовали в данной области как синонимы для определения растения, ДНК которого содержит экзогенную молекулу ДНК. Трансгенное растение может быть стабильно трансформировано так, чтобы оно содержало чужеродную ДНК, которая функционирует и включена в геномную ДНК растения, или является трансгенным растением, которое было трансформировано основанными на вирусах векторами и временно экспрессировало чужеродную ДНК.
Термин «изолированный» и «очищенный» означает «подвергнутой обработке человеком» и может быть применим к полинуклеотидам и белкам. Клонированный полинуклеотид представляет собой, например, изолированный полинуклеотид.
Способы трансформации. Указанные отдельные клетки тестировали в отношении трансформации ядер и пластид с использованием Agrobacterium и полиэтиленгликоля (ПЭГ) в случае ядерной трансформации и баллистическую бомбардировку в случае трансформации пластид. При попытках трансформации ядер показана доставка плазмидной ДНК и временная экспрессия желтого флуоресцирующего белка. Клетки подвергали восстановлению при трансформации пластид, и стабильная трансформация показана с помощью ПЦР-анализа. Наращивали массу изолятов транспластомных каллюсов и анализировали в отношении селектируемого маркера, экспрессии гена nptII, с помощью ELISA.
Методика трансформации, описанная в настоящей публикации, может быть применена в способах, используемых в здравоохранении животных. Однако трансформация, основанная на отдельных клетках, с помощью новых способов доставки, включая доставку наночастиц, также может обеспечивать уникальные подходы к трансформации сельскохозяйственных растений в дополнение к использованию типов клеток-хозяев, применяемых для продуцирования рекомбинантных белков.
Разработка трансформации отдельных клеток с использованием способов, основанных на ПЭГ и/или электропорации, позволяет получать отдельные клетки с интактной стенкой, применимые так же, как и системы клеток бактерий/млекопитающих, а также применимые в высокопроизводительных системах трансформации для таких типов клеток.
Возможность трансформации отдельных клеток имеет многочисленные возможные применения. Например, способы, раскрытые в данном описании, применимы для усовершенствования методик, связанных с продуктивностью культур растительных клеток для применений в области здравоохранения животных. Кроме того, способы согласно настоящему изобретению применимы для повышения эффективности методик, используемых в области здравоохранения животных и для получения биофармацевтических продуктов на основе растительных клеток. Способы согласно настоящему изобретению также могут помогать в проведении скрининга элитных клонов трансгенных клеточных линий. Такие возможности можно использовать для закладки суспензионных клеточных мини-культур, чтобы минимизировать изменчивость экспрессии в разных партиях, и для разработки SOP, чтобы минимизировать или исключить нетрансгенные клетки или наличие множественных событий в агрегатах.
Как обсуждалось в разделе «Уровень техники», основанные на Agrobacterium способы очень неэффективны, а основанная на WHISKERSTM трансформация не может служить в качестве высокопроизводительного способа. ПЭГ-опосредованный способ используют в случае протопластов. Хотя протопласты табака легко подвергаются трансформации, их трудно подвергнуть процессу HTP-трансформации вследствие проблем, связанных с регенерацией клеточных стенок.
В отличие от этого настоящее изобретение обеспечивает интактную клеточную стенку. Опосредованный ПЭГ способ является первым способом, в котором сообщается об отдельной клетке с интактной клеточной стенкой. Способы согласно настоящему изобретению также являются высокоэффективными. Также способ исключает интеграцию остова благодаря использованию для трансфекции очищенных фрагментов плазмид. Протокол для быстрой трансформации с использованием отдельных растительных клеток при осуществлении таких способов, как активируемая флуоресценцией сортировка клеток (FACS), может быть идеальным для миниатюризации и автоматизации способов скрининга подходящих событий при пониженной стоимости ресурсных и временных затрат. Такой протокол может значительно улучшить современный способ селекции каллусов или агрегатов в суспензии посредством скрининга трансформированных клеток с помощью сортировщиков клеток и позволяет определять гомогенно экспрессирующие элитные события для дальнейшего совершенствования при промышленном исследовании или получении на конвейере.
Таким образом, способы согласно настоящему изобретению обеспечивают фундаментальные основы, например, для исследования и разработки новых биологических технологий, для HTP-скрининга для нужд здравоохранения животных и улучшения линий клеток-хозяев.
Настоящее изобретение обеспечивает возможность дальнейшей разработки анализов, основанных на отдельных клетках, и способов сортировки клеток для идентификации стабильно экспрессирующих клеток на основе экспрессии РНК, связанной с клеточными зондами, используемыми для исследования гашения флуоресценции.
Такие отдельные клетки также применимы для временного и/или стабильного скрининга представляющего интерес гена (GOI) при осуществлении программ по сохранению свойств и защите сельскохозяйственных растений.
Если специально не указано или не предполагается иное, термины, используемые в настоящем описании в единственном числе, означают «по меньшей мере, один».
Все патенты, заявки на выдачу патентов, предварительные заявки и публикации, указанные или цитированные в настоящем описании, включены в виде ссылки в полном объеме в той степени, в которой они не противоречат конкретным идеям настоящего описания.
ПРИМЕР 1 - Материалы и способы.
Культивируемые в суспензии клетки BY2 получали из японского табака и поддерживали в среде LSBY2 в 7-дневном цикле. Суспензию дурмана обыкновенного и суспензии гаванского табака Pettite инициировали из каллусов, полученных в DAS, и суспензии Xanthi получали от профессора Jack Widholm из UIUC, IL. Суспензионные клетки JT-NT1, полученные из Вашингтонского университета, которые поддерживали в среде NT1B в 7-дневном цикле, использовали только для исследования фермента расщепления пектина, чтобы разделить клетки на отдельные клетки. Клетки культивировали во встряхиваемых колбах при 25-28ºC в темноте на орбитальном встраивающем устройство при 150 об/мин. Колхицин получали из Fluka, DAS-PMTI-1 (Martin et al., 2001; Smith et al., 2001), получали из DAS CRS, и расщепляющие пектин ферменты (пектолиазу Y и пектиназу) получали из Sigma. Концентрации исходного раствора в случае обоих ингибиторов полимеризации тубулина, используемых в данном исследовании, растворяли в ДМСО, чтобы получить 0,5 М маточный раствор. Тестируемые концентрации ферментов пектиназы и пектолиазы были в диапазоне от 0,0005% до 0,005%. Суспензионные линии клеток табака NT-I и BY-2, например, являются подходящими для практического осуществления настоящего изобретения. Клетки BY-2 являются коммерчески доступными и применимы, например, согласно Nagata et al. (Nagata, T., Nemoto, Y. and Hasezawa. S. [1992], Tobacco BY-2 cell line as the "HeLa" cell in the cell biology of higher plants. Int. Rev. Cytol. 132: 1-30). Клетки NT-I исходно получали из Nicotiana tabacum L. cv. ярко-желтого (bright yellow) 2. Линия клеток NT-I широко используется и легко доступна; хотя любую суспензионную линию табака можно использовать при практическом осуществлении настоящего изобретения. Следует отметить, что происхождение линии клеток NT-I неясно. Кроме того, линия клеток, по-видимому, вариабельна и склонна изменяться в ответ на условия культивирования. Клетки NT-I, подходящие для применения в приведенных ниже примерах, доступны из Американской коллекции типов культур с номером доступа ATCC 74840. См. также патент США № 6140075.
ПРИМЕР 2 - Микроскопические исследования.
Размножение и разделение клеток наблюдали в световом микроскопе (используя оптическую микроскопию по Номарскому и темнопольную оптическую микроскопию). Сферические клетки и отдельные клетки подсчитывали, используя гемацитометр, чтобы определить степень размножения и разделения клеток соответственно. Количество клеток в агрегатах определяли, используя обработку 5% (масс./об.) триоксидом хрома в течение 16 часов и подсчитывая клетки (Henshaw et al., 1966). Жизнеспособность клеток определяли посредством окрашивания клеток (Yokoyama et al., 1997) диацетатом флуоресцеина (FDA) и йодидом пропидия (PI), используя флуоресцентный микроскоп (Zeiss Photomicroscope). Чтобы определить наличие клеточной стенки в таких культурах отдельных клеток, использовали оптический осветлитель. В данном исследовании использовали Calcafluor, полученный из Sigma, который является специфичным флуоресцентным красителем целлюлозы, и образование комплекса целлюлозы-Calcafluor наблюдали с помощью флуоресцентной микроскопии (Zeiss Photomicroscope). Calcofluor (Sigma Chemical Co., St. Louis, Mo.) готовили в виде 0,1% (масс./об.) раствора в буфере PBS и хранили в темноте при комнатной температуре (Kwok et al., 2003). Перед использованием краску Calcafluor центрифугировали при 15000 g в течение 2 мин, чтобы удалить осадок. К разделенным клеткам добавляли одну или две капли раствора Calcafluor. После выдерживания в течение 2 или 3 минут при комнатной температуре суспензию клеток промывали водой и контрастно красили 0,1% голубым Эванса (Sigma; E-2129) в TBS (pH 7,2) в течение 1 минуты при комнатной температуре и исследовали в УФ-микроскопе при длине волны 395-415 нм (наблюдаемый свет 455 нм). Клеточные стенки выглядели в виде голубовато-белых или бирюзовых овальных ореолов.
ПРИМЕР 3 - Результаты непрерывных обработок пектиназой и пектолиазой в среде.
Суспензии клет