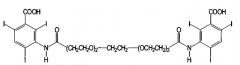Биоразрушаемое средство для поддержания просвета сосудов
Иллюстрации
Показать всеНастоящее изобретение относится к медицине, конкретно к биоразрушаемым стентам, состоящим из внутреннего биоразрушаемого металлического каркаса и внешнего полимерного покрытия. Биоразрушаемое покрытие состоит из биоразрушаемых полимеров и может дополнительно включать в себя по меньшей мере одно фармакологически активное вещество, такое как противовоспалительный, цитостатический, цитотоксический, антипролиферативный агент, агент против образования микротрубочек, антиангиогенный, антирестенозный (против рестеноза), антифунгицидный, противоопухолевый, антимиграционный, гипокоагулирующий и/или противотромбообразующий агент. Стент проявляет функцию поддержания просвета сосуда только в течение времени, до того как регенерированная ткань снова становится способной выполнять эту функцию. 11 з.п. ф-лы, 24 пр.
Реферат
Настоящее изобретение относится к биоразрушаемым стентам, состоящим из внутреннего биоразрушаемого металлического каркаса и внешнего полимерного покрытия. Биоразрушаемое покрытие состоит предпочтительно из биоразрушаемых полимеров и дополнительно может содержать по меньшей мере одно фармакологически активное вещество, такое как противовоспалительный, цитостатический, цитотоксический, антипролиферативный агент, агент против образования микротрубочек, антиангиогенный, антирестенозный (против рестеноза), антифунгицидный, противоопухолевый, антимиграционный, гипокоагулирующий и/или противотромбообразующий агент.
В настоящее время имплантация стентов является обычной хирургической процедурой для лечения стенозов. Последние исследования показали, что васкулярные стенозные сосуды не нужно постоянно расширять при помощи эндопротезов, особенно стента. Достаточно расширить ткань при помощи эндопротеза временно, поскольку в присутствии протеза-стента ткань может регенерироваться в части васкулярного стеноза и затем оставаться расширенной даже без поддержки, например, стента. Это означает, что после определенного времени протез, поддерживающий ткань, по существу теряет свое действие, поскольку регенерированная ткань снова позволяет поддерживать нормальный диаметр сосуда сама собой, так что никакой рестеноз не может иметь место после удаления протеза.
Биоразрушаемый металлический стент, главным образом изготовляемый из магния, описан в Европейском патенте ЕР 1419793 В1. В заявке на патент Германии DE 10207161 А1 описаны стенты, изготовленные из сплавов магния и сплавов цинка. В заявке на патент Германии DE 19856983 А1 описаны биоразрушаемые стенты, изготовленные из магния, кальция, титана, циркония, ниобия, тантала, цинка или кремния или сплавов или смесей вышеуказанных веществ. Приведены конкретные примеры стентов, изготовленных из сплава цинк/кальций.
Дополнительные биоразрушаемые металлические стенты, изготовленные из магния, титана, циркония, ниобия, тантала, цинка и/или кремния в качестве компонента А и лития, натрия, калия, кальция, марганца и/или железа в качестве компонента В описаны в заявке на Европейский патент ЕР 0966979 А2. Приведены конкретные примеры стентов, изготовленных из сплава цинк/титан с массовым процентом титана от 0,1 до 1% и сплава цинка/кальция с отношением массовых процентов цинка и кальция 21:1.
С одной стороны, эти стенты имеют недостатком слишком быстрое растворение и, кроме того, растворение происходит нерегулируемым образом, так что некоторые из них дезинтегрируются уже после двух недель.
Другим недостатком таких стентов является требуемая степень прочности сегментов, которая по сравнению со стентами из обычных материалов, как например, стенты из медицинской нержавеющей стали, нитинола и сплава кобальт/хром, распорки (стойки) стента имеют более широкую, а также более толстую конструкцию. Результатом этого является увеличенная поверхность контактирования с окружающей средой, с другой стороны, стент далее проникает в полость сосуда и может оказывать влияние на кровоток. Кроме того, тем самым включение в васкулярную стенку замедляется, вследствие чего должна быть покрыта увеличенная поверхность стента. Кроме того, поскольку процесс растворения начинается до включения стента в васкулярную стенку, могут отщепляться фрагменты, которые могут переноситься посредством кровотока и таким образом могут вызвать инфаркт сердца.
Следующим недостатком описанных биорезорбируемых металлических стентов является то, что они обеспечивают только очень ограниченные возможности для включения фармакологически активного агента в металлический каркас, который будет высвобождать его во время разрушения стента.
Задачей настоящего изобретения является обеспечение стента, который проявляет свою функцию поддержания просвета сосуда только в течение времени, до того как регенерированная ткань снова становится способной выполнять эту функцию, и лишен недостатков общепринятых стентов.
Эта задача решается согласно независимым пунктам формулы изобретения. Более подходящие варианты осуществления изобретения следуют из зависимых пунктов изобретения, описания и примеров.
Настоящее изобретение относится к биоразрушаемым стентам, состоящим из внутреннего биоразрушаемого каркаса, содержащего по меньшей мере один металл и окруженного полимерным биоразрушаемым покрытием.
Полимерный слой уменьшается сам собой на распорках стента или может оборачивать все пустоты, подобно чулку, либо на стороне, противоположной люминальной стороне, либо на люминальной стороне тела стента, или может заполнять свободные промежутки тела стента таким образом, чтобы оболочка лежала на той же плоскости, что и таким же образом обернутые распорки стента. Формы покрытия могут быть пригодным образом комбинированы.
Согласно изобретению, внутренний каркас стента состоит из металла, сплава металлов, оксида металла, хлорида металла, нитрида металла или смеси указанных веществ. Особенно предпочтительно, когда внутренний каркас состоит из сплава металлов, содержащего до 3 мас.%, предпочтительно, до 20 мас.% и особенно предпочтительно, только до 10 мас.% оксидов металлов, солей металлов, карбидов металлов и/или нитридов металлов. Кроме того, в состав композиции или сплава может быть включено до 1 мас.% других компонентов, таких как углеродные, азотные, кислородные примеси, неметаллы или органические вещества.
Кроме того, внутренний металлический каркас обладает свойством растворения более быстрым, чем полимерное внешнее покрытие, т.е. внутренняя структура стента подвергается более быстрому биоразрушению, чем полимерное покрытие, в физиологических условиях. При применении разных биоразрушаемых полимеров на стенте имеется дополнительная возможность применения полимеров, которые различаются по времени разрушения. Так, может быть выгодным, чтобы покрытие на люминальной стороне растворялось медленнее, чем покрытие на стороне, противоположной люминальной стороне стента. Таким образом, например, замедляется разрушение стента кровотоком. Другим преимуществом является стабилизация тела стента, так что никакие фрагменты не могут отщепляться преждевременно. Полное обертывание на всем протяжении внутренней поверхности тела стента может дополнительно регулировать эти действия.
Сплав металлов предпочтительно превращается внутри полимерной оболочки в его соответствующие соли металлов, которые проходят через полимерное покрытие.
Подходящие металлические внутренние каркасы стента изготавливают из металлических материалов, проявляющих разность потенциалов по меньшей мере -0,48 эВ, предпочтительно, по меньшей мере -0,53 эВ, более предпочтительно, по меньшей мере -0,58 эВ и особенно предпочтительно, по меньшей мере -0,63 эВ, по сравнению с каломельным электродом или проявляющих разность потенциалов в диапазоне от -0,3 до -2,5 эВ, предпочтительно, от -0,4 до -1,5 эВ, более предпочтительно, от -0,45 до -1,25 эВ и особенно предпочтительно, от -0,5 до -1,0 эВ по сравнению с каломельным электродом.
Для регистрации измеренной разности потенциалов применяют электрохимическое расположение двух электродов. Поскольку разность потенциалов нужно определить воспроизводимым образом, необходима точка отсчета, которая будет изменяться во время измерения.
Для этой цели обычно применяют электроды второго типа. Эти металлические электроды покрывают их нерастворимыми солями, и вокруг них течет раствор соли более высокой концентрации. К этой группе относится, например, каломельный электрод (уточнено: насыщенный каломельный электрод, SCE). Название “каломель” происходит от тривиального названия нерастворимого быстро хлорида ртути(I).
Каломельный электрод (а также некоторые другие электроды металл/соль металла) оказались сами на практике пригодными в качестве электродов сравнения. Например, практическим применением является измерение разности потенциалов в растворе при помощи каломельного электрода. Такое измерение можно также применять для определения подходящего металла, особенно подходящего сплава металлов.
Разность потенциалов обычно описывают известным уравнением Нернста:
Как можно легко понять, потенциал Е зависит исключительно от концентрации нерастворимой быстро соли ртути. Если концентрация аниона, т.е. концентрация противоиона, сохраняется постоянной, то Е также остается постоянной. Этого можно достичь выбором очень высокой концентрации аниона.
Каломельный электрод состоит из ртути, самого электрода, покрытого твердым Hg2Cl2, и погруженного в насыщенный раствор KCl (высокая концентрация ионов Cl-). Солевой мостик применяют для точных измерений, чтобы подавить диффузионные потенциалы. Таблицы, содержащие величины, определенные таким устройством, следует всегда составлять из величин по отношению к такой точке отсчета (каломельный электрод).
Таким образом, каломельный электрод в качестве электрода второго типа является весьма подходящим в качестве электрода сравнения для измерений потенциалов. Каломельный электрод в качестве электрода сравнения выбран также в настоящем изобретении.
Устройство, указанное выше, можно теперь применять для выбора подходящих материалов, которые являются менее благородными, чем каломель, т.е. их потенциал сравнения находится в диапазоне от 0,3 до 2,5 эВ, предпочтительно, от 0,35 до 2,2 эВ, более предпочтительно, от 0,4 до 1,8 эВ, более предпочтительно, от 0,45 до 1,4 эВ, более предпочтительно, от 0,48 до 1,2 эВ, более предпочтительно, от 0,50 до 1,0 эВ, более предпочтительно, от 0,50 до 0,9 эВ, более предпочтительно, от 0,50 до 0,80 эВ, и особенно предпочтительно, от 0,50 до 0,70 эВ (указаны в абсолютных величинах, т.е. без алгебраического обозначения) по сравнению с каломельным электродом.
Особенно предпочтительным является внутренний каркас, состоящий из сплава, содержащего магний, кальций, марганец, железо, цинк, кремний, иттрий, цирконий и/или гадолиний, и более предпочтительно из сплава магния, кальция, марганца, железа, цинка, кремния, иттрия, циркония или гадолиния, содержание их в этом сплаве для более высоких массовых процентов указывается как масс.%.
Чтобы избежать возможность того, что металлический каркас растворяется слишком быстро и дезинтегрирует на фрагменты, которые могут вымываться из кровотока и вызывать инфаркт сердца, внутренний биорезорбируемый каркас из металла, соли металла, оксида металла и/или сплава металлов заключают в полимерное покрытие, покрывающее распорки стента или, как уже указывалось, все цилиндрическое тело стента.
Согласно изобретению, полимерное покрытие действует таким образом, что внутренний металлический каркас может сам растворяться внутри покрытия и ионы металлов могут выходить из покрытия в окружающую ткань. Так, например, полимерное покрытие является пористым или обеспечено каналами или отверстиями и действует таким образом, что ионы (анионы, а также катионы) могут выходить из него.
Согласно изобретению, полимерное покрытие может быть представлено в форме ионопроницаемой мембраны или может иметь нано- или микропоры, которые дают возможность проникать воде, а также выходить ионам.
Такие покрытия, пористые или обеспеченные каналами или отверстиями, можно получить либо нанесением полимерного покрытия на стент, что приводит к созданию проницаемого полимерного слоя, либо приданием полимерному покрытию проницаемости после нанесения покрытия. Термин “проницаемый” будет означать, что полимерное покрытие является пористым или имеет каналы, поры или отверстия, которые позволяют входить воде и выходить ионам.
Такие покрытия можно получить либо при помощи полимеров, которые сами образуют пористое покрытие на поверхности стента, либо при помощи раствора олигомеров и/или полимеров, которые наносят на поверхность стента и которые подвергают затем дополнительному сшиванию (например, глутаровым альдегидом и/или другими диальдегидами) после нанесения и несшитые олигомеры и полимеры затем вымывают из покрытия предпочтительно растворителем или применением самопроизвольно полимеризуемого вещества, такого как ненасыщенные жирные кислоты и производные ненасыщенных жирных кислот, где неполимеризованные вещества предпочтительно вымывают с поверхности стента растворителем. Следующими возможностями для генерации проницаемого полимерного покрытия на стенте являются нанесения сравнительно неэластичного или твердого, соответственно хрупкого полимерного покрытия, которое лопается при расширении стента и образует трещинки и таким образом становится проницаемым, предпочтительно, после раздувания стента. Кроме того, к полимерному раствору для покрытия можно добавить одно или несколько веществ, которые можно смыть после нанесения покрытия на стент и образования проницаемой структуры. Предпочтительным здесь является добавление солей в форме порошка, частиц или также в растворенной форме. Образованные соли полимерного покрытия могут быть вымыты из полимерного покрытия, предпочтительно, водой, с образованием пористой структуры покрытия. Конечно, соли можно не вымывать до имплантации стента. Стент с полимерным покрытием вместе со всеми включенными фармакологически приемлемыми солями можно также имплантировать еще в непроницаемой форме, соли затем естественным образом вымываются посредством кровотока, поскольку проницаемое покрытие генерируется только после того, как физиологически приемлемые соли, такие как NaCl, NaBr, NaI, NaSO4, KCl, NaHCO3 или другие физиологически приемлемые соли, известные специалисту в данной области, вымываются из полимерного покрытия.
Наконец, имеется возможность генерации непроницаемого полимерного покрытия на стенте, которому затем придают проницаемость при помощи химических, механических, оптических или других способов. Например, применение оснований или кислот может сделать полимерное покрытие проницаемым, этого можно также достичь применением лазеров или других механических способов полировки, таких как способы химической полировки или пескоструйной обработки. Такие способы известны специалисту в данной области и, конечно, их нужно приспосабливать для соответствующего покрытия, его толщины и твердости и для применяемых полимеров.
Гарантируется, что этим вариантом осуществления, по меньшей мере вначале, обеспечивается присутствие металлсодержащего внутреннего каркаса, который может оказывать достаточное расширяющее воздействие на сосуд для сохранения его открытым и предотвращения самопроизвольного возврата к прежнему состоянию, т.е. самопроизвольного спадения стенок сосуда после расширения вследствие поврежденных или расслабленных васкулярных мышц. Поскольку сосуд может восстанавливать свою эластичность и упругость спустя некоторое время, нет необходимости сохранять сосуд перманентно открытым стентом как постоянным имплантатом, т.е. как бионеразрушаемым или только медленно биоразрушаемым имплантатом.
Кроме того, имеется проблема рестеноза или стеноза (сужения) в бионеразрушаемых стентах, поскольку сосуд сдавливается или закупоривается внутри из-за зарастания стента клетками гладких мышц. Дополнительно имеется проблема помещения другого стента в месте, в которое был уже имплантирован бионеразрушаемый стент.
Кроме того, существует опасность позднего тромбоза при применении высвобождающих вещество стентов, изготовленных из известных бионеразрушаемых материалов, которые могут самопроизвольно привести, часто спустя даже один год, к острой закупорке. Такие тревожные результаты стали известны летом 2006 года. Поверхность стента, которая все же не составляет единое целое, вследствие цитотоксических действий активного агента, была названа как причина позднего тромбоза, имеющего место после этого времени. В связи с этим польза от применения высвобождающих вещество стентов до сих пор подвергается сильному сомнению.
Эти недостатки также устраняются стентом согласно изобретению, поскольку он растворяется полностью регулируемым образом после определенного времени. Полимерная оболочка согласно изобретению дает возможность проведения биологического разрушения металлического внутреннего каркаса без опасности отделения фрагментов, поскольку полимерная оболочка покрывает внутренний каркас полностью таким образом, что большие или также маленькие фрагменты не могут проникнуть через полимерное покрытие. В противоположность этому, возможным является проникновение ионов и солей, которые образуются из металлического каркаса в физиологических условиях.
Такие ионы металлов, а также их противоионы могут проникать через полимерное покрытие, соответственно, выходя через поры от нано- до микроразмера.
В особенно предпочтительном варианте осуществления настоящего изобретения внутренний металлический или металлсодержащий каркас разрушается быстрее в физиологических условиях, чем внешняя полимерная оболочка, так что пустая полимерная оболочка, проросшая в васкулярную стенку, остается там в течение некоторого времени, но при этом является эластичной, больше не оказывает значительного давления на васкулярную стенку и даже близко соответствует новой форме сосуда. Затем эта полимерная оболочка также биоразрушается, так что спустя 2-12 месяцев биоразрушаемый стент полностью растворяется. Таким образом, согласно изобретению, полимерное покрытие растворяется медленнее, чем металлическая внутренняя структура и предоставляет возможность для проникновения солей и ионов, так что внутренняя структура может раствориться и соли и ионы могут ресорбироваться из окружающей ткани. В этом особенно предпочтительном варианте осуществления настоящего изобретения покрытый стент сконструирован таким образом, что стент врастает в ткань до того, как биорезорбируемое покрытие начинает растворяться. Растворение внутреннего каркаса стента может происходить до того, как стент врастает в васкулярную ткань, тогда как предпочтительно, чтобы врастание и растворение внутреннего каркаса стента по существу имело место одновременно. Наоборот, скорость растворения внутренней структуры стента по сравнению с покрытием, нанесенным на него, является существенной в таком особенно предпочтительном варианте осуществления. Полимерное покрытие предпочтительно должно растворяться максимально до 15 масс.%, более предпочтительно, до 10 масс.% и особенно предпочтительно, до 5 масс.%, когда внутреннее тело стента растворяется полностью. Термин «полимерное покрытие» относится только к компонентам, образующим полимерное покрытие, а не к компонентам покрытия, которые не связываются в полимерную форму, такие как частицы соли, которые будут вымываться из покрытия посредством кровотока. Другими словами, скорость растворения внутреннего каркаса стента в отношении к полимерному покрытию будет составлять по меньшей мере до 10:1, предпочтительно, до 20:1, более предпочтительно, до 30:1, еще более предпочтительно, до 40:1 и особенно предпочтительно, до 50:1. Отношение 20:1 здесь означает, что по меньшей мере 20 масс.% внутреннего каркаса стента растворилось и высвободилось через полимерное покрытие, когда максимально 1 масс.% полимерного покрытия растворилось или биоразрушилось.
Способ определения кинетики растворения непокрытого металлического стента согласно изобретению состоит в помещении стента в трубку между двумя пористыми мембранами или пластинками-фильтрами и пропусканием физиологического солевого раствора, буфера PBS (фосфатный буфер с 14,24 г NaH2PO4, 2,72 г K2HPO4 и 9 г NaCl; рН 7,4; Т=37°С) или сыворотки крови через трубку, предпочтительно с такой же скоростью, что и скорость кровотока в сосудах тела человека.
Скорость растворения полимерного покрытия можно определить нанесением полимерного покрытия на бионеразрушаемый стент, например стент из нержавеющей стали, и помещением его подобным образом между двумя мембранами в трубке, через которую пропускают физиологический солевой раствор, буфер PBS или сыворотку крови.
Растворение стента можно изучать оптическим способом и дополнительно количественным измерением массы.
В другом варианте осуществления согласно изобретению полимерное покрытие демонстрирует углубления, отверстия и/или каналы, которые делают возможным проникновение солей или ионов, но имеют размеры не такие большие, чтобы через них могли пройти фрагменты металлического внутреннего каркаса.
Эти углубления, отверстия и/или каналы предпочтительно ориентированы перпендикулярно центральной оси отдельных стоек стента и, кроме того, они предпочтительно не расположены на концах стоек стента. Эти углубления, отверстия и/или каналы можно создать механическим, химическим, термическим или оптическим действием на полимер, например, механической обработкой, такой как пескоструйная обработка, химическими способами, такими как травление или окисление, механическими-химическими способами, такими как способы полирования, термическими способами, такими как плавление или выжигание, или оптическими способами, такими как лазерная обработка.
В другом особенно предпочтительном варианте осуществления углубления, отверстия и/или каналы заполняют фармакологически активным агентом. Подходящие активные агенты перечислены дополнительно ниже. Активный агент(ы), который вводят в углубления, отверстия и/или каналы, можно смешать с фармацевтически приемлемым носителем, таким как соль, контрастная среда, наполнитель, олигомер, органические соединения, такие как аминокислоты, витамины, углеводы, жирные кислоты, масла, жиры, воски, белки, пептиды, нуклеотиды или растворитель.
В качестве фармакологически приемлемого носителя можно применять, например, лактозу, крахмал, натриевую соль карбоксиметилкрахмала, сорбит, сахарозу, стеарат магния, дикальцийфосфат, сульфат кальция, тальк, маннит, этиловый спирт, поливиниловые спирты, поливинилпирролидоны, желатин, природные сахара, природные, а также синтетические камеди, такие как аравийская камедь или гуаровая камедь, альгинат натрия, бензоат натрия, ацетат натрия, глицериды, миристаты, такие как изопропилмиристат, пальмитаты, трибутил- и триэтилцитраты и их ацетилпроизводные, фталаты, такие как диметилфталат или дибутилфталат, бензиловый эфир бензойной кислоты, триацетин, 2-пирролидон, борную кислоту, силикаты магния и алюминия, природную carob-камедь, камедь карайи, гуаровую камедь, трагакант, агар, каррагенаны, целлюлозу, производные целлюлозы, такие как метилцеллюлоза, натриевую соль карбоксиметилцеллюлозы, гидроксипропилметилцеллюлозу, микрокристаллическую целлюлозу, а также альгинаты, оксиды алюминия и бентониты, полиэтиленгликоль, а также воски, такие как пчелиный воск, карнаубский воск, канделильский воск и тому подобное.
Дополнительными носителями могут быть витамины, такие как витамин А, витамин С (аскорбиновая кислота), витамин D, витамин Н, витамин K, витамин Е, витамин В1, витамин В2, витамин В3, витамин В5, витамин В6, витамин В12, тиамин, рибофлавин, ниацин, пиридоксин и фолиевая кислота.
Дополнительными подходящими носителями являются гепарин, сульфат гепарина, хитозан, хитин, сульфат хондроитина, коллаген, фибрин, ксантоны, флавоноиды, терпеноиды, целлюлоза, вискозное волокно, пептиды с 50-500 аминокислотами, нуклеотиды с 20-300 парами оснований, а также сахариды с 20-400 мономерами сахара, жирные кислоты, эфиры жирных кислот, производные жирных кислот, простые эфиры, липиды, липоиды, глицериды, триглицериды, сложный эфир гликоля, сложный эфир глицерина и масла, такие как льняное масло, конопляное масло, кукурузное масло, ореховое масло, рапсовое масло, соевое масло, подсолнечное масло, маковое масло, сафлоровое масло, жир зародышей пшеницы, шафранное масло, виноградное масло, масло энотеры, масло бурачника, масло чернушки посевной, масло водорослей, рыбий жир, жир печени трески и/или смеси вышеуказанных масел.
Подходящими аминокислотами являются глицин, аланин, валин, лейцин, изолейцин, серин, треонин, фенилаланин, тирозин, триптофан, лизин, аргинин, гистидин, аспартат, глутамат, аспарагин, глутамин, цистеин, метионин, пролин, 4-гидроксипролин, N,N,N-триметиллизин, 3-метилгистидин, 5-гидроксилизин, О-фосфоносерин, γ-карбоксиглутамат, ε-N-ацетиллизин, ω-N-метиларгинин, цитруллин, орнитин.
Кроме того, подходящими носителями являются нижеследующие жирные кислоты и эфиры нижеследующих жирных кислот: эйкозапентаеновая кислота (ЕРА), тимнодоновая кислота, докозагексаеновая кислота (DHA), α-линоленовая кислота, γ-линоленовая кислота, миристолеиновая кислота, пальмитолеиновая кислота, петрозелиновая кислота, олеиновая кислота, вакценовая кислота, гадолеиновая кислота, гондолеиновая кислота, гондоиновая кислота, эруциновая кислота, нервоновая кислота, элаидиновая кислота, трет-вацценовая кислота, линолевая кислота, γ-линоленовая кислота, дигомо-γ-линоленовая кислота, арахидоновая кислота, α-линоленовая кислота, стеаридоновая кислота, DPA, меадиновая кислота, стеллагептаеновая кислота, таксоловая кислота, пиноленовая кислота, сциадоновая кислота, таририновая кислота, санталбиновая или ксимениновая кислота, стеаролиновая кислота, 6,9-октадецениновая кислота, пирулиновая кислота, крепениновая кислота, гейстериновая кислота, ETYA, лауриновая кислота, миристиновая кислота, пальмитиновая кислота, маргариновая кислота, стеариновая кислота, арахиновая кислота, бегеновая кислота и лигноцериновая кислота, а также производные и смеси вышеуказанных жирных кислот.
Особенно предпочтительным, однако, является растворение по меньшей мере одного противовоспалительного, цитостатического, цитотоксического, антипролиферативного, агента против образования микротрубочек, антиангиогенного, антирестенозного (против рестеноза), антифунгицидного, противоопухолевого, антимиграционного, гипокоагулирующего и/или противотромбообразующего агента в растворителе и введение его в виде по существу чистого активного агента в углубления, отверстия и/или каналы в полимерном покрытии, что можно достичь посредством способа разбрызгивания или пипетирования. После выпаривания растворителя активный агент остается внутри углублений, отверстий и/или каналов.
Обычные органические растворители, такие как диметилсульфоксид, простой эфир, такой как диоксан, тетрагидрофуран (ТГФ), петролейный эфир, диэтиловый эфир, метил-трет-бутиловый эфир, кетоны, такие как ацетон, бутанон или пентанон, спирты, такие как метанол, этанол, пропанол, изопропанол, карбоновые кислоты, такие как муравьиная кислота, уксусная кислота, пропионовая кислота, амиды, такие как диметилформамид (DFA) или диметилацетамид, ароматические растворители, такие как толуол, бензол, ксилол, чистые углеводородные растворители, такие как пентан, гексан, циклогексан, галогенированные растворители, такие как хлороформ, метиленхлорид, тетрахлорид углерода, а также эфиры карбоновых кислот, такие как метиловый эфир уксусной кислоты и этиловый эфир уксусной кислоты, а также вода, служат в качестве растворителя в зависимости от растворимости активного агента.
Кроме того, особенно предпочтительным является добавление активного агента к контрастной среде или аналогу контрастной среды и введение его в этой форме в углубления, отверстия и/или каналы.
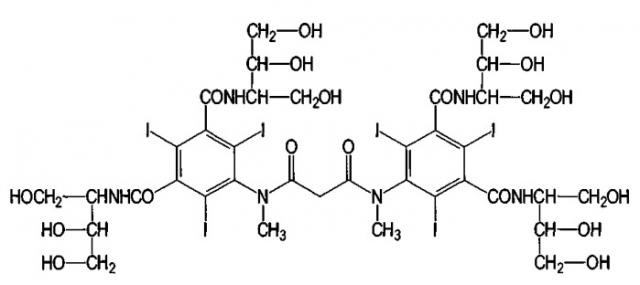
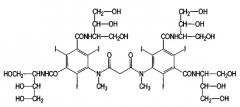
В качестве контрастных сред или аналогов контрастных сред можно применять обычные радиографические контрастные среды (позитивные, а также негативные контрастные среды), такие как контрастные среды, обычно применяемые для способов получения изображений (в артрографии, радиографии, компьютерной томографии (СТ), ядерной спиновой томографии, магнитной резонансной томографии (MRT)). Контрастные среды и/или аналоги контрастных сред обычно содержат барий, иод, марганец, железо, лантан, церий, празеодим, неодим, самарий, европий, гадолиний, тербий, диспрозий, гольмий, эрбий, тулий, иттербий и/или лутеций, предпочтительно, в виде ионов в связанной и/или комплексной форме, где предпочтительными являются содержащие иод контрастные среды.
Следующие примеры можно назвать иодсодержащими контрастными средами:
Амидотризоевая кислота
Иотролан
Иопамидол
Иодоксамовая кислота
Следующим примером является иодлипиодол®, иодированный олеум папаверис, маковое масло. Исходное вещество иодированных контрастных сред, амидотризоат в форме натриевой и меглуминовой солей, является коммерчески доступным под торговым знаком гастрографин® и гастролюкс® (Германия, Швейцария).
Предпочтительными являются также гадолинийсодержащие или суперпарамагнитные частицы оксида железа, а также ферримагнитные или ферромагнитные частицы железа, такие как наночастицы.
Другим классом предпочтительных контрастных сред являются парамагнитные контрастные среды, которые обычно содержат лантаноид.
Среди парамагнитных веществ с неспаренными электронами имеется, например, гадолиний (Gd+3), имеющий всего семь неспаренных электронов. Кроме того, к этой группе относятся европий (Eu2+, Eu3+), диспрозий (Dy3+) и гольмий (Но3+). Эти лантаноиды можно также применять в хелатированной форме с применением, например, гемоглобина, хлорофилла, полиазакислот, поликарбоновых кислот и особенно EDTA, DTPA, DMSA, DMPS и DOTA в качестве хелатирующих агентов.
Примерами гадолинийсодержащих контрастных средств являются гадолиний и диэтилентриаминпентауксусная кислота.
Гадопентетовая кислота (Gd-DPTA)
Гадодиамид
Гадотерат меглумина
Гадотеридол
Для увеличения переноса активного агента можно применять так называемые медиаторы переноса, которыми, однако, могут быть сами активные агенты. Особенно интересными в качестве медиаторов переноса являются химические соединения с низкой молекулярной массой, которые ускоряют или облегчают поглощение активного агента в васкулярную стенку, так чтобы присутствующий активный агент или комбинацию активных агентов можно было перенести регулируемым способом и в предполагаемой дозе во время краткосрочного контактирования. Такие свойства обнаружены у веществ, взаимодействующих непосредственно с липидным двойным слоем клеточной мембраны или с рецепторами на клеточной мембране, или проникающих в цитозоль через мембранные транспортные белки, действующие в качестве носителей, или каналов (ионные насосы), где они изменяют мембранный потенциал и таким образом мембранную проницаемость клеток. Поглощение активного агента в клетке таким образом облегчается и, соответственно, ускоряется.
К таким применимым соединениям относятся, например, сосудорасширяющие агенты, такие как брадикинин, каллидин, гистамин или NOS-синтаза, которая высвобождает сосудорасширяющий NO из L-аргинина, вещества растительного происхождения, такие как экстракт гингко билоба, ДМСО, ксантоны, флавоноиды, терпеноиды, растительные и животные красители, пищевые красители, NO-высвобождающие вещества, такие как тетранитрат пентаэритрита (PETN). Указанные выше контрастные среды и аналоги контрастных сред относятся к этой категории.
Углубления, отверстия и/или каналы, наполненные активным агентом или композицией активных агентов таким способом, что содержимое их растворяется относительно быстро и высвобождается, таким образом раскрывая или открывая углубления, отверстия и/или каналы непосредственно после имплантации стента. Активный агент внутри углублений, отверстий и/или каналов высвобождается очень быстро, так что это можно характеризовать как быстрое высвобождение, т.е. быстрое высвобождение, которое занимает время предпочтительно от нескольких часов до 2 дней.
Проблему рестеноза, соответственно направленное врастание стента в васкулярную стенку, можно, таким образом, устранить посредством начального высвобождения активного агента.
Такое быстрое высвобождение активного агента можно дополнительно сочетать с медленным высвобождением активного агента, принимая во внимание то, что это может быть тот же самый или другой активный агент. Этот активный агент наносят на полимерное покрытие так, чтобы полимерное покрытие действовало также в качестве носителя.
В полимерном покрытии предпочтительно содержится цитостатическая доза противовоспалительного, цитостатического, цитотоксического, антипролиферативного агента против образования микротрубочек, антиангиогенного, антирестенозного (против рестеноза), антифунгицидного, противоопухолевого, антимиграционного, гипокоагулирующего и/или противотромбообразующего агента. Этот активный агент затем высвобождается в количестве, соответствующем биоразрушению полимерного покрытия.
Таким образом, биорезорбируемый стент согласно изобретению дополнительно обеспечивает возможность высвобождения активного агента и особенно комбинации быстрого и медленного высвобождения активного агента. Кроме того, активные агенты, противодействующие адгезии тромбоцитов и соответственно образованию тромбов, можно применять направленным способом, обертыванием тела стента на люминальной стороне. Такие возможности позволяют направленным образом высвобождать активный агент или комбинацию активных агентов, которые особенно адаптированы к окружающей среде. Активные агенты можно применять в одном и том же стенте направленным способом и независимо друг от друга.
Таким образом, стент согласно изобретению имеет ряд убедительных преимуществ относительно известных вариантов осуществления. Первое, полимерная оболочка предотвращает дезинтеграцию и разрушение металлического каркаса, которые могут привести к серьезным последствиям. В особенно предпочтительных вариантах осуществления более быстрое биоразрушение внутреннего металлического или металлсодержащего каркаса по сравнению с полимерным покрытием гарантирует, что внутренний каркас растворяется первым, и его продукты растворения высвобождаются регулируемым способом и резорбируются тканью. Когда сосуд может возвращать подходящую поддержку своего расширения, внутренний каркас уже находится в состоянии растворения. После растворения внутренней структуры полимерная наружная оболочка также биоразрушается.
Вследствие структуры полимерной наружной оболочки с углублениями, отверстиями, каналами и/или порами получают систему, которая дополнительно сочетает быстрое и медленное высвобождение активного агента или комбинации активных агентов направленным способом.
Углубления, отверстия, каналы и/или поры можно заполнять активным агентом или композицией, содержащей активный агент, направленным способом, и активный агент может быстро высвобождаться из этих полостей, или всю поверхность или часть поверхности внешней полимерной оболочки покрывают активным агентом или композицией, содержащей активный агент. Здесь может быть предложен и реализован любой вариант осуществления.
Кроме того, имеется возможность внедрения в полимерный биоразрушаемый слой одного или также нескольких активных агентов, которые затем будут медленно высвобождаться в такой же степени, в какой полимерная наружная оболочка растворяется, т.е. биоразрушается.
Система является очень эластичной, имеет преимущества общепринятого элюирующего лекарственное средство стента и дополнительно сочетает быстрое лечение активным агентом с локальной длительной терапией и, кроме того, является полностью биоразрушаемой, так что после некоторого времени в теле пациента больше не присутствует чужеродное тело. Например, проблема позднего рестеноза из-за стента, которая в настоящее время беспокоит экспертов, может быть таким образом устранена на 100%.
Например, резорбируемый ст