Фармацевтические композиции, включающие полимерные связующие вещества с негидролизуемыми ковалентными связями, и применение указанных композиций для лечения глютеновой болезни
Иллюстрации
Показать всеГруппа изобретений относится к медицине, в частности к фармацевтическим композициям, способам применения для лечения пациентов, страдающих глютеновой болезнью. Композиция содержит высокомолекулярный синтетический полимер, который содержит (а) сополимер гидроксиэтилметакрилата (НЕМА) и 4-стиролсульфоновой кислоты или ее соли; (б)сополимер (НЕМА) и сульфопропилметакрилата или его соли, (в) полимер 4-стиролсульфоновой кислоты или его соли или (г) полимер сульфопропилметакрилата или его соли. Указанный полимер способен к образованию электростатических связей при pH ниже, чем изоэлектрическая точка глютена и пептидов, образующихся при расщеплении глютена, и способен к связыванию с глютеном или пептидами, образующимися при расщеплении глютена в желудочно-кишечном тракте, и фармацевтически приемлемый носитель. Изобретение обеспечивает использование полимерного вещества для связывания глютена или пептида, образующегося при расщеплении глютена, для снижения расщепления глютена до токсических пептидов или для снижения взаимодействия глютена или пептидов, образующихся при расщеплении глютена со слизистой оболочкой желудочно-кишечного тракта, что приводит к снижению вредного воздействия глютена. 7 н. и 76 з.п. ф-лы, 9 ил., 34 пр.
Реферат
Ссылка на родственные заявки
По данной заявке испрашивается приоритет на предварительный патент по заявке США № 60/735820, поданной 14 ноября 2005 г. Все вышеуказанные документы полностью включены в качестве ссылки.
Область техники, к которой относится изобретение
Данное изобретение касается фармацевтических композиций, включающих полимерные связующие вещества, и способов применения указанных композиций. Более конкретно данное изобретение касается неусваиваемых синтетических полимеров для связывания глютена или глиадина и/или пептидов, образующихся при расщеплении глютена или глиадина, и способов применения указанных полимеров.
Обоснование изобретения
Глютеновая болезнь, известная также как глютеновая интолерантность, является синдромом, характеризующимся поражением слизистой оболочки тонкой кишки после воздействия либо глиадиновой фракции глютена пшеницы, либо соответствующих растворимых в спирте белков (проламинов) ячменя и ржи на генетически чувствительных субъектов. Глютеновая болезнь является общим аутоиммунным нарушением, имеющим генетические, экологические и иммунологические компоненты. Болезнь тесно связана с генами, которые кодируют лейкоцитарные антигены человека DQ2 и DQ8 [1]. Идентифицирован 33-мерный фрагмент α-глиадина, имеющий ряд характеристик, позволяющих предположить, что данный глиадин является возможным инициатором воспалительной реакции на глютен у пациентов с глютеновой болезнью [2].
Симптомы глютеновой болезни могут изменяться в диапазоне от легкой слабости, боли в костях и афтозного стоматита до хронической диареи, вздутия живота и прогрессирующей потери в весе [3]. По причине широкого ряда симптомов наличие глютеновой болезни диагностировать сложно. Зараженные данным заболеванием страдают от нарушений под действием кисломолочных продуктов (укорочение и ворсинчатое сглаживание) в собственной пластинке слизистой оболочки и криптовых участках кишечника [3]. Кроме того, гастроинтестинальная карцинома или лимфома развивается у 15 процентов пациентов с нелеченой или резистентной глютеновой болезнью [4]. Безглютеновая диета позволяет предупредить почти все осложнения заболевания [5]. Такая диета подразумевает исключение всех продуктов, содержащих пшеницу, рожь, ячмень или производных указанных зерновых. Задача трудная, поскольку многие скрытые источники глютена могут быть найдены в ингредиентах многих пищевых продуктов, подвергшихся технологической обработке.
До настоящего времени, не считая исключения из диеты глютенсодержащих продуктов, не существовало фармакологического лечения, пригодного для пациентов с глютеновой болезнью. Поразительно, что на сегодняшний день изучаются сравнительно немногочисленные терапевтические стратегии. Изучаются подходы, основанные на толерантности антитела и опосредованного T-клетками отклика на токсические пептиды глиадинов или на создании нейтрализующих антител против IL-15, блокирующих опосредованные IL-15 изменения в слизистой оболочке тонкой кишки [6]. Перспективное направление связано с открытием экзогенных ферментов, которые легко могут разлагать токсические пептиды in situ [7]. Однако высокая стоимость, связанная с крупномасштабным производством ферментов, и возможная утрата активности после перорального введения являются потенциальными ограничениями для промышленного выпуска указанных ферментов. Дополнительные подходы, имеющие целью воспрепятствовать активации глютенреактивных T-клеток, включают ингибирование связывания глютеновых пептидов с лейкоцитарным антигеном человека (HLA) DQ2 (или DQ8). Решающая роль HLA в развитии глютеновой болезни делает HLA прямым объектом терапевтического воздействия. Недавно раскрытая рентгеновская кристаллическая структура HLA-DQ2, комплексно связанного с дезаминированным глютеновым пептидом, дала важную информацию для разработки HLA-DQ2-блокирующего соединения [8]. Антагонисты зонулина также предложены в качестве терапевтического средства от глютеновой болезни. Зонулин представляет собой белок, вовлеченный в регуляцию межклеточных непроницаемых перегородок в тонком кишечнике. Обнаружено, что экспрессия зонулина возрастает во время острой фазы глютеновой болезни, клинического состояния, при котором кишечная проницаемость увеличивается [9].
В настоящее время исследуется разработка зерновых с низким содержанием или без содержания иммунотоксических последовательностей, но с приемлемым хлебопекарным качеством. Такие зерновые потенциально могут быть получены селекцией старых сортов пшеницы [10], посредством трансгенной технологии, включающей мутацию последовательностей, порождающих иммуностимулирующие последовательности [11] или включением нетоксичных глютеновых генов в безвредные организмы, такие как рис [12]. Хотя такие зерновые технически сложны для создания и существует возможность того, что перекрестное опыление с глютен-содержащими зерновыми может привести к реинтродукции иммунотоксических последовательностей, доступность таких зерновых может дать пациентам с глютеновой болезнью более питательную диету.
Полимерные связующие вещества
Ряд полимерных связующих веществ был использован для лечения или профилактики некоторых заболеваний.
Классическим примером полимерного связующего вещества является холестирамин, катионная смола, которая образует комплекс с билиарными кислотами в кишке и, следовательно, снижает уровни холестерина в крови. Недавно севеламергидрохлорид, новое полимерное, не содержащее алюминий и кальций, фосфатное связующее вещество с незначительными побочными действиями было запущено в серийное производство для лечения гиперфосфатаземии у пациентов с диализом. Пожалуй, наиболее интересным открытием в данной области является анионный высокомолекулярный полимер, GT160-246, который, как установлено, нейтрализует активность A токсина Clostridium difficile как in vitro, так и in vivo [13]. Данный эндотоксин является наиболее часто устанавливаемой причиной инфекционной нозокомиальной диареи. GT160-246 обеспечивает перспективный и безопасный неантибактериальный способ лечения и профилактики C. difficile колита у людей.
Предположение, что высокомолекулярные полимеры могут находить потенциальное применение при глютеновой болезни, вытекает из исследования Auricchio et al. [14], показывающего, что маннан (гомополисахарид маннозы) и олигомеры ацетилглюкозамина оказывают защитное действие на пробы слизистой оболочки кишки, взятые у пациентов с активной глютеновой болезнью [14]. Полученные данные указывают на то, что агглютинирующие и токсические пептиды связываются указанными карбогидратами. Secundo et al. (26) исследовали влияние другого полисахарида, декстрина, на вторичную структуру глиадинов и сделали предположение, что декстрин может быть использован для получения нетоксических производных продуктов питания для пациентов, страдающих глютеновой болезнью. Несмотря на приведенные интересные предварительные данные, дальнейшие исследования in vivo для подтверждения полученных результатов не проводились. Основным недостатком природных карбогидратов является способность к расщеплению в условиях in vivo, что может сделать указанные карбогидраты неактивными in situ.
Данное изобретение стремится изыскать решения, удовлетворяющие указанным и другим потребностям.
Данное описание ссылается на ряд документов, содержание которых полностью включено здесь в качестве ссылки.
Сущность изобретения
В частности, согласно аспекту настоящего изобретения разработана фармацевтическая композиция, содержащая полимерное связующее вещество, включающее высокомолекулярный синтетический полимер с основной цепью, образованной негидролизуемыми ковалентными связями, указанный полимер способен к образованию электростатических связей при pH ниже, чем изоэлектрическая точка глютена и пептидов, образующихся при расщеплении глютена, и способен к связыванию с глютеном или пептидами, образующимися при расщеплении глютена, в желудочно-кишечном тракте, и фармацевтически приемлемый носитель.
В особом варианте осуществления фармацевтической композиции полимерное связующее вещество способно к гидрофобным взаимодействиям с глютеном или пептидами, образующимися при расщеплении глютена. В другом специфическом варианте осуществления фармацевтической композиции полимерное связующее вещество способно к образованию водородных связей. В ином специфическом варианте осуществления фармацевтической композиции полимерное связующее вещество способно к специфическому связыванию с глютеном или пептидами, образующимися при расщеплении глютена, в желудочно-кишечном тракте. В еще одном специфическом варианте осуществления фармацевтической композиции полимерное связующее вещество способно к связыванию с глютеном или пептидами, образующимися при расщеплении глютена, в кишечнике. В другом специфическом варианте осуществления фармацевтической композиции полимерное связующее вещество представляет собой сополимер гидроксиэтилметакрилата (HEMA) и гидрата натриевой соли 4-стиролсульфоновой кислоты (SStNa). В еще одном специфическом варианте осуществления фармацевтической композиции полимерное связующее вещество представляет собой полимер гидрата натриевой соли 4-стиролсульфоновой кислоты (SStNa). В другом специфическом варианте осуществления фармацевтической композиции полимерное связующее вещество представляет собой полимер калиевой соли сульфопропилметакрилата (SPMAK).
В другом специфическом варианте осуществления фармацевтической композиции полимерное связующее вещество является линейным. В еще одном специфическом варианте осуществления фармацевтической композиции полимерное связующее вещество является звездообразным. В другом специфическом варианте осуществления фармацевтической композиции полимерное связующее вещество является 3-18-лучевым звездообразным сополимером. В другом специфическом варианте осуществления фармацевтической композиции полимерное связующее вещество является 5-18-лучевым звездообразным сополимером. В еще одном специфическом варианте осуществления фармацевтической композиции полимерное связующее вещество является 5-лучевым звездообразным сополимером. В другом специфическом варианте осуществления фармацевтической композиции полимерное связующее вещество является 8-лучевым звездообразным сополимером. В другом специфическом варианте осуществления фармацевтической композиции полимерное связующее вещество является 18-лучевым звездообразным сополимером. В другом специфическом варианте осуществления фармацевтической композиции полимерное связующее вещество представляет собой сополимер HEMA и SStNa и имеет молярное процентное соотношение HEMA/SStNa приблизительно в пределах от 93,5/6,5 до 1/99. В еще одном специфическом варианте осуществления фармацевтической композиции сополимер является линейным HEMA/SStNa (51,5/48,5 мол.%). В другом специфическом варианте осуществления фармацевтической композиции сополимер является линейным HEMA/SStNa (43/57 мол.%). В другом специфическом варианте осуществления фармацевтической композиции сополимер имеет молярное процентное соотношение HEMA/SPMAK приблизительно в пределах от 93,5/6,5 до 1/99%). В другом специфическом варианте осуществления фармацевтической композиции сополимер имеет молярное процентное соотношение HEMA/SPMAK приблизительно в пределах от 86/14 до 1/99%.
В другом специфическом варианте осуществления фармацевтической композиции сополимер является линейным HEMA/SPMAK (45/55 мол.%).
В другом специфическом варианте осуществления фармацевтическая композиция по настоящему изобретению дополнительно включает антагонист зонулина или HLA-DQ2-ингибитор.
Согласно другому аспекту настоящего изобретения разработан способ применения полимерного связующего вещества по данному изобретению, включающий введение пациенту, страдающему глютеновой болезнью, фармацевтически эффективного количества указанного полимерного связующего вещества.
В специфическом варианте осуществления способ по настоящему изобретению предназначен для связывания глютена или пептида, образующегося при расщеплении глютена, в организме пациента.
В другом специфическом варианте осуществления способ по настоящему изобретению предназначен для снижения расщепления глютена до токсических пептидов в организме пациента.
В еще одном специфическом варианте осуществления способ по настоящему изобретению предназначен для снижения взаимодействия глютена или пептидов, образующихся при расщеплении глютена, со слизистой оболочкой желудочно-кишечного тракта пациента.
В другом специфическом варианте осуществления способа по настоящему изобретению указанное введение осуществляют до или во время приема глютен-содержащей пищи указанным пациентом. В еще одном специфическом варианте осуществления способа по настоящему изобретению указанное введение осуществляют после приема глютенсодержащей пищи указанным пациентом.
Согласно другому аспекту настоящего изобретения предусматривается применение полимерного связующего вещества по настоящему изобретению для изготовления лекарственного средства.
Согласно другому аспекту настоящего изобретения предусматривается применение полимерного связующего вещества по настоящему изобретению для связывания глютена или пептида, образующегося при расщеплении глютена, в желудочно-кишечном тракте нуждающегося в таком лечении пациента.
Согласно другому аспекту настоящего изобретения предусматривается применение полимерного связующего вещества по настоящему изобретению в целях изготовления лекарственного средства, предназначенного для связывания глютена или пептида, образующегося при расщеплении глютена, в желудочно-кишечном тракте нуждающегося в таком лечении пациента.
Согласно другому аспекту настоящего изобретения предусматривается применение полимерного связующего вещества по настоящему изобретению для снижения взаимодействия глютена или пептидов, образующихся при расщеплении глютена, со слизистой оболочкой желудочно-кишечного тракта нуждающегося в таком лечении пациента.
Согласно другому аспекту настоящего изобретения предусматривается применение полимерного связующего вещества по настоящему изобретению в целях изготовления лекарственного средства, предназначенного для снижения взаимодействия глютена или пептидов, образующихся при расщеплении глютена, со слизистой оболочкой желудочно-кишечного тракта нуждающегося в таком лечении пациента.
Согласно другому аспекту настоящего изобретения предусматривается применение полимерного связующего вещества по настоящему изобретению для снижения расщепления глютена на токсические пептиды в желудочно-кишечном тракте нуждающегося в таком лечении пациента.
Согласно другому аспекту настоящего изобретения предусматривается применение полимерного связующего вещества по настоящему изобретению в целях изготовления лекарственного средства, предназначенного для снижения расщепления глютена на токсические пептиды в желудочно-кишечном тракте нуждающегося в таком лечении пациента.
В специфическом варианте применения по настоящему изобретению пациент страдает глютеновой болезнью.
Согласно еще одному аспекту настоящего изобретения предложена пища, включающая полимерное связующее вещество по настоящему изобретению.
В специфическом варианте пищи по настоящему изобретению, указанная пища является глютенсодержащей пищей. В конкретном варианте пищи по настоящему изобретению указанная пища представляет собой хлеб.
Согласно еще одному аспекту настоящего изобретения предложен способ употребления пищи по настоящему изобретению, включающий введение указанной пищи пациенту, страдающему глютеновой болезнью, во время приема пищи пациентом. В специфическом варианте осуществления, способ по настоящему изобретению предназначен для связывания глютена или пептида, образующегося при расщеплении глютена, содержащихся в еде пациента. В другом специфическом варианте осуществления, способ по настоящему изобретению предназначен для снижения расщепления на токсические пептиды глютена, содержащегося в еде пациента. В специфическом варианте осуществления, способ по настоящему изобретению предназначен для снижения взаимодействия глютена или пептидов, образующихся при расщеплении глютена, со слизистой оболочкой желудочно-кишечного тракта пациента.
Согласно еще одному аспекту настоящего изобретения предложен способ приготовления пищи для пациента, страдающего глютеновой болезнью, включающий введение в указанную пищу полимерного связующего вещества по настоящему изобретению. В специфическом варианте осуществления способа по настоящему изобретению, указанная пища является глютенсодержащей пищей.
Настоящее изобретение касается высокомолекулярного инертного и невсасывающегося полимерного связующего вещества, используемого для адсорбции глютена и/или продуктов расщепления глютена. Такая система помогает предупредить или снизить вредные действия глютена на слизистую оболочку желудочно-кишечного тракта. Не в порядке ограничения предполагается, что пептидное связывание с полимером имеет двойной эффект. Во-первых, ферментативное расщепление и генерация токсических фрагментов замедляются в результате адсорбции глютена и/или продуктов расщепления глютена на инертном носителе. Во-вторых, образование комплекса с высокомолекулярным полимером снижает пептидное всасывание и последующую иммунную реакцию. Таким образом, данная система обеспечивает профилактическое вспомогательное средство для пациентов, сталкивающихся с ситуациями, когда нельзя удостовериться в отсутствии глютеновых остатков или когда нельзя достать безглютеновую пищу.
Хотя специфические неусваиваемые синтетические полимеры описаны здесь, изобретение не ограничивается указанными примерами. Как использован здесь, подразумевается, что термин "неусваиваемый", когда применяется для определения полимеров по настоящему изобретению, означает полимер с основной цепью, состоящей из негидролизуемых ковалентных связей. Предполагается, что специалист в данной области может легко установить другие неусваиваемые синтетические полимеры, которые могут быть использованы согласно данному изобретению. Подобным образом полимеры, конкретно описанные здесь, могут быть оптимизированы для обеспечения максимального сродства к глютену и продуктам расщепления глютена и сведения к минимуму связывания с другими белками. Конечно, некоторая доля таких белков/пептидов избежит адсорбции на полимерах по настоящему изобретению, но считается, что суточное потребление глиадина в количестве 4-14 мг не вызывает нарушения слизистой оболочки тонкого кишечника у пациентов с глютеновой болезнью [15]. Такая система ни в коем случае не заменяет безглютеновую диету в качестве основного лечения. Однако указанная система может иногда быть использована как профилактическое вспомогательное средство, когда пациент сталкивается с ситуациями, где нельзя удостовериться в отсутствии глютеновых остатков или когда нельзя достать безглютеновую пищу.
Полимерные связующие вещества по настоящему изобретению могут успешно снижать пероральное всасывание глютена и образующихся из глютена пептидов. Такие полимерные связующие вещества действуют в желудочно-кишечном тракте, без абсорбции в кровяное русло, тем самым сводится к минимуму возможность нежелательного действия, оказываемого самим полимером. При pH ниже изоэлектрической точки глютена и образующихся из глютена пептидов полимерные связующие вещества отрицательно заряжены, тогда как указанные белки и пептиды заряжены положительно, что делает возможным возникновение электростатических взаимодействий. Такие полимерные связующие вещества могут также вступать в гидрофобные взаимодействия с указанными белками и пептидами. В отдельных вариантах осуществления, полимерные связующие вещества по настоящему изобретению могут также быть способны к образованию водородных связей. Хотя последняя характеристика может быть желательной, показано, что данная характеристика является несущественной, поскольку некоторые полимеры по настоящему изобретению, например, гомополимер калиевой соли сульфопропилметакрилата (SPMAK), который не обладает указанной характеристикой, как обнаружено, способны к связыванию глютена. Такие полимерные связующие вещества могут быть синтезированы с помощью мономеров, приведенных ниже в таблице 1, не рассматриваемых как ограничивающие. Специалисты в данной области техники могут выбрать комбинации из одного или более указанных (или других) мономеров для получения полимерных связующих веществ по настоящему изобретению:
Производные стирола:
- Стиролсульфонат.
- Стиролсульфат.
- Стиролсульфанилат.
- Сульфофенилаланин.
- Тирозинсульфат.
- Сульфофенетилакриламид.
- Сульфофенетилметакриламид.
- Винилнафталинсульфонат.
- Винилнафталинсульфат.
- Винилбифенилсульфонат.
- Винилбифенилсульфат.
- Анетолсульфонат.
- Стиролы с краун-эфирными составляющими.
- Стиролы, замещенные N,N-диалкиламидогруппами.
- 4-метоксистирол.
- 4-(2-(N,N-диметиламино)этил)стирол.
- 4-(2-(N,N-диметиламино)метил)стирол.
- 4-(2-(N,N-диэтиламино)этил)стирол.
- 4-бис(N,N-диэтиламино)фосфино-α-метилстирол.
- 4-винилфенол.
- 3-винилкатехол.
- 4-винилацетофенон.
- 4-винилбензойная кислота.
- 3-винилбензойная кислота
- 2-(4-винилфенил)-1,3-диоксолан.
- 2-(4-винилфенил)-1,3-диоксан.
- 4-диметоксиметилстирол-(4-винилбензальдегиддиметилацеталь).
- 2-(2-винилфенил)-1,3-диоксолан.
- 2-(3-винилфенил)-1,3-диоксолан.
- 1-(4-винилфенил)-4-метил-2,6,7-триоксабицикло[2.2.2.]октан.
- 4-(2-гидроксиэтил)стирол.
- 4-(3-гидроксипропил)стирол.
- 4-{[4-(4-винилфенил)бутокси]метил}-1-метил-2,6,7-триоксабицикло[2.2.2.]октан.
- 4-винилтиофенол.
- 4-(2-меркаптоэтил)стирол.
- 2-(4-винилфенил)-2-оксазолин.
- N,N-диэтил-4-винилбензолсульфонамид.
- N-метил-N-[(4-винилфенил)сульфонил]пиперазин.
- 4-аминостирол.
- 3-аминостирол.
- 4-аминометилстирол.
- 3-аминометилстирол.
- 4-(2-аминоэтил)стирол.
Стирол, содержащий гидроксильную группу (гидроксильные группы):
- (п-Винилбензамидо)-β-хитобиоза.
- (п-Винилбензамидо)-β-лактоза.
- N-(п-винилбензил)-L-гулонамид.
- N-(п-винилбензил)-6-D-глюкарамид.
- N-(п-винилбензил)-6-D-глюкарамид-1-ат.
- 4-Акриламидофенил-β-лактозид.
- N-(п-винилбензил)-D-глюкоронамид.
- 4-винилбензил-D-глюко(D-манно)гексит.
- п-[2-[N-(п-винилбензил)карбамоил]этил]фенил-α-D-маннопиранозид.
- п-[2-[N-(п-винилбензил)карбамоил]этил]фенил-β-D-маннопиранозид.
- N-(п-винилбензил)-5-[O-β-D-галактопиранозил-(1→4)]-D-глюконамид.
- α-маннопиранозид.
- β-маннопиранозид.
Акриловые мономеры:
- Глицидилакрилат.
- 2-Гидроксиэтилакрилат.
- 2-Гидроксиэтилметакрилат.
- Гидроксипропилметакрилат.
- 2-(N,N-Диметиламино)этилметакрилат.
- 2-(N,N-Диэтиламино)этилметакрилат.
- 3-Сульфопропилметакрилат.
- Тетрагидропиранилметакрилат.
- Бензилметакрилат.
- 2-глюконамидоэтилметакрилат.
- 2-лактобионамидоэтилметакрилат.
- 2-(2',3',4',6'-тетра-O-ацетил-β-D-глюкопиранозилокси)этилакрилат.
- (4,5-дигидрокси-6-гидроксиметил-3-метилкарбоксамидотетрагидро-2H-2-пиранилокси)этилакрилат.
Сульфатизированные мономеры:
- Винилсульфат.
- Пропенсульфат.
- Бутенсульфат.
- Пентенсульфат.
- Гексенсульфат.
- Гептенсульфат.
- Октенсульфат.
- Ноненсульфат.
- Деценсульфат.
- Ундеценсульфат.
- Додеценсульфат.
Сульфонированные мономеры:
- Винилсульфонат.
- Пропенсульфонат.
- Бутенсульфонат.
- Пентенсульфонат.
- Гексенсульфонат.
- Гептенсульфонат.
- Октенсульфонат.
- Ноненсульфонат.
- Деценсульфонат.
- Ундеценсульфонат.
- Додеценсульфонат.
Фосфатированные мономеры:
- Винилфосфат.
- Пропенфосфат.
- Бутенфосфат.
- Пентенфосфат.
- Гексенфосфат.
- Гептенфосфат.
- Октенфосфат.
- Ноненфосфат.
- Деценфосфат.
- Ундеценфосфат.
- Додеценфосфат.
Другие:
- Малеиновый ангидрид.
- N-акрилoилированный 3'-сульфоЛьюисx-Glc мономер.
- α-сиалозидакриламид.
- N-винилпиридин.
- N-винилпирролидинон.
- Винилимидазол.
- 1,3-Диметил-2-(4-винилфенил)имидазолидин.
- 3-(N-акрилоиламино)пропил-O-(β-D-галактопиранозил)-(1→4)-2-ацетамидо-2-деокси-β-D-глюкопиранозид.
- 6-(N-акрилоиламино)гексил-O-(β-D-галактопиранозил)-(1→4)-2-ацетамидо-2-деокси-β-D-глюкопиранозид.
- 3-(N-акрилоиламино)пропил-2-ацетамидо-2-деокси-β-D-глюкопиранозид.
- 6-(N-акрилоиламино)гексил-2-ацетамидо-2-деокси-β-D-глюкопиранозид.
- н-пентенил-β-D-галактопиранозид.
- н-пентенил-O-(2-ацетамидо-2-деокси-β-D-глюкопиранозил)-(1→4)-2-ацетамидо-2-деокси-β-D-глюкопиранозид.
- н-пентенил-O-(β-D-галактопиранозил)-(1→4)-2-ацетамидо-2-деокси-β-D-глюкопиранозид.
- н-пентенил-O-(β-D-галактопиранозил)-(1→4)-β-D-глюкопиранозид.
- н-пентенил-O-(β-D-галактопиранозил)-(1→4)-[O-(α-L-фукопиранозил)-(1→3)]-2-ацетамидо-2-деокси-β-D-глюкопиранозид.
- н-пентенил-O-(β-D-галактопиранозил)-(1→6)-2-ацетамидо-2-деокси-β-D-глюкопиранозид.
- н-пентенил-O-(β-D-галактопиранозил)-(1→3)-2-ацетамидо-2-деокси-β-D-глюкопиранозид.
- н-Алкенил-2-ацетамидо-2-деокси-α-D-глюкопиранозиды (и сульфатизированные производные);
- 2-N-акрилоиламиноэтоксилированный 4-O-(β-D-галактопиранозил)-β-D-глюкопиранозид (и сульфатизированные производные).
- натриевая соль N-малеиновой амидо-2-деоксиглюкозы.
- натриевая соль N-малеинового амидо-1-деоксилактитола.
- Фукоза-7-оксанорборнен-производное.
- C-Glc-7-оксанорборнен-производное.
- C-Man-7-оксанорборнен-производное.
- Несимметричная глюкоза, включающая 7-оксанорборнен-производное.
- O-Glc-7-оксанорборнен-производное.
- O-Man-7-оксанорборнен-производное.
- Несимметричная манноза, включающая 7-оксанорборнен-производное.
- O-Man-7-оксанорборнен-производное.
- поли(7-оксанорборнен)ы на основе производных сахаров.
- поли(норборнен)ы на основе производных сахаров.
Хотя полимерные связующие вещества по настоящему изобретению содержат основную цепь, образованную негидролизуемыми ковалентными связями, указанные полимерные связующие вещества могут также включать боковые цепи, содержащие гидролизуемые ковалентные связи.
Термин "глютен" означает белковую группу, обнаруженную в различных зерновых. Глютен может быть разделен на фракции этанол-растворимых проламинов и этанол-нерастворимых глютенинов. Спирторастворимые проламины пшеницы, ржи, ячменя и, возможно, овса являются токсическими для организма пациентов с глютеновой болезнью. Общим свойством проламина пшеницы является высокое содержание глутамина (>30%) и пролина (>15%). Проламины пшеницы подразделяются на α/β-, γ- и ω-глиадины, содержащие одинаковые или периодически повторяющиеся глутамин- и пролин-обогащенные пептидные эпитопы, которые, очевидно, ответственны за наблюдаемую токсичность глютена.
Термин "пептид, образующийся при расщеплении глютена" означает любой пептид, образующийся при расщеплении глютена, который требуется связать полимерами по настоящему изобретению после всасывания глютена. Указанный термин включает, но не в порядке ограничения, все пептиды, перечисленные в Ciccocioppo [23].
Термин "высокомолекулярный полимер" означает полимер с молекулярной массой в пределах от 5,000 до 5,000000 г/моль.
Термин "фармацевтически приемлемый носитель" означает раствор, суспензию, эмульсию, таблетку или капсулу, полученные с общеупотребимыми наполнителями, такими как описаны в Modern Pharmaceutics [27].
Термин "фармацевтически эффективное количество" полимера по настоящему изобретению означает количество, являющееся эффективным для снижения взаимодействия глютена или пептидов, образующихся при расщеплении глютена, со слизистой оболочкой желудочно-кишечного тракта после всасывания глютена у нуждающегося в таком лечении пациента. Эффективное количество полимера по настоящему изобретению может составлять приблизительно в пределах от 200 мг до 15 г в день (например, 200 мг; 250 мг; 300 мг; 500 мг; 750 мг; 1 г; 1,5 г; 2 г; 2,5 г; 3 г, 5 г; 7,5 г).
Термин "специфически связывается" в выражении "полимерное связующее вещество, которое специфически связывается с глютеном или пептидами, образующимися при расщеплении глютена", означает способность полимера связываться в желудочно-кишечном тракте с белками или пептидами, образующимися при всасывании пищи, которые являются гидрофобными, такими как глютен и образующиеся из глютена пептиды, в большей степени, чем глютен и указанные пептиды связываются с другими белками пищи, такими как казеин и/или альбумин.
Настоящее изобретение охватывает линейные и звездообразные полимеры. Звездообразные полимеры согласно специфическим вариантам осуществления настоящего изобретения имеют 3-18 лучей.
Термин "нуждающийся в таком лечении пациент" означает человека, страдающего глютеновой болезнью, съедающего или съевшего глютенсодержащую пищу.
Термины "включающий" и "содержащий" означают и употребляются наравне с фразами "включающий, но не ограниченный указанным" и "содержащий, но не ограниченный указанным".
Термин "такой как" означает и является взаимозаменяемым фразе "такой как, но не ограниченный указанным".
Другие объекты, преимущества и отличительные признаки настоящего изобретения станут более очевидными по прочтении следующего неограничительного описания специфических вариантов осуществления, приведенных в качестве примеров, только со ссылкой на сопровождающие чертежи.
Краткое описание чертежей
В приложенных чертежах:
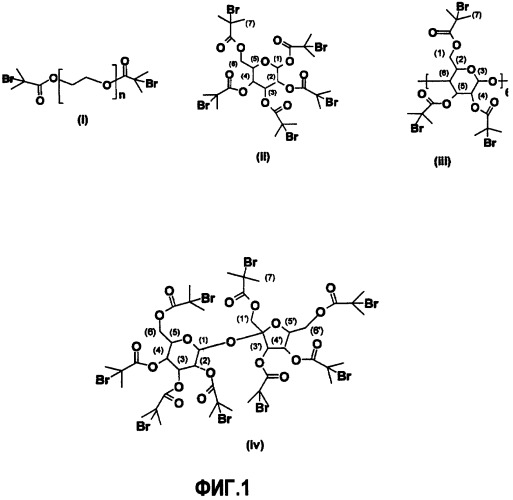
Фиг.1 представляет химические структуры линейных и многофункциональных инициаторов ATRP, используемых для синтеза описанных здесь полимеров, (i) PEG-диброммакроинициатора; (ii) 1,2,3,4,6-пента-O-изобутирилбромид-R-D-глюкозы; (iii) октадека-O-изобутирилбромид-R-циклодекстрина; (iv) окта-O-изобутирилбромидсахарозы;
Фиг.2 представляет SDS-PAGE связывания альбумина и α-глиадина с сополимером (HEMA-SStNa) (пример 10) при pH 6,8, в трипликате: (A) белковые стандарты; (B) смесь альбумина и α-глиадина; (C) смесь альбумина (40 мг/л), α-глиадина (40 мг/л) и сополимера (HEMA-SStNa) (160 мг/л);
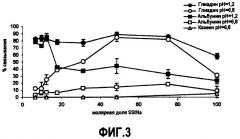
Фиг.3 представляет профиль связывания линейного сополимера (HEMA-SStNa) с глиадином, альбумином и казеином при pH 1,2 и 6,8, где каждая точка соответствует полимеру по каждому из примеров 5-10 и 12-13;
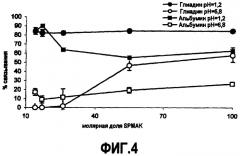
Фиг.4 представляет профиль связывания линейного сополимера (HEMA-SPMAK) с глиадином и альбумином при pH 1,2 и 6,8, где каждая точка соответствует полимеру по каждому из примеров 17-21;
Фиг.5 графически представляет влияние структуры полимера на связывание глиадина при нейтральном pH (SStNa=25-31 мол.%; см. примеры 9, 14, 15 и 16);
Фиг.6 графически представляет влияние структуры полимера на связывание глиадина при нейтральном pH (SPMAK=16-19 мол.%; см. примеры 18, 22, 23 и 24);
Фиг.7 представляет влияние полимера по изобретению на пищеварительное расщепление глиадина в моделируемых интестинальных условиях. Сравнительные ВЭЖХ-профили глиадина, расщепляемого под действием пепсина, трипсина и химотрипсина (PTC) в отсутствие (a) и в присутствии (b) полимера. Хроматограмма (c) соответствует исходному α-глиадину;
Фиг.8 представляет изменение трансэпителиального электрического сопротивления (TEER) Caco-2 монослоя после инкубации с растворами PEG (Mn: 35,000; белые кружки), PVP (Mw: 58,000; черные квадраты), сополимера (HEMA-SStNa) (пример 10; белые треугольники) и полной средой (черные звездочки) в качестве контроля. Клетки поддерживают в DMEM клеточной культуральной среде, пополненной 10% FBS. Концентрация полимера имеет фиксированное значение, равное 1 г/л; и
Фиг.9 представляет профиль связывания двух линейных сополимеров (HEMA-SStNa), содержащих около 50% SStNa и имеющих две различных молекулярных массы (примеры 10 и 11), с глиадином и альбумином при pH 1,2 и 6,8.
Описание иллюстративных вариантов осуществления
Материалы
α-Глиадин любезно предоставлен институтом Institut National de Ia Recherche Agronomique (Nantes, France). α-Глиадин получают из мягкой пшеницы, как описано Popineau et al. (16-21). Вкратце, после экстракции сырого глиадина из глютена (выделенного из муки), подгруппы глиадина разделяют и очищают последовательно ионообменной хроматографией, гель-хроматографией и, наконец, хроматографией гидрофобного взаимодействия.
Альбумин сыворотки теленка закупают у Serological Proteins (Kankakee, IL). α-Казеин (из коровьего молока), SStNa, HEMA, SPMAK, R-D-глюкозу, α-циклодекстрингидрат, сахарозу (98%), поли(этиленгликоль) (PEG) (Mn 2000), 2-бромизобутирилбромид, бромид меди Cu(I)Br и 2,2'-дипиридил, все закупают у Sigma-Aldrich (St Louis, MO) и используют в состоянии поставки. Пробирки Эппендорфа, микродозаторы и 96-луночные планшеты (максимальное извлечение) получены от Axygen Scientific (Union City, CA).
Синтез инициаторов
Инициаторы радикальной полимеризации с переносом атома (ATRP) (фиг.1) получают из PEG, R-D-глюкозы, сахарозы и α-циклодекстрина. Бромидную функционализацию последних трех молекул осуществляют по методике, описанной Stenzel-Rosenbaum'ом и сотрудниками [22].
Настоящее изобретение иллюстрируется более подробно следующими неограничивающими примерами.
ПРИМЕР 1
Синтез PEG-диброммакроинициатора (i)
Раствор HO-PEG-OH (Mn 2000, 10 г, 5 ммоль) и триэтиламина (10 г, 0,1 моль) в 70 мл безводного толуола слегка охлаждают на бане лед-вода. Затем к реакционной смеси медленно добавляют 2-бромизобутирилбромид (4,91 мл, 0,04 моль). Раствор нагревают до комнатной температуры и перемешивают в течение 48 ч. Смесь фильтруют, половину раствора выпаривают и PEG-макроинициатор осаждают в охлажденный диэтиловый эфир (фиг.1 (i)).
Выход: 90%, после осаждения. Белое твердое вещество. 1Н ЯМР (δ, м.д., СDCl3): 3,50 (188H), 1,80 (12H, c).
ПРИМЕР 2
Синтез 1,2,3,4,6-Пента-O-изобутирилбромид-R-D-глюкозы (ii)
2-бромизобутирилбромид (50 г, 0,22 моль) медленно добавляют к раствору R-D-глюкозы (5,0 г, 0,028 моль) в безводной смеси из хлороформа (100 мл) и пиридина (50 мл). Раствор нагревают до температуры кипения с обратным холодильником в течение 3 ч, сохраняя сухую атмосферу, и затем перемешивают при комнатной температуре еще 12 ч. После чего промывают последовательно охлажденной льдом водой, NaOH (0,1 M) и водой, и сушат над безводным MgSO4. Сырой продукт перекристаллизовывают из метанола, получая белые кристаллы (фиг.1 (ii)).
Выход: 70%. 1Н-ЯМР (СDCl3): 1,85-2,04 (м, 30Н, Н-7), 6,42 (д, 1Н, Н-1), 5,25 (дд, 1Н, Н-2), 5,69 (т, 1Н, Н-3), 5,35 (т, 1Н, Н-4), 4,38 (м, 3Н, Н-5/6).
ПРИМЕР 3
Синтез октадека-O-изобутирилбромид-R-циклодекстрина (iii)
Октадека-O-изобутирилбромид-R-циклодекстрин синтезируют путем медленного добавления 2-бромизобутирилбромида (50 г, 0,22 моль) к раствору R-циклодекстрина (5,0 г, 0,005 моль) в безводном пиридине (150 мл). Раствор перемешивают в течение 24 ч в сухой атмосфере при комнатной температуре. Затем промывают охлажденной льдом водой, NaOH (0,1 M) и водой, в указанном порядке, после чего сушат над безводным MgSO4. Сырой продукт перекристаллизовывают из смеси метанол/H2O (3:1, о/о), получая белые кристаллы (фиг.1 (iii)).
Выход: 55%. 1Н-ЯМР (СDCl3): 1,95 (м, 108Н, Н-7), 5,84 (д, 12Н, Н-1), 4,46 (дд, 6Н, Н-2), 5,7 (м, 6Н, Н-3), 5,13/5,38 (т/дд, 6Н, Н-4), 4,78 (дд, 6Н, Н-5), 4,45 (м, 6Н, Н-6).
ПРИМЕР 4
Синтез окта-O-изобутирилбромидсахарозы (iv)
Окта-O-изобутирилбромидсахарозу синтезируют путем медленного добавления 2-бромизобутирилбромида (50 г, 0,22 моль) к раствору сахарозы (5,0 г, 0,014 моль) в безводном пиридине (150 мл). Раствор перемешивают в течение 24 ч в сухой атмосфере при комнатной температуре. Затем промывают охлажденной льдом водой, NaOH (0,1 M) и водой, после чего сушат над безводным MgSO4. Сырой продукт перекристаллизовывают из смеси метанол/H2O (3:1, о/о), получая белые кристаллы (фиг.1 (vi)).
Выход: 50%. 1Н-ЯМР (СDCl3): 1,99 (м, 48Н, Н-7), 4,15 (д, 1Н, Н-5'), 4,46 (м, 5Н, Н-6'/1'/5'), 4,68 (дт, 2Н, Н-6), 4,81 (д, 1Н, Н-3'), 5,13 (дд, 1Н, Н-2), 5,38 (т, 1Н, Н-4'), 5,67 (т, 1Н, Н-4), 5,76 (т, 1Н, Н-3), 5,85 (д, 1Н, Н-1).
ПРИМЕР 5
Синтез линейного сополимера гидроксиэтилметакрилат (HEMA)/гидрат натриевой соли 4-стиролсульфоновой кислоты (SStNA) (93,5/6,5 мол.% после очистки)
Инициатор ATRP i (фиг.1) (50 мг), SStNa (0,375 г) и HEMA (7,12 г) растворяют в 46 мл смеси метанол/вода (1/4) и дегазируют аргоном в течение 15 мин. Затем добавляют при перемешивании и при 20°C Bpy (20,28 мг), Cu(I