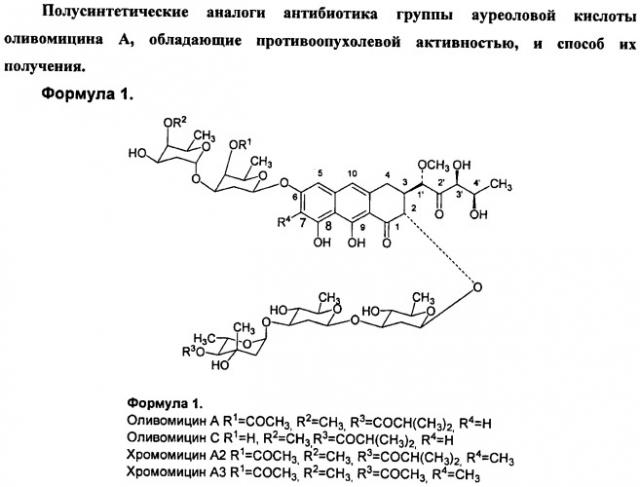
Полусинтетические аналоги антибиотика группы ауреоловой кислоты оливомицина а, обладающие противоопухолевой активностью, и способ их получения
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности и касается новых производных противоопухолевого антибиотика группы ауреоловой кислоты оливомицина А, обладающие противоопухолевой активностью и низкой токсичностью, и способа их получения. Изобретение также включает в себя способ получения производных антибиотика группы ауреоловой кислоты оливомицина А, заключающийся в селективном окислении боковой цепи агликона оливомицина А реакцией с периодатом натрия, с последующим проведением реакции амидирования полученного ключевого интермедиата 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А с соответствующими аминами в присутствии конденсирующего агента. Соединения по настоящему изобретению обладают выраженной противоопухолевой активностью и низкой токсичностью по сравнению с исходным оливомицином А. 2 н.п.ф-лы, 5 табл., 1 ил., 9 пр., 1 схема.
Реферат
Изобретение относится к фармацевтической промышленности и касается новых производных противоопухолевого антибиотика группы ауреоловой кислоты оливомицина А и способа их получения.
Антибиотики группы ауреоловой кислоты являются высокоэффективными природными противоопухолевыми препаратами, некоторые из которых разрешены к применению в качестве антинеопластических агентов для лечения ряда опухолевых заболеваний. Важнейшими представителями этой группы являются: оливомицин А (оливомицин 1) (формула 1, R1=COCH3, R2=CH3, R3=COCH(CH3)2, R4=H), оливомицин С (формула 1, R1=H, R2=CH3, R3=COCH(CH3)2, R4=H), хромомицин А2 (формула 1, R1=COCH3, R2=CH3, R3=COCH(CH3)2, R4=(CH3), хромомицин A3 (формула 1, R1=COCH3, R2=CH3, R3=COCH3, R4=CH3), митрамицин.
Механизм действия антибиотиков группы ауреоловой кислоты основан на взаимодействии их с GC-парами в малой бороздке ДНК и нарушении структуры и функции нуклеиновых кислот, в том числе генной транскрипции [Симонова B.C., Самусенко А.В., Филиппова Н.А., Тевяшова А.Н., Лынив Л.С., Кулик Г.И., Чехун В.Ф., Штиль А.А. «Оливомицин вызывает апоптоз опухолевых клеток и подавляет р53-индуцированную транскрипцию», Бюллетень экспериментальной биологии и медицины, 2005, том 139, №4, стр.451-455]. Антибиотики группы ауреоловой кислоты наряду с ценными свойствами имеют ряд недостатков, основными из которых являются высокая токсичность, мутагенность, канцерогенность, миело- и иммунодепрессивное действие.
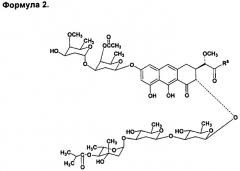
Настоящее изобретение призвано получить полусинтетические аналоги нового типа антибиотика группы ауреоловой кислоты оливомицина А, обладающие высокой противоопухолевой активностью и сниженной токсичностью. Изобретение включает соединения, соответствующие формуле 2:
где R5 представляет собой гидроксил, NH2, 2-амино-2-дезоксигексоза, C3-C10 аминоциклоалкил или C1-C5-аминоалкил с прямой или разветвленной углеводородной цепью, необязательно замещенный одним или несколькими гидроксилами или аминогруппами, бензил, необязательно имеющий заместители в ароматическом кольце.
Хотя химическая модификация природных антибиотиков, в том числе противоопухолевых является важнейшим способом получения новых препаратов, обладающих преимуществами перед исходными антибиотиками, химическая модификация антибиотиков группы ауреоловой кислоты практически не проводилась.
Путь биосинтеза антибиотика оливомицина А штаммом-продуцентом описан в работе [Roush W.R., Hartz R.A., Gustin D.J. «Total synthesis of olivomycin A», Journal of American Chemical Society, 1999, vol. 121, pp.1990-1991]. Описаны подходы к химической модификации оливомицина А по 2'-карбонильной группе и по ароматической части агликона [Kumar V., Remers W.A., "Preparation and antitumor activity of olivomycin A analogues". Journal of Medicinal chemistry, 1980, vol.23, pp.376-379]. Авторы осуществили следующие химическую трансформацию оливомицина А по 2'-карбонильной группе и получили имин, оксимы, гидразон, семикарбазон. Все известные производные оливомицина А по карбонильной группе обладают цитотоксичностью, сравнимой с исходным оливомицином А. Ранее нами был описан способ получения производных антибиотика группы ауреоловой кислоты оливомицина А, заключающийся в селективной модификации 2'-карбонильной группы оливомицина А реакцией с аминооксиуксусной кислотой, с последующим проведением реакции амидирования полученного ключевого интермедиата 2'-(карбоксиметоксим) оливомицина 1 (2'-(карбоксиметоксим)оливомицина А) с соответствующими аминами в присутствии конденсирующего агента [Патент на изобретение №2350621 «Производные антибиотика группы ауреоловой кислоты оливомицина 1, обладающие противоопухолевой активностью, и способ их получения»]. Описанная модификация приводила к снижению цитотоксической активности производных минимум на один порядок по сравнению с исходным оливомицином А. На основании данных по антипролиферативной активности и ингибированию производными оливомицина А работы топоизомеразы I было сделано предположение о том, что удлинение и увеличение объема боковой цепи агликона производных оливомицина А затрудняло образование комплекса антибиотик-ДНК вследствие стерических факторов [Деженкова Л.Г. Диссертация на соискание ученой степени кандидата химических наук, «Связь структура-активность в ряду противоопухолевых антибиотиков, их аналогов и производных - новых ингибиторов топоизмеразы I», Москва, 2008 г.].
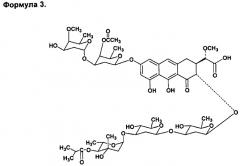
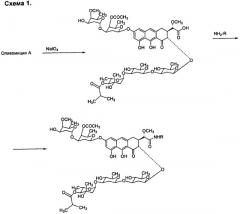
По сравнению с этими производными соединения по настоящему изобретению содержат более короткую боковую цепь, которая, предположительно, не будет препятствовать взаимодействию антибиотика с мишенью. Соединения обладают цитотоксичностью, близкой к таковой для исходного антибиотика. Изобретение также включает в себя способ получения новых полусинтетических аналогов антибиотика группы ауреоловой кислоты оливомицина А (формула 2), заключающийся в селективном окислении боковой цепи агликона оливомицина А в положении 3 реакцией с периодатом натрия (Схема 1), с последующим проведением реакции амидирования полученного ключевого интермедиата 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А (формула 3) с аминами в присутствии конденсирующего агента.
Реакцию амидирования 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А (формула 3) амином с получением соединения формулы 2 проводят в присутствии конденсирующих агентов, известных из уровня техники и применяемых для образования амидной связи, например дифенилфосфорилазида (DPPA) или конденсирующих агентов фосфониевого и урониевого типов, преимущественно фосфониевого типа, преимущественно, бензотриазол-1-ил-окси-триспирролидинофосфоний гексафторфосфата (PyBOP). Реакцию амидирования 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А (формула 3) амином с получением соединения формулы 2 проводят в растворителе, выбираемом из метанола, этанола, N,N-диметилформамида, диметилсульфоксида, толуола, ксилола и хлороформа/дихлорометана или их смеси. Подобранные условия проведения амидирования 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А (формула 3) в присутствии конденсирующего агента позволяют вводить в реакцию первичные амины различного строения, в том числе 2-амино-2-дезоксигексозы, C3-C10 циклоалкиамины, C1-C5-алкиламины с прямой или разветвленной углеводородной цепью, необязательно замещенные одним или несколькими гидроксилами или аминогруппами, бензиламины, необязательно имеющие заместители в ароматическом кольце.
Соединения формулы 2 обладают выраженной противоопухолевой активностью и сниженной токсичностью по сравнению с исходным оливомицином А (см. Примеры 6-9) и могут быть использованы для лечения онкологических заболеваний.
Вспомогательные средства:
Периодат натрия, бензотриазол-1-ил-окси-триспирролидинофосфоний гексафторфосфат (РуВОР), дифенилфосфорилазид (DPPA) были коммерческими продуктами фирмы Acros. Гидрохлорид 2-адамантиламина, метиловый эфир L-аланина, D-галактозамин, 4-фторбензиламин, триэтиламин, были коммерческими продуктами фирмы Aldrich (США).
Тонкослойную хроматографию осуществляли на пластинках с силикагелем G60 (Merck) в смесях растворителей: хлороформ-метанол-уксусная кислота 10:1:0.01 (I), хлороформ-метанол-уксусная кислота 7:1:0.01 (II). Для препаративной очистки использовали колоночную хроматографию на силикагеле Merck G60 с размером частиц 0.040-0.063 µм.
ВЭЖХ проводили на приборе Shimadzu HPLC LC 10 на колонке Kromasil-110A-C18, №2671, 4×250 мм, элюент: 0.01н. H3PO4 (pH 2.6) - MeCN, в градиенте ацетонитрила от 40% до 80% (система А) или 30% до 90% (система Б), скорость потока 1 мл/мин или на колонке Gemini-C-C18, №542, 6×250 мм, элюент: 0.01н. H3PO4 (pH 2.6) - MeCN, в градиенте ацетонитрила от 20% до 80%, скорость потока 1 мл/мин (система В). Регистрация велась на длине волны 270 нм, при температуре 20°С.
1Н ЯМР и 13С ЯМР спектры регистрировали на спектрометрах Varian VXR-400 (США) при частоте 400 МГц.
Масс-спектры при ионизации электрораспылением (ESI) получали на приборе Finnigan MAT 900S (Германия) и на приборе «micrOTOF-Q II» («Bruker Daltonics GmbH», Германия).
Примеры взаимодействия 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А с первичными аминами, принадлежащими к различным классам органических соединений, в присутствии конденсирующего агента с получением производных антибиотика группы ауреоловой кислоты оливомицина А по настоящему изобретению и изучение их противоопухолевой активности:
Пример 1. Получение 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина A (LCTA 1498) (Формула 3)
К раствору оливомицина А (500 мг, 0.418 ммоль) в МеОН (5 мл) добавляли раствор периодата натрия (200 мг, 0.935 ммоль) в H2O (0.5 мл). Реакционную смесь выдерживали при комнатной температуре в течение 24 ч. Реакционную смесь разбавляли этилацетатом (50 мл), промывали водой (3×30 мл), высушивали над Na2SO4 и упаривали. Остаток наносили на колонку с силикагелем, элюировали смесью CHCl3-МеОН-CH3COOH (15:1:0.1). Фракции, содержащие целевое вещество, объединяли, удаляли растворитель на роторном вакуумном испарителе до минимального объема и добавляли гексан. Выпавший осадок отфильтровывали, промывали гексаном, высушивали.
Выход: 410 мг (86%). Rf(I) 0.58, Rt(A) 15.41.
Тпл 170-172°С (с разложением).
13С-ЯМР (DMSO-d6) спектр 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А полностью соответствует 13С-ЯМР спектру исходного оливомицина (DMSO-d6) [отнесение сигналов см. Yoshimura Y., Koenuma M., Matsumoto K., Tori K., Tend Y. "NMR studies of Chromomycins, olivomycins and their derivatives", The Journal of Antibiotics, 1988, vol. XLI, No 1, pp.53-67], за исключением:
- отсутствуют сигналы: 211.81 м.д. (соответствующий 2'-карбонильной группе в оливомицине А);
- в области 65.00-80.00 м.д., соответствующей сигналам групп СНОН, присутствует на два сигнала меньше, чем в исходном антибиотике;
- отсутствует сигнал 19.47 м.д. (соответствующий 5'-CH3-группе);
- появляется сигнал: 173.05 (-СООН).
ESI MS MW вычислено для C55H7O25 1138.48, найдено.: 1137 (М-Н)-1.
Пример 2. Общая методика амидирования 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А.
К раствору 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А (0.131 ммоль) в ДМСО (3 мл) добавляли гидрохлорид амина (0.395 ммоль). Значение pH реакционной смеси доводили до 7.5-8 добавлением триэтиламина. Несколькими порциями добавляли конденсирующий реагент (0.263 ммоль), контролируя pH реакционной смеси добавлением триэтиламина. Реакционную смесь перемешивали в течение 40-60 мин, затем добавляли эфир, смесь трясли с эфиром, удаляя верхний неокрашенный слой. Полученное вязкое масло растворяли в этилацетате. Выпавший белый осадок отфильтровывали, маточный раствор упаривали до небольшого объема, добавляли петролейный эфир. Выпавший осадок отфильтровывали, высушивали. При необходимости дополнительной очистки (чистота по ВЭЖХ <90%) полученный амид растворяли в CHCl3 и наносили на колонку с силикагелем. Вещество элюировали сначала CHCl3, а затем смесью CHCl3-МеОН-CH3COOH (7:1:0.1). Фракции, содержащие целевое вещество, объединяли, удаляли растворитель на роторном вакуумном испарителе до минимального объема и добавляли петролейный эфир. Выпавший осадок отфильтровывали, промывали петролейным эфиром, высушивали.
Чистота полученных соединений изучалась методами ТСХ и ВЭЖХ. Структура полученных соединений была подтверждена данными масс-спектрометрии.
Пример 3. Амидирование 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина A (LCTA 1498) (Формула 3) алкиламином с разветвленной углеводородной цепью, несущей дополнительную третичную аминогруппу, на примере получения N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А (LCTA-1599)
К раствору 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А (150 мг, 0.131 ммоль) в ДМСО (3 мл) добавляли гидрохлорид N,N-диметиламиноэтиламина (49 мг, 0.395 ммоль). Значение pH реакционной смеси доводили до 7.5-8 добавлением триэтиламина. Несколькими порциями добавляли РуВОР (103 мг, 0.263 ммоль), контролируя pH реакционной смеси добавлением триэтиламина. Реакционную смесь перемешивали в течение 40 мин, затем добавляли эфир (20 мл), смесь трясли с эфиром, удаляя верхний неокрашенный слой. Полученное вязкое масло растворяли в этилацетате (20 мл). Выпавший белый осадок отфильтровывали, маточный раствор упаривали до небольшого объема (~1 мл), добавляли петролейный эфир. Выпавший осадок отфильтровывали, высушивали.
Выход: 130 мг (82%). Rf(II) 0.33, Rt(A) 6.21.
Тпл 175-177°C (с разложением).
ESI MS: MW вычислено для C59H88N2O24 1208.57, 1209.58 (M+H)+1.
Пример 4. Амидирование 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина A (LCTA 1498) (Формула 3) бензиламином, имеющим заместитель в ароматическом ядре, на примере получения 4-фторбензиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А (LCTA 1974)
К раствору 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А (10 мг, 0.01 ммоль) в ДМФА (0.5 мл) добавляли гидрохлорид 4-фторбензиламина (8 мг, 0.03 ммоль). Значение pH реакционной смеси доводили до 7.5-8 добавлением триэтиламина (~0.005 мл, 0.03 ммоль). Затем добавили DPPA 0.012 мл (0.06 ммоль). Реакционную смесь перемешивали в течение 2 часов, затем добавляли эфир (2 мл), смесь несколько раз встряхивали с эфиром, удаляя верхний неокрашенный слой. Полученное вязкое масло затвердело при добавлении петролейного эфира. Выпавший осадок отфуговали на центрифуге и высушили.
Выход: 7 мг (70%). Rt (Б) 19.51.
Аналогичным образом были получены в том числе следующие соединения: LCTA 1597 (метиламид 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А), LCTA 1598 (амид 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А), LCTA 1600 (3-гидроксипропиламид 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А), LCTA 1601 (адамантиламид 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А), LCTA 1964 (метиловый эфир L-аланиламид 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А), LCTA 1973 (D-галактозамид 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А, LCTA 1974 (4-фторбензиламид 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А). Данные соединения соответствуют Формуле 2, где значения R5 представлены в таблице 1.
| Таблица 1 | |||||
| Данные ВЭЖХ и масс-спектрометрии | |||||
| Соединение | R5 | Rt (система) | Масс-спектр (ESI MS) | Класс амина, вводимого в реакцию | |
| Вычислено [M] | Найдено [M+Na]+1 | ||||
| LCTA 1498 | ОН | 15.41 (A) | C55H78O25 1138.48 | 1137.49* | - |
| LCTA 1597 | NHCH3 | 16.60 (A) | C56H81NO24 1151.51 | 1174.54 | Алкиламин |
| LCTA1598 | NH2 | 13.94 (A) | C55H79NO24 1137.50 | 1160.34 | NH2 |
| LCTA 1599 | 6.21 (A) | C59H88N2O24 1208.57 | 1231.47 | Замещенный алкиламин с аминогруппой | |
| LCTA1600 | 12.90 (A) | C58H85NO25 1195.54 | 1218.57 | Замещенный алкиламин с гидроксильной группой | |
| LCTA 1601 | 30.11 (Б) | С65H93NO24 1271.61 | 1294.64 | Циклоалкиламин | |
| LCTA 1964 | 19.51 (Б) | C59H85NO26 1223.54 | 1246.55 | Замещенный алкиламин (аминокислота) | |
| LCTA 1973 | 13.27 (Б) | C61H89NO29 1299.55 | 1298.55* | 2-Амино-2-дезоксимоносахарид | |
| LCTA 1974 | 16.38 | C62H84NO24 1245.32 | 1268.53 | Бензиламин с заместителем в ароматическом ядре | |
| *[М-Н]-1 |
Пример 5. Получение L-глутамата N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина A (LCTA-1852)
К раствору N,N-диметиламиноэтиламида 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А (LCTA 1599) (100 мг, 0.083 ммоль) в МеОН (3 мл) добавляли раствор L-глутаминовой кислоты в воде (0.5 мл). Смесь перемешивали в течение 15 минут при комнатной температуре, добавляли ацетон (10 мл), концентрировали в вакууме до небольшого объема (~0.5 мл). Добавляли ацетон (1 мл), этилацетат (1 мл), петролейный эфир (10 мл). Выпавший осадок отфильтровывали, промывали петролейным эфиром, высушивали.
Выход: 100 мг (90%).
Пример 6.
Изучение антипролиферативной активности заявленных новых полусинтетических аналогов оливомицина А проводилось на культуре опухолевых клеток рака толстого кишечника НТС116. Данные об антипролиферативной активности изученных производных оливомицина А представлены в таблице 3
| Таблица 3 | ||
| Антипролиферативная активность оливомицина А и новых полусинтетических аналогов оливомицина А в отношении опухолевых клеток аденомы толстой кишки линии НТС116 и лейкоза человека линии К-562 (МТТ-тест, 72 ч, температура 37°C, приведено среднее значение по результатам двух измерений). | ||
| Соединение | IC50 * (µM) | |
| НСТ-116 | K-562 | |
| Оливомицин А | 0.02 | 0.045 |
| LCTA 1498 | 2 | 2.2 |
| LCTA 1597 | 0.12 | - |
| LCTA 1598 | 0.1 | - |
| LCTA 1599 | 0.02 | 0.045 |
| LCTA 1852 | 0.04 | 0.05 |
| LCTA 1600 | 0.16 | - |
| LCTA 1601 | 0.18 | - |
| LCTA 1964 | 0.02 | 0.055 |
| LCTA 1974 | 0.3 | - |
| IC50 - концентрация соединения, вызывающая гибель 50% клеток |
Пример 7.
Изучение противоопухолевой активности препарата LCTA 1599 при многократном ежедневном введении в сравнении с оливомицином проводили на мышах с лимфомой Р388. Самки мышей B6D2F1, с массой тела от 20 до 25 г, привиты внутрибрюшинно по 106 асцитных опухолевых клеток лимфомы Р388 в день 0. Препараты вводили внутривенно 1 раз в день, ежедневно с 3 по 7 с (Таблица 4).
| Таблица 4 | |||||||
| Сравнение активности оливомицина и ЛХТА-1599 на модели асцитной лимфомы Р388. | |||||||
| № гр. | Оливомицин | ЛХТА 1599 | ΔМТ0→7 | ΔМТ0→11 | СПЖ (ранж) | УПЖ | ЛГ |
| мг/кг/с | мг/кг/с | % | % | с | % | l/n (%) | |
| 1 | интактные | 100±3* | 102±2* | 0/5 (0) | |||
| 2 | - | - | 119±2 | 119±2 | 9,1 (7-12) | 0/15 (0) | |
| 3 | 4 | 85±2* | 71±1* | 12,0 (5-17) | 31 | 13/15 (87) | |
| 4 | 2 | 104±2* | 114±3 | 12,3 (10-14) | 35 | 0/10 (0) | |
| 5 | 1 | 117±3 | 123±2 | 11,3 (8-13) | 24 | 0/10(0) | |
| 6 | 4 | 103±1* | 104±5* | 13,9 (12-18) | 52 | 0/9 (0) | |
| 7 | 2 | 114±2 | 111±3 | 11,7 (10-14) | 28 | 0/10 (0) | |
| 8 | 1 | 122±2 | 122±2 | 10,4 (8-13) | 14 | 0/10(0) | |
| Примечания: интактные - мыши без опухоли и лечения. ΔМТ0→7 и ΔМТ0→11 - изменение массы тела к 7 и 11 с, масса тела в день 0 принята за 100%. СПЖ - средняя продолжительность жизни. УПЖ - увеличение продолжительности жизни. ЛГ - лекарственная гибель. l/n - в числителе число мышей, погибших в результате летальной токсичности препарата, в знаменателе - общее число мышей в группе. * - достоверное отличие от контроля роста опухоли (гр.2). |
Как видно из представленных данных, оливомицин в дозе 4 мг/кг чрезвычайно токсичен (резкое похудание всех мышей, ЛГ=87%). Препарат ЛХТА-1599 в изученных условиях не токсичен и вызывает сильный противоопухолевый эффект в дозе 4 мг/кг. При этом доза может быть увеличена. Продолжительность жизни мышей с лимфомой Р388, которым вводили препарат ЛХТА 1599, была выше по сравнению с контрольной группой (УПЖ до 52%). Введение препарата LCTA 1599 тормозило накопление асцита, что выражалось в высокодостоверном замедлении увеличения массы тела, масса тела у контрольных мышей увеличилась к 7 суткам до 119% за счет накопления асцита.
Пример 8.
Изучение противоопухолевой активности препарата LCTA 1599 при многократном введении (раз в 4 дня) в сравнении с оливомицином проводили на мышах с лимфомой Р388. Самки мышей B6D2F1, с массой тела от 19 до 23 г, привиты внутрибрюшинно по 106 асцитных опухолевых клеток лимфомы Р388 в день 0. Препараты вводили внутривенно 1 раз в день 1, 4, 7, 10 и 13 с. В гр.3 - 3 мыши получили все 5 инъекций, в гр.4 - 1 мышь, в гр.5 - 4 мыши (таблица 5).
| Таблица 5 | ||||||||
| Сравнение активности оливомицина и ЛХТА-1599 на модели асцитной лимфомы Р388. | ||||||||
| № гр | Оливомицин | ЛХТА 1599 | ΔМТ0→7 | ΔМТ0→10 | Дни гибели | СПЖ | УПЖ | ЛГ |
| мг/кг/с | мг/кг/с | % | % | с | % | l/n (%) | ||
| 1 | интактные | 100±2* | 99±2* | Забиты на 17 с | 0/5 (0) | |||
| 2 | - | - | 127±2 | 125±2 | 9, 9, 9, 10, 10, 11, 11, 11, 11, 11 | 10,2 (9-11) | 0/10 (0) | |
| 3 | 4 | 108±3* | 107±2* | 12, 13, 14, 15, 15 | 13,5 (12-15) | 32 | 1/5 (20) | |
| 4 | 2 | 118±2* | 120±2 | 11, 13, 13, 13, 14 | 12,8 (11-14) | 25 | 0/5 (0) | |
| 5 | 4 | 118±1* | 118±2* | 13, 14, 14, | 14,2 (13-16) | 39 | 0/5 (0) | |
| 14,16 | ||||||||
| Примечания: интактные - мыши без опухоли и лечения. ΔМТ0→7, ΔМТ0→10 - изменение массы тела к 7 и 10 суткам, масса тела в день 0 принята за 100%. СПЖ - средняя продолжительность жизни. УПЖ - увеличение продолжительности жизни. ЛГ - лекарственная гибель. l/n - в числителе число мышей, погибших в результате летальной токсичности препарата, в знаменателе - общее число мышей в группе. * - достоверное отличие от контроля роста опухоли (гр.2). |
Изменение режима введения препаратов привело к несколько лучшей переносимости оливомицина. Оливомицин в дозе 4 мг/кг вызвал похудание и гибель после 5-й инъекции только 1-й мыши (ЛГ 20%). Препарат ЛХТА 1599 в изученных условиях не токсичен и вызывает сильный противоопухолевый эффект в дозе 4 мг/кг/с.
Пример 9.
Изучение противоопухолевой активности препарата LCTA 1852 при многократном введении (раз в 4 дня) в сравнении с оливомицином проводили на мышах с меланомой В-16. Самки мышей B6D2F1 привиты подкожно по 106 клеток меланомы В16 в день 0. Препараты введены в дни 1, 4, 7, 10, 13 в/в (пятикратное введение) или в дни 1, 4, 7, 10, 13, 16, 19, 22 в/в (восьмикратное введение). Мыши забиты в день 28 (03.07.09) (таблица 6).
Т.к. активность оливо не зависела от числа введений, выборки объединены.
| Таблица 6 | |||||||||
| Сравнение активности оливомицина и ЛХТА 1852 на модели меланомы В-16 | |||||||||
| № гр. | Препарат | Доза | Параметры при забое (28 с): | ||||||
| МО | ТРО | МП | МС | МТ-МО | РК (%) | ЛГ/n (%) | |||
| мг/кг/с | мг | % | мг | мг | % к д.0 | ||||
| 1 | интактные | - | - | 1178±35 | 77±4uu | 108±1uu | - | 0/10 (0) | |
| 2 | КРО | 0 | 2647±464 | 1193±43 | 243±31 | 93±3 | 5/8 (62,5) | 0/25 (0) | |
| 3 | Оливомицин | 2×5 | 1388±472 | 48 | 1078±44 | 183±27 | 95±4 | 2/8 (25) | 0/8 (0) |
| 4 | Оливомицин | 2×8 | 1465±581 | 45 | 1126±52 | 155±15 | 97±5 | 2/10 (20) | 0/10 (0) |
| 6 | ЛХТА-1852 | 10×5 | 423±172uu | 73 | 1021±25uu | 188±22 | 98±2 | 1/10 (10) | 0/10 (0) |
| 8 | ЛХТА-1852 | 5×8 | 1283±458u | 52 | 1070±36i,u | 203±33 | 95±2 | 3/10 (30) | 0/10 (0) |
| 9 | ЛХТА-1852 | 10×8 | 410±109uu | 85 | 1088±82 | 171±21 | 94±4 | 5/10 (50) | 0/10 (0) |
| Примечания: КРО - контроль роста опухоли. ТРО - торможение роста опухоли. МО, МП, МС, МТ - масса опухоли, печени, селезенки, тела. МТ-МО - масса тела без | |||||||||
| опухоли (масса корпуса). Опухоли развились у всех мышей. РК - раковая кахексия - сильное похудание в терминальной стадии опухолевой болезни. ЛГ - лекарственная гибель, n - число мышей. В группе мышей, не получавших препараты (КРО) к моменту забоя, пало в результате развития опухолевой болезни 4 из 25 мышей. * - в этой группе введение оливомицина привело к сильному похуданию 3 из 5 мышей, u - Р<0,05; uu - Р<0,01 по сравнению с гр.2 КРО. |
Как видно из представленных данных (таблица 6, Фиг.1), для препарата ЛХТА-1852 наблюдаются достоверные отличия от КРО на 19 с (Р=0,02), на 25 с (Р=0,007), на 28 с (Р=0,0015). Для оливомицина достоверные отличия от КРО наблюдаются только на 28 с (Р=0,008). Таким образом, противоопухолевый эффект препарата ЛХТА 1852 достоверно сильнее, чем эффект оливомицина на 21 с (почти достоверно Р=0,055), на 25 с (Р=0,02), на 28 с (Р-0,03).
Таким образом, при введении соединения LCTA 1599 (в дозах 2 и 4 мг/кг) или ЛХТА 1852 (10 мг/кг) при различных режимах введения внутривенно отмечается выраженное противоопухолевое действие этих препаратов и отсутствие токсической гибели мышей на различных моделях опухолей у мышей. Продолжительность жизни леченных мышей превышала таковую у контрольных мышей (УПЖ до 52%). Введение LCTA 1599 тормозило накопление асцита, что выражалось в высокодостоверном замедлении увеличения массы тела. При применении оливомицина А в дозе до 4 мг/кг в сутки внутрибрюшинно наблюдалась токсическая гибель большинства мышей.
Таким образом, предложенный новый способ модификации антибиотика группы ауреоловой кислоты оливомицина А позволяет получать новые производные оливомицина А, обладающие преимуществами перед исходным антибиотиком оливомицином А, а именно высокой противоопухолевой активностью и низкой токсичностью соединений.
1. Производные антибиотика группы ауреоловой кислоты, соответствующие формуле 2, где R5 представляет собой гидроксил, NH2, 2-амино-2-дезоксигексоза, C3-C10аминоциклоалкил или C1-C5-аминоалкил с прямой или разветвленной углеводородной цепью, необязательно замещенный одним или несколькими гидроксилами, или аминогруппами, бензил, необязательно имеющий заместители в ароматическом кольце.
2. Способ получения производных антибиотика группы ауреоловой кислоты оливомицина А по п.1, заключающийся в селективном окислении боковой цепи агликона оливомицина А реакцией с периодатом натрия (Схема 1), с последующим проведением реакции амидирования полученного ключевого интермедиата 1'-дез-(2,3-дигидрокси-н-бутироил)-1'-карбоксиоливомицина А (формула 3) с соответствующими аминами в присутствии конденсирующего агента.