Соединения для ингибирования фермента
Иллюстрации
Показать всеИзобретение относится к соединениям на основе пептидов, включающим в себя трехчленные циклы, содержащие гетероатом, которые эффективно и селективно ингибируют специфические активности N-концевых нуклеофильных (Ntn) гидролаз, связанных с протеасомой. Соединения на основе пептидов содержат эпоксид и функционализированы у N-конца. Соединения на основе пептидов проявляют противовоспалительные свойства и ингибирование пролиферации клеток. Возможно пероральное введение указанных ингибиторов протеасомы на основе пептидов благодаря их биодоступности. 7 н. и 27 з.п. ф-лы, 14 пр.
Реферат
Уровень техники изобретения
Деградация белков у эукариотов преимущественно опосредована метаболическим путем убиквитина, в котором белки, нацеленные на деструкцию, присоединены к 76 аминокислоте полипептида убиквитина. После нацеливания убиквитинированные белки затем служат в качестве субстратов для протеасомы 26S, мультикаталитической протеазы, которая разрывает белки на короткие пептиды благодаря действию ее трех основных протеолитических активностей. В то время как, имея основной функцией участие во внутриклеточном белковом обмене, опосредованная протеасомой деградация также играет ключевую роль во многих процессах, таких как включение главного комплекса тканевой совместимости (МНС) класса I, апоптоз, деление клеток и NF-κB-активация.
Протеасома 20S представляет собой 700 kDa комплекс мультикаталитической протеазы цилиндрической формы, состоящей из 28 субъединиц, организованных в четыре цикла, который играет важную роль в регулировании роста клеток, включении главного комплекса тканевой совместимости класса I, апоптозе, обработке антигенов, активации NF-κB и трансдукции провоспалительных сигналов. В дрожжах и других эукариотах 7 различных α-субъединиц образуют внешние циклы и 7 различных β-субъединиц содержат внутренние циклы. α-Субъединицы служат в качестве связующих точек для регуляторных комплексов 19S (PA700) и 11S (PA28), также как и в качестве физического барьера для внутренней протеолитической камеры, образованной двумя циклами β-субъединиц. Таким образом, in vivo, считают, что протеасома существует как 26S частица («протеасома 26S»). Эксперименты in vivo показали, что ингибирование формы 20S протеасомы может быть легко скоррелировано с ингибированием 26S-протеасомы. Расщепление аминоконцевых пропоследовательностей β-субъединиц во время образования частиц действует на аминоконцевые остатки треонина, которые служат в качестве каталитических нуклеофилов. Таким образом, субъединицы, отвечающие за каталитическую активность в протеасоме, обладают аминоконцевыми нуклеофильными остатками, и указанные субъединицы относятся к группе N-концевых нуклеофильных (Ntn) гидролаз (в которых N-концевой остаток представляет собой, например, Cys, Ser, Thr и другие нуклеофильные члены). Указанная группа включает в себя, например, ацилазу пенициллина G (PGA), ацилазу пенициллина V (PVA), амидотрансферазу (GAT) глутамина (PRPP) и бактериальную гликозиласпарагиназу. В дополнение к повсеместно экспрессированным β-субъединицам, более высокие позвоночные также обладают тремя β-субъединицами, индуцируемыми γ-интерфероном (LMP7, LMP2 и MECL1), которые заменяют их обычные включения, X, Y и Z, соответственно, изменяя таким образом каталитическую активность протеасомы. Путем использования различных пептидных субстратов определены три главных протеолитических активности протеасомы 20S эукариотов: химотрипсин-подобная активность (CT-L), которая расщепляет большие гидрофобные остатки; трипсин-подобная активность (Т-L), которая расщепляет основные остатки; и пептидилглутамильная пептидная гидролизующая активность (PGPH), которая расщепляет кислотные остатки. Протеасоме приписывают также две дополнительные менее характеристичные активности: BrAAP-активность, которая расщепляет аминокислоты с разветвленными цепями; и SNAAP-активность, которая расщепляет малые нейтральные аминокислоты. Главная протеолитическая активность протеасомы, по-видимому, обеспечена различными каталитическими точками, поскольку ингибиторы, точечные мутации в β-субъединицах и обмен β-субъединиц, включающих γ-интерферон, в различной степени изменяет указанные активности.
В последние годы протеасома становится привлекательной целью для терапевтических вмешательств при раковых, иммунных и аутоиммунных заболеваниях, воспалениях, ишемических состояниях, нейродегенеративных расстройствах и других заболеваниях. На сегодняшний день одобренным FDA ингибитором протеасомы является только бортезомиб (VELCADETM), однако в настоящее время клинические испытания проходят несколько других ингибиторов протеасом. Пока все указанные терапевтические ингибиторы протеасомы в настоящее время вводят IV (внутривенно). Клиническое применение ингибиторов протеасом при лечении гематологической злокачественности, такой как миелома и лимфома, частично ограничено необходимостью частого введения IV и может быть улучшено пероральным (РО) введением. Однако вследствие природы пептида указанных молекул системное действие, следующее за РО-введением указанных ингибиторов, ограничено некоторыми факторами, включая желудочный рН, желудочные и кишечные пептидазы, аспираторы, желчевыделение и кишечная и печеночная метаболическая активности.
Способы, использованные для преодоления способности пептидов к ферментативному расщеплению и улучшения абсорбции в кровоток из пищеварительного тракта, включают в себя аналоги, которые имеют структуру, менее подобную пептидам, и которые уменьшены в размере. Такие способы полагают успешными, если аналог пептида достигает удовлетворительного уровня в крови после перорального введения, или, в случае ингибиторов протеасомы, если активность протеасомы в крови удовлетворительно снижается.
Вышеуказанная технология применима для получения аналогов пептид-эпоксикетонов, ингибиторов протеасомы, обеспечивая им при этом оральную биодоступность.
Сущность изобретения
Изобретение относится к классу молекул, известному как α',β'-эпоксиды пептидов и α',β'-азиридины пептидов. Подразумевают, что исходные молекулы эффективно, необратимо и селективно связываются с N-концевыми нуклеофильными (Ntn) гидролазами и могут специфически ингибировать отдельные активности ферментов, обладающих множественной каталитической активностью.
В том случае, если полагают только избавиться от денатурированных и нескладчатых белков, протеасому теперь распознают как составляющий протеолитический механизм, который регулирует уровень различных внутриклеточных белков путем их разложения сигнально-зависимым образом. Однако большой интерес представляют собой идентифицирующие реагенты, которые могут специфически влиять на активность протеасомы и других Ntn-гидролаз и таким образом быть применимыми в качестве проб для изучения роли указанных ферментов в биологических процессах. Здесь описаны, синтезированы и исследованы соединения, которые нацелены на Ntn-гидролазы. Предложены и заявлены пептид-эпоксиды и пептид-азиридины, которые могут эффективно, селективно и необратимо ингибировать отдельные активности протеасомы.
В отличие от некоторых других ингибиторов на основе пептидов описанные здесь пептид-эпоксиды и пептид-азиридины не предполагают значительного ингибирования непротеасомных протеаз, таких как трипсин, химотрипсин, катепсин В, папаин и кальпаин, в концентрации до 50 мкМ. При более высоких концентрациях ингибирование может наблюдаться, но скорее как конкурентный и ненеобратимый процесс, если ингибитор только конкурирует с субстратом. Новые пептид-эпоксиды и пептид-азиридины также предполагают ингибирование активации NF-κВ и стабилизацию уровней р53 в клеточной культуре. Более того, предполагается, что указанные соединения имеют противовоспалительную активность. Таким образом, указанные соединения могут представлять собой уникальные молекулярные зонды, которые универсальны для изучения функции Ntn-фермента в нормальных биологических и патологических процессах.
В одном из аспектов изобретение обеспечивает ингибиторы, состоящие из трехчленного цикла, содержащего гетероатом. Указанные ингибиторы могут ингибировать каталитическую активность ферментов N-концевых нуклеофильных гидролаз (например, протеасомы 20S или протеасомы 26S), если указанный ингибитор присутствует в концентрации ниже примерно 50 мкМ. Относительно протеасомы 20S данные ингибиторы гидролаз ингибируют химотрипсин-подобную активность протеасомы 20S, если ингибитор присутствует в концентрации ниже примерно 5 мкМ, и не ингибирует трипсин-подобную активность или PGPH-активность протеасомы 20S, если присутствует в концентрации ниже примерно 5 мкМ. Ингибитор гидролазы может представлять собой, например, пептидо-α',β'-эпоксикетон или пептидо-α',β'-азиридинкетон, а пептид может быть тетрапептидом. Пептид может включать в себя разветвленные или неразветвленные боковые цепи, такие как водород, С1-6-алкил, С1-6-гидроксиалкил, С1-6-алкоксиалкил, арил, С1-6-аралкил, С1-6-алкиламид, С1-6-алкиламин, С1-6-карбоновую кислоту, С1-6-эфир карбоновой кислоты, С1-6-алкилтиол или простой С1-6-алкилтиоэфир, например изобутил, 1-нафтил, фенилметил и 2-фенилэтил. Αтом α'-углерода α',β'-эпоксикетона или α',β'-азиридинкетона может представлять собой хиральный атом углерода, такой как углерод (R) или β-конфигурации, как определено здесь.
В другом аспекте изобретение предоставляет фармацевтические композиции, включая фармацевтически приемлемый носитель и фармацевтически эффективное количество ингибитора гидролазы, которые ослабляют симптомы нейродегенеративного заболевания (такого как болезнь Альцгеймера), мышечной дистрофии, рака, хронических инфекционных заболеваний, лихорадки, атрофии мышц, денервации, нервных заболеваний, повреждений нервов, голодания и иммунно-зависимых состояний, и прочие.
В другом аспекте изобретение предоставляет соединения и фармацевтические композиции, которые биодоступны перорально.
В другом аспекте изобретение предоставляет противовоспалительные композиции.
В другом аспекте изобретение предоставляет способы, предназначенные для: ингибирования или уменьшения ВИЧ-инфекции у субъекта, воздействия на уровень экспрессии гена вируса у субъекта; изменения ряда антигенных пептидов, продуцированных протеасомой в организме; определения, регулируется ли клеточный, эволюционный или физиологический процесс или продукт в организме протеолитической активностью конкретной Ntn-гидролазой; лечения болезни Альцгеймера у субъекта; уменьшения скорости деградации мышечного белка; уменьшения скорости деградации внутриклеточного белка в клетке; уменьшения скорости деградации белка р53 в клетке; ингибирования роста злокачественных новообразований, родственных р53, у субъекта; ингибирования включения антигена в клетке; подавления иммунной системы субъекта; ингибирования деградации IκB-α в организме; уменьшения содержания NF-κB в клетке, мышце, органе или у субъекта; влияния на циклин-зависимые циклы эукариотических клеток; лечения пролиферативных заболеваний у субъекта; воздействия на протеасом-зависимое регулирование онкопротеинов в клетке; лечения роста злокачественного новообразования у субъекта; лечения у субъекта апоптоза, родственного р53; и скрининга белков, продуцируемых N-концевыми нуклеофильными гидролазами. Каждый из указанных способов предусматривает введение или контактирование эффективного количества композиции, содержащей предложенные ингибиторы гидролазы, субъекту, клетке, ткани, органу или организму.
Другие особенности и преимущества изобретения будут понятны из последующего подробного описания и из формулы изобретения.
Подробное описание изобретения
Изобретение включает в себя соединения, применимые в качестве ингибиторов ферментов. Указанные соединения обычно применимы для ингибирования ферментов, содержащих нуклеофильную группу у N-конца. Например, активности ферментов или субъединиц ферментов, содержащих в боковой цепи N-концевые нуклеофильные аминокислотные группы, такие как (группы) треонина, серина или цистеина, могут быть успешно ингибированы описанными здесь ингибиторами ферментов. Активности ферментов или субъединиц ферментов, содержащих неаминокислотные нуклеофильные группы у N-конца, такие как, например, защитные группы или углеводные группы, также могут быть успешно ингибированы описанными здесь ингибиторами ферментов.
Вне связи с конкретной теорией действия считают, что указанные N-концевые нуклеофилы Ntn образуют аддукты с эпоксидной функциональной группой описанных здесь ингибиторов ферментов. Например, полагают, что в субъединице β5/Pre2 протеасомы 20S N-концевой треонин необратимо образует морфолино- или пиперазино-аддукт в результате взаимодействия с пептид-эпоксидом или пептид-азиридином, таким как описано ниже. Образование такого аддукта представляет собой расщепление с разрывом цикла эпоксида или азиридина.
В вариантах осуществления, включающих указанные группы, связанные с α'-углеродами, стереохимия α'-углерода (углерода, образующего часть эпоксидного или азиридинового цикла) может быть (R) или (S). Изобретение основано отчасти на предложенной здесь структурно-функциональной информации, которая доказывает следующие предпочтительные стереохимические отношения. Отмечено, что предпочтительное соединение может иметь несколько стереоцентров, обозначенных сверху-снизу (или β-α, где β, как использовано здесь, показывает (расположение) над плоскостью (молекулы)), или отношением (R)-(S) (то есть не требуется, чтобы каждый стереоцентр соединения соответствовал предпочтительному состоянию). В некоторых предпочтительных вариантах осуществления стереохимия α'-углерода является (R), то есть атом Х является β, или (расположенным) над плоскостью молекулы.
С точки зрения стереохимии для определения абсолютной стереохимии следуют правилам Кана-Ингольда-Прелога (Cahn-Ingold-Prelog). Указанные правила описаны, например, в Organic Chemistry, Fox and Whitesell; Jones and Bartlett Publishers, Boston, MA (1994); раздел 5-6, стр. 177-178, причем раздел 5-6 приведен в качестве ссылки. Пептиды могут иметь повторяющуюся структуру основной цепи с боковыми цепями, отходящими от звеньев основной цепи. Обычно каждое звено основной цепи содержит связанную с ним боковую цепь, хотя в некоторых случаях боковая цепь представляет собой атом водорода. В других вариантах осуществления не каждое звено основной цепи содержит связанную с ним боковую цепь. Пептиды, применимые в пептид-эпоксидах или пептид-азиридинах, имеют два или более звена основной цепи. В некоторых вариантах осуществления, применимых для ингибирования химотрипсин-подобной (CT-L) активности протеасомы, присутствуют от двух до четырех звеньев основной цепи, а в некоторых предпочтительных вариантах осуществления для ингибирования CT-L присутствуют три звена основной цепи.
Боковые цепи, отходящие от звеньев основной цепи, могут представлять собой боковые цепи природной алифатической или ароматической аминокислоты, такие как водород (глицин), метил (аланин), изопропил (валин), втор-бутил (изолейцин), изобутил (лейцин), фенилметил (фенилаланин), и боковую цепь, составляющую аминокислоту пролин. Боковые цепи также могут представлять собой разветвленные или неразветвленные алифатические или ароматические группы, такие как этил, н-пропил, н-бутил, трет-бутил и арилзамещенные производные, такие как 1-фенилэтил, 2-фенилэтил, (1-нафтил)метил, (2-нафтил)метил, 1-(1-нафтил)этил, 1-(2-нафтил)этил, 2-(1-нафтил)этил, 2-(2-нафтил)этил и подобные соединения. Арильные группы могут быть дополнительно замещены разветвленными или неразветвленными С1-6-алкильными группами или замещенными алкильными группами, ацетилом и подобными или дополнительными арильными группами, или замещенными арильными группами, такими как бензоил и подобные. В качестве заместителей боковой цепи также могут быть использованы гетероарильные и гетероциклильные группы. Гетероарильные группы представляют собой азот-, кислород- и серусодержащие арильные группы, такие как тиенил, бензотиенил, нафтотиенил, тиантренил, фурил, пиранил, изобензофуранил, хроменил, пирролил, имидазолил, пиразолил, пиридил, пиразинил, индолил, пуринил, хинолил и подобные. Гетероциклильные группы представляют собой тетрагидрофуран, пиперидин, пиперазин, пирролидин, морфолин, лактоны, лактамы и подобные.
В некоторых вариантах осуществления в пептид-эпоксиды или пептид-азиридины могут быть введены полярные или заряженные остатки. Например, могут быть введены аминокислоты природного происхождения, такие как гидроксисодержащие (Thr, Tyr, Ser) или серусодержащие (Met, Cys), также как не-незаменимые аминокислоты, например, таурин, карнитин, цитруллин, цистин, орнитин, норлейцин и другие. Неприродные заместители боковой цепи с заряженными или полярными членами могут также представлять собой такие, как, например, С1-6-алкильные цепи или С6-12-арильные группы, с одной или более гидрокси-, короткоцепными алкокси-, сульфидными, тио-, карбоксильными, сложноэфирными, фосфоно-, амидо- или аминогруппами, или указанными заместителями, замещенными одним или более атомами галогена. В некоторых предпочтительных вариантах осуществления в боковой цепи пептидного звена присутствует по меньшей мере одна арильная группа.
В некоторых вариантах осуществления звенья основной цепи представляют собой амидные единицы [-NH-CHR-C(=O)-], в которых R представляет собой боковую цепь. Такая конструкция не исключает аминокислоты природного происхождения, пролина, или другой неприродной циклической аминокислоты, которые могут быть определены специалистами в данной области техники.
В других вариантах осуществления звенья основной цепи представляют собой N-алкилированные амидные единицы (например, N-метилированные и подобные), аналоги олефинов (в которых одна или более амидных связей заменены олефиновыми связями), аналоги тетразола (в которых тетразольный цикл использует цис-конфигурацию основной цепи) или комбинации указанных связей основной цепи. Еще в других вариантах осуществления α-углерод аминокислоты модифицирован α-алкильным заместителем, например аминоизомасляной кислотой. В некоторых дополнительных вариантах осуществления боковые цепи местно модифицированы, например, путем ΔЕ или ΔZ дегидро-модификации, в которой между α- и β-атомами боковой цепи присутствует двойная связь, или, например, путем ΔЕ или ΔZ циклопропильной модификации, в которой между α- и β-атомами боковой цепи присутствует циклопропильная группа. В других дополнительных вариантах осуществления при использовании аминокислотных групп могут быть применены D-аминокислоты. Дополнительные варианты осуществления могут включать в себя циклизацию боковых цепей с основной цепью, образование дисульфидной связи, образование лактама, азосвязь и другие модификации, обсужденные в “Peptides and Mimics, Design of Conformationally constraind” by Hruby and Boteju, в “Molecular Biology and Biotechnology: A Comprehensive Desk Reference” изд. Robert A. Meyers, VCH Publishers (1995), стр. 658-664, приведенных здесь в качестве ссылки.
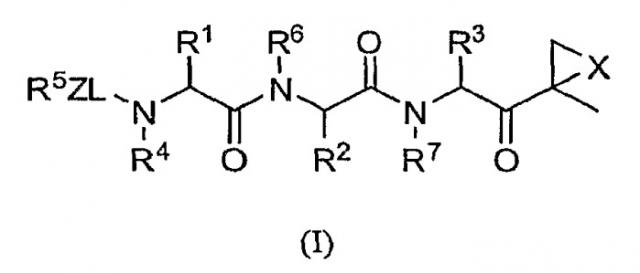
Один из аспектов изобретения относится к соединениям структуры формулы (I) или их фармацевтически приемлемым солям:
в которой
L выбран из С=О, C=S и SO2, предпочтительно С=О;
Х выбран из О, S, NH и N-C1-6-алкила;
Z отсутствует, С1-6-алкил или С1-6-алкоксигруппа предпочтительно отсутствует;
каждый из R1, R2 и R3 независимо друг от друга выбран из водорода, С1-6-алкила, С1-6-алкенила, С1-6-алкинила, С1-6-гидроксиалкила, С1-6-алкоксиалкила, арила, С1-6-аралкила, гетероарила, гетероциклила, С1-6-гетероциклоалкила, С1-6-гетероаралкила, карбоциклила и С1-6-карбоциклоалкила;
R4 выбран из водорода, С1-6-аралкила и С1-6алкила;
R5 представляет собой гетероарил; и
R6 и R7 независимо друг от друга выбраны из водорода, С1-6-алкила и С1-6-аралкила.
В некоторых вариантах осуществления R1, R2 и R3 независимо друг от друга выбраны из водорода, С1-6-алкила, С1-6-гидроксиалкила, С1-6-алкоксиалкила, С1-6-аралкила, С1-6-гетероциклоалкила, С1-6-гетероаралкила и С1-6-карбоциклоалкила. В некоторых вариантах осуществления любой из R1, R2 и R3 независимо друг от друга представляет собой С1-6-алкил, выбранный из метила, этила, пропила, изопропила, бутила, втор-бутила и изобутила. В некоторых вариантах осуществления любой из R1, R2 и R3 независимо друг от друга представляет собой С1-6-гидроксиалкил. В некоторых таких вариантах осуществления любой из R1, R2 и R3 независимо друг от друга выбран из гидроксиметила и гидроксиэтила, предпочтительно гидроксиметил. В некоторых вариантах осуществления любой из R1, R2 и R3 независимо друг от друга представляет собой С1-6-алкоксиалкил. В некоторых таких вариантах осуществления любой из R1, R2 и R3 независимо друг от друга выбран из метоксиметила и метоксиэтила, предпочтительно метоксиметил. В некоторых вариантах осуществления любой из R1, R2 и R3 независимо друг от друга представляют собой С1-6-гетероаралкил. В некоторых таких вариантах осуществления любой из R1, R2 и R3 независимо друг от друга выбран из имидазолилметила, пиразолилметила, тиазолилметила и пиридилметила, предпочтительно имидазол-4-илметила, тиазол-4-илметила, 2-пиридилметила, 3-пиридилметила или 4-пиридилметила. В некоторых вариантах осуществления любой из R1, R2 и R3 независимо друг от друга представляет собой С1-6-аралкил. В некоторых таких вариантах осуществления любой из R1, R2 и R3 независимо друг от друга выбран из фенилметила (бензила) и фенилэтила, предпочтительно фенилметил. В некоторых вариантах осуществления любой из R1, R2 и R3 независимо друг от друга представляет собой С1-6-карбоциклоалкил. В некоторых таких вариантах осуществления любой R1 представляет собой циклогексилметил. В некоторых вариантах осуществления все R1, R2 и R3 различны. В некоторых вариантах осуществления любые два из R1, R2 и R3 одинаковы. В некоторых вариантах осуществления все R1, R2 и R3 одинаковы.
В некоторых вариантах осуществления по меньшей мере один из R1 и R2 выбран из С1-6-гидроксиалкила и С1-6-алкоксиалкила. В некоторых таких вариантах осуществления по меньшей мере один из R1 и R2 представляет собой алкоксиалкил. В некоторых таких вариантах осуществления по меньшей мере один из R1 и R2 выбран из метоксиметила и метоксиэтила.
В некоторых вариантах осуществления R3 выбран из С1-6-алкила и С1-6-аралкила, предпочтительно С1-6-алкила. В некоторых таких вариантах осуществления R3 выбран из метила, этила, изопропила, втор-бутила и изобутила. В некоторых таких вариантах осуществления R3 представляет собой изобутил. В некоторых альтернативных вариантах осуществления R3 выбран из фенилметила и фенилэтила, предпочтительно фенилметил.
В некоторых вариантах осуществления R4, R6 и R7 независимо друг от друга выбраны из водорода и метила и предпочтительно представляют собой водород.
В некоторых вариантах осуществления R5 представляет собой 5- или 6-членный гетероарил. В некоторых таких вариантах осуществления R5 выбран из изоксазола, изотиазола, фурана, тиофена, оксазола, тиазола, пиразола или имидазола, предпочтительно из изоксазола, фурана или тиазола.
В некоторых вариантах осуществления R5 представляет собой бициклический гетероарил. В некоторых таких вариантах осуществления бициклический гетероарил выбран из бензизоксазола, бензоксазола, бензотиазола и бензизотиазола.
В некоторых вариантах осуществления L представляет собой С=О, Z отсутствует и R5 представляет собой изоксазол-3-ил или изоксазол-5-ил. В некоторых предпочтительных вариантах такого осуществления, если изоксазол-3-ил замещен, он замещен по меньшей мере в 5-положении. В некоторых предпочтительных вариантах осуществления, если изоксазол-5-ил замещен, он замещен по меньшей мере в 3-положении.
В некоторых вариантах осуществления L представляет собой С=О, Z отсутствует и R5 представляет собой незамещенный изоксазол-3-ил.
В некоторых вариантах осуществления L представляет собой С=О, Z отсутствует и R5 представляет собой замещенный изоксазол-3-ил. В некоторых таких вариантах осуществления R5 представляет собой изоксазол-3-ил, замещенный заместителем, выбранным из С1-6-алкила, С1-6-алкоксигруппы, С1-6-алкоксиалкила, С1-6-гидроксиалкила, остатка карбоновой кислоты, аминокарбоксилата, С1-6-алкиламинокарбоксилата, (С1-6-алкил)2аминокарбоксилата, С1-6-алкилкарбоксилата, С1-6-гетероаралкила, С1-6-аралкила, С1-6-гетероциклоалкила и С1-6-карбоциклоалкила. В некоторых предпочтительных вариантах такого осуществления R5 представляет собой изоксазол-3-ил, замещенный заместителем, выбранным из метила, этила, изопропила и циклопропилметила.
В некоторых вариантах осуществления L представляет собой С=О, Z отсутствует и R5 представляет собой изоксазол-3-ил, замещенный от 4- до 6-членным азотсодержащим С1-6-гетероциклоалкилом. В некоторых таких вариантах осуществления R5 представляет собой изоксазол-3-ил, замещенный азетидинилметилом, предпочтительно азетидин-1-илметилом. В некоторых альтернативных вариантах такого осуществления L представляет собой С=О, Z отсутствует и R5 представляет собой изоксазол-3-ил, замещенный радикалом , в котором W представляет собой О, NR или СН2 и R представляет собой Н или С1-6-алкил. В некоторых таких вариантах осуществления W представляет собой O.
В некоторых вариантах осуществления L представляет собой С=О, Z отсутствует и R5 представляет собой изоксазол-3-ил, замещенный 5-членным азотсодержащим С1-6-гетероаралкилом, таким как пиразолилметил, имидазолилметил, триазол-5-илметил, предпочтительно 1,2,4-триазол-5-илметил.
В некоторых вариантах осуществления L представляет собой С=О, Z отсутствует и R5 представляет собой изоксазол-3-ил, замещенный С1-6-алкоксигруппой или С1-6алкоксиалкилом, предпочтительно метоксигруппой, этоксигруппой, метоксиметилом или метоксиэтилом.
В некоторых вариантах осуществления L представляет собой С=О, Z отсутствует и R5 представляет собой изоксазол-3-ил, замещенный С1-6-гидроксиалкилом, предпочтительно гидроксиметилом или гидроксиэтилом.
В некоторых вариантах осуществления L представляет собой С=О, Z отсутствует и R5 представляет собой изоксазол-3-ил, замещенный остатком карбоновой кислоты, аминокарбоксилатом, С1-6-алкиламинокарбоксилатом, (С1-6-алкил)2аминокарбоксилатом или С1-6-алкилкарбоксилатом. В некоторых таких вариантах осуществления R5 замещен метилкарбоксилатом или этилкарбоксилатом, предпочтительно метилкарбоксилатом.
В некоторых вариантах осуществления L представляет собой С=О, Z отсутствует и R5 представляет собой незамещенный изоксазол-5-ил.
В некоторых вариантах осуществления L представляет собой С=О, Z отсутствует и R5 представляет собой замещенный изоксазол-5-ил. В некоторых таких вариантах осуществления R5 представляет собой изоксазол-5-ил, замещенный заместителем, выбранным из С1-6-алкила, С1-6-алкоксигруппы, С1-6-алкоксиалкила, С1-6-гидроксиалкила, остатка карбоновой кислоты, аминокарбоксилата, С1-6-алкиламинокарбоксидала, (С1-6-алкил)2аминокарбоксилата, С1-6-алкилкарбоксилата, С1-6-гетероаралкила, С1-6-аралкила, С1-6-гетероциклоалкила и С1-6-карбоциклоалкила. В некоторых предпочтительных вариантах такого осуществления R5 представляет собой изоксазол-3-ил, замещенный заместителем, выбранным из метила, этила, изопропила и циклопропилметила.
В некоторых вариантах осуществления L представляет собой С=О, Z отсутствует и R5 представляет собой изоксазол-3-ил, замещенный от 4- до 6-членным азотсодержащим С1-6-гетероциклоалкилом. В некоторых таких вариантах осуществления R5 представляет собой изоксазол-5-ил, замещенный азетидинилметилом, предпочтительно азетидин-1-илметилом. В некоторых альтернативных вариантах такого осуществления L представляет собой С=О, Z отсутствует и R5 представляет собой изоксазол-3-ил, замещенный радикалом формулы , в которой W представляет собой О, NR или СН2 и R представляет собой Н или С1-6-алкил. В некоторых таких вариантах осуществления W представляет собой O.
В некоторых вариантах осуществления L представляет собой С=О, Z отсутствует и R5 представляет собой изоксазол-5-ил, замещенный 5-членным азотсодержащим С1-6-гетероаралкилом, таким как пиразолилметил, имидазолилметил, триазол-5-илметил, предпочтительно 1,2,4-триазол-5-илметил.
В некоторых вариантах осуществления L представляет собой С=О, Z отсутствует и R5 представляет собой изоксазол-5-ил, замещенный С1-6-алкоксигруппой или С1-6-алкоксиалкилом, предпочтительно метоксигруппой, этоксигруппой, метоксиметилом или метоксиэтилом.
В некоторых вариантах осуществления L представляет собой С=О, Z отсутствует и R5 представляет собой изоксазол-5-ил, замещенный С1-6-гидроксиалкилом, предпочтительно гидроксиметилом или гидроксиэтилом.
В некоторых вариантах осуществления L представляет собой С=О, Z отсутствует и R5 представляет собой изоксазол-3-ил, замещенный остатком карбоновой кислоты, аминокарбоксилатом, С1-6-алкиламинокарбоксилатом, (С1-6-алкил)2аминокарбоксилатом или С1-6-алкилкарбоксилатом. В некоторых таких вариантах осуществления R5 замещен метилкарбоксилатом или этилкарбоксилатом, предпочтительно метилкарбоксилатом.
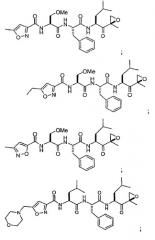
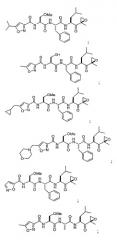
В некоторых вариантах осуществления соединение формулы I выбрано из
Один из аспектов изобретения относится к медицинскому устройству, включающему описанную здесь композицию, которая содержит ингибитор, имеющий структуру формулы I. В одном из вариантов осуществления композиции вводят в медицинское устройство. В некоторых вариантах осуществления медицинское устройство представляет собой полимерную матрицу, содержащую гель, или керамическую матрицу и ингибитор. Указанный полимер может быть природного происхождения или синтетическим. В некоторых вариантах осуществления указанный гель служит в качестве депо лекарства, адгезива, шва, барьера или пломбы.
Другой аспект изобретения относится к медицинскому устройству, содержащему субстрат, имеющий поверхность, на которой расположен ингибитор, имеющий структуру формулы I. В одном из вариантов осуществления ингибитор размещен непосредственно на медицинском устройстве. В другом варианте осуществления покрытие расположено таким образом, чтобы покрытие, состоящее из полимерной матрицы или керамической матрицы с ингибитором, имеющим структуру формулы I, было диспергировано или растворено.
В одном из вариантов осуществления медицинское устройство представляет собой коронарный, сосудистый, периферический или билиарный стент. Более конкретно, стент данного изобретения представляет собой расширяющийся стент. В случае покрытия матрицей, содержащей ингибитор, имеющий структуру формулы I, матрица эластична для приспособления к сжатому или расширенному состоянию указанного расширяющегося стента. В другом варианте осуществления данного изобретения стент имеет по меньшей мере участок, который может вставляться или имплантироваться в тело пациента, причем участок имеет поверхность, которая адаптирована для воздействия на тело пациента и в котором по меньшей мере часть поверхности покрыта ингибитором, имеющим структуру формулы I, или покрытие состоит из матрицы, содержащей диспергированный или растворенный в ней ингибитор, имеющий структуру формулы I. Пример подходящего стента предложен в патенте США № 4733665, который приведен здесь в качестве ссылки.
В другом варианте осуществления медицинское устройство данного изобретения представляет собой хирургический инструмент, такой как сосудистый имплантат, внутрипросветное устройство, хирургический уплотнитель или сосудистая подложка. Более конкретно, медицинское устройство данного изобретения представляет собой катетер, порт доступа имплантируемого сосуда, центральный венозный катетер, артериальный катетер, сосудистый имплантат, внутриаортный баллонный насос, шов, вентрикулярный вспомогательный насос, элюирующий лекарство барьер, адгезив, сосудистую накидку, экстра/перисосудистую подложку, фильтр крови или фильтр, адаптированный для размещения в кровеносном сосуде, покрытом ингибитором, имеющим структуру формулы I, либо непосредственно, либо матрицей, содержащей ингибитор, имеющий структуру формулы I.
В некоторых вариантах осуществления внутрипросветное медицинское устройство покрыто ингибитором, имеющим структуру формулы I, или покрытием, состоящим из биологически толерантной матрицы и ингибитора, имеющего структуру формулы I, диспергированного в полимере, указанное устройство, имеющее внутреннюю поверхность и внешнюю поверхность, имеет покрытие, нанесенное на по меньшей мере часть внутренней поверхности, внешней поверхности или обеих.
В некоторых вариантах осуществления медицинское устройство может быть применимым для предупреждения рестеноза после ангиопластики. Медицинское устройство может также быть применимо для лечения различных заболеваний и состояний осуществлением локализованного введения ингибитора, имеющего структуру формулы I. Указанные заболевания и состояния включают в себя рестеноз, воспаление, ревматоидный артрит, повреждения тканей, вызванные воспалением, гиперпролиферативные заболевания, тяжелый или артритный псориаз, мышечная дистрофия, хронические инфекционные заболевания, аномальная иммунная реакция, состояния, поражающие чувствительные кровяные тельца, повреждения, родственные ишемическим состояниям, и вирусные инфекции и пролиферация. Примерами заболеваний и состояний, которые лечат с применением медицинских устройств данного изобретения, покрытых лекарственным средством, являются атеросклероз, острый коронарный синдром, болезнь Альцгеймера, рак, лихорадка, мышечная слабость (атрофия), денервация, закупорка сосуда, внезапный приступ, ВИЧ-инфекция, повреждения нервов, почечная недостаточность, связанная с ацидозом, и печеночная недостаточность. Смотри, например, Goldberg, патент США № 5340736.
Термин «Сx-y-алкил» относится к замещенным или незамещенным углеводородным группам, включая алкильные группы с нормальной цепью и алкильные группы с разветвленной цепью, которые содержат от х до y атомов углерода в цепи, включая галогеноалкильные группы, такие как трифторметил и 2,2,2-трифторэтил и т.д. С0-алкил означает водород, где группа находится в концевом положении, если связь внутренняя. Термины «С2-y-алкенил» и «С2-y-алкинил» относятся к замещенным или незамещенным ненасыщенным алифатическим группам, аналогичным по длине, и возможному замещению вышеописанным алкилам, но содержащим по меньшей мере одну двойную или тройную связь, соответственно.
Термин «алкоксигруппа» относится к алкильной группе, содержащей присоединенный к ней атом кислорода. Представительные алкоксигруппы включают в себя метоксигруппу, этоксигруппу, пропоксигруппу, трет-бутоксигруппу и подобные. «Простой эфир» представляет собой два углеводорода, ковалентно связанные атомом кислорода. Соответственно, заместитель алкила, который представляет собой простой алкиловый эфир, является ил