Окисляемые виды соединений в качестве внутреннего стандарта в контрольных растворах для биосенсоров
Иллюстрации
Показать всеИзобретение касается способа различения контрольного раствора от биологического образца при работе электрохимического сенсора, где анализируемым веществом является глюкоза, а биологическим образцом - цельная кровь. Способ включает введение контрольного раствора, содержащего заданное количество анализируемого вещества, и заданное количество соединения внутреннего стандарта. Далее, к электрохимическому сенсору прикладывают первый низкий потенциал, достаточный для окисления указанного анализируемого вещества и не достаточный для окисления указанного соединения внутреннего стандарта (iнизкого напряжения), и второй высокий потенциал, достаточный для окисления указанного соединения внутреннего стандарта и указанного анализируемого вещества (iвысокого напряжения) с дальнейшим расчетом дифференциального индекса (ДИ) по формуле: ДИ=iвысокого напряжения/iнизкого напряжения. Если ДИ является значительно большим чем 1, определяют, что присутствует контрольный раствор; если ДИ является примерно равным 1, определяют, что присутствует образец. 2 н. и 16 з.п. ф-лы, 3 табл., 8 пр., 12 ил.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области медицинских приборов. Более конкретно, изобретение относится к биосенсорам, которые применяются для измерения количества анализируемых веществ в телесных жидкостях.
Уровень техники
Для проведения таких измерений часто применяют оптические способы, но настоящее изобретение относится к усовершенствованию электрохимических биосенсоров. Хотя способ, описываемый здесь, можно применять для измерения других анализируемых веществ, включая холестерин, мочевину, креатинин и креатин, измерение глюкозы в цельной крови представляет особый интерес. Хотя данное описание выделяет приложение изобретения для измерения глюкозы, следует понимать, что у изобретения более широкие приложения.
Изобретение относится к электрохимическому прибору, в котором потенциал приложен к электродам, находящимся в контакте с биологическим образцом и реагентами. Ток, возникающий при реакции анализируемого вещества с реагентами, измеряют и затем устанавливают соотношение его величины с количеством анализируемого вещества в образце. Такие приборы называется амперометрическими в противоположность кулонометрическим приборам, которые измеряют общий заряд в кулонах, продуцируемый за счет реакции с образцом, посредством интегрирования тока за все время измерения. Амперометрические приборы имеют то преимущество, что они в меньшей степени зависят от объема и времени. Они не требуют дожидаться, чтобы прореагировал весь объем анализируемого вещества, а делают замеры анализируемого вещества посредством измерения скорости реакции в заданное время.
В данной области техники описано много конструкций таких биосенсоров, например, опубликованные в патентной заявке US 2001/0042683. Электроды, обычно, описывают как рабочий электрод и вспомогательный электрод. Электроды находятся в контакте с твердым слоем, содержащим реагенты, которые окисляют анализируемое вещество в образце, например глюкозооксидазу, и медиаторы, которые реокисляют восстановленный фермент. Восстановленный медиатор сам окисляется на рабочем электроде, что дает измеряемый ток. Величину этого тока применяют для расчета количества глюкозы в исследуемом образце, поскольку он является непрямой мерой окисления глюкозы в образце. Реакции можно описать с помощью следующих этапов:
Глюкоза+Фокисл→Фвосст+Продукт (глюконовая кислота, глюконолактон)
Фвосст+Медокисл→Медвосст+Фокисл
Медвосст→Медокисл+nе-
Где Фокисл и Фвосст являются окисленной и восстановленной формами окислительно-восстановительных центров фермента и Медокисл и Медвосст являются окисленной и восстановленной формами медиатора.
Для измерения глюкозы фермент может быть глюкозооксидазой и медиатор феррицианидом. Измерение других анализируемых веществ задействует подходящие ферменты и медиаторы. Типичные сочетания фермента, медиатора и анализируемого вещества приведены в Таблице 1.
| Таблица 1 | ||
| Избранные субстраты и системы ферментов и медиаторов | ||
| анализируемое вещество | фермент | медиатор |
| Глюкоза | глюкозооксидаза | феррицианид |
| Глюкоза | глюкозо-дегидрогеназа | феррицианид |
| холестерин | холестерин-оксидаза | феррицианид |
| Лактат | лактат-оксидаза | феррицианид |
| мочевая кислота | уриказа | феррицианид |
| Спирт | алкоголь-оксидаза | фенилендиамин |
Чтобы обеспечить точные измерения, применяют контрольные растворы, содержащие известные количества глюкозы, для проверки того, правильно ли работает прибор. Состав контрольных растворов был субъектом большого числа патентов и публикаций. Представительными являются US патенты №№3920580; 4572899; 4729959; 5028542 и 5605837; WO 93/21928; WO 95/13535 и WO 95/13536. Хотя в них применялись контрольные растворы, содержащие сыворотку крови, более свежие патенты касаются замещения основанных на сыворотке контрольных растворов свободными от сыворотки растворами, поскольку свободные от сыворотки растворы являются более надежными и устойчивыми по сравнению с растворами, содержащими сыворотку. Контрольный раствор должен содержать известную концентрацию глюкозы в похожем на сыворотку матриксе для определения точности работы как ферментативного биосенсора, так и измерителя потенциостата. Очевидно, что композиция может быть устойчивой в течение продолжительных периодов хранения перед употреблением.
Контрольные растворы должны служить цели проверки работы/действия системы мониторинга глюкозы, но в то же время их следует идентифицировать и отличать от показаний действительных образцов крови. Такая необходимость обусловлена тем, что контрольные растворы содержат известные количества глюкозы и предоставляют показания, не имеющие терапевтического значения. Если контрольные растворы нельзя идентифицировать и нельзя отличать их ответы от ответов образцов крови с помощью измерителя образцов, то показания содержания глюкозы в контрольных растворах будут включены в историю измерений содержания глюкозы, что приведет к неправильной интерпретации диабетического состояния больного. Или, если контрольный раствор замещает образец крови, это может быть ошибочно принято врачом за указание на необходимость изменения лечения. Далее, поскольку температурный ответ контрольных растворов отличается от такового образцов крови, температурная компенсация для измерений, сделанных при температурах, отличных от 25°С, будет менее точной, если измеритель образцов не сможет различать между образцами крови и контрольными растворами. Поэтому очень желательно, чтобы система мониторинга глюкозы автоматически детектировала и идентифицировала контрольные растворы, чтобы отличать измерения глюкозы в контрольных растворах от таковых в образцах крови, и предоставлять отдельные температурные компенсации как для образцов крови, так и для контрольных растворов.
Есть несколько патентов, описывающих способы идентификации контрольных растворов посредством разных механизмов. В патенте US №5723284 обсуждается электрохимическое измерение глюкозы в крови. Этот патент предлагает модифицировать контрольные растворы, изменяя соотношение показаний тока, взятых за два периода окисления, разделенные периодом покоя. Измеритель распознает, что измеряется контрольный раствор, и предпринимает нужное действие для того, чтобы предотвратить включение этих результатов в результаты для образца крови. Этот патент также поясняет, что контрольный раствор должен содержать буфер с рН в интервале от 4,8 до 7,5, чтобы быть эффективным.
Другой способ определения того, измеряется ли содержание глюкозы в контрольном растворе или образце крови, раскрыт в заявке US 2002/0139692 A1. Здесь определяют индекс, который связывает падение электрического тока с природой тестируемого образца. Патенты US 5620579 и 5653863 предлагают начать проверку образца, предоставляя исходный пульс положительного потенциала на короткое время для окисления всякого преждевременно восстановленного медиатора. Такой исходный пульс называют «периодом выгорания».
Когда прилагают потенциал к рабочему электроду и вспомогательному электроду и помещают жидкий образец в сенсор, сухие реагенты увлажняются жидким образцом и начинает протекать ток, обычно возрастающий до пика и затем падающий за «период выгорания», обычно, протяженностью около 10 с. В течение этого периода предварительно восстановленный медиатор окисляется для уменьшения погрешности измерения в сторону неверных завышенных результатов. Если количество образца недостаточно, то можно внести дополнительную ошибку, поскольку не все реагенты могут вступить в реакцию или контакт рабочего и вспомогательного электродов с образцом может быть недостаточным, таким образом уменьшая ток в течение «периода выгорания».
После завершения периода выгорания предоставляют период покоя при более низком потенциале или в отсутствие потенциала (открытый контур). Во время этого периода покоя глюкозооксидазная реакция продолжает протекать и медиатор восстанавливается. Затем опять прилагают постоянный потенциал между рабочим и вспомогательным электродами и измеряют ток в течение короткого периода, обычно, приблизительно, от двух до десяти секунд. Ток вначале высокий, но он быстро понижается, поскольку начинает контролироваться диффузией медиатора. В заданное время измеряемый ток применяют для определения содержания глюкозы в образце.
Добавление соединения внутреннего стандарта является общепринятой практикой в аналитической химии для предоставления количественного стандартного сигнала. Этот рабочий принцип применен в недавно опубликованной патентной заявке №WO 2005/078118, где внутренний стандарт добавляют в систему реагентов для получения формуляции.
В WO 2004/040286 A1 предлагается, чтобы контрольный раствор включал восстанавливающее вещество, выбранное из мочевой кислоты, билирубина, аскорбиновой кислоты, метиленового синего, бис(2-гидроксиэтил)иминотрис(гидроксиметил)метана, N,N-бис-(2-гидроксиэтил)-2-аминоэтан-сульфоновой кислоты и ацетаминофена, таким образом, изменяя соотношение показаний тока, полученных за два периода окисления, разделенных периодом покоя, и позволяя идентифицировать контрольный раствор.
Данные изобретатели искали улучшенный способ различения контрольных растворов и биологических образцов. Эти способы детально описаны ниже.
Раскрытие изобретения
Данное изобретение предоставляет способ различения контрольного раствора и биологического образца при работе электрохимического измерителя с помощью количественного индекса. В одном осуществлении изобретение является контрольным раствором, который включает известные количества глюкозы, буферную систему с подходящим значением рН и соединение внутреннего стандарта. Соединение внутреннего стандарта добавляют к контрольному раствору для идентификации контрольного раствора с помощью системы мониторинга глюкозы. Изобретение предоставляет способ детектирования присутствия соединения внутреннего стандарта, вычисления количественного индекса и идентификации того, что анализируется контрольный раствор.
В одном осуществлении анализируемое вещество в биологическом образце является глюкозой в цельной крови, и медиатор является феррицианидом калия. Соединение внутреннего стандарта окисляется при потенциале более высоком, чем необходимый для окисления медиатора, который применяют для измерения окисления анализируемого вещества. Внутренний стандарт имеет заданную концентрацию в контрольном растворе вместе с заданной концентрацией глюкозы. Связанный с глюкозой медиатор и внутренний стандарт избирательно окисляются на электроде при различных потенциалах (низком и высоком). Когда глюкоза является анализируемым веществом, внутренний стандарт должен окисляться при потенциале по меньшей мере на 100 мВ выше, чем потенциал, применяемый для окисления восстановленного медиатора.
Соединения внутреннего стандарта, применимые для измерения глюкозы в контрольных растворах, включают любые виды соединений, окисляемых на электроде при подходящем потенциале, например металлоорганические соединения, координационные соединения и соединения органических аминов. Количество применяемого соединения внутреннего стандарта связано с количеством глюкозы в контрольном растворе. Предпочтительно, количество соединения внутреннего стандарта выбирают так, чтобы контрольный раствор можно было распознать, когда содержание глюкозы в контрольном растворе является максимальным необходимым для проверки электрохимического измерителя глюкозы. Альтернативно, количество соединения внутреннего стандарта может варьировать пропорционально количеству глюкозы.
Сравнение измерений, сделанных при низком и высоком потенциале, предоставляет способ детектирования соединения внутреннего стандарта и таким образом контрольного раствора. Когда протокол измерения включает два периода, разделенные периодом покоя, можно прикладывать высокое и низкое напряжения в течение любого из периодов или обоих. Потенциал прилагают к сенсору, который получает контрольный раствор. Ток, возникающий при потенциале, достаточном для окисления соединения внутреннего стандарта, сравнивают с током, возникающим при потенциале, достаточном для окисления только анализируемого вещества (например, глюкозы), но не соединения внутреннего стандарта. Соотношение между двумя измеренными токами, названное дифференциальным индексом (ДИ), предоставляет средство для различения контрольного раствора от жидкого образца, лишенного соединения внутреннего стандарта.
ДИ=Iвысокого напряжения/Iнизкого напряжения
Где Iвысокого напряжения и Iнизкого напряжения являются величинами токами, измеряемыми при высоком и низком напряжении.
При более высоком напряжении окисляются как соединение внутреннего стандарта, так и восстановленный медиатор, в то время как при более низком напряжении окисляется только медиатор.
Значение ДИ около единицы указывает на то, что образец лишен соединения внутреннего стандарта и может считаться биологическим образцом, тогда как значение ДИ значительно выше единицы, предпочтительно, по меньшей мере 1,5 указывает на то, что образец является контрольным раствором.
В другом осуществлении изобретение предоставляет соединение внутреннего стандарта, пригодное для индикации присутствия контрольного раствора, применяемого для проверки точности системы электрохимического биосенсора/потенциостата. Когда анализируемым веществом является глюкоза в цельной крови, соединением внутреннего стандарта может быть окисляемое металлоорганическое соединение, координационное соединение или органический амин.
Одним результатом настоящего изобретения является улучшение воспроизводимости измеряемого тока и точности получившегося анализа. Если высокий и низкий потенциалы приложены во время одного и того же периода окисления, например периода выгорания и периода снятия показаний, применяемых при окислении глюкозы, становится менее вероятным, что внешние факторы, например движение образца или температура окружающей среды, окажут влияние на дифференциальный индекс. Множественные повторы показаний тока при высоком и/или низком напряжениях могут улучшить точность результатов. Также, когда определяют присутствие контрольного раствора, можно применять алгоритм температурной коррекции/поправки, применимый для контрольного раствора. С помощью применения различных температурных алгоритмов для контрольного раствора и биологического образца (например, цельной крови), можно улучшить клинические результаты и достигнуть более жесткого интервала величин.
Краткое описание фигур
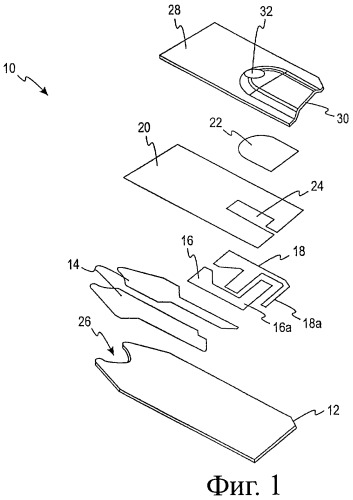
Фигура 1 представляет изображение биосенсора в разобранном виде согласно одному осуществлению.
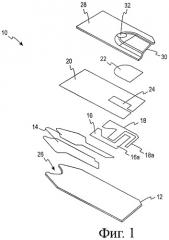
Фигура 2 представляет изображение биосенсора в собранном виде по фигуре 1.
Фигура 3 представляет график зависимости потенциала от времени в течение периода выгорания.
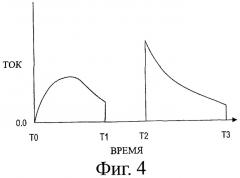
Фигура 4 представляет график зависимости тока от времени для потенциала, приложенного, как на фигуре 3.
Фигура 5 представляет циклическую вольтамперограмму, описанную в примере 1.
Фигура 6 представляет циклическую вольтамперограмму, описанную в примере 2.
Фигура 7 представляет циклическую вольтамперограмму, описанную в примере 3.
Фигура 8 представляет циклическую вольтамперограмму, описанную в примере 4.
Фигура 9А-Д иллюстрирует последовательность потенциалов, описанную в примере 5.
Фигура 10А-Б представляет циклические вольтамперограммы, описанные в примере 6.
Фигура 11 представляет график зависимости тока от времени, полученный по примеру 7.
Фигура 12 представляет график зависимости тока от времени, полученный по примеру 8.
Осуществление изобретения
Описание предпочтительных осуществлений
Далее будет описано изобретение в приложении к измерению содержания глюкозы в цельной крови, способ промышленной важности. Однако способ по изобретению имеет другие приложения, где другие анализируемые вещества, например холестерин, мочевина, креатинин и креатин, обнаруживают в биологических жидкостях, например моче, слюне и внутритканевой жидкости, и где контрольные растворы применяют для проверки точности электрохимических измерителей.
Электрохимические биосенсоры
Настоящее изобретение не ограничивается конкретной конструкцией биосенсора среди многих, раскрытых в данной области. Пример биосенсора, который может применяться, описан в патенте US №6531040, проиллюстрированном на фигурах 1 и 2.
Биосенсор 10 показан в разобранном виде на фигуре 1. Он включает изолирующее основание 12, на которое последовательно нанесены (обычно, с помощью техники распечатки с экрана) матрица (pattern) электрического проводника 14, матрица электрода (части 16 и 18), изолирующая (диэлектрическая) матрица 20 и реакционный слой 22 и завершены покрывающим слоем 28. Капилляр 30, образованный между покрывающим слоем 28 и слоем реагента 22, предоставляет путь для жидкого анализируемого образца. Биосенсор показан на фигуре 2, на которой все элементы на основании показаны в одном плане.
Функцией реакционного слоя 22 является проведение химической реакции с глюкозой или другим анализируемым веществом в жидком анализируемом образце и продукция электрического тока, который измеряют и приводят в соответствие с количеством присутствующего анализируемого вещества. Реакционный слой 22 обычно содержит фермент или ферменты и акцептор электронов. Фермент реагирует с анализируемым веществом, продуцируя электроны, которые доводятся до поверхности рабочего электрода с помощью акцептора электронов. Акцептор электронов называется здесь также медиатором, который восстанавливается при реакции с анализируемым веществом и ферментом. Фермент в реакционном слое можно сочетать с гидрофильным полимером, например полиэтиленоксидом (полиэтиленгликолем). Одним ферментом, который можно применять для реакции с глюкозой, является глюкозооксидаза и медиатором может быть феррицианидная соль, применяемая вместе с буфером, поддерживающим рН на значении приблизительно 5-7. Другим ферментом, который можно применять, является дегидрогеназа глюкозы вместе с кофактором, например пирролохинолин-хиноном (ПХХ) с применением буфера, поддерживающего рН около 6-8.
Две электродные части, 16 и 18, предоставляют, соответственно, рабочий и вспомогательный электроды, необходимые для электрохимического определения концентрации анализируемого вещества. Приведенная деталь конструкции показывает, что рабочий и вспомогательный электроды устроены так, что основная часть вспомогательного электрода находится после (в терминах направления жидкости вдоль пути тока) открытой части рабочего электрода 16А.
Составная часть вспомогательного электрода 18А, однако, расположена выше верхнего элемента рабочего электрода 16А, так что когда количество исследуемого жидкого образца (например, образца цельной крови) недостаточное для полного покрытия рабочего электрода входит в пространство капилляра, образуется электрический контакт между частью 18А вспомогательного электрода и открытой частью 16А рабочего электрода из-за проводимости образца цельной крови. Область вспомогательного электрода, однако, доступная для контакта с образцом цельной крови так мала, что только очень слабый ток может проходить между электродами и, таким образом, через детектор тока. Когда полученный сигнал находится ниже определенного заданного уровня, сенсорное устройство информирует пользователя, что недостаточно крови попало в полость сенсора и что следует провести другое измерение или добавить больше крови. Когда конкретные размеры электродов не являются критическими, область элемента 18А вспомогательного электрода обычно меньше приблизительно 10% такового рабочего электрода и, более конкретно, меньше приблизительно 6%.
Рабочий и вспомогательный электроды обычно отпечатаны с помощью электродных чернил с толщиной линии, обычно, 14 мкм (0,00055") и, обычно, содержат электрохимически активный углерод. Компоненты проводящих ток чернил могут быть смесью углерода и серебра, выбранной для предоставления проводящего пути с низким сопротивлением между электродами и измерителем, с которым они находятся в рабочей связи через контакт с проводящим рисунком на раздвоенном конце типа «рыбий хвост» 26 сенсора. Вспомогательный электрод может состоять из серебра/хлорида серебра, хотя углерод предпочтителен. Для повышения воспроизводимости показаний измерителя диэлектрический образец изолирует электроды от жидкого исследуемого образца за исключением определенной области (площадки) близко к центру электродного образца 24. Как видно на фигуре 2, определенная площадь является важной для этого типа электрохимического определения, потому что измеряемый ток зависит не только от концентрации анализируемого вещества и области реакционного слоя 22, но и от площади рабочего электрода 16А, которая находится в контакте с исследуемым образцом, содержащим анализируемое вещество.
Типичный диэлектрический слой 20 включает отвержденный ультрафиолетом модифицированный акрилатный мономер, олигомер или полимер и составляет около 10 мкм (0,0004") в толщину. Диэлектрический слой также может быть отвержден влагой или отвержден теплом. Крышка или покрытие 28 приспособлено, чтобы соответствовать основанию для образования пространства для размещения жидкого исследуемого образца, в котором расположены вспомогательный и рабочий электроды. Крышка 28 предоставляет вогнутое пространство 30 и обычно получается штамповкой плоского листа деформируемого материала. Крышка 28 проткнута для предоставления воздушной отдушины 32 и соединена с основанием 12 герметически. Крышка и основание можно герметически соединить с помощью ультразвуковой сварки, при которой основание 12 и крышку 28 сначала прикладывают друг к другу и затем прижимают вместе между плавящей с помощью вибрационного тепла частью или рогом и неподвижным зажимом. Контакт образуется только с плоскими невмятыми районами крышки. Энергия ультразвука от кристалла или другого передатчика рассеивается в виде тепла в полимерном соединении, разрешая сплавление вместе (соединение) деталей из термопластических материалов. Штампованная крышка и основание можно также соединить друг с другом с применением адгезивного материала на внутренней стороне крышки. Способ соединения крышки с основанием более полно описан в патенте US №5798031.
Подходящие материалы для изолирующего основания 12 включают поликарбонат, полиэтилен-терефталат, пространственно стабильные виниловые и акриловые полимеры и смеси полимеров, например поликарбонат/полиэтилен-терефталат и структуры с металлической фольгой (например, найлон/алюминий/поливинилхлоридный ламинат). Крышку обычно производят из листа деформируемого полимерного материала, например поликарбоната или пригодного для штамповки сорта полиэтилен-терефталата, модифицированного гликолем полиэтилен-терефталата или композиций с металлической фольгой (например, структур на алюминиевой фольге).
Другие конструкции электрохимического сенсора можно применять согласно настоящему изобретению. Примерами электрохимического сенсора, которые можно применять для измерения концентраций глюкозы, являются таковые, применяемые в системах Bayer HealthCare's Ascensia™ DEX® и ELITE®. Больше деталей об этих электрохимических биосенсорах можно найти в патенте US №№5120420 и 5320732. Другие электрохимические сенсоры продаются в Matsushita Electric Industrial Company. Еще один пример электрохимического сенсора, который можно применять в амперометрической системе мониторинга, раскрыт в патенте US №5429735.
Электрохимические сенсоры могут располагаться в приборе-автомате для определения глюкозы в крови, снабженном набором сенсоров или тестирующих элементов. Пример упаковки сенсоров, помещенной в автомат, раскрыт в патенте US 5660791.
Измерение глюкозы в цельной крови.
В типичном биосенсоре для измерения содержания глюкозы в цельной крови рабочий и вспомогательный электроды покрывают одним слоем реагента либо посредством совместной печати, либо совместного нанесения. Слой реагента обычно включает полимеры и реакционноспособные ингредиенты, которыми являются фермент, окисляющий глюкозу в образце крови, и медиатор, т.е. окислительно-восстановительное соединение, которое окисляет фермент после его восстановления в процессе окисления глюкозы. Восстановленный медиатор переносит электроны после ферментативной реакции окисления глюкозы на рабочий электрод и реокисляется на поверхности электрода. Приложенная разность напряжений между двумя электродами приводит к тому, что медиатор отдает электроны рабочему электроду, генерируя измеряемый ток, который пропорционален количеству глюкозы в образце. Биосенсор также может включать много слоев реагента или может включать различные одиночные или множественные слои на каждом электроде, рабочем и вспомогательном.
Как описано ранее, амперометрические сенсоры прикладывают к электродам заданный потенциал и возникающий ток измеряют в течение заданного периода времени, который может быть весьма коротким, скажем, 5-10 с, для коррекции ошибки, которая может возникать из-за преждевременного восстановления медиатора. В предпочтительной системе потенциал прикладывают в течение двух периодов времени, разделенных периодом покоя. Типичный график потенциала как функции времени для первого периода, или периода «выгорания» представлен на фигуре 3. Фигура 4 показывает типичный график зависимости возникающего тока от времени. Ток поднимается до пика, когда образец увлажняет слой реагента, создавая условия для прохождения реакций окисления и восстановления, и затем уменьшается, когда диффузия начинает контролировать реакцию. После этого короткого периода приложенный потенциал снимают или по крайней мере уменьшают в течение периода покоя, когда окисление глюкозы и восстановление медиатора продолжаются. Затем снова прикладывают потенциал в течение второго периода времени и измеряют ток за период снятия показаний (например, 10 с). Поскольку восстановленный медиатор получается в результате одновременного окисления фермента, возникающий вначале ток является высоким, но затем он быстро уменьшается и достигает стационарного контролируемого диффузией уровня. Ток, измеряемый под конец короткого периода «снятия показаний», применяется для определения содержания глюкозы в образце крови с помощью заранее полученного соотношения между величиной тока в конце периода снятия показаний и содержанием глюкозы в контрольных образцах с известной концентрацией глюкозы.
Контрольные растворы
Как обсуждалось ранее, применяются разные подходы для обеспечения того, что контрольный раствор предоставляет точные показания и может быть отличен от биологического образца. Настоящее изобретение применяет окисляемые виды соединений (например, внутренний стандарт), которые окисляются только при более высоком напряжении, чем применяемое для измерения содержания глюкозы (или другого анализируемого вещества). Это означает, что при низком потенциале, достаточном для полного окисления зависимого от глюкозы медиатора, но не соединения внутреннего стандарта, можно измерять только содержание глюкозы. Однако, когда потенциал достаточно высок для окисления добавленного соединения внутреннего стандарта, будут окисляться оба, как глюкоза, так и соединение внутреннего стандарта. Хотя глюкоза и окисляется при высоком потенциале, измерение, сделанное при более низком потенциале, уже является контролируемым диффузией, и не зависит от общего количества глюкозы, окисленной ферментом. Поэтому является возможным добавлять к контрольному раствору такие виды внутреннего стандарта и применять их для идентификации раствора как контрольного в отличие от биологического образца.
Разницу между токами, измеряемыми при высоких и низких напряжениях, можно сравнивать для индикации присутствия характеристического внутреннего стандарта в контрольном растворе. Дифференциальный индекс (ДИ) включает следующие составляющие тока, относящиеся к глюкозе и к соединению внутреннего стандарта:
ИД=Iвысокое напр./Iнизкое напр.=(Iвнутр.стан.+Iглюк)/Iглюк=1+Iвнут.станд./Iглюк
Где Iвысокое напр. является током, измеряемым при высоком напряжении,
Iнизкое напр. является током, измеряемым при низком напряжении.
Отсюда следует, что если внутреннего стандарта нет (например, в образцах крови), Iвнутр.стан. равно нулю и значение Iвысокое напр. практически такое же, как значение Iнизкое напр.. Таким образом, значение ДИ приблизится к 1. Когда присутствует внутренний стандарт, значение ДИ больше 1 в зависимости от количества соединения внутреннего стандарта относительно количества глюкозы. Если количество внутреннего стандарта, добавленного к контрольному раствору, предоставляет ток, сходный с таковым, возникающим при окислении восстановленного глюкозой медиатора, значение ДИ может быть около 2. Внутренний стандарт может быть включен в количестве, подходящем для контрольного раствора, соответствующего высокой концентрации глюкозы. Обычно применяют несколько контрольных растворов, соответствующих низкой, нормальной и высокой концентрации глюкозы, для проверки измерителя глюкозы. Если, например, количество внутреннего стандарта выбрано так, чтобы ДИ было 1,75 или больше для наиболее высокой концентрации глюкозы в контрольном растворе, то ток, зависимый от внутреннего стандарта, будет относительно высоким по сравнению с током, зависимым от глюкозы, в контрольном растворе с наиболее низкой концентрацией глюкозы. Тогда такое же количество внутреннего стандарта, применяемое в контрольном растворе с наименьшей концентрацией глюкозы, даст еще большее значение ДИ. Такие высокие значения ДИ предоставят большую уверенность в идентификации присутствия контрольного раствора, а не биологического образца, например, цельной крови. Ясно, что количественный индекс, например, ДИ имеет преимущество по сравнению с более качественными способами, полагающимися на форму кривой зависимости тока от времени в периоде выгорания или в периоде снятия показаний, как предлагается в других патентах. Добавление внутреннего стандарта, окисляемого при более высоком напряжении, предоставляет результат, который не зависит от ферментативной реакции и состава контрольного раствора.
В одном осуществлении количество внутреннего стандарта, добавленного к контрольному раствору, связано с количеством присутствующей глюкозы. Так, количество внутреннего стандарта в контрольном растворе пропорционально концентрации глюкозы для поддержания приблизительно постоянной величины ДИ. Одним способом является применение достаточного количества внутреннего стандарта для получения ДИ около 1,5 или выше, когда максимальное количество глюкозы составляет около 300 мг/дл. Далее, количество внутреннего стандарта уменьшают так, чтобы контрольные растворы, содержащие более низкие концентрации глюкозы, поддерживали значение ДИ около 1,5 или выше.
Добавление внутреннего стандарта к контрольным растворам делает возможным легко отличать контрольные растворы от биологических образцов и предоставляет улучшенную точность анализа. Соединения внутреннего стандарта могут быть любым соединением, электрохимически окисляемым при нужном потенциале. Важно понимать, что не все соединения, окисляемые химически, являются окисляемыми электрохимически при подходящем потенциале или при любом окислительном потенциале. Химически окисляемые виды (например, гомогенный раствор) могут не окисляться электрохимически при подходящем потенциале, потому что на электроде надо преодолеть кинетический барьер переноса электронов. Таким образом, восстановительный агент по своей химической природе может не окисляться электрохимически на электроде. В зависимости от окислительно-восстановительного потенциала медиатора в реакционной системе сенсора потребуются соединения внутреннего стандарта с различными окислительно-восстановительными потенциалами. Например, если медиатором в реакционной системе является рутений-гексамин (Ru(NH3)6 3+), то координационное соединение ферроцианид калия или металлоорганические соединения ферроцен и его производные могут применяться в качестве внутренних стандартов в контрольном растворе. С другой стороны, если медиатором реакционной системы является феррицианид, то другие соединения, например бис-трис или 4-аминобензонитрил, могут применяться в качестве внутреннего стандарта в контрольном растворе. В каждом случае соединение внутреннего стандарта обладает окислительно-восстановительным потенциалом, который по крайней мере на 100 мВ выше, чем окислительно-восстановительный потенциал медиатора.
Примеры соединений внутреннего стандарта включают, но не ограничиваются этим, органические амины, например 3-(N-морфолино)-пропан сульфоновую кислоту (MOPS), N-(2-гидроксиэтил)-пиперазин-N'-(2-этан сульфоновую кислоту) (HEPES), 2-(гидрокси-1,1-бис(гидроксиметил)-этиламино)-этан сульфоновую кислоту (TES), 2-морфолиноэтан-сульфоновую кислоту (MES), бис(2-гидроксиэтил)амино-трис(гидроксиметил)метан(Bis-Tris), 4-аминобензонитрил, 4-амино-бензойную кислоту и 4-йоданилин. В примерах ниже показано, что бис-трис (Bis-Tris) и несколько других соединений применимы в качестве внутреннего стандарта в контрольных растворах, содержащих глюкозу.
Хотя бис-трис можно применять в качестве внутреннего стандарта, он также может служить буфером. Значение рН контрольного раствора является важным фактором для реакции, когда глюкоза окисляется ферментом, например глюкозооксидазой. При измерении глюкозы предпочтителен рН приблизительно от 5 до 7, когда применяют глюкозооксидазу, тогда как при применении глюкозодегидрогеназы предпочтителен рН около 6-8. Обычно включают буфер для обеспечения протекания окисления глюкозы с ожидаемой скоростью. Преимуществом настоящего изобретения является то, что соединение внутреннего стандарта и буфер могут быть различными веществами, где каждое выполняет свою функцию, позволяя таким образом оптимизировать каждую функцию (буфера и внутреннего стандарта) отдельно. Буферы можно выбирать из таковых совместимых с ферментативным реагентом. Примеры включают, но не ограничиваются этим, цитратный буфер и фосфатный буфер.
Полимерные материалы, применяемые для симуляции гидродинамических свойств крови, могут включать полиэтилен оксид, полигидроксиэтилметакрилат, поливинилпирролидон (ПВП), ксантановую смолу в количестве около 12-20 весовых процентов. Глюкоза обычно присутствует в контрольных растворах в количествах, эквивалентных приблизительно от 30 до 400 мг/дл, соответствующих интервалу, охватывающему ожидаемое содержание глюкозы в образцах крови.
Другие добавки могут включать соли, буферы, красители, противомикробные агенты, полимеры, загустители и поверхностно-активные вещества.
Способ действия контрольного раствора
Очевидно, что введение материала внутреннего стандарта, окисляемого при более высоком напряжении, чем применяется для окисления связанного с глюкозой медиатора, сделает необходимым приложение более высокого напряжения в какой-то момент по протоколу измерения. Когда применяют два периода, как описано выше, являющиеся периодами «выгорания» и «снятия показаний», можно применять различные комбинации скачков напряжения в течение периодов выгорания и снятия показаний для предоставления как значения ДИ для идентификации контрольного раствора, так и тока, по величине которого определяют содержание глюкозы в контрольном растворе. Согласно простейшему способу высокое напряжение прилагают в течение периода выгорания и низкое напряжение прилагают в течение периода снятия показаний. Таким обра