Способ определения состояния стенки кровеносных сосудов
Иллюстрации
Показать всеИзобретение относится к области медицины. Сущность способа определения состояния стенки кровеносных сосудов заключается в том, что осуществляют забор периферической венозной крови у больного в объеме 10 мл, после центрифугирования 5 мл периферической крови пациента на градиенте плотности ρ=1,077 и ультрацентрифугировании еще 5 мл периферической крови того же пациента. Фракции мононуклеаров и эндотелиальных клеток помещают в соответствующие флаконы для культивирования. Адгезированные к поверхности флаконов клетки диссоциируют и подсчитывают в камере Горяева. Количество клеток делят на количество подсчитанных квадратов, умножают на 1000, что соответствует содержанию первичных эндотелиальных прогениторных клеток или специализированных эндотелиальных прогениторных клеток из расчета на 5 мл крови. При значении количества первичных эндотелиальных прогениторных клеток, превышающих в 20 и более раз количество специализированных эндотелиальных прогениторных клеток, говорят об отсутствии эндотелиальной дисфункции - ЭД0. При значении количества первичных эндотелиальных прогениторных клеток, превышающем от 5 до 20 раз количество специализированных эндотелиальных прогениторных клеток, говорят о высокой репаративной способности эндотелия сосудов и сохранной функции эндотелиоцитов - физиологическая дисфункция эндотелия, ЭДф. При значении количества первичных эндотелиальных прогениторных клеток, превышающем от 2 до 5 раз количество специализированных эндотелиальных прогениторных клеток, говорят о достаточной репаративной способности эндотелия сосудов и относительно сохранной функции эндотелиоцитов - умеренная эндотелиальная дисфункция, ЭД I. При соотношении количества первичных эндотелиальных прогениторных клеток к количеству специализированных эндотелиальных прогениторных клеток, равном 1:1,0-1,4 или 1,5:1, говорят об эндотелиальной дисфункции средней степени тяжести и сохранной способности к репарации эндотелиального слоя - ЭД II. При соотношении количества первичных эндотелиальных прогениторных клеток к количеству специализированных эндотелиальных прогениторных 1:≥1,5 клеток, говорят о выраженной эндотелиальной дисфункции с сильным нарушением репаративной способности эндотелия - ЭД III. Использование заявленного способа позволяет не только выявить эндотелиальную дисфункцию, диагностировать степень тяжести, но и определить репаративную способность сосудистой стенки, что имеет важное прогностическое и терапевтическое значение и может быть использовано для подбора адекватного патологическому состоянию метода лечебной коррекции, а также может быть использовано в научных целях для поиска и усовершенствования медицинских технологий лечения сосудистых заболеваний. 2 ил., 3 пр., 1 табл.
Реферат
Изобретение относится к медицине, а именно к кардиологии, неврологии, терапии, и может быть использовано для выявления эндотелиальной дисфункции и определения репаративной способности сосудистой стенки у пациентов с сосудистыми заболеваниями, а так же использовано для медицинских научных исследований.
Усиление продукции эндотелиальных прогениторных клеток возникает в ответ на повреждение сосудистой стенки и ишемию тканей, направлено на неоваскуляризацию и репарацию эндотелиального слоя сосудистого русла.
Существует распространенный подход к определению количества циркулирующих эндотелиальных прогениторных клеток и оценка по нему эндотелиальной дисфункции.
Выделение эндотелиальных прогениторных клеток
1) Периферическую кровь собирают в туб, содержащий 0,5 мМ EDTA.
2) Фракцию мононуклеаров выделяют из крови на градиенте плотности 1,077.
3) Помещают мононуклеары из расчета 1×106 клеток на см2 в культуральные лунки (или культуральный флакон), содержащие 2% желатин и питательную среду M199 с 20% FBS (fetal bovin serum), 0.05 мг/мл Bovine Pituitary Extract, антибиотики и 10 ЕД/мл гепарина.
4) Культивируют в инкубаторе при нормальных условиях (37°C, 5% CO2) 72 часа.
5) Убирают питательную среду с неадгезированными к поверхности лунки клетками (или поверхности флакона).
6) Добавляют новую питательную среду, как описано в пункте 3, отличающуюся по содержанию 2% FBS.
7) а) производят подсчет клеточности под фазово-контрастным микроскопом,
б) вносят в лунки разведенные согласно инструкции антитела-маркеры эндотелиальных прогениторных клеток, например, (FITC)-conjugated CD31 и производят подсчет с использованием люминесцентной микроскопии,
в) вносят питательную среду с ростовым фактором VEGF для дальнейших экспериментов и инкубируют клетки при 37°C, 5% CO2, 4-7 дней с заменой питательной среды каждые три дня.
Этот способ применяется исследователями (преобладающее большинство работ выполнено за рубежом) с незначительными модификациями питательной клеточной среды, времени инкубации и внесения различных маркеров-антигенов (Hristov M., Weber C. Endothelial progenitor cells in vascular repair and remodeling. Pharmacological Research. 2008; 58: 148-151).
В таблице 1 приведены данные по содержанию эндотелиальных прогениторных клеток при различных заболеваниях на основании работ разных авторов с использованием описанного выше способа.
NYHA = New York Heart Association; ADMA = asymmetric dimethylarginine; CFU = colony-forming units of EPCs; EPC = endothelial progenitor cell; HDL = high-density lipoprotein; KDR = kinase insert domain receptor; LDL = low-density lipoprotein; NO = nitric oxide, ОНМК - острое нарушение мозгового кровообращения, ИБС - ишемическая болезнь сердца, ОИМ - острый инфаркт миокарда, ХСН - хроническая сердечная недостаточность.
Недостатки данного способа определения количества циркулирующих эндотелиальных прогениторных клеток и оценки эндотелиальной дисфункции: отсутствие учета уже специализированных эндотелиальных прогениторных клеток в эндотелиоциты, а значит отсутствие оценки репаративной возможности эндотелиального слоя сосудистого русла и выраженности эндотелиальной дисфункции.
Известен способ оценки эндотелиальной дисфункции по циркулирующим эндотелиоцитам в крови, предложенным Красновой Л.Г. и др. (патент РФ №2234094; G01N 33/49, 08.10.2004), в основе которого лежит определение количества десквамированных эндотелиоцитов в периферической крови способом Hladovec J. (Hladovec, J. Circulating endothelial cells in acute myocardial infarction and angina // Klin Wochenschr. 1978; №56, P.1033-1036) после создания на 4 минуты положительного давление в области плеча, превышающего систолическое артериальное давление на 40-50 мм рт.ст. Недостатком этого способа является отсутствие морфо-функциональной дифференциации циркулирующих эндотелиоцитов и невозможность проведения оценки репаративной способности эндотелиального слоя. Кроме того, создание извне повышенного давления в области плеча (манжеточная проба) является физическим провоцирующим фактором локальной дисфункции эндотелия сосудов в области плеча (синдром сдавления).
Способ оценки степени эндотелиальной дисфункции (патент РФ №2324939; G01N 33/49, 20.05.2008), заключающийся в определении спущенных эндотелиоцитов, мембран-высвобожденных микрочастиц и физико-морфологических параметров мембраны лимфоцитов крови является эффективным средством диагностики эндотелиальной дисфункции с использованием математической формулы и диагностических стандартов, но не предполагает оценку репаративной функции эндотелия сосудов, что является существенным недостатком в прогнозировании течения эндотелиальной дисфункции и выборе методов лечения.
Задачей предлагаемого способа является оценка репаративной способности эндотелия сосудов.
Поставленную задачу осуществляют за счет того, что после центрифугирования 5 мл периферической крови пациента на градиенте плотности ρ=1,077 и ультрацентрифугирования 5 мл периферической крови того же пациента выделяют фракцию мононуклеаров и эндотелиальных клеток, затем помещают в соответствующие флаконы для культивирования; полученные фракции первичных прогениторных эндотелиальных клеток и специализированных прогениторных эндотелиальных клеток, адгезированные к поверхности флаконов, диссоциируют и подсчитывают в камере Горяева в 2 больших квадратах или камере Бюркера в 4 больших квадратах; затем полученное количество клеток делят на 2 для камеры Горяева и на 4 для камеры Бюркера: при значении количества первичных эндотелиальных прогениторных клеток, превышающим в 20 и более раз количество специализированных эндотелиальных прогениторных клеток, говорят об отсутствии эндотелиальной дисфункции - ЭД0; при значении количества первичных эндотелиальных прогениторных клеток, превышающем от 5 до 20 раз количество специализированных эндотелиальных прогениторных клеток, говорят о высокой репаративной способности эндотелия сосудов и сохранной функции эндотелиоцитов - физиологическая дисфункция эндотелия, ЭДф; при значении количества первичных эндотелиальных прогениторных клеток, превышающем от 2 до 5 раз количество специализированных эндотелиальных прогениторных клеток, говорят о достаточной репаративной способности эндотелия сосудов и относительно сохранной функции эндотелиоцитов - умеренная эндотелиальная дисфункция, ЭД I; при соотношении количества первичных эндотелиальных прогениторных клеток к количеству специализированных эндотелиальных прогениторных клеток, равном 1:1,0-1,4 или 1,5:1, говорят об эндотелиальной дисфункции средней степени тяжести и сохранной способности к репарации эндотелиального слоя - ЭД II; при соотношении количества первичных эндотелиальных прогениторных клеток к количеству специализированных эндотелиальных прогениторных 1:≥1,5 клеток говорят о выраженной эндотелиальной дисфункции с сильным нарушением репаративной способности эндотелия - ЭД III.
Способ осуществляют следующим образом: забор венозной крови в объеме 10 мл проводят толстой иглой из локтевой вены пациента в пластмассовую пробирку с ризками, содержащую 0,03 мл гепарина; затем тщательно перемешивают кровь с гепарином в пробирке. Допустимо хранение пробирки с кровью в холодильнике при +5С° в течение 3-4 часов. В условиях лаборатории проводят повторное ресуспендирование крови в пробирке.
Затем из пробирки, содержащей 10 мл крови, разделяют кровь в лабораторных условиях на 2 пробирки по 5 мл для последующего выделения первичных эндотелиальных прогениторных клеток и специализированных эндотелиальных прогениторных клеток.
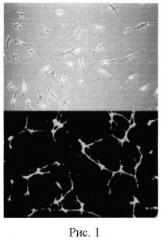
Пробирку №1 центрифугируют на градиенте плотности ρ=1,077 для выделения клеток мононуклеарной фракции, которые затем помещают из расчета 1×106 клеток в см2 во флакон для культивирования, содержащий 20 мл питательной среды М199 с 2% FBS (fetal bovin serum, из расчета поддержания жизнеспособности, а не клеточного роста), 0.05 мг/мл Bovine Pituitary Extract, антибиотики, инкубируют в течение 24 часов при нормальных условиях (37°С, 5% CO2), затем убирают питательную среду с клетками, неадгезированными к ростовой поверхности флакона, добавляют 0,25% трипсин/ЭДТА (1 ммоль/л) в объеме 5 мл для диссоциации клеток от ростовой поверхности, производят перемещение клеток с трипсин/ЭДТА в пробирку и доводят до 15 мл PBS, затем центрифугируют при +4°C, 5000 оборотов, 10 минут, к полученному осадку добавляют 1 мл PBS и осуществляют подсчет в камере Горяева в 2 больших квадратах (камере Бюркера в 4 больших квадратах), затем полученное число делят на 2 для камеры Горяева (и на 4 для камеры Бюркера), умножают на 1000, что соответствует содержанию первичных эндотелиальных прогениторных клеток из расчета на 5 мл крови (рисунок 1).
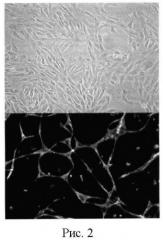
Пробирку №2 центрифугируют при +4°С в течение 20 минут при скорости 395 g, к осадку добавляют 0,2 мл ADP (1 мг/мл раствора), суспендируют в течение 10 минут до полного смешивания, центрифугируют при +4°С в течение 20 минут на скорости 395g (для отделения от тромбоцитарных агрегатов), полученный супернатант центрифугируют при +4°С в течение 20 минут, 2100 g, полученный осадок помещают во флакон для культивирования с питательной средой М199 с 2% FCS (heat inactivated fetal calf serum), антибиотиками и 2 mM L-глутамином, после 24 часов инкубирования (37°C, 5% CO2) убирают питательную среду с эндотелиоцитами (апоптотическими), неадгезированными к ростовой поверхности флакона, во флакон вносят 0,25% трипсин/ЭДТА (1 ммоль/л) в объеме 5 мл для диссоциации клеток от ростовой поверхности, производят перемещение клеток с трипсин/EDTA в пробирку и доводят до 15 мл PBS, затем центрифугируют при +4°С, 5000 оборотов, 10 минут, к полученному осадку добавляют 1 мл PBS и осуществляют подсчет в камере Горяева в 2 больших квадратах (камере Бюркера в 4 больших квадратах), затем полученное число делят на 2 для камеры Горяева (и на 4 для камеры Бюркера), умножают на 1000, что соответствует содержанию специализированных эндотелиальных прогениторных клеток из расчета на 5 мл крови (рисунок 2).
При значении количества первичных эндотелиальных прогениторных клеток, превышающем в 20 и более раз количество специализированных эндотелиальных прогениторных клеток, говорят об отсутствии эндотелиальной дисфункции - ЭД0; при значении количества первичных эндотелиальных прогениторных клеток, превышающем от 5 до 20 раз количество специализированных эндотелиальных прогениторных клеток, говорят о высокой репаративной способности эндотелия сосудов и сохранной функции эндотелиоцитов - физиологическая дисфункция эндотелия, ЭДф; при значении количества первичных эндотелиальных прогениторных клеток, превышающем от 2 до 5 раз количество специализированных эндотелиальных прогениторных клеток, говорят о достаточной репаративной способности эндотелия сосудов и относительно сохранной функции эндотелиоцитов - умеренная эндотелиальная дисфункция, ЭД I; при соотношении количества первичных эндотелиальных прогениторных клеток к количеству специализированных эндотелиальных прогениторных клеток, равном 1:1,0-1,4 или 1,5:1, говорят об эндотелиальной дисфункции средней степени тяжести и сохранной способности к репарации эндотелиального слоя - ЭД II; при соотношении количества первичных эндотелиальных прогениторных клеток к количеству специализированных эндотелиальных прогениторных 1:≥1,5 клеток, говорят о выраженной эндотелиальной дисфункции с сильным нарушением репаративной способности эндотелия - ЭД III.
Исследование количества первичных и специализированных эндотелиальных прогениторных клеток проведены у больных гипертонической болезнью в сочетании с ишемической болезнью сердца (72 человека) и гипертонической болезнью без ишемической болезни сердца (50 человек), а так же у относительно здоровых пациентов с синдромом панических атак (30 человек), что соответствует нейроциркуляторной дистонии (всего 152 человека). В результате у пациентов, страдающих гипертонической болезнью II стадии, риск 3 определена ЭД II в 61,1%±3,3 случаев (p<0,01); у 38,9%±4.5 (p<0,05) определена ЭД III, из которых у 78%±1,4 (р<0,01) развились сосудистые осложнения в ближайшие полгода от момента исследования. У пациентов, страдающих гипертонической болезнью и ишемической болезнью сердца, стенокардией напряжения II ф.кл. диагностировали ЭД II в 96%±2,3 случаев (p<0,01), у 2 пациентов диагностирована ЭД III, в ближайшие полгода от момента исследования 1 из них был доставлен в стационар с диагнозом - инфаркт миокарда, второй пациент с тромбоэмболией легочной артерии. У 25 (83,3%) пациентов с синдромом панических атак диагностирована ЭДф (p<0,05), у 5 человек (16,7%) - ЭД I (p>0,05).
На рисунке 1 представлена микрофотография культуры эндотелиальных прогениторных клеток, увеличение ×900, верхняя часть рисунка - фазово-контрастная микроскопия, нижняя - люминесцентная.
На рисунке 2 представлена микрофотография культуры специализированных эндотелиальных клеток, увеличение ×900, верхняя часть рисунка - фазово-контрастная микроскопия, нижняя - люминесцентная.
Пример 1
Мужчина 45 лет, страдает в течение 10 лет гипертонической болезнью и в течение 5 лет ишемической болезнью сердца, стенокардией напряжения II ф. кл.
Регулярно получает стандартную сердечно-сосудистую терапию.
В развернутом анализе крови отмечается незначительное повышение СОЭ (12 мм/ч), в биохимическом анализе крови: увеличение содержания общего холестерина (6,2 ммоль/л). Других отклонений не выявлено.
При проведении лабораторных анализов определено, что содержание первичных эндотелиальных прогениторных клеток составило 2000 клеток из расчета на 5 мл образца периферической крови пациента, и 1700 специализированных эндотелиальных клеток из расчета на 5 мл крови. 2000/1700=1,18, что соответствует ЭД II.
Эти результаты свидетельствуют об эндотелиальной дисфункции средней степени тяжести и сохранной способности к репарации эндотелиального слоя.
Пример 2.
Женщина 50 лет, страдающая в течение 20 лет гипертонической болезнью II, риск 3, кризовое течение.
Прием лекарственных препаратов по потребности, несмотря на рекомендации лечащего врача.
В развернутом анализе крови отклонений не выявлено, в биохимическом анализе крови повышена концентрация фибриногена (4,5 г/л), общий холестерин 5,2 ммоль/л.
Лабораторно: 900 первичных эндотелиальных прогениторных клеток из расчета на 5 мл крови и 2152 специализированных эндотелиальных прогениторных клеток из расчета на 5 мл крови. 2152/900=2,39, что соответствует ЭД III и свидетельствует о выраженной эндотелиальной дисфункции с сильным нарушением репаративной способности эндотелия.
Через 1,5 месяца от проведенного исследования пациентка была госпитализирована с диагнозом острое нарушение мозгового кровообращения в левой среднемозговой артерии по ишемическому типу.
Пример 3.
Женщина 32 лет, страдающая в течение 10 лет синдромом панических атак.
Из медикаментозных препаратов периодически получала рибоксин и валериану.
В развернутом и биохимическом анализе крови отклонений не обнаружено.
Лабораторно: первичных эндотелиальных прогениторных клеток 10000 из расчета на 5 мл крови, специализированных эндотелиальных прогениторных клеток 200 из расчета на 5 мл крови. 10000/250=40. Это соответствует ЭД0 и говорит об отсутствии эндотелиальной дисфункции.
Использование заявляемого способа позволяет не только выявить эндотелиальную дисфункцию, диагностировать ее степень тяжести, но и определить репаративную способность сосудистой стенки, что имеет важное прогностическое и терапевтическое значение, может быть использовано для подбора адекватного патологическому состоянию метода лечебной коррекции, а также может быть использовано в научных целях для поиска и усовершенствования медицинских технологий лечения сосудистых заболеваний.
Способ определения состояния стенки кровеносных сосудов, включающий забор периферической венозной крови у больного в объеме 10 мл, после центрифугирования 5 мл периферической крови пациента на градиенте плотности ρ=1,077 и ультрацентрифугирования еще 5 мл периферической крови того же пациента выделяют фракцию мононуклеаров и эндотелиальных клеток, отличающийся тем, что полученные фракции клеток помещают в соответствующие флаконы для культивирования, адгезированные к поверхности флаконов клетки диссоциируют и подсчитывают в камере Горяева, полученное количество клеток делят на количество подсчитанных квадратов, умножают на 1000, что соответствует содержанию первичных эндотелиальных прогениторных клеток или специализированных эндотелиальных прогениторных клеток из расчета на 5 мл крови; при значении количества первичных эндотелиальных прогениторных клеток, превышающем в 20 и более раз количество специализированных эндотелиальных прогениторных клеток, говорят об отсутствии эндотелиальной дисфункции - ЭД0; при значении количества первичных эндотелиальных прогениторных клеток, превышающем от 5 до 20 раз количество специализированных эндотелиальных прогениторных клеток, говорят о высокой репаративной способности эндотелия сосудов и сохранной функции эндотелиоцитов - физиологическая дисфункция эндотелия, ЭДф; при значении количества первичных эндотелиальных прогениторных клеток, превышающем от 2 до 5 раз количество специализированных эндотелиальных прогениторных клеток, говорят о достаточной репаративной способности эндотелия сосудов и относительно сохранной функции эндотелиоцитов - умеренная эндотелиальная дисфункция, ЭД I; при соотношении количества первичных эндотелиальных прогениторных клеток к количеству специализированных эндотелиальных прогениторных клеток, равном 1:1,0-1,4 или 1,5:1, говорят об эндотелиальной дисфункции средней степени тяжести и сохранной способности к репарации эндотелиального слоя - ЭД II; при соотношении количества первичных эндотелиальных прогениторных клеток к количеству специализированных эндотелиальных прогениторных 1:≥1,5 клеток говорят о выраженной эндотелиальной дисфункции с сильным нарушением репаративной способности эндотелия - ЭД III.