Способ контроля результатов редукции полости левого предсердия
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к кардиохирургии. До операции определяют рост и вес пациента. Рассчитывают площадь поверхности его тела и индивидуальный, нормальный для данного пациента, объем левого предсердия. Инструментально определяют объем левого предсердия, после уменьшения этого значения на 20% вычисляют его площадь поверхности до редукции. Во время операции на открытом сердце выбирают участок редукции и вычисляют его площадь. Полученное значение вычитают из площади поверхности левого предсердия до редукции. По остатку вычисляют получившийся после редукции объем левого предсердия. Полученный объем сравнивают с желаемым и оценивают необходимость редукции выбранной зоны и продолжения редукции. В случае необходимости проводят редукцию выбранной зоны. Выбирают новый участок редукции, вычисляют его площадь и повторяют вышеописанный алгоритм. В случае, если редукция не нужна, то процедуру атриопластики прекращают. Способ позволяет добиться контролируемого уменьшения объема левого предсердия до нормального, что приводит к увеличению дыхательных объемов, уменьшению времени искусственной вентиляции легких после операции, уменьшению количества осложнений, связанных с дыханием. 3 фиг., 1 табл.
Реферат
Изобретение относится к сердечно-сосудистой хирургии, в частности к способам хирургического лечения осложнений митрального порока сердца, конкретно - к способам контроля результатов хирургической редукции объема левого предсердия.
При пороках митрального клапана происходит увеличение объема левого предсердия. В ряде случаев левое предсердие может достигать гигантских размеров (атриомегалия), сдавливая окружающие органы, приводя к нарушению их функции. В полости увеличенного левого предсердия происходит застой крови, что наряду с фибрилляцией предсердий увеличивает вероятность тромбообразования. Осложнение в виде левой атриомегалии имеют от 10% до 19% всех пациентов, оперированных по поводу митрального порока.
Процедура редукции полости левого предсердия (атриопластика) направлена на ликвидацию синдромов сдавления окружающих органов, уменьшение вероятности тромбообразовання.
К настоящему времени предложено большое количество методов редукции полости левого предсердия, при этом отсутствуют способы, позволяющие контролировать процедуру атриопластики в процессе ее выполнения. В литературе имеются рекомендации добиваться максимального уменьшения объема предсердия [Бабляк Д.Е., Аверчук В.Г., Бабляк А.Д. "Обоснование целесообразности левой атриопластики в хирургическом лечении митральных пороков сердца, осложненных гигантским левым предсердием" // Груд. и сердечно-сосудистая хирургия, N 4,1996. Стр. 15-19. В.А.Иванов, Д.А.Подчасов "Результаты пластики левого предсердия при коррекции митрального порока, осложненного атриомегалией". // Хирургия. Журнал им. Н.И.Пирогова, №9, 2005. Стр. 4-9].
Известными методами контроля степени редукции полости предсердия, путем измерения его размеров, являются эхокардиография (ЭХО - КГ), компьютерная томография (КТ), магнитно-резонансная томография (МРТ). С помощью сложных приборов и установок, работа которых основана на различных физических принципах, измеряют размеры левого предсердия до и после операции и определяют ее эффективность. Прототипом заявляемого изобретения выбрана транспищеводная ЭХО-КГ, выполняемая интраоперационно.
Рентгеновская компьютерная томография - это послойное рентгенологическое исследование, основанное на компьютерной реконструкции изображения, получаемого при круговом сканировании объекта узким пучком рентгеновского излучения. Помимо обычной компьютерной томографии, позволяющей получать только двухмерные изображения аксиального сечения, существует метод мультиспиралыюй компьютерной томографии (МСКТ), позволяющий получать изображение срезов в любом сечении и осуществлять трехмерную реконструкцию исследуемой области. Некоторые установки для МСКТ снабжены кардиосинхронизаторами, позволяющими включать аппарат в строго определенные фазы сердечного цикла, что дает возможность получать качественные изображения движущихся структур сердца. Это позволяет точно рассчитать объем камер сердца, рассчитать фракцию выброса, оценить регионарную сократимость миокарда.
Недостатки метода: метод дорог, требует громоздкого оборудования и специального помещения, не применим в условиях кардиохирургической операционной, связан с воздействием на пациента ионизирующего излучения, имеются сложности при исследовании пациентов, страдающих клаустрофобией. [Прокоп М. "Спиральная и многослойная компьютерная томография: Учебное пособие: В 2 т.". Пер. с англ. Под ред. А.В.Зубарева, Ш.Ш.Шотемора. - М.: МЕДпресс-ннформ, 2006. Линденбратен Л.Д., Королюк И.П. "Медицинская радиология (основы лучевой диагностики и лучевой терапии): Учебник. - 2-е издание". - М.: Медицина, 2000. Стр.92-99].
Магнитно-резонансная томография - метод функциональной диагностики, основанный на использовании явления ядерного магнитного резонанса. В основе его лежит способность ядер некоторых атомов вести себя как магнитные диполи. Этими свойствами обладают ядра, содержащие нечетное количество нуклонов: 1H; 13C; 19F: 31P и др. Применяемые в медицинской практике магнитно-резонансные томографы настроены на атомы водорода, так как они находятся в тканях в наибольшем количестве, что обусловливает наилучшее качество изображения.
МРТ позволяет получать изображения тонких слоев тела человека в любой плоскости. Высокопольные магнитно-резонансные томографы позволяют получать двухмерное и трехмерное изображение тканей, в частности полостей сердца. Разработан математический аппарат, позволяющий с высокой точностью определять объем полостей тела.
Недостатки метода: метод дорог, требует громоздкого оборудования, специального помещения (экранирование от внешних магнитных полей и радиоизлучения), не применим в условиях кардиохирургической операционной, связан с воздействием на пациента сильного магнитного поля, соответственно не применим у лиц, имеющих различного рода имплантанты из ферромагнитных материалов (происходит их нагревание, смещение), имеются сложности при проведении исследования у больных, страдающих клаустрофобией, установки производят сильный шум [Линденбратен Л.Д., Королюк И.П. "Медицинская радиология (основы лучевой диагностики и лучевой терапии): Учебник. - 2-е издание". - М.: Медицина, 2000. Стр.135-143. Stark D.D., Bradley W.G. "Magnetic Resonance Imaging". - St. Louis: Mosby Year Book, 1992].
ЭХО-КГ - метод функциональной диагностики, в основе которого лежит использование ультразвука (УЗ). Благодаря малой длине УЗ волны, УЗ исследование позволяет выявлять мелкие детали исследуемого объекта. Чем больше частота УЗ, тем меньше длина волны и, следовательно, больше разрешающая способность исследования, тем меньше глубина проникновения УЗ в ткани. На практике используются УЗ датчики с частотой от 2 до 7,5 МГц. При частоте 2 МГц длина волны составляет 0,8 мм, но реальная разрешающая способность ниже. Определение объема полостей сердца основано на построении двухмерного изображения в "В" - режиме. Предпочтительный способ определения объема левого предсердия - двухмерное исследование во взаимно перпендикулярных проекциях. Существует ряд алгоритмов, позволяющих определять объем левого предсердия - "метод дисков", "площадь - длина" и другие, включающие соответствующие математические расчеты. В настоящее время существуют 2 основных методики ЭХО-КГ, применяемых в хирургии - трансторакальная и транспищеводная ЭХО-КГ.
Трансторакальная ЭХО-КГ имеет ряд недостатков. Проведению ее мешают акустические препятствия на пути УЗ луча, которые находятся внутри или вне сердца. Это - подкожная клетчатка, ребра, мышцы, кальцинаты, протезированные клапаны и т.п. При трансторакальной ЭХО-КГ, для достижения необходимой проникающей способности УЗ, приходится применять датчики 2,5-3,5 МГц, что ограничивает разрешающую способность и снижает точность измерений. Трансторакальная ЭХО-КГ не применима во время операций на сердце, требует дорогостоящего оборудования [Шиллер Н.Б., Осипов М.А. "Клиническая эхокардиография, второе издание". - М., Практика, 2005, стр.9-33, 62-96, 115-119; Feigenbaum H. "Evolution of echocardiography." Circulation 93(7): 1321-1327,1996].
Во время открытых операций на сердце применима только транспищеводная ЭХО-КГ (Transesophageal echocardiography - TEE), которая рассматривается как прототип заявляемого изобретения. Датчик TEE располагается близко к сердцу, в связи с чем метод обладает большей разрешающей способностью. Отсутствуют акустические препятствия УЗ волне. Способ осуществляется следующим образом. Редукция левого предсердия всегда выполняется попутно с коррекцией порока митрального клапана, или реже аортального и трехстворчатого клапанов. После введения в наркоз и интубации трахеи в пищевод пациента вводят пищеводный эхокардиографический датчик. Измеряют диаметр левого предсердия. В случае, если диаметр равен или превышает 60-65 мм, то делают вывод о необходимости редукции левого предсердия. В случае, если диаметр левого предсердия больше 40 мм и меньше 60 мм, считается, что редукцию проводить нецелесообразно, поскольку размер левого предсердия уменьшится самостоятельно благодаря коррекции клапанного порока. После проведения редукции, восстановления сердечной деятельности и отключения аппарата искусственного кровообращения проводят повторное измерение диаметра левого предсердия. Если полученное значение диаметра меньше исходного, то редукцию считают успешной [Е.Apostolakis, J.H.Shuhaiber. The surgical management of giant left atrium. Eur J Cardiothoracic Surg, 2008, 33: 182-190]. Тем не менее метод имеет недостатки, связанные с тем, что точное измерение размеров левого предсердия возможно только на работающем сердце, т.е. до и после редукции его объема. В случае остановки сердца и эвакуации крови из полости левого предсердия определение его объема невозможно по причине наличия в нем воздуха, который непроницаем для ультразвука. Также на остановленном и тем более разгруженном сердце объем левого предсердия изменяется в связи с его деформацией. Метод требует дорогостоящего оборудования. Применение методики связано с возможностью ряда осложнений, таких как повреждение пищевода, зубов, ларингоспазм, бронхоспазм, нарушения сердечного ритма [Шиллер Н.Б., Осипов М.А. "Клиническая эхокардиография, второе издание". - М., Практика, 2005, стр.256-280; Daniel W., Erbel R., et al. "Safety of transesophageal echocardiography. A multicenter survey of 10419 examinations. " Circulation 83(3): 817-821, 1991].
Так как процедура редукции объема левого предсердия является второстепенной по отношению к коррекции порока митрального клапана, то в случае недостаточной или избыточной редукции, если только это не вызывает серьезных нарушений сердечной деятельности, повторная остановка сердца и дополнительные процедуры по коррекции объема левого предсердия считаются нецелесообразными. Недостаточное уменьшение объема предсердия может обусловливать присущие ему патологические эффекты. Чрезмерное уменьшение объема предсердия ведет к увеличению вероятности развития отека легких при нестабильности гемодинамики. Таким образом, существует проблема - как выполнить процедуру редукции объема левого предсердия за одну остановку сердца и с высокой вероятностью достигнуть желаемых размеров левого предсердия.
Задачей изобретения является контроль результатов редукции левого предсердия сразу после ее выполнения, не восстанавливая сердечную деятельность.
Это достигается тем, что до операции определяют рост и вес пациента. Рассчитывают площадь поверхности его тела. На основе этого показателя рассчитывают индивидуальный, нормальный для данного пациента объем предсердия. Он потребуется в дальнейшем для сравнения с ним расчетного объема предсердия. Определяют существующий объем левого предсердия методом трансторакального ЭХО-КГ (возможно использование для этой цели методов МСКТ или МРТ), вычитают 20% и вычисляют площадь поверхности левого предсердия. Во время операции на открытом сердце выбирают зону редукции и вычисляют площадь зоны редукции, это значение вычитают из площади поверхности левого предсердия до редукции и по остатку вычисляют ожидаемый после редукции объем левого предсердия, полученный объем сравнивают с желаемым и делают вывод о необходимости редукции выбранной зоны и продолжении редукции. Проводят редукцию, выбирают новый участок редукции и вычисляют его площадь. Затем вышеописанный алгоритм повторяют и делают вывод о необходимости дальнейшей редукции.
Предлагаемая методика технически проста, не требует дополнительного оборудования. В отличие от прототипа позволяет точно определять объем предсердия на остановленном и разгруженном сердце в ходе операции, на каждом ее этапе. Это позволяет добиться контролируемого уменьшения объема левого предсердия до нормального, что приводит к увеличению дыхательных объемов, уменьшению времени искусственной вентиляции легких после операции, уменьшению количества осложнений, связанных с дыханием (трахеобронхиты, пневмонии, ателектазы). Также нормализация объема левого предсердия ведет к уменьшению вероятности расстройств гемодинамики после операции - уменьшается потребность в инотропной поддержке и ее продолжительность. Нормализация объема левого предсердия ведет к увеличению скорости кровотока и ликвидации застойных зон в его полости, что ведет к снижению вероятности тромбообразования и уменьшению количества тромбоэмболических эпизодов. Все перечисленные положительные моменты позволяют снизить смертность, уменьшить сроки стационарного лечения, уменьшить количество принимаемых лекарственных препаратов, улучшить качество жизни пациентов в отдаленном периоде. Метод не связан с воздействием на организм человека магнитных полей и ионизирующего излучения.
Способ осуществляется следующим образом. Определяют рост и вес больного. Рассчитывается площадь поверхности тела пациента: Sтела=√((вес (кг)*рост (см))/3600). Рассчитывается индивидуальный, нормальный для данного пациента, объем предсердия: Sтела(м2)*41=VN (мл). Он потребуется в дальнейшем для сравнения с ним расчетного объема предсердия. Результат заносится в протокол (таблица 1).
Накануне операции определяется объем левого предсердия методом ЭХО-КГ. Результат заносится в протокол (исходные V и S предсердия). Из исходного объема предсердия вычитается 20% (уменьшение левого предсердия за счет ликвидации гемодинамической нагрузки после коррекции порока и за счет ушивания атриотомного разреза), получаем объем (V1) и на основании его вычисляем площадь поверхности (S1) предсердия (это те параметры, которые получатся в случае коррекции митрального порока без атриопластики). Результат также заносится в протокол.
В процессе выполнения процедуры производится ряд последовательных действий (фиг.1, 2 и 3). Оператор измеряет размеры первой зоны редукции (далее зона 1) при помощи длинного пинцета и линейки (пинцет используется в качестве циркуля), называет их помощнику, который осуществляет расчеты.
| Таблица 1 | |||
| Протокол расчетов | |||
| Протокол расчета объема левого предсердия | |||
| ФИО: | |||
| Дата: | |||
| Рост = см | Вес = кг | Sтела = м2 | Нормальный объем ЛП(VN) = мл |
| Исходный объем ЛП(V) = мл | |||
| Объем и площадь поверхности ЛП без атриопластики: | |||
| V1 = мл | S1 = см2 | ||
| А = см | Б = см | V2 = мл | |
| В+Д = см | Г = см | V3 = мл | |
| Е = см | Ж = см | V4 = мл | |
| Ж+И = см | З = см | V5 = мл | |
| К = см | Д = см | И = см | |
| V6 = мл | |||
| Подпись ( ) |
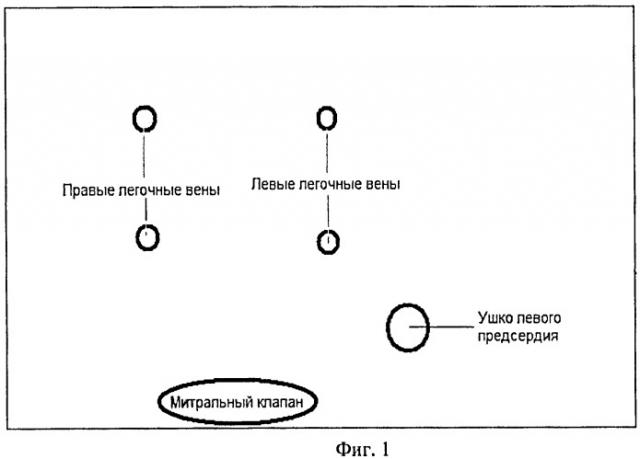
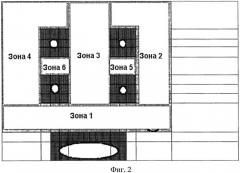
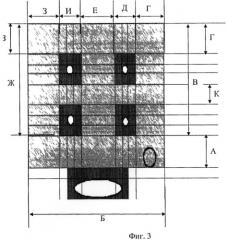
На фиг.1 изображена схема анатомических ориентиров левого предсердия. На фиг.2 представлена схема левого предсердия, указаны зоны редукции с номерами. На фиг.3 представлена схема образований левого предсердия, темно-серым цветом обозначены зоны отступа, светло-серым цветом обозначены зоны редукции предсердия, буквами обозначены размеры конкретных зон.
Суть расчетов: Длина первой зоны редукции (Б) умножается на ее ширину (А). Получается площадь поверхности зоны 1 (Sзоны 1). Из площади поверхности предсердия (S1) вычитается площадь поверхности зоны 1, получается площадь поверхности левого предсердия после его пластики в зоне 1 (S2). Площадь поверхности левого предсердия после его пластики в зоне 1 подставляется в формулу V=4,187*(√(S/12,56))3 и вычисляется объем левого предсердия после атриопластики в зоне 1 (V2).
A*B=Sзона 1
S1-Sзона 1=S2
V2=4,187*(√(S2/12,56))3.
Объединив формулы, получаем V2=4,187*(√((S1-A*B)/12,56))3.
Рассчитав V2, помощник сообщает его значение оператору, который осуществляет сравнение V2 и VN, принимает решение о необходимости атриопластики в зоне 1 и в других зонах. Выполняется пластика предсердия в зоне 1 (парааннулярная зона) и выбирается следующая зона. Данный алгоритм повторяется до тех пор, пока не будет достигнут необходимый объем предсердия, либо будет отсутствовать техническая возможность продолжения процедуры (натяжение тканей, необходимость сохранения проводящих путей и т.п.).
В случае продолжения процедуры оператор измеряет вторую зону редукции левого предсердия (далее зона 2). Значения длины зоны 2 (В+Д) и ее ширины (Г) сообщаются помощнику, который вычисляет S3 по формуле S3=S2-(В+Д)*Г, затем вычисляет V3 по формуле V3=4,187*(√((S2-(В+Д)*Г)/12,56))3. Значение V3 сообщается оператору, который осуществляет его сравнение с VN, на основании чего принимается решение о необходимости продолжения атриопластики в зоне 2 и в остальных зонах, выполняется пластика в зоне 2.
В случае продолжения атриопластики оператор измеряет длину (Ж) и ширину (Е) третьей зоны редукции левого предсердия (далее зона 3), сообщает их значения помощнику. Помощник вычисляет значение S4 по формуле S4=S3-Ж*Е и значение V4=4,187*(√((S3-(Ж*Е)/12,56))3. Значение V4 сообщается оператору, который проводит сравнение V4 и VN, принимает решение о необходимости пластики предсердия в зоне 3 и в других зонах, осуществляет атриопластику в зоне 3.
В случае продолжения атриопластики оператор измеряет длину (Ж+И) и ширину(З) зоны 4, сообщает их значения помощнику. Помощник вычисляет значение S5, по формуле S5=S4-(Ж+И)*З и V5, по формуле V5=4,187*(√((S4-(Ж+И)*З)/12,56))3. Значение V5 сообщается оператору, который принимает решение о необходимости дальнейшей пластики предсердия на основании сравнения V5 и VN. При необходимости выполняется атриопластика в зоне 4.
В случае необходимости дальнейшего уменьшения объема левого предсердия оператор измеряет длину и ширину зоны 5 (Д и К) и зоны 6 (И и К), сообщает их помощнику, который рассчитывает значение S6 по формуле S6=S5-(Д*К+И*К) и V6, по формуле V6=4,187*(√(S6/12,56))3. Значение V6 сообщается оператору, который сравнивает его с VN и принимает решение о необходимости атриопластики в зонах 5 и 6 (теоретически существует возможность пластики межпредсердной перегородки).
После выполнения атриопластики во всех указанных зонах внутреннюю поверхность левого предсердия составляют межпредсердная перегородка, легочные вены и митральный клапан с зонами отступа.
Теоретически, если диаметр каждой легочной вены = 10 миллиметров, диаметр фиброзного кольца митрального клапана = 40 миллиметров, диаметр межпредсердной перегородки = 50 миллиметров, отступ от легочных вен и фиброзного кольца митрального клапана составляет 10 миллиметров, то диаметр предсердия, стенка которого образована указанными образованиями составляет 40 миллиметров (норма).
Технология измерений (фиг.3): Значение "A" получают путем измерения расстояния между нижними легочными венами и фиброзным кольцом митрального клапана, из которого вычитается ширина двух зон отступа (20 миллиметров). Значение "Б" получают путем измерения расстояния от ушитого ушка левого предсердия до нижнего края атриотомного разреза. Значение "В+Д" получают путем измерения расстояния от ушитого ушка левого предсердия до верхнего края атриотомного разреза (по стенке левого предсердия между левыми легочными венами и межпредсердной перегородкой). Значение "Г" получают путем измерения расстояния между левыми легочными венами и межпредсердной перегородкой, из которого вычитают ширину зоны отступа от легочных вен (10 миллиметров). Значение "Е" получают путем измерения расстояния между правыми и левыми легочными венами, из которого вычитают ширину зон отступа (20 миллиметров). Значение "Ж" получают путем измерения расстояния от парааннулярного шва до верхнего края атриотомного разреза. Значение "З" получают путем измерения расстояния между правыми легочными венами и межпредсердной перегородкой, из которого вычитается ширина зоны отступа. Значение "Ж+И" получают путем измерения расстояния от верхнего до нижнего края атриотомного разреза (по задней стенке предсердия между межпредсердной перегородкой и правыми легочными венами). Значение "К" получают путем измерения расстояния между верхними и нижними легочными венами, из которого вычитается ширина зон отступа (20 миллиметров). Расстояние "Д" определяют путем измерения расстояния между швами в зонах 2 и 3. Расстояние "И" измеряется между швами в зонах 3 и 4.
Мы исходили из следующих теоретических предпосылок:
1. В норме индекс объема левого предсердия (отношение объема левого предсердия к площади поверхности тела человека) составляет 41 мл/м2.
2. После радикальной коррекции порока митрального клапана происходит уменьшение объема левого предсердия за счет снижения градиента давления на клапане и/или регургитации. Согласно многочисленным наблюдениям указанное уменьшение объема предсердия составляет в среднем 20%. Сюда же включается уменьшение объема предсердия за счет захвата его стенки в шов предсердия.
3. Левое предсердие представляет собой образование сложной формы, которая индивидуальна в каждом конкретном случае. На фоне существующего порока митрального клапана, по мере увеличения объема левого предсердия, его форма приближается к сферической.
4. Редукция полости левого предсердия независимо от метода (пликация, резекция), по сути своей является уменьшением площади поверхности стенки предсердия.
5. При выполнении редукции левого предсердия методом пликации по Кавазо - зона пликации представляет собой прямоугольник. При резекционных методах редукции резецируемые участки имеют форму эллипса (краевая резекция), треугольника (пластика по Синатра), прямоугольника и иную (аутотрансплантация сердца).
6. Существуют математические формулы, позволяющие описать площадь всех вышеперечисленных геометрическх фигур, а следовательно, имеется возможность рассчитать параметры необходимой хирургической процедуры уменьшения левого предсердия для достижения заданного результата.
7. Существуют общеизвестные хирургические принципы выполнения пликационной атриопластики, согласно которым рекомендуется отступать от устьев легочных вен и фиброзного кольца митрального клапана не менее 10 миллиметров, во избежание деформации указанных структур, повреждения коронарных артерий и проводящих путей (фиг.3).
Для упрощения расчетов форма левого предсердия считается сферической. Реально измеренные диаметры предсердия во взаимно перпендикулярных плоскостях в расчетах не используются. Единственный реальный параметр, используемый при расчетах - объем ЛП, который определяется любым современным методом (ЭХО-КГ, ЯМРТ, МСКТ). Зоны атриопластики считаются прямоугольными. Необходимые формулы:
Объем сферы: V=4/3*π*r3; откуда r=3√(V/4,187).
Площадь поверхности сферы: S=4*π*r2=12,56*(3√(V/4,187))2; отсюда V=4,187*(√(S/12,56))3. Это основные рабочие формулы.
Площадь поверхности эллипса: S=π*a*b.
Площадь поверхности прямоугольника: S=a*b.
Площадь поверхности прямоугольного треугольника: S=a*b/2.
Простые расчеты показывают, что выполнение атриопластики во всех указанных зонах (Фиг.3) всегда позволяет добиться нормального размера предсердия.
Процедура пластики левого предсердия выполнена 137 пациентам в нашем центре, из них описанная методика использована у 10 пациентов. Результаты лечения указанных 10 пациентов (исследуемая группа) сравнивались с аналогичными результатами у остальных 127 пациентов, которые составили контрольную группу. Применение нашего метода контроля позволило у всех 10 пациентов исследуемой группы получить итоговый объем левого предсердия, близкий к расчетному VN. Погрешность (разница полученного объема предсердия и VN) составила в исследуемой группе 20±7%, по результатам измерений объема левого предсердия методом транспищеводной ЭХО-КГ после операции. В контрольной группе разница полученного объема левого предсердия и VN составила 150±78% (в подавляющем большинстве случаев полученные размеры левого предсердия превышали VN). Время пережатая аорты состоит из времени выполнения клапанной коррекции и пластики левого предсердия и зависит от количества клапанов, которые подверглись коррекции, характера коррекции, объема процедуры редукции левого предсердия (или в одной зоне, или во всех шести). У 127 пациентов время пережатая аорты составило 34-206 минут. Применение предлагаемого способа увеличивало время пережатая аорты на 1.5-5 мин. Среднее время искусственной вентиляции легких после окончания операции в исследуемой группе составило 6±2 часов, в контрольной группе - 12±7 часов. Дыхательных и тромбоэмболических осложнений на госпитальном этапе не было ни у кого из 10 пациентов исследуемой группы. В контрольной группе у 13 (10,2%) пациентов были отмечены дыхательные осложнения и у 5 (4%) пациентов различного рода тромбоэмболии. У 3 (30%) больных исследуемой группы отсутствовала потребность в инотропной поддержке, в контрольной группе инотропная поддержка не требовалась у 12 (9,4%) больных. У остальных 7 (70%) больных исследуемой группы дозы инотропной поддержки не превышали 0,05 мкг/кг*мин (микрограмм на килограмм массы тела в минуту) адреналина и 5 мкг/кг*мин допмина. В контрольной группе превышение указанных доз инотропных препаратов наблюдалось у 51 (40%) пациента. Общая длительность инотропной поддержки в исследуемой группе составила 12±6 часов, в контрольной группе - 24±17 часов. Смертельных исходов в исследуемой группе не было, в контрольной группе погибли 3 (2,3%) пациента.
Способ контроля результатов редукции полости левого предсердия путем определения размеров левого предсердия до и после редукции, отличающийся тем, что дополнительно до операции определяют рост и вес пациента, рассчитывают площадь поверхности его тела и индивидуальный, нормальный для данного пациента, объем левого предсердия, по инструментально определенному объему левого предсердия, после уменьшения этого значения на 20%, вычисляют его площадь поверхности до редукции, во время операции на открытом сердце выбирают участок редукции, вычисляют его площадь, это значение вычитают из площади поверхности левого предсердия до редукции и по остатку вычисляют получившийся после редукции объем левого предсердия, полученный объем сравнивают с желаемым и оценивают необходимость редукции выбранной зоны и продолжения редукции, в случае необходимости проводят редукцию выбранной зоны, выбирают новый участок редукции, вычисляют его площадь и повторяют вышеописанный алгоритм, а в случае, если редукция не нужна, то процедуру атриопластики прекращают.