Фармацевтические лекарственные формы и композиции фенилэфрина для абсорбции в ободочной кишке
Иллюстрации
Показать всеИзобретение раскрывает фармацевтическую композицию, подходящую для перорального введения. Фармацевтическая композиция содержит ядро, содержащее полимерную матрицу контролированного высвобождения, включающую гидроксипропилцеллюлозу и натриевую соль карбоксиметилцеллюлозы, и фенилэфрин или его фармацевтически приемлемую соль, и поддающийся эрозии слой, необязательно, содержащий фенилэфрин или его фармацевтически приемлемую соль. При приеме субъектом композиции внутрь полимерная матрица контролированного высвобождения из указанных компонентов обеспечивает нулевой или близкий к нулю порядок высвобождения фенилэфрина или его фармацевтически приемлемой соли, и по меньшей мере, часть фенилэфрина абсорбируется в ободочной кишке субъекта. Фармацевтическая композиция может, кроме того, содержать один или более дополнительных терапевтически активных агентов, выбранных из группы, состоящей из антигистамина, анальгетика, жаропонижающего средства и нестероидного противовоспалительного средства. Изобретение обеспечивает улучшенную биодоступность фенилэфрина и приводит к продолжительным концентрациям в плазме активного фенилэфрина при однократном болюсном введении препарата. 2 н. и 83 з.п. ф-лы, 8 ил., 18 табл.
Реферат
Уровень техники
Фенилэфрин и его фармацевтически приемлемые соли признаются специалистами в данной области техники в качестве назальных деконгестантов, безопасных и эффективных для человека при введении с частыми интервалами. Доступные для приобретения лекарственные формы включают назальный гель, назальные капли и назальный спрей (то есть назальные капли Alconefrin® или назальный гель Neo-Synephrine®), так же как и пероральные таблетки или желатиновые капсулы немедленного высвобождения (то есть Sudafed РЕ™ или жидкие капсулы DayQuil®). Благодаря короткому периоду полураспада in vivo активной формы фенилэфрина в плазме, фенилэфрин и его фармацевтически приемлемые соли, в виде существующих в настоящее время лекарственных форм, как правило, вводятся каждые четыре часа для облегчения заложенности носа.
Таким образом, существует неудовлетворенная потребность в менее частой доставке фенилэфрина для удобства пациента и в продолжительном наличии терапевтически активного фенилэфрина в организме субъекта, нуждающегося в таком введении.
Менее частое введение приводит к более точному соблюдению больными соответствующих режимов введения. Кроме того, постоянные терапевтические уровни активных компонентов в плазме могут быть более эффективными и даже действенными по сравнению с колебаниями, наблюдаемыми при введении многократных доз обычной лекарственной формы немедленного высвобождения, при условии продолжительных эффективных уровней и уменьшения серьезности и частоты побочных эффектов от высоких пиковых уровней в плазме. Таким образом, лекарственные формы, содержащие фенилэфрин, которые могут вводиться менее часто, например один раз за каждые 8, 12, 16, 20 или 24 часа, необходимы.
Краткое изложение сущности изобретения
Данное изобретение предоставляет композиции и способы эффективной доставки фенилэфрина с обеспечением улучшенной и стабильной биодоступности, которые обеспечивают эффективный фенилэфрин в дополнение к повышенному удобству. Изобретение отчасти основано на наблюдении изобретателей, что фенилэфрин эффективно абсорбируется из ободочной кишки, и их оценки, что лекарственные формы, которые позволяют абсорбцию из ободочной кишки, будут обеспечивать более высокую долю фенилэфрина, оставшегося в терапевтически активной несвязанной форме, по сравнению с лекарственными формами, позволяющими абсорбцию из верхних отделов желудочно-кишечного (ЖК) тракта. Введение лекарственной формы, обеспечивающей абсорбцию из ободочной кишки, имеет дополнительное преимущество благодаря продолжительным концентрациям в плазме активного фенилэфрина при однократном болюсном введении препарата.
В одном объекте изобретение предоставляет фармацевтические композиции, подходящие для перорального введения, содержащие фенилэфрин или его фармацевтически приемлемую соль, в которых фенилэфрин сделан доступным для абсорбции из ободочной кишки. В одном варианте выполнения изобретения композиция находится в виде твердой лекарственной формы, содержащей: ядро, содержащее фенилэфрин или его фармацевтически приемлемую соль, и поддающийся эрозии слой, инкапсулирующий ядро, где состав и толщина поддающегося эрозии слоя являются такими, что ядро обнажается, когда композиция поступает в ободочную кишку или приблизительно в то время, когда композиция достигает ободочной кишки.
В определенных вариантах выполнения изобретения поддающийся эрозии слой содержит полимерную матрицу. В других вариантах выполнения изобретения поддающимся эрозии слоем является покрывающий слой. В одном объекте поддающимся эрозии слоем является полимерная матрица определенного состава и толщины, так что слой разрушается через определенное количество времени. В другом объекте поддающимся эрозии слоем является полимерная матрица или покрывающий слой определенного состава, который разрушается при взаимодействии с определенной средой. В определенных вариантах выполнения изобретения поддающийся эрозии слой разрушается при определенном значении рН. В других вариантах выполнения изобретения поддающийся эрозии слой содержит субстраты, специфичные к ободочной кишке, и разрушается в ободочной кишке. В определенных вариантах выполнения изобретения субстрат, специфичный к ободочной кишке, разрушается в присутствии специфичных для ободочной кишки ферментов, но не во время прохода через верхние отделы пищеварительного тракта, включая желудок и/или тонкую кишку. В другом объекте изобретение предоставляет фармацевтические композиции, подходящие для перорального введения, содержащие фенилэфрин или его фармацевтически приемлемую соль, в которых фенилэфрин сделан доступным для абсорбции из всех отделов ЖК тракта, включая двенадцатиперстную кишку, тощую кишку, подвздошную кишку и ободочную кишку. Определенными вариантами выполнения изобретения являются фармацевтические композиции, разработанные в виде единичной лекарственной формы для доставки фенилэфрина или его фармацевтически приемлемой соли в организм субъекта, нуждающегося в этом, с обеспечением максимума концентрации неметаболизированного фенилэфрина в плазме (вышеупомянутого субъекта) в промежутке от около 0.1 до 16 часов после приема композиции внутрь, и где неметаболизированный фенилэфрин поддерживается на уровне, превышающем 0.1 нг/мл, на момент около 6, 8, 12, и/или 24 часов после приема композиции внутрь.
В определенных вариантах выполнения изобретения поддающийся эрозии слой (слои) и/или другая составная часть(и) композиции, отличная(ые) от ядра, содержит(ат) фенилэфрин или его фармацевтически приемлемую соль. Например, помимо ядра, содержащего фенилэфрин или его фармацевтически приемлемую соль, фенилэфрин так же распределен в поддающемся эрозии слое, содержащем полимерную матрицу. Полимерная матрица содержит фенилэфрин или его фармацевтически приемлемую соль, включенные в состав лекарственной формы для их немедленного высвобождения.
В определенных вариантах выполнения изобретения композиция, кроме того, содержит энтеральное покрытие и/или верхние покрытие, где функцией верхнего покрытия является улучшение внешнего вида или вкусовых качеств лекарственной формы.
В одном варианте выполнения изобретения композиция представляет собой лекарственную форму в виде капсулы, где фенилэфрин или его фармацевтически приемлемая соль заключены в капсулу, которая выгружает свое содержимое при поступлении в ободочную кишку или приблизительно в момент достижения ободочной кишки. В одном варианте выполнения изобретения композиция представляет собой лекарственную форму в виде капсулы, где фенилэфрин или его фармацевтически приемлемая соль заключены в капсулу, которая выгружает часть своего содержимого, когда композиция поступает в ободочную кишку.
В одном варианте выполнения изобретения лекарственная форма в виде капсулы, кроме того, включает фенилэфрин или его фармацевтически приемлемую соль для их немедленного высвобождения и/или один или более дополнительных терапевтических агентов для их немедленного или пролонгированного высвобождения.
В еще одном варианте выполнения изобретения фармацевтическая композиция изобретения представляет собой контейнер с механизмом высвобождения. Такая структура состоит из нерастворимого в воде контейнера, содержащего в себе фенилэфрин или его фармацевтически приемлемую соль, и пробки. Пробка удаляется через заданное время запаздывания вследствие набухания, эрозии или растворения.
В еще одном варианте выполнения изобретения фармацевтическая композиция изобретения по своей структуре разработана в виде порошка, перорального геля, эликсира, дисперсных гранул, сиропа, суспензии или тому подобного. В одном варианте выполнения изобретения, в котором фармацевтическая композиция изобретения по своей структуре разработана в виде порошка, суспензия из такого порошка может быть замешена непосредственно перед применением.
В одном варианте выполнения изобретения фармацевтическая композиция изобретения разработана так, что подходит для педиатрического применения.
В одном варианте выполнения изобретения фармацевтическая композиция, кроме того, содержит один или более дополнительных терапевтических агентов. Такой агент или агенты может (могут) быть добавлен(ны) в лекарственную форму для его (их) немедленного высвобождения при принятии внутрь, пролонгированного высвобождения или высвобождения в ободочной кишке одновременно с фенилэфрином, или для любой комбинации вышеперечисленного. Дополнительным терапевтическим агентом может быть деконгестант, жаропонижающее средство, противовоспалительное средство, супрессант кашля, отхаркивающее средство, анальгетик или любой другой терапевтический агент или комбинация таких агентов, полезная для облегчения симптомов простуды, сезонной или другой аллергии, сенной лихорадки или проблем с синусом, любые из которых могут вызвать усиление выделений из носа.
Другим объектом изобретения является метод лечения симптомов простуды, гриппа, аллергии или неаллергического ринита у субъекта, нуждающегося в этом, включающий введение композиции изобретения. В определенных вариантах выполнения изобретения композиция вводится каждые 8, 12, 16, 20 или 24 часа. В одном предпочтительном варианте выполнения изобретения композиция вводится каждые 12 часов.
Другим объектом изобретения являются способы введения фенилэфрина, включающие доставку фенилэфрина в ободочную кишку субъекта. Примерные композиции, полезные для этих способов, описаны выше. В определенных вариантах выполнения изобретения таким способом является способ, в котором максимальная концентрация несвязанного фенилэфрина в плазме субъекта достигается в промежутке от около 5 до около 24 часов после введения, и более предпочтительно, в промежутке от около 6 до около 12 часов после введения.
Определенными вариантами выполнения изобретения являются способы, поддерживающие стабильную биодоступность фенилэфрина в организме субъекта, содержащие пероральное введение в организм субъекта композиции, содержащей фенилэфрин или его фармацевтически приемлемую соль, где, по меньшей мере, часть фенилэфрина абсорбируется из ободочной кишки, и где концентрация несвязанного фенилэфрина в плазме субъекта составляет, по меньшей мере, 0.1, 0.5, 1.0 или 2.5 нг/мл на момент 6 часов после введения композиции. В конкретных вариантах выполнения изобретения концентрация несвязанного фенилэфрина в плазме субъекта составляет, по меньшей мере, 0.1, 0.5, 1.0 или 2.5 нг/мл на момент 12 часов после введения композиции. В конкретных вариантах выполнения изобретения концентрация несвязанного фенилэфрина в плазме субъекта составляет, по меньшей мере, 0.1, 0.5, 1.0 или 2.5 нг/мл на момент 24 часов после введения композиции. Другими определенными вариантами выполнения изобретения являются способы введения фенилэфрина в организм субъекта, содержащие пероральное введение в организм субъекта композиции, содержащей фенилэфрин или его фармацевтически приемлемую соль, причем вышеупомянутая композиция доставляет фенилэфрин в ободочную кишку, где фенилэфрин высвобождается в ободочную кишку и абсорбируется из ободочной кишки, таким образом, достигая относительного AUC0-24 (определяемого как процентное отношение значения AUC0-24 для несвязанного фенилэфрина к значению AUC0-24 для всего (то есть несвязанного + связанного) фенилэфрина в плазме субъекта (смотрите абзац [0049] для примерных способов определения)), по меньшей мере, 1, 2 или 6%. В одном варианте выполнения изобретения процентное отношение значения AUC0-24 для несвязанного фенилэфрина к значению AUC0-24 для всего фенилэфрина в плазме субъекта составляет, по меньшей мере, от около 1 до около 14%. В одном варианте выполнения изобретения процентное отношение значения AUC0-24 для несвязанного фенилэфрина к значению AUC0-24 для всего фенилэфрина в плазме субъекта составляет, по меньшей мере, от около 2 до около 10%.
В еще одном варианте выполнения изобретения композиция включает двухслойную таблетку со слоем немедленного высвобождения и слоем пролонгированного высвобождения.
Как будет понятно специалистам в данной области техники после прочтения данного описания изобретения, поддающийся эрозии слой фармацевтических композиций данного изобретения обеспечивает пролонгированное или контролированное высвобождение фенилэфрина, доставляя в организм субъекта терапевтически эффективное количество в течение 8, 12, или 24 часов. В предпочтительных вариантах выполнения изобретения данные фармацевтические композиции, кроме того, содержат дополнительное количество фенилэфрина в части немедленного высвобождения, доставляющей количество фенилэфрина при введении в организм субъекта.
В определенных вариантах выполнения изобретения предпочтительно иметь оба вида высвобождения, то есть немедленное высвобождение фенилэфрина, которое обеспечивает первоначальный всплеск, сопровождаемое пролонгированным высвобождением фенилэфрина в ободочной кишке в течение 6, 8, 12, 16 или 24 часов. Так же, в определенных вариантах выполнения изобретения, предпочтительно иметь немедленное высвобождение, которое обеспечивает первоначальный всплеск, сопровождаемое пролонгированным высвобождением фенилэфрина в верхних отделах ЖК тракта (то есть тощей кишке и подвздошной кишке) так же как и в ободочной кишке в течение 6, 8, 12, 16 или 24 часов.
Другие объекты изобретения предоставляют способы введения фенилэфрина в организм субъекта, в которых пресистемная трансформация фенилэфрина минимизирована. Любые методы, описанные здесь, могут быть осуществлены на практике, применяя фармацевтическую композицию изобретения.
Данное изобретение может быть более полно понято посредством Фигур, Подробного описания и Примеров, которые следуют ниже.
Краткое описание Фигур
Фиг.1А представляет собой схематическое изображение примерной лекарственной формы с контролируемой продолжительностью эрозии. Фиг.1В представляет собой схематическое изображение гранулированного ядра.
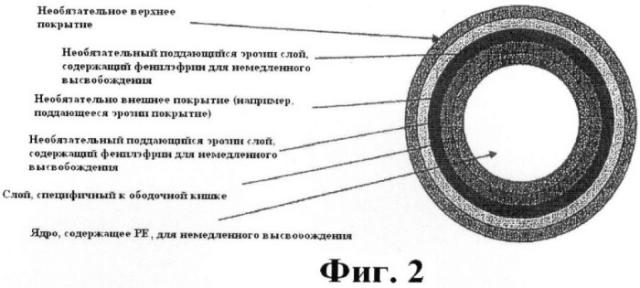
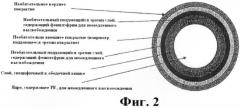
Фиг.2 представляет собой схематическое изображение примерной лекарственной формы с рН-контролируемой эрозией.
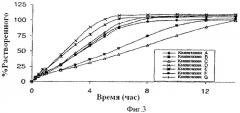
Фиг.3 показывает профиль растворения примерных лекарственных форм A-G.
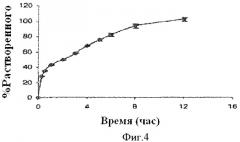
Фиг.4 показывает профиль растворения примерных предпочтительных лекарственных форм, содержащих ядро таблетки с продолжительным высвобождением, компоненты которого включают 22.5 мг гидрохлорида фенилэфрина, и активное покрытие с немедленным высвобождением, инкапсулирующее ядро, компоненты которого включают 7.5 мг гидрохлорида фенилэфрина и 5 мг лоратадина.
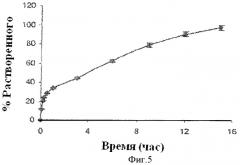
Фиг.5 показывает профиль растворения двухслойной таблетки, содержащей слой фенилэфрина, разработанный для пролонгированного высвобождения, и слой фенилэфрина и лоратадина, разработанный для немедленного высвобождения.
Фиг.6 показывает профили значений концентрации в плазме всего, так же как связанного и несвязанного фенилэфрина. В частности, Фиг.6А показывает полулогарифмический график, и Фиг.6В показывает линейный график. Кроме того, Фиг.6С показывает диаграмму значений Cmax всего, так же как связанного и несвязанного фенилэфрина, достигшего уровня дозы 1 мг, после доставки 10 мг и 30 мг фенилэфрина в ободочную кишку.
Фиг.7 показывает профили симулированных концентраций в плазме для вариантов 10 мг дозы фенилэфрина немедленного высвобождения, так же как и 30 мг дозы фенилэфрина (подробно изложенных в Таблице 17), перекрывающих интервалы, подробно изложенные в Таблице 16.
Фиг.8 показывает профили симулированных концентраций в плазме для вариантов 10 мг дозы фенилэфрина немедленного высвобождения, также как и 30 мг дозы фенилэфрина (подробно изложенных в Таблице 18), перекрывающих интервалы, подробно изложенные в Таблице 16.
Подробное описание изобретения
Определения
В качестве применяемого здесь термин "фармацевтически приемлемая соль фенилэфрина" включает, но без ограничения к этому, гидрохлорид фенилэфрина, битартрат фенилэфрина, таннат фенилэфрина и т.д. В одном предпочтительном варианте выполнения изобретения фармацевтически приемлемой солью фенилэфрина является гидрохлорид фенилэфрина.
Термин "неметаболизированный фенилэфрин" означает фенилэфрин, который не был химически изменен с момента поступления в организм субъекта, за исключением высвобождения свободного основания, то есть фенилэфрин, который не был связан сульфотрансферазой или UDP-глюкуронилтрансферазой. Неметаболизированный фенилэфрин проявляет терапевтическую активность (активности). В этом описании изобретения термин "несвязанный фенилэфрин" используется взаимозаменяемо с термином "Неметаболизированный фенилэфрин" и означает терапевтически активную форму фенилэфрина. "Неметаболизированный фенилэфрин" не включает фенилэфрин, который был однажды инактивирован вследствие связывания, но позже стал несвязанным и не является терапевтически активным.
Термин "пресистемная трансформация", в качестве применяемого здесь в связи с фенилэфрином, означает трансформацию фенилэфрина перед тем, как фенилэфрин захватывается кровотоком и таким образом поступает в плазму. Пресистемная трансформация исключает трансформацию фенилэфрина в печени или внутри кровотока.
Термин "среда в ободочной кишке" или "ободочнокишечная среда", в качестве применяемого здесь, означает среду внутри ободочной кишки, в пищеварительном тракте.
Термин "специфичный для ободочной кишки (к ободочной кишке)", в качестве применяемого здесь, означает типично, преимущественно или исключительно обнаруживаемый в ободочной кишке, связанный с ободочной кишкой или относимый к ободочной кишке, но не каким другим частям пищеварительного тракта.
Термин "дозировка" или "доза", в качестве используемого здесь, означает количество фармацевтической композиции, содержащей терапевтически активный(ые) агент(ы), вводимые одновременно. "Дозировка" или "доза" включает введение одной или более единиц фармацевтической композиции, вводимых одновременно.
Термин "AUC", в качестве применяемого здесь, для любого данного лекарственного средства означает "площадь под кривой концентрация - время" в интервале дозирования или активацию лекарственного средства к моменту времени на графике, вычисленную по формуле трапеций. AUC - это параметр, показывающий кумулятивную концентрацию лекарственного средства в плазме по прошествии времени, и является индикатором общего количества и наличия лекарственного средства в плазме. "AUQ0-t" определяется как AUC для любого значения времени (t) вплоть до 24 часов. В предпочтительном варианте выполнения изобретения t составляет 24 часа (обозначается здесь как AUC0-24). "AUC0-∞" определяется как вычисленное значение AUC, экстраполированное до бесконечности. AUC0-∞ вычисляется как равное AUC0-t+Ct/λz, где Ct обозначает концентрацию в момент 24 часов, и λz означает константу скорости конечной стадии или константу скорости элиминации. Константа скорости конечной стадии или элиминации λz определяется из угла наклона кривой "концентрация лекарственного вещества - время", применяя линейную регрессию по конечным измерительным точкам кривой. "Относительное AUC0-24" определяется как процентное отношение значения AUC0-t для несвязанного фенилэфрина к значению AUC0-t для всего фенилэфрина в плазме субъекта в интервале доз.
Данное изобретение предоставляет композиции и способы действенной и эффективной доставки фенилэфрина, обеспечивающие улучшенную биодоступность и удобство.
Фенилэфрин эффективен при введении через короткие интервалы времени для временного облегчения гиперемии и/или заложенности носа, вызванных простудой, сезонной или другой аллергией, сенной лихорадкой, проблемами синуса или аллергическим и неаллергическим ринитом, которые могут вызвать увеличение выделений из носа. В настоящее время фенилэфрин доступен в виде назальных лекарственных форм и пероральных лекарственных форм для лечения этих недомоганий. Однако пероральные лекарственные формы должны приниматься часто и показывают субоптимальную эффективность из-за короткого периода полураспада фенилэфрина в плазме, около 2 часов, вызванного быстрым метаболизмом активного агента. Кроме того, при введении перорально фенилэфрин быстро абсорбируется из ЖК тракта, но подвергается экстенсивной пресистемной трансформации в слизистой кишечника, что приводит к соединению, превращенному в форму, не являющуюся активной. Пресистемная трансформация фенилэфрина в основном имеет место во время абсорбции из верхних отделов кишечного тракта, то есть тощей кишки или подвздошной кишки, благодаря активностям сульфотрансферазы или UDP-глюкуронилтрансферазы, которые находятся там в большом числе и количестве, по сравнению с более низким отделом ЖК тракта, то есть ободочной кишкой. При проникновении в кровоток фенилэфрин выводится из плазмы через печень.
Без какого-либо намерения ограничиваться каким-либо механизмом, изобретатели предполагают, что быстрое и экстенсивное превращение путем пресистемной трансформации уменьшает эффективную концентрацию фенилэфрина в плазме. На самом деле, введение фенилэфрина каждые 4 часа в виде лекарственной формы с немедленным высвобождением, в форме таблетки ли, капсулы или раствора, как оказывается, имеет субоптимальную эффективность в качестве назального деконгестанта.
Данное изобретение отчасти основано на наблюдении, что абсорбция фенилэфрина из нижнего отдела кишечного тракта, где сульфотрансферазы и UDP-глюкуронилтрансферазы обнаруживаются в небольшом числе и количествах, увеличивает биодоступность фенилэфрина на фактор, равный трем, по сравнению с биодоступностью, измеренной для перорального введения фенилэфрина в форме немедленного высвобождения. Известно, что перорально вводимая лекарственная форма достигает илеоцекального соединения в организме здорового взрослого человека в среднем за около 5 часов и поступает в ободочную кишку в среднем через около 6-8 часов. В общем, интервал достижения перорально вводимой лекарственной формой ободочной кишки составляет от около 2 часов до около 8 часов. В среднем время пребывания принятого внутрь вещества в ободочной кишке здорового взрослого человека составляет от 12 до 24 часов. Кроме того, благодаря ограниченной проходимости слизистой мембраны ободочной кишки и времени пребывания проглоченных веществ в ободочной кишке, болюсное введение одного или более дополнительных терапевтических агентов, которые могут быть абсорбированы из ободочной кишки, может привести к продолжительным уровням в плазме такого агента, абсорбированного из ободочной кишки. Весьма увеличенная абсорбция несвязанного фенилэфрин из ободочной кишки намного превышает ту, которая может быть ожидаема при сравнении с абсорбцией из ободочной кишки других активных терапевтических агентов, которые, как известно, являются субъектом для подобной пресистемной трансформации.
Фармацевтические композиции
В одном объекте изобретение предоставляет фармацевтические композиции, подходящие для перорального введения, содержащие фенилэфрин или его фармацевтически приемлемую соль, в которых фенилэфрин сделан доступным для абсорбции из ободочной кишки. Определенными вариантами выполнения изобретения являются фармацевтические композиции, приготовленные в единичной лекарственной форме для доставки фенилэфрина или его фармацевтически приемлемой соли в организм субъекта, нуждающегося в этом, причем такая доставка приводит к обнаруживаемому неметаболизированному фенилэфрину в плазме субъекта через около 5 часов после принятия вышеупомянутым субъектом композиции внутрь. В других вариантах выполнения изобретения неметаболизированный фенилэфрин обнаруживается через около 6, 8, 12, 16, 20 или 24 часа после принятия вышеупомянутым субъектом композиции внутрь. Наличие фенилэфрин в плазме субъекта определяется посредством способов, применяемых специалистами в данной области техники для определения содержания всего фенилэфрина и несвязанного фенилэфрина в плазме.
Примерные способы для определения общего фенилэфрина и несвязанного фенилэфрина описываются в следующих работах: K.Gumbhir. An Investigation of Pharmacokinetics of Phenylephrine and its Metaboiites in Humans, PhD-диссертация по фармацевтическим наукам Миссурийского университета в Канзас-Сити (1993); K. Gumbhir и W.D. Mason. Determination of m-hydroxymandelic acid, m-hydroxyphenyiglycol and their conjugates in human plasma using liquid chromatography with electrochemical detection. Журнал «Journal of Pharmaceutical and Biomedical Analysis» 12: 943-949 (1994); J.H.Hengstmannand J.Goronzy. Pharmacokinetics of 3H-Phenylephrine in Man. Журнал «European Journal of Clinical Pharmacology» 21: 335-341 (1982); V.Vumaand I.Kanfer. High-performance liquid chromatographic determination of phenylephrine in human serum with coulometric detection. Журнал «Journal of Chromatography» 678: 245-252 (1996); M.Yamaguchi, H.Monji, I.Aoki, and T.Yashiki. High Performance liquid chromatographic determination of phenylephrine in human serum using coulometric switching flourescence detection. Журнал «Journal of Chromatography B.» 661: 93-99 (1994); A.Stockis, X.Deroubaix, B.Jeanbaptiste, R.Lins, A.M.Allemon, and H.Laufen. Relative Bioavailability of Carbinoxamine and Phenylephrine from a Retard Capsule after Single and Repeated Dose Adminstration in Healthy Subjects. Arzneim. - Forsch./Drug Res. 45: 1009-1012 (1995); A.Martinsson, S.Bevegard, and P.Hjemdahl. Analysis of Phenylephrine in Plasma: Initial Data About Concentration-Effect Relationship. Журнал «European Journal of Clinical Pharmacology» 30: 427-431 (1986); все из которых включены здесь путем ссылки. Количество связанного фенилэфрина может быть вычислено путем вычитания оцененного количества несвязанного фенилэфрина из оцененного количества всего фенилэфрина.
Определенными вариантами выполнения изобретения являются фармацевтические композиции, созданные в виде единичной лекарственной формы для доставки фенилэфрина или его фармацевтически приемлемой соли в организм субъекта, нуждающегося в этом, так что несвязанный фенилэфрин обнаруживается в плазме субъекта в течение, по меньшей мере, 4.5 часов после принятия вышеупомянутым субъектом композиции внутрь. В других вариантах выполнения изобретения неметаболизированный фенилэфрин обнаруживается в течение, по меньшей мере, около 5, 6, 8, 12, 16, 20 или 24 часов после принятия композиции внутрь.
В некоторых вариантах выполнения изобретения композиция создается в виде лекарственной формы для доставки, по меньшей мере, части фенилэфрина в ободочную кишку субъекта. В других вариантах выполнения изобретения помимо доставки части фенилэфрина в ободочную кишку субъекта композиция выполнена в виде такой лекарственной формы, что, кроме того, пролонгированное высвобождение фенилэфрина достигается в верхних отделах ЖК тракта субъекта. В других вариантах выполнения изобретения, помимо доставки части фенилэфрина в ободочную кишку субъекта, композиция выполнена в виде такой лекарственной формы, что, кроме того, немедленное высвобождение фенилэфрина достигается в верхних отделах ЖК тракта субъекта. В еще одних вариантах выполнения изобретения помимо доставки части фенилэфрина в ободочную кишку субъекта композиция выполнена в виде такой лекарственной формы, что, кроме того, как немедленное высвобождение, так и пролонгированное высвобождение фенилэфрина достигается в верхних отделах ЖК тракта субъекта. Во всех вариантах выполнения изобретения по доли это составляет около 5-95% от количества введенного фенилэфрина или его фармацевтически приемлемой соли. В конкретных вариантах выполнения изобретения доля составляет около 5, 10, 20, 25, 30, 50, 67, 75, 90 или 95% от количества введенного фенилэфрина или его фармацевтически приемлемой соли. В определенных вариантах выполнения изобретения доля составляет около 1/4, 1/5, 3/4 или 9/10 количества введенного фенилэфрина или его фармацевтически приемлемой соли. В других вариантах выполнения изобретения доля составляет около 17, 42, 45, 50, 54 или 61% от количества введенного фенилэфрина или его фармацевтически приемлемой соли. Предпочтительно доля составляет около 5-20% от количества введенного фенилэфрин или его фармацевтически приемлемой соли. Более предпочтительно доля составляет около 10-15% от количества введенного фенилэфрина или его фармацевтически приемлемой соли.
В одном объекте изобретение предоставляет фармацевтические композиции, подходящие для перорального введения, содержащие фенилэфрин или его фармацевтически приемлемую соль, в которых фенилэфрин сделан доступным для абсорбции из всех отделов ЖК тракта, включая двенадцатиперстную кишку, тощую кишку, подвздошную кишку и ободочную кишку. Определенными вариантами выполнения изобретения являются фармацевтические композиции, созданные в виде единичной лекарственной формы для доставки фенилэфрина или его фармацевтически приемлемой соли в организм субъекта, нуждающегося в этом, причем такая доставка приводит к тому, что субъект показывает максимум концентрации неметаболизированного фенилэфрина в плазме в промежутке от около 0.1 до 16 часов после принятия композиции внутрь, и неметаболизированный фенилэфрин поддерживается на уровне, превышающем 0.1 нг/мл, в течение около 6, 8, 12 и/или 24 часов после принятия композиции внутрь. Например, в определенных вариантах выполнения изобретения субъект показывает максимум концентрации неметаболизированного фенилэфрина в плазме между около 0.1 и 14 часами, 0.1 и 12 часами, 0.1 и 10 часами, 0.1 и 8 часами, 0.1 и 6 часами, 0.1 и 4 часами, 0.1 и 2 часами после принятия композиции внутрь, и несвязанный фенилэфрин поддерживается на уровне, превышающем 0.1 нг/мл (например, 0.5 нг/мл, 1 нг/мл или 2.5 нг/мл) в течение около 6, 8, 12 и/или 24 часов после принятия композиции внутрь. В одном предпочтительном варианте выполнения изобретения субъект показывает максимум концентрации неметаболизированного фенилэфрина в плазме между около 0.75 и 2 часами после принятия композиции внутрь, и несвязанный фенилэфрин поддерживается на уровне, превышающем 0.1 нг/мл (например, 0.5 нг/мл, 1 нг/мл или 2.5 нг/мл), на момент около 6, 8, 12 и/или 24 часа после принятия композиции внутрь.
В одном предпочтительном варианте выполнения изобретения композиция обеспечивает 12-часовое пролонгированное высвобождение фенилэфрина или его фармацевтически приемлемой соли. В одном варианте выполнения изобретения композиция находится в виде твердой лекарственной формы, содержащей ядро с пролонгированным высвобождением, содержащее фенилэфрин или его фармацевтически приемлемую соль, и покрывающий ядро слой, содержащий фенилэфрин или его фармацевтически приемлемую соль, с немедленным или пролонгированным высвобождением.
В одном варианте выполнения изобретения композиция находится в виде лекарственной формы для доставки более чем 40% от всего фенилэфрина или его фармацевтически приемлемой соли до входа в ободочную кишку. В другом варианте выполнения изобретения композиция находится в виде лекарственной формы для доставки, по меньшей мере, части всего фенилэфрина или его фармацевтически приемлемой соли, предпочтительно более чем 20%, немедленно или в течение 1 часа после принятия внутрь. Более предпочтительно более чем 40% всего фенилэфрина доставляется посредством пролонгированного высвобождения в верхние отделы ЖК тракта субъекта до входа в ободочную кишку. Смотрите, например, варианты доз в Таблицах 16 и 17, где около 33% доставляется в ободочную кишку, конкретно Таблица 17 (вариант дозы: 10 мг IR+10 мг SR+10 мг ободочнокишечного) и Таблица 18 (вариант дозы: 20 мг IR+20 мг SR+20 мг ободочнокишечного). Смотрите так же предпочтительный вариант выполнения изобретения для дозы, содержащей 30 мг фенилэфрина, где около 17% доставляется в ободочную кишку, конкретно 5 мг из 30 мг дозы доставляется в ободочную кишку.
В другом варианте выполнения изобретения композиция находится в виде лекарственной формы для доставки 25% от всего фенилэфрина или его фармацевтически приемлемой соли в форме немедленного высвобождения и 75% всего фенилэфрина или его фармацевтически приемлемой соли в течение 6-8 часов. Смотрите, например, Таблицы 8 и 9. В предпочтительном варианте выполнения изобретения около 10-15% от введенного количества фенилэфрина или его фармацевтически приемлемой соли доставляется в ободочную кишку.
В одном варианте выполнения изобретения композиция содержит ядро, содержащее фенилэфрин или его фармацевтически приемлемую соль, и один или более поддающихся эрозии слоев, которые разрушаются до обнажения ядра и высвобождения фенилэфрина или его фармацевтически приемлемой соли для абсорбции в ободочной кишке. В определенных вариантах выполнения изобретения поддающийся эрозии слой (слои) содержит(ат) покрытие(ия), полимерную(ые) матрицу(ы) и/или оболочку(и), инкапсулирующую(ие) такое ядро. В других вариантах выполнения изобретения поддающийся эрозии слой (слои) включает(ют) матрицу, в которую вставлено ядро.
Понятно, что дополнительные компоненты для содействия фармацевтической композиции и ее улучшения, такие как один или более вязкость модифицирующий агентов, стабилизирующих агентов и суспендирующих агентов, и буферов для поддержания соответствующего рН, известных в данной области техники в качестве фармацевтически приемлемых и обычно применяемых в фармацевтической композиции, добавляются по желанию. Дополнительные фармацевтические эксципиенты, общепринятые и применяемые, обнаруживаются, например, в Remington's Pharmaceutical Sciences (Gennaro, A., ed.), Mack Pub., 1990. Так же, один или более подсластителей, таких как сахароза, сахарин, Сукралоза и т.д., для улучшения вкуса, один или более консервантов, таких как бензоат натрия, и/или пищевой краситель, возможно, но необязательно, добавляются по желанию. Фармацевтические композиции изобретения могут так же содержать любую другую, одну или более добавку, обычно применяемую в лекарственных формах фармацевтических композиций.
Способы создания матриц и покрытий, с или без терапевтически активных агентов внутри таких матриц и покрытий, известны в данной области техники. Например, способы создания пероральных фармацевтических лекарственных форм с контролируемым высвобождением описываются у Gupta and Robinson, "Oral controlled release delivery," Chapter 6 in Treatise on Controlled Drug Delivery, Editor A.Kydonieus, Dekker, N.Y., 1992; и в патенте США №7,163,696 (например, смотрите от раздела 3, строка 22, до раздела 4, строка 53), включенных здесь путем ссылки.
Иллюстративные примеры лекарственных форм или композиций данного изобретения
1) Лекарственная форма с зависимой от времени или контролируемой по продолжительности эрозией.
У воздерживавшегося от пищи здорового взрослого человека желудок опорожняется каждые 45-80 минут, и время прохода от рта до илеоцекального соединения составляет около 5 часов. Поэтому фармацевтическая композиция, содержащая поддающийся эрозии слой, который полностью разрушается через около 5 часов - около 12 часов, предпочтительно через около 6 часов - около 8 часов после принятия внутрь, будет защищать ядро, содержащее фенилэфрин, до тех пор, пока не будет достигнут целевой участок абсорбции в ободочной кишке для высвобождения фенилэфрина.
В одном варианте выполнения изобретения композиция представляет собой твердую лекарственную форму, содержащую: ядро, содержащее фенилэфрин или его фармацевтически приемлемую соль, и поддающийся эрозии слой, инкапсулирующий ядро, и, возможно, но не обязательно, содержащий фенилэфрин или его фармацевтически приемлемую соль, где состав и толщина поддающегося эрозии слоя являются такими, что ядро обнажается, когда композиция поступает в ободочную кишку, или приблизительно в то время, когда композиция достигает синапса ободочной кишки.
В определенных вариантах выполнения изобретения, где поддающийся эрозии слой содержит фенилэфрин или его фармацевтически приемлемую соль, поддающийся эрозии слой высвобождает фенилэфрин или его фармацевтически приемлемую соль для абсорбции на протяжении всего желудочно-кишечного тракта. Например, включение фенилэфрина или его фармацевтически приемлемой соли в один или более поддающихся эрозии слоев и/или внешнее покрытие обеспечивает немедленное высвобождение и/или пролонгированное высвобождение фенилэфрина или его фармацевтически приемлемой соли в верхних отделах желудочно-кишечного тракта, при приеме композиции внутрь, помимо высвобождения фенилэфрина из обнаженного ядра, когда композиция достигает ободочной кишки.
В определенных вариантах выполнения изобретения композиция, кроме того, включает внешний слой, возможно, но не обязательно, содержащий фенилэфрин или его фармацевтически приемл