Новые композиции липосом
Иллюстрации
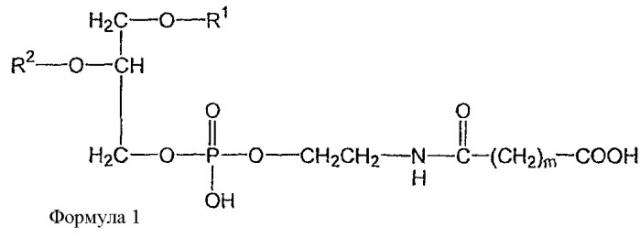
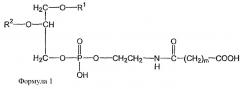
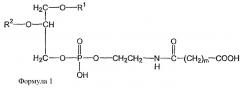
Показать всеГруппа изобретений относится к области медицины и может быть использована в форме содержащих липосомы составов для лечения рака. Липосома включает один или более фосфатидилхолинов, первое производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, инкапсулированное лекарственное вещество и, по меньшей мере, один дополнительный липид, который представляет собой холестерин или производное холестерина. Модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина включает направляющий лиганд, присоединенный ко второму производному N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина. Первое производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1
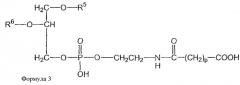
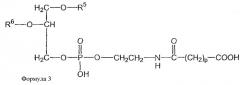
и второе производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 3
Направляющий лиганд предпочтительно представляет собой трансферрин, а инкапсулированное лекарственное вещество - оксалиплатин. При этом липосома не включает немодифицированный фосфатидилэтаноламин, фосфатидилхолин из яйца или гидрофильный полимер, используемый для увеличения периода полужизни липосомы в циркуляторном русле, а направляющий лиганд не представляет собой интактное антитело. Описывается также способ получения липосомы и способ лечения рака с ее помощью. Группа изобретений обеспечивает улучшенную адресную доставку лекарственного вещества в опухолевые клетки. 21 н. и 92 з.п. ф-лы, 30 ил., 4 табл., 30 пр.
Реферат
Перекрестная ссылка на родственные заявки
В этой заявке испрашивается приоритет по патентной заявке Японии No. 2005-67469, поданной 10 марта 2005 г., содержание которой включено сюда путем ссылки во всей своей полноте.
Уровень техники
Эффективность лечения многих заболеваний, включая рак, существенно улучшилась в течение последних нескольких десятилетий, однако, многие схемы лечения требуют применения лекарственных веществ с опасными побочными эффектами, включая, например, алопецию, тошноту, рвоту, слабость и т.д. При некоторых схемах введения может также назначаться применение лекарственных веществ, которые не стабильны в физиологических условиях, например биологические терапевтические средства (например, гены или продукты генов) и/или другие лекарственные вещества, которые легко распадаются или другим образом изменяются при введении и таким образом теряют свою эффективность до достижения желаемого терапевтического результата. Такая нестабильность также делает более трудными и дорогими хранение лекарственных веществ и получение препаратов для введения.
Существует ряд классов противораковых агентов, охватывающих около 100 конкретных лекарственных веществ, а также многочисленные схемы комбинированной лекарственной терапии, способы доставки и схемы лечения. Противораковые агенты можно классифицировать в соответствии с несколькими критериями, такими как класс соединения и заболевание, подвергаемое лечению. Разработаны определенные агенты, имеющие преимущества при быстром делении раковых клеток и направленно действующие на конкретных фазах клеточного цикла, представляя другой способ классификации. Агенты могут быть также сгруппированы в соответствии с типом и тяжестью их побочных эффектов или способа доставки. Однако наиболее общепринятой классификацией противораковых агентов, основанных не на биотерапии, является классификация по классу химического соединения, что широко охватывает механизм действия этих соединений.
В зависимости от источника информации существуют небольшие различия в классификации противораковых агентов. Классы соединений описываются в Physician's Desk Reference следующим образом: алкалоиды; алкилирующие агенты; противоопухолевые антибиотики; антиметаболиты; гормоны и аналоги гормонов; иммуномодуляторы; фотосенсибилизирующие агенты; и другие разнородные агенты.
Соединения класса алкалоидов могут быть также обозначены как ингибиторы митоза, так как они являются специфическими для определенной фазы клеточного цикла и предназначены для ингибирования митоза или ингибирования ферментов, требуемых для митоза. Они происходят обычно из растительных алкалоидов и других природных продуктов и действуют в течение M-фазы клеточного цикла. Этот класс соединений часто используют для лечения неоплазий, таких как острый лимфобластный лейкоз, лимфома Ходжкина и неходжкинская лимфома; нейробластомы и рак легких, молочной железы и семенников.
Алкилирующие агенты представляют собой большой класс химиотерапевтических агентов, включающий следующие подклассы, каждый из которых представляет собой ряд индивидуальных лекарственных веществ: алкилсульфонаты; азиридины; этиленимины и метилмеламины; производные горчичного газа; производные нитрозомочевины; и другие, включая соединения платины. Алкилирующие агенты атакуют неопластические клетки путем прямого алкилирования ДНК клеток и, следовательно, вызывают неправильную репликацию ДНК. Этот класс соединений обычно используют для лечения разнообразных заболеваний, включая хронические лейкозы, лимфому неходжкинского типа, лимфому Ходжкина, множественную миелому и определенные типы рака легких, молочной железы и яичников.
Производные нитрозомочевины часто входят в категорию алкилирующих агентов, и они имеют сходный механизм действия, но вместо прямого алкилирования ДНК они ингибируют ферменты репарации ДНК, вызывая нарушение репарации. Эти соединения имеют преимущества, будучи способными пересекать гематоэнцефалический барьер и, следовательно, могут быть использованы для лечения опухолей мозга.
Противоопухолевые антибиотики обладают противомикробной и цитотоксической активностью и также воздействуют на ДНК путем химического ингибирования ферментов и митоза или путем изменения клеточных мембран. Они не являются специфичными для фаз клеточного цикла и широко используются для лечения рака.
Антиметаболитный класс противораковых агентов воздействует на рост ДНК и РНК и является специфичным для S-фазы клеточного цикла. Они могут быть разделены далее по типу соединения, что включает аналоги фолиевой кислоты, аналоги пуринов и аналоги пиримидинов. Они часто применяются при лечении хронических лейкозов, опухолей молочной железы, яичника, желудочно-кишечного тракта.
Существует два класса гормонов или аналогов гормонов, применяемых в качестве противораковых агентов, это кортикостероидные гормоны и половые гормоны. Тогда как некоторые кортикостероидные гормоны могут как убивать раковые клетки, так и замедлять рост опухоли, и они используются для лечения лимфомы, лейкозов и т.д., половые гормоны функционируют в первую очередь снижая рост раковых опухолей молочной железы, простаты и эндометрия. Существуют многочисленные подклассы гормонов и гормональных аналогов, включая андрогены, антагонисты гормонов коры надпочечников, антиандрогены, антиэстрогены, ингибиторы ароматазы, эстрогены, аналоги высвобождающего фактора лютеинизирующего гормона (LHRH) и прогестины.
Дополнительный небольшой класс противораковых агентов классифицируется как иммунотерапевтический. Существуют агенты, которые предназначены для стимуляции иммунной системы для более эффективной атаки на неопластические (раковые) клетки. Эту терапию часто используют в сочетании с другими видами терапии.
Существует также ряд соединений, таких как кампотектины, которые обычно перечисляют как «другие» противораковые агенты, и они могут быть применены для лечения разнообразных неоплазий.
Сочетания противораковых агентов также применяются для лечения ряда типов рака. Например, Sanofi Syntholabo продает ELOXATIN™ (оксалиплатин для инъекций) для лечения колоректального рака для применения в сочетании с 5-фторурацилом и леувокорином. Это сочетание лекарственных веществ часто применяют совместно с хирургическим вмешательством при лечении колоректального рака. Оксалиплатин представляет собой алкилирующий агент, который, как считается, действует путем ингибирования как репликации, так и транскрипции ДНК. В отличие от других агентов, содержащих платину, оксалиплатин продемонстрировал пониженную вероятность развития устойчивости. Оксалиплатин дополнительно описан в патентах США Nos. 4169846; 5338874; 5298642; 5959133; 5420319; 5716988; 5290961; и в Wilkes GM. "New therapeutic options in colon cancer: focus on oxaliplatin " Clin J Oncol Nurs. (2002) 6:131-137.
Несмотря на то что существует множество противораковых агентов, преимущества данных соединений часто перевешиваются тяжестью побочных эффектов, оказываемых агентом. Это соотношение часто обозначается как терапевтический индекс, который описывает баланс между требуемой дозой для достижения разрушения раковых клеток по сравнению с дозой, при которой вещество неприемлемо токсично для индивидуума. Препятствием для большинства противораковых агентов является относительно низкий диапазон терапевтического индекса (т.е. узкий диапазон доз, при которых раковые клетки разрушаются без неприемлемой токсичности для индивидуума). Эта характеристика лимитирует частоту и дозировку, когда агент полезен, и часто побочные эффекты становятся непереносимыми до того, как рак может быть полностью искоренен.
Тяжелые побочные эффекты, случающиеся при большинстве типов химиотерапии рака, являются результатом неспецифической природы этих лекарственных веществ, которые не делают различий между здоровыми и раковыми клетками, и взамен разрушают и те, и другие. С помощью определенных лекарственных веществ, специфичных для фаз клеточного цикла, пытаются уменьшить эти эффекты, направленно действуя на фазу клеточного цикла, вовлеченную в репликацию и деление клетки. Эти лекарственные вещества, однако, не делают различий между раковыми клетками и здоровыми клетками, которые находятся в состоянии нормального клеточного деления. Клетки, которые наиболее страдают от этих типов химиотерапии, представляют собой те, которые часто подвергаются клеточному делению, включая клетки крови, клетки волосяных фолликулов и клетки полового и пищеварительного трактов.
Наиболее общими побочными эффектами противораковых агентов являются тошнота и рвота. Большая часть индивидуумов страдает также от миелосуппрессии или подавления функций костного мозга, который продуцирует красные клетки крови, белые клетки крови и тромбоциты. Эти и другие побочные эффекты также усугубляются подавлением иммунной системы, сопровождающимся деструкцией и отсутствием продукции белых клеток крови и связанным с этим риском оппортунистической инфекции.
Другие побочные эффекты, обычные для широкого спектра противораковых агентов, включают: потерю волос (алопецию); потерю веса; изменения вкуса; стоматит и эзофагит (воспаление и язвы); запор; диарею; слабость; повреждение сердца; изменения нервной системы; повреждение легких; повреждение репродуктивных тканей; повреждение печени; повреждение почек и мочевой системы.
Широкий диапазон побочных эффектов, связанных с большинством противораковых агентов и их тяжесть у индивидуумов, которые уже ослаблены заболеванием и возможно иммунодефицитны, заставил исследователей искать механизмы, с помощью которых они могут облегчить некоторые из побочных эффектов, поддерживая в то же время эффективность лечения. Было предпринято несколько подходов к этой проблеме. Они включают сочетанную химиотерапию, когда множество противораковых агентов вводят совместно; адъювантную терапию, когда дополнительные агенты прописывают вместе с противораковым агентом для борьбы с побочными эффектами противоракового агента; сочетание лечения разной модальности, когда химиотерапию сочетают с облучением и/или хирургическим вмешательством; альтернативные носители для доставки для введения противораковых агентов, липосомы с инкапсулированными противораковыми агентами.
Липосомы образуются, когда фосфолипиды и их производные диспергируются в воде. При дисперсии в воде фосфолипиды образуют замкнутые пузырьки, называемые «липосомами», которые характеризуются липидными бислоями, инкапсулирующими водную основу. Различные липосомы применялись в качестве носителей для заключения в них терапевтических агентов, таких как лекарственные вещества, ферменты и генетические последовательности для применения в медицинской науке, в фармацевтической науке и в биохимии.
Примеры липосомных композиций включают патенты США Nos. 4983397; 6476068; 5834012; 5756069; 6387397; 5534241; 4789633; 4925661; 6153596; 6057299; 5648478; 6723338; 6627218; патентные заявки США Nos: 2003/0224037; 2004/0022842; 2001/0033860; 2003/0072794; 2003/0082228; 2003/0212031; 2003/0203865; 2004/0142025; 2004/0071768; международные патентные заявки WO 00/74646; WO 96/13250; WO 98/33481; Papahadjopolulos D, Allen TM, Gbizon A, et al., «Sterically stabilized liposomes: Improvements in pharmacokinetics and antitumor therapeutic efficacy» Proc Natl Acad Sci U.S.A. (1991) 88: 11460-11464; Allen TM, Martin FJ. «Advantages of liposomal delivery systems for anthracyclines» Semin Oncol (2004) 31: 5-15 (suppl 13). Weissig et al. Pharm. Res. (1998) 15: 1552-1556.
На более ранних стадиях разработки липосом применяли существующие в природе фосфолипиды клеточной мембраны, такие как фосфолипиды яичного желтка и фосфолипиды сои. В случае их внутривенного введения, однако, липосомы, использующие эти фосфолипиды, вероятно, включались в ретикулоэндотелиальную систему печени или селезенки, создавая проблему короткого периода пребывания в крови в результате чего снижая эффективность лекарственного вещества. После этого, в виде способа решения этой проблемы в качестве составляющей мембраны липосом применяли синтетические фосфолипиды, чья липидная часть содержит только насыщенные связи, для того, чтобы сделать более твердой мембрану липосом.
При попытке увеличить период полужизни в циркуляторном русле и избежать захвата ретикулоэндотелиальной системой исследователи разработали липосомы, которые были модифицированы включением полиэтиленгликоля или других гидрофильных полимеров (например, ПЭГ липосому, в которой один или более из составляющих липидов были модифицированы присоединением ПЭГ). Модифицированные ПЭГ липосомы часто также обозначались как «экранированные» липосомы. Doxil™ (липосомы с доксорубицином HCl для инъекций) представляет собой заключенный в липосомы доксорубицин с добавлением полиэтиленгликоля (ПЭГ), применяемого для избегания ретикулоэндотелиальной системы (RES) и пролонгирования времени циркуляции лекарственного вещества. Смотри Vail DM, Amantea MA, Colbern GT, et al, «Pegylated Liposomal Doxorubicin: Proof of Principle Using Preclinical Animal Models and Pharmacokinetic Studies.» Semin Oncol. (2004) 31 (Suppl 13): 16-35. Однако неблагоприятные эффекты вызывались также пролонгированным удерживанием в крови (например, синдром руки и стопы, неблагоприятный эффект Doxil™ на периферическую систему и т.д.), что становилось признанной проблемой.
Примеры липосом включают патенты США Nos. 4983397; 5013556; 6316024; 6056973; 5945122; 5891468; 6126966; 5593622, 5676971; 6586559; и 5846458, публикации патентных заявок США Nos. 2003/0224037; 2004/0022842; 2003/0113262; 2002/0136707; международные патентные заявки WO 99/30686; WO 02/41870 Aliminana et al., Prep. Biochem. Biotech. (2004) 34(1): 77-96. Липосомы описаны также в патентах США Nos. 6228391; 6197333; 6046225; 5292524; и в публикациях патентных заявок США Nos. 20050271588; 20040213833; 20040029210; 20030175205; 20030162748; 20030130190; 20030059461; и 20020034537.
В дополнение к липосомам, модифицированным ПЭГ, исследователи разработали множество других производных липидов. Эти производные липидов могут быть также включены в липосомы. Смотри, например: международную патентную заявку WO 93/01828; Park YS, Maruyama K, Huang L. «Some negatively charged phospholipids derivatives prolong the liposome circulation in vivo.» Biochimica et Biophysica Acta (1992) 1108: 257-260; Ahl et al., Biochimica Biophys. Acta (1997) 1329: 370-382.
Дополнительные липидные композиции описаны в патентах США Nos. 6936272; 6897196; 6077834; и в публикациях патентных заявок США Nos. 20050136064; 20040234588; 20030215490; 20030166601; и 20010038851.
В дополнение к модификации липосом ПЭГ и другими гидрофильными полимерами, исследователи также разработали липосомы, которые предназначены для специфической направленной доставки к конкретным типам клеток с помощью включения направляющих факторов (также обозначаемых как направляющие лиганды) для конкретных типов клеток. Примеры направляющих факторов/лигандов включают асиалогликопротеин, фолат, трансферрин, антитела и т.д. В некоторых случаях один или более составляющих липидов может быть модифицировано путем присоединения направляющего фактора.
Примеры липидных композиций, включающих направляющие факторы, включают патенты США Nos. 5049390; 5780052; 5786214; 6316024; 6056973; 6245427; 6524613; 6749863; 6177059; 6530944; патентные заявки США Nos. 2004/0022842; 2003/0224037; 2003/143742; 2003/0228285; 2002/0198164; 2003/0220284; 2003/0165934; 2003/0027779; международные патентные заявки Nos. WO 95/33841; WO 95/19434; WO 2001037807; WO 96/33698; WO 2001/49266; WO 9940789; WO 9925320; WO 9104014; WO 92/07959; EP 1369132; JP 2001002592; Iinuma H, Maruyama K, et al., «Intracellular targeting therapy of cisplatin-encapsulated transferrin-polyethylene glycol liposome on peritoneal dissemination of gastric cancer» Int J Cancer (2002) 99 130-137; Ishida O, Maruyama K, Tanahashi H, Iwatsuru M, Sasaki K, et al., «Liposomes bearing polyethylene glycol-coupled transferrin with intracellular targeting property to the solid tumors in vivo.» Pharmaceutical Research (2001) 18: 1042-1048; Holmberg et al., Biochem. Biophys. Res. Comm. (1989) 165(3): 1272-1278; Nam et al., J. Biochem. Mol Biol (1998) 31(1): 95-100; Nag et al., J. Drug Target. (1999) 6(6): 427-438.
В частности, Iinuma et al. разработали Tf-ПЭГ-липосому с трансферрином (Tf), присоединенным к поверхности липосомы. Iinuma et al. показали, что большее количество липосом связывалось с поверхностью опухолевых клеток и наблюдался более высокий захват липосом опухолевыми клетками в случае Tf-ПЭГ липосом по сравнению с ПЭГ-липосомами (Inuma et al., там же; Ishida et al., там же).
Однако, несмотря на последние достижения, сделанные в области доставки лекарственных веществ и меченых соединений, включая применение композиций липосом, все еще сохраняется потребность в усовершенствованных липидных композициях для доставки лекарственных веществ и меченых соединений к конкретным клеткам и/или тканям, за счет чего достигается терапевтический или диагностический эффект. В частности, в области онкологии лекарственные составы с улучшенной специфичностью и сниженной токсичностью необходимы для уверенного терапевтического успеха без неблагоприятного влияния на здоровые клетки и также без индукции опасных побочных эффектов у индивидуума, подвергаемого лечению. Сходно, меченые соединения, которые могут быть применены для диагностики состояний, особенно угрожающих жизни состояний, на ранней стадии (например, с высокой специфичностью и/или высокой чувствительностью) и также для точного мониторинга тяжести/степени состояния (например, прогрессии или регрессии с или без лечения), должны также существенно улучшить качество и успешность терапии.
Краткое изложение сущности изобретения
Настоящее изобретение относится к новым содержащим липиды композициям (включая липосомы (например, липосомы направленного действия, ненагруженные липосомы), липидные смеси и содержащие липосомы композиции), которые могут необязательно включать лекарственное вещество или меченое соединение или могут быть применены для получения составов, которые включают лекарственное вещество или меченое соединение, где содержащая липиды композиция создает преимущества в плане снижения побочных эффектов лекарственного вещества или меченого соединения, и/или также предотвращения разрушения, и/или потери эффективности лекарственного вещества или меченого соединения. Изобретение также включает способы получения и применения описанных здесь содержащих липиды композиций. В определенных аспектах изобретения содержащие липиды композиции могут быть применены для лечения или диагностики рака (например, рака молочной железы, рака желудка, колоректального рака, рака ободочной кишки, рака поджелудочной железы, не мелкоклеточного рака легких, мелкоклеточного рака легких, рака мозга, рака печени, рака почки, рака простаты, рака мочевого пузыря, рака яичника или гематологических злокачественных заболеваний (например, лейкоза, лимфомы, множественной миеломы и т.д.).
В определенных воплощениях предлагаются липосомы направленного действия, включающие один или более фосфолипидов, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, инкапсулированное лекарственное вещество или меченое соединение и необязательно, по меньшей мере, один дополнительный липид, где модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина включает направляющий лиганд, присоединенный к второму производному N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и где производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1,
и второе производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 3,
где R1, R2, R5 и R6 каждый независимо представляет собой ацильную группу, и m и p независимо представляют собой целое число от 1 до 10; и где липосома не включает немодифицированный фосфатидилэтаноламин или полиэтиленгликоль и где направляющий лиганд не представляет собой интактное антитело.
В других воплощениях предлагаются ненагруженные липосомы, включающие один или более фосфолипидов, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и необязательно, по меньшей мере, один дополнительный липид, где модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина включает направляющий лиганд, присоединенный к второму производному N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина; и где производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1
и второе производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 3
где R1, R2, R5 и R6 каждый независимо представляет собой ацильную группу, и m и p независимо представляют собой целое число от 1 до 10; и где липосома не включает немодифицированный фосфатидилэтаноламин, полиэтиленгликоль, лекарственное вещество или меченое соединение и где направляющий лиганд не представляет собой интактное антитело.
В определенных воплощениях липосом направленного действия и ненагруженных липосом R1, R2, R5 и R6 представляют собой олеоил или стеароил, и m и p равно 3. В определенных воплощениях направляющим лигандом является трансферрин. В конкретных воплощениях один или более фосфолипидов представляют собой DMPC или DSPC, и присутствует, по меньшей мере, один дополнительный липид представляющий собой холестерин. В определенных воплощениях липосом направленного действия и ненагруженных липосом R1, R2, R5 и R6 представляют собой олеоил, m и p равно 3, один или более фосфолипидов представляют собой DMPC и, дополнительный липид представляет собой холестерин.
В определенных воплощениях липосом направленного действия и ненагруженных липосом m и p каждый независимо является целым числом от 2 до 4. В некоторых воплощениях m и p равны и являются целым числом от 2 до 4. В конкретных воплощениях m и p равны и составляют 3. В определенных воплощениях R1, R2, R5 и R6 каждый независимо представляет собой олеоил, стеароил, пальмитоил или миристоил. В некоторых воплощениях R1 и R2 являются одинаковыми и R5 и R6 являются одинаковыми. В других воплощениях R1, R2, R5 и R6 являются одинаковыми. В конкретных воплощениях R1, R2, R5 и R6 представляют собой олеоил или стеароил. В определенных воплощениях R1, R2, R5 и R6 представляют собой олеоил.
В дополнительных воплощениях предлагаются липидные смеси, включающие смесь одного или более фосфолипидов, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и необязательно, по меньшей мере, один дополнительный липид, где производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1
и сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлен формулой 2
и где R1, R2, R3 и R4, каждый независимо представляет собой ацильную группу, m и n независимо представляют собой целое число от 1 до 10; и где смесь не включает немодифицированный фосфатидилэтаноламин или полиэтиленгликоль.
В определенных воплощениях липидных смесей m и n каждый независимо является целым числом от 2 до 4. В некоторых воплощениях m и n равны и являются целым числом от 2 до 4. В конкретных воплощениях m и n равны и составляют 3.
В определенных воплощениях липидных смесей R1, R2, R3 и R4 каждый независимо представляет собой олеоил, стеароил, пальмитоил или миристоил. В некоторых воплощениях R1 и R2 являются одинаковыми и R3 и R4 являются одинаковыми. В конкретных воплощениях R1, R2, R3 и R4 являются одинаковыми. В некоторых воплощениях R1, R2, R3 и R4 представляют собой олеоил или стеароил. В определенных воплощениях m и n равны 3, где один или более фосфолипидов представляют собой DMPC или DSPC, и присутствует, по меньшей мере, один дополнительный липид, представляющий собой холестерин. В определенных воплощениях липидных смесей R1, R2, R3 и R4 представляют собой олеоил, m и n равны 3, один или более фосфолипидов представляют собой DMPC и дополнительный липид представляет собой холестерин.
В дополнительных воплощениях предлагаются липидные смеси, включающие смесь одного или более фосфолипидов, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и необязательно, по меньшей мере, один дополнительный липид, где производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1
и модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина включает направляющий лиганд, соединенный со вторым производным N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина; и где второе производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 3
где R1, R2, R5 и R6 каждый независимо представляет собой ацильную группу, m и p независимо представляют собой целое число от 1 до 10; и где смесь не включает немодифицированный фосфатидилэтаноламин или полиэтиленгликоль, и где направляющий лиганд не представляет собой интактное антитело.
В определенных воплощениях липидных смесей, где присутствует модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, m и p каждый независимо является целым числом от 2 до 4. В конкретных воплощениях m и p равны и являются целым числом от 2 до 4. В конкретных воплощениях m и p равны и составляют 3.
В определенных воплощениях липидных смесей, где присутствует модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, R1, R2, R5 и R6 каждый независимо представляет собой олеоил, стеароил, пальмитоил или миристоил. В некоторых воплощениях, где R1 и R2 являются одинаковыми, и R5, и R6 являются одинаковыми. В дополнительных воплощениях R1, R2, R5 и R6 являются одинаковыми. В некоторых воплощениях R1, R2, R5 и R6 представляют собой олеоил или стеароил. В некоторых воплощениях R1, R2, R5 и R6 представляют собой олеоил или стеароил, m и p равно 3, один или более фосфолипидов представляют собой DMPC или DSPC, по меньшей мере, один дополнительный липид представляет собой холестерин, и направляющим лигандом является трансферрин. В определенных воплощениях липидных смесей R1, R2, R5 и R6 представляют собой олеоил, m и p равно 3, один или более фосфолипидов представляют собой DMPC, дополнительный липид представляет собой холестерин, и направляющим лигандом является трансферрин.
В определенных воплощениях предлагаются содержащие липосомы композиции, включающие липосомы, включающие один или более фосфолипидов, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и необязательно, по меньшей мере, один дополнительный липид, где производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1
и сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлен формулой 2
где R1, R2, R3 и R4 каждый независимо представляет собой ацильную группу, m и n независимо представляют собой целое число от 1 до 10; и где композиция не включает немодифицированный фосфатидилэтаноламин или полиэтиленгликоль.
В некоторых воплощениях содержащих липосомы композиций m и n каждый независимо является целым числом от 2 до 4. В определенных воплощениях m и n равны и являются целым числом от 2 до 4. В конкретных воплощениях m и n равны и составляют 3.
В некоторых воплощениях содержащих липосомы композиций R1, R2, R3 и R4 каждый независимо представляет собой олеоил, стеароил, пальмитоил или миристоил. В конкретных воплощениях R1 и R2 являются одинаковыми, и R3 и R4 являются одинаковыми. В некоторых воплощениях R1, R2, R3 и R4 являются одинаковыми. В определенных воплощениях R1, R2, R3 и R4 представляют собой олеоил или стеароил. В некоторых воплощениях R1, R2, R3 и R4 представляют собой олеоил или стеароил, и m и n равны 3, и один или более фосфолипидов представляют собой DMPC, DSPC, POPC или DPPС. В определенных воплощениях R1, R2, R3 и R4 представляют собой олеоил, m и n равны 3, один или более фосфолипидов представляют собой DMPC, и дополнительный липид представляет собой холестерин.
В дополнительных воплощениях содержащих липосомы композиций предлагаются содержащие липосомы композиции, включающие липосомы, включающие один или более фосфолипидов, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и необязательно, по меньшей мере, один дополнительный липид, где производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1
и модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина включает направляющий лиганд, присоединенный ко второму производному N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина; и где второе производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 3
и где R1, R2, R5 и R6, каждый независимо представляет собой ацильную группу, m и p независимо представляют собой целое число от 1 до 10; и где композиция не включает немодифицированный фосфатидилэтаноламин или полиэтиленгликоль, и где направляющий лиганд не представляет собой интактное антитело.
В определенных воплощениях содержащих липосомы композиций, где присутствует модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, m и p каждый независимо является целым числом от 2 до 4. В конкретных воплощениях m и p равны и являются целым числом от 2 до 4. В некоторых воплощениях m и p равны и составляют 3.
В определенных воплощениях содержащих липосомы композиций, где присутствует модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, R1, R2, R5 и R6 каждый независимо представляет собой олеоил, стеароил, пальмитоил или миристоил. В конкретных воплощениях, R1 и R2 являются одинаковыми, и R5 и R6 являются одинаковыми. В определенных воплощениях R1, R2, R5 и R6 являются одинаковыми. В некоторых воплощениях R1, R2, R5 и R6 представляют собой олеоил или стеароил. В конкретных воплощениях R1, R2, R5 и R6 представляют собой олеоил или стеароил, один или более фосфолипидов представляют собой DMPC или DSPC, по меньшей мере, один дополнительный липид представляет собой холестерин, и направляющим лигандом является трансферрин. В определенных воплощениях R1, R2, R5 и R6 представляют собой олеоил, m и p равно 3, один или более фосфолипидов представляют собой DMPC, дополнительный липид представляет собой холестерин, и направляющим лигандом является трансферрин.
В дополнительных воплощениях содержащих липосомы композиций в них включено лекарственное вещество. В определенных воплощениях один или более фосфолипидов представляют собой DMPC или DSPC, R1, R2 и, когда присутствуют, R5 и R6 представляют собой олеоил или стеароил, m и, когда присутствует, p равно 3, по меньшей мере, один дополнительный липид, когда присутствует, представляет собой холестерин, лекарственное вещество представляет собой оксалиплатин, и направляющий лиганд, если присутствует, представляет собой трансферрин. В определенных воплощениях композиция дополнительно включает сахар в концентрации от приблизительно 1 до приблизительно 20% процентов сахара (об./об.). В определенных воплощениях один или более фосфолипидов представляют собой DMPC или DSPC, R1, R2 и, когда присутствуют, R5 и R6 представляют собой олеоил, m и, когда присутствует, p равно 3, по меньшей мере, один дополнительный липид, когда присутствует, представляет собой холестерин, лекарственное вещество представляет собой оксалиплатин, и направляющий лиганд, если присутствует, представляет собой трансферрин.
В дополнительных воплощениях содержащих липосомы композиций в них включено меченое соединение. В определенных воплощениях меченое соединение включает радиоизотопный остаток.
В определенных воплощениях липосом направленного действия, ненагруженных липосом, липидных смесей и содержащих липосомы композиций присутствует, по меньшей мере, один дополнительный липид. В конкретных воплощениях, по меньшей мере, один дополнительный липид представляет собой холестерин или производное холестерина.
В конкретных воплощениях липосом направленного действия, ненагруженных липосом, липидных смесей и содержащих липосомы композиций один или более фосфолипидов представляют собой фосфатидилхолин, фосфатидную кислоту, фосфатидилсерин или фосфатидилглицерин. В конкретных воплощениях один или более фосфолипидов представляют собой нейтральные фосфолипиды. В некоторых воплощениях один или более фосфолипидов представляют собой фосфатидилхолин. В конкретных воплощениях фосфатидилхолин включает остаток насыщенной жирной кислоты. В определенных воплощениях один или более фосфолипидов представляют собой DMPC, DSPC, POPC или DPPC. В некоторых из этих воплощений присутствует, по меньшей мере, один дополнительный липид. И в определенных из них, по меньшей мере, один дополнительный липид представляет собой холестерин или производное холестерина. В конкретных воплощениях включены DMPC и холестерин, DSPC и холестерин, POPC и холестерин или DPPC и холестерин. В определенных воплощениях включены DMPC и холестерин.
В конкретных воплощениях липосом направленного действия, ненагруженных липосом, липидных смесей и содержащих липосомы композиций направляющий лиганд, когда присутствует, направлен на клетку-мишень. В некоторых воплощениях направляющий лиганд направлен на рецептор клеточной поверхности клетки-мишени. В конкретных воплощениях направляющий лиганд представляет собой трансферрин, фолиевую кислоту, гиалуроновую кислоту, сахарную цепь или фрагмент моноклонального антитела. В других воплощениях направляющий лиганд представляет собой трансферрин, фолиевую кислоту, гиалуроновую кислоту или сахарную цепь. В конкретных воплощениях направляющий лиганд представляет собой трансферрин, фолиевую кислоту, гиалуроновую кислоту или сахарную цепь. В некоторых воплощениях направляющий лиганд представляет собой трансферрин. В конкретных воплощениях трансферрин находится в холо-форме, но не в апо-форме. В некоторых воплощениях трансферрин находится в холо-форме.
В определенных воплощениях липосом направленного действия и ненагруженных липосом средний диаметр липосомы составляет от приблизительно 50 нм до приблизительно 250 нм. В других, средний диаметр липосомы составляет от приблизительно 90 нм до приблизительно 200 нм.
В конкретных воплощениях липосом направленного действия и ненагруженных липосом дзета-потенциал липосомы является негативным. В определенных воплощениях дзета-потенциал составляет от приблизительно -75 мВ до приблизительно -90 мВ. В других, дзета-потенциал составляет от приблизительно -80 мВ до приблизительно -85 мВ.
В определенных воплощениях содержащих липосомы композиций, липосом направленного действия и ненагруженных липосом составы дополнительно включают раствор.
В конкретных воплощениях липосом направленного действия и содержащих липосомы композиций присутствует лекарственное вещество.
В конкретных воплощениях липосом направленного действия и содержащих липосомы к