Сахарид-конъюгатные вакцины
Иллюстрации
Показать всеИзобретение раскрывает композиции для вызывания иммунного ответа у пациента, включающие комбинацию двух или более моновалентных конъюгатов, где каждый из моновалентных конъюгатов включает протеин-носитель N19, конъюгированный с сахаридным антигеном из серогрупп А, С, W135 или Y Neissera meningitides. При этом предпочтительно, что молекула протеина-носителя в моновалентном конъюгате конъюгирована более чем с одной молекулой сахаридного антигена. Изобретение также раскрывает мультивалентный конъюгат для вызывания иммунного ответа у пациента, включающий два или более антигенно отличающихся сахаридных антигенов из серогрупп А, С, W135 или Y Neissera meningitides, конъюгированных с протеином-носителем N19. Композиции могут включать один или более упомянутых моновалентных конъюгатов и один или более упомянутых мультивалентных конъюгатов. В изобретении показана возможность применения мультивалентного конъюгата и композиций в производстве медикамента для усиления иммунного ответа у пациента. Композиции по изобретению при их использовании вызывают значительно более сильный и быстрый иммунный ответ и обладают пониженной реактогенностью для пациента. 7 н. и 9 з.п. ф-лы, 18 ил., 2 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение касается области вакцин и относится к новым композициям, включающим два или более сахаридных антигенов, конъюгированных с полиэтитопным протеином-носителем, включающим эпитопы Т-клеток из многочисленных патогенных протеинов. Изобретение также относится к способам получения упомянутых композиций и применениям этих композиций.
УРОВЕНЬ ТЕХНИКИ
Поливалентные вакцины в уровне техники известны. Одним из их примеров является тетравалентная вакцина капсулярных полисахаридов из серогрупп А, С, Y и W135 N. Meningitides, которая известна уже в течение многих лет [1, 2] и разрешена для применения на человеке. Однако несмотря на эффективность для подростков и взрослых она индуцирует слабый иммунный ответ, защищает на короткое время и не может быть использована для маленьких детей [напр., 3]. Причина заключается в том, что полисахариды являются независимыми от Т-клеток антигенами, которые обычно индуцируют слабый иммунный ответ, который невозможно усилить. Часто возникает беспокойство относительно широко распространенного использования поливалентных вакцин, поскольку они склонны к значительному снижению иммунной функции, известной как иммуносупрессия. Иммуносупрессия может происходить, когда количество антигена, вводимого субъекту, превышает способность иммунной системы реагировать. Такое состояние называется антиген-перегрузкой. Иммуносупрессия может также возникать в результате того, что один компонент антигена препятствует иммунной системе реагировать на другой компонент антигена поливалентной вакцины. Последняя форма иммуносупрессии называется вакцинной интерференцией.
В последние 20 лет были разработаны конъюгатные вакцины, включающие бактериальные капсулярные полисахариды, конъюгированные с протеинами-носителями.
Примеры включают Haemophilus influenzae тип b (Hib) конъюгатную вакцину [4], а также конъюгатные вакцины против Streptococcus pneumoniae [5] и серогруппы С Neisseria meningitides (MenC) [6].
Протеины-носители, используемые в разрешенных вакцинах, включают токсоид столбняка (ТТ), дифтерийный токсоид (DT), нетоксичный СRМ197-мутант дифтерийного токсина и комплекс протеинов наружних мембран из группы В N. Meningitides. Поскольку все больше конъюгированных вакцин вводится в медицинскую практику, дети могут получать многочисленные инъекции протеина-носителя либо в виде самой вакцины (напр., ТТ или DT), либо в виде протеина-носителя, присутствующего в конъюгатной вакцине. Так как эти протеины являются высокоиммуногенными как на уровне В-, так и на уровне Т-клеток, избыток носителя может индуцировать иммунную супрессию у примированных индивидов [7]. Это явление, называемое индуцируемой носителем эпитопной супрессией, как предполагается, существует благодаря специфичным к носителю антителам и внутримолекулярной антигенной конкуренции [8]. В идеале, протеин-носитель должен индуцировать сильный вспомогательный эффект по отношению к конъюгированному эпитопу В-клеток (напр., полисахариду) без индуцирования ответа антител против самого себя. Использование универсальных эпитопов, которые иммуногенны в отношение большинства молекул главного комплекса гистосовместимости класса II, является одним из подходов к достижению этой цели [9]. Такие эпитопы идентифицированы в ТТ и других протеинах. Тем не менее, имеется потребность в дальнейших усовершенствованиях.
Таким образом, целью изобретения является обеспечение усовершенствованных сахаридных конъюгатов.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Было обнаружено, что полиэпитопные протеины-носители являются особенно полезными в качестве носителей комбинаций сахаридов. Кроме того, было обнаружено, что против этих протеинов-носителей возникает лишь слабый иммуногенный ответ, хотя они включают ряд известных патогенных эпитопов, при этом можно было бы ожидать, что иммуногенный ответ усиливался бы пропорционально числу патогенных эпитопов.
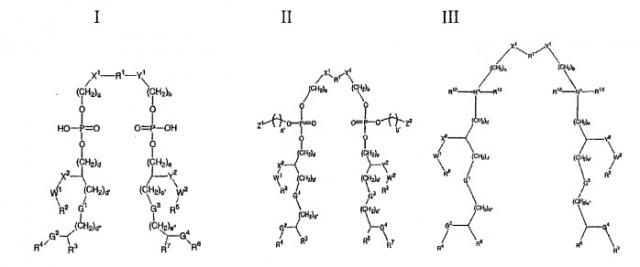
В некоторых вариантах осуществления изобретения предлагается, таким образом, композиция, включающая комбинацию двух или более моновалентных конъюгатов (напр., 2, 3, 4, 5, 6 или более. См. Фигуру 1А). Каждый моновалентный конъюгат включает (i) протеин-носитель, включающий эпитопы Т-клеток из двух или более (напр., 2, 3, 4, 5, 6 или более) патогенов, конъюгированный с (ii) сахаридным антигеном. Предпочтительно, протеин-носитель, используемый в каждом конъюгате, является одним и тем же. Предпочтительно, по крайней мере, что один из эпитопов протеина-носителя не происходит из того же самого патогена, что и сахаридный антиген. Предпочтительно, никакой из эпитопов пртотеина-носителя не происходит из того же самого патогена, что и сахаридный антиген.
Хотя каждая молекула протеина-носителя в каждом моновалентном конъюгате может быть конъюгирована с более чем одной молекулой сахаридного антигена (напр., 1, 5, 10, 20 или более) благодаря многочисленным сайтам присоединения на каждой молекуле протеина-носителя (Фигура 1В), каждый сахаридный антиген, конъюгированный с любым данным протеином-носителем, предпочтительно, происходит из того же самого антиген-отдельного патогена. Например, сахаридные антигены из МеnА отличаются от каждого из сахаридных антигенов из MenC, MenW или MenY, и поэтому мы говорим, что они происходят из антиген-отдельного патогена, в то время как сахаридные антигены из Hib все происходят из того же самого антиген-отдельного патогена. В отдельном конъюгате длина цепей индивидуальных сахаридов, хотя и происходящих из того же самого антиген-отдельного патогена, могут быть различны.
В качестве альтернативы, в некоторых вариантах осуществления изобретения предлагается мультивалентный конъюгат, включающий два или более (напр., 2, 3, 4, 5, 6 или более) антигенно отличающихся сахаридных антигенов, конъюгированных с одной и той же молекулой протеина-носителя (Фигура 1C). В этом случае сахаридные антигены происходят из разных антиген-отдельных патогенов. Поэтому, например, в такой конъюгатной композиции каждая молекула протеина-носителя может иметь конъюгированные с ней сахаридные антигены из двух или более МеnА, MenC, MenW, MenY и Hib. Изобретение также обеспечивает композицию, включающую два или более (напр., 1, 3, 4, 5, 6 или более) этих мультивалентных конъюгатов.
В качестве еще одной альтернативы, изобретение обеспечивает композицию, включающую один или более (напр., 1, 2, 3, 4, 5, 6 или более) моновалентных конъюгатов и один или более (напр., 1, 2, 3, 4, 5, 6 или более) мультивалентных конъюгатов, описанных выше.
Протеин-носитель
Протеин-носитель может включать 2 или более эпитопов Т-клеток (напр., 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 или более). Предпочтительно, протеин-носитель включает 6 или более, либо 10 или более эпитопов. Более предпочтительно, протеин-носитель включает 19 или более эпитопов. Каждый протеин-носитель может иметь только одну копию конкретного эпитопа или может иметь более одной копии конкретного эпитопа. Предпочтительно, эпитопы являются CD44+ эпитопами Т-клеток. Предпочтительно, протеин-носитель включает, по крайней мере, один бактериальный эпитоп и, по крайней мере, один вирусный эпитоп. Предпочтительно, эпитопы происходят из антигенов, по отношению которым человеческая популяция часто подвергается либо природной инфекции, либо вакцинации, например эпитопы могут происходить из вируса гепатита А, вируса гепатита В, вируса кори, вируса гриппа, вируса опоясывающей ветряной оспы, протеинов теплового шока из Mycobacterium bovis и М. leprae и/или штаммов Streptococcus, и т.д. Предпочтительно, эпитопы выбирают из токсина столбняка (ТТ), Plasmodium falciparum CSP (PfCs), ядерного капсида вируса гепатита В (HBVnc), гемагглютинина гриппа (НА), поверхностного HBV-антигена (HBsAg) и матриксный белок гриппа (МТ). Эпитопы, используемые в протеинах-носителях, предпочтительно, выбирают из Р23ТТ (SEQ ID NO: 1), Р32ТТ (SEQ ID NO: 2). P21TT (SEQ ID NO: 3), PfCs (SEQ ID NO: 4), P30TT (SEQ ID NO: 5), P2TT (SEQ ID NO: 6), HBVnc (SEQ ID NO: 7), НА (SEQ ID NO: 8), HBsAg (SEQ ID NO: 9) и МТ (SEQ ID NO: 10).
Предпочтительно, эпитопы соединены спейсерами. Предпочтительно, спейсер является короткой аминокислотной последовательностью (напр., 1, 2, 3, 4 или 5), которая не является эпитопом. Предпочтительный спейсер включает один или более глициновых остатков, напр., -KG-. Предпочтительно, протеин-носитель включает N- или С-концевую область, включающую шести-His-овый хвост, иммуноаффинный тэг, полезный для скринирования протеина-носителя (например, может быть использована последовательность "MDYKDDDD" [SEQ ID NO: 12]), и/или последовательность расщепления протеазой. Предпочтительно, протеолитическая последовательность является сайтом распознавания фактора Ха.
Предпочтительно, носитель не включает эпитопов супрессора Т-клеток.
Предпочтительно, протеин-носитель является N19 (SEQ ID NO: 11). Показано, что генетически сконструированный протеин, обозначаемый как N19 [10], экспрессируемый в Escherichia coli и имеющий несколько универсальных эпитопов, распознаваемых CD4+ Т-клетками человека, ведет себя как сильный носитель, когда он конъюгирован с Hib-полисахаридом [11]. N-концевая область N19 состоит из (i) шести-His-ового хвоста, который может быть использован во время очистки, (ii) сигнальной пептидной последовательности Met-Asp-Tyr-Lys-Asp-Asp-Asp-Asp (SEQ ID NO: 12), распознаваемой кроличьим поликлональным антителом, которая может быть использована для скринирования позитивных колоний во время процедуры клонирования, (iii) последовательности Ile-Glu-Gly-Arg (SEQ ID NO: 13) сайта распознавания Фактора Ха для легкого удаления метки. N19 представляет собой дупликацию первых девяти эпитопов, перечисленных в Таблице 1, плюс эпитоп (МТ) матриксного белка гриппа, распознаваемый CD4+. Эпитопы разделены спейсером Lys-Gly для обеспечения гибкости молекулы и для возможности последовательной конъюгации полисахарида с первичными ε-аминогруппами остатков Lys.
Помимо эпитопов, распознаваемых CD4+, протеины-носители могут включать другие пептиды или протеиновые фрагменты, такие как эпитопы из иммуномодулирующих цитокинов, таких как интерлейкин-2 (IL-2) или гранулоцит-макрофаговый колониестимулирующий фактор (GM-CSF).
| Таблица 1 | ||||
| Т-клеточный эпитоп | Происхождение | Положение аминокислот | Аминокислотная последовательность (SEQ ID NO) | Ссылки |
| Р23ТТ | Токсин столбняка | 1084-1099 | VSIDKFRIFCKANPK (1) | 12 |
| Р32ТТ | Токсин столбняка | 1174-1189 | LKFIIKRYTPNNEIDS (2) | 12 |
| Р21ТТ | Токсин столбняка | 1064-1079 | IREDNNITLKLDRCNN (3) | 13 |
| PfCs | P.falciparum Circumsporozoite протеин | 380-398 | EKKIAKMEKASSVFNVVN (4) | 14 |
| Р30ТТ | Токсин столбняка | 947-967 | FNNFTVSFWLRVPKVSASHLE (5) | 15 |
| Р2ТТ | Токсин столбняка | 830-843 | QYIKANSKFIGITE (6) | 15, 16 |
| HBVnc | Нуклеокапсид вируса гепатита В | 50-69 | PHHTALRQAILCWGELMTLA (7) | 17 |
| НА | Гемагглютинин вируса гриппа | 307-319 | PKYVKQNTLKLAT (8) | 16 |
| HBsAg | Поверхностный протеин вируса гепатита В | 19-33 | FFLLTRILTIPQSLD (9) | 18 |
| MT | Матриксный белок вируса гриппа | 17-31 | YSGPLKAEIAQRLEDV (10) | 19 |
Сахаридные антигены
Предпочтительно, сахаридный антиген, конъюгированный с протеином-носителем в композиции согласно изобретению, является бактериальным сахаридом и, в частности, капсулярным бактериальным сахаридом.
Примеры капсулярных бактериальных сахаридов, которые могут входить в состав композиций согласно изобретению, включают капсулярные сахариды из Neisseria meningitidis (серогруппы А, В, С, W135 и/или Y), Streptococcus pneumoniae (серотипы 1, 2, 3, 4, 5, 6В, 7F, 8, 9N, 9V, 10А, 11А, 12F, 14, 15В, 17F, 18С, 19А, 19F, 20, 22F, 23F и 33F, в частности 4, 6В, 9V, 14, 18С, 19F и/или 23F), Streptococcus agalactiae (типы Ia, Ib, II, III, IV, V, VI, VII, и/или VIII, такие как сахаридные антигены, раскрытые в ссылочных документах 20-23), Haemophilus influenzae (группы штаммов: а, b, с, d, e и/или f), Pseudomonas aeruginosa (например, липополисахарид (LPS), выделенный из РА01, O5 серотип), Staphylococcus aureus (например, из серотипов 5 и 8), Enterococcus faecalis или E.faecium (трисахаридные повторы), Yersinia enterocolitica, Vibrio cholerae, Salmonella typhi, Klebsiella spp., и т.д. Другие сахариды, которые могут входить в состав композиций согласно изобретению, включают глюканы (напр., глюканы грибков, такие как содержащиеся в Candida albicans) и капсулярные грибковые сахариды, напр., из капсулы Cryptococcus neoformans.
Капсула N. meningitidis серогруппы А (МеnА) представляет собой гомополимер (α1→6)-связанного N-ацетил-D-маннозамин-1-фосфата, при частичном O-ацетилировании в С3-и С4-положениях. Капсула N. meningitidis серогруппы В (МеnВ) представляет собой гомополимер (α2→8)-связанной сиаловой кислоты. Капсулярный сахарид N. meningitidis серогруппы С (МеnС) представляет собой гомополимер (α2→9)-связанной сиаловой кислоты, при переменном O-ацетилировании в положениях 7 и/или 8. Сахарид N. meningitidis серогруппы W135 представляет собой полимер, содержащий дисахаридные единицы - сиаликовая кислота-галактоза [→4)-D-Neup5Ac(7/9ОAc)-α-(2→6)-D-Gal-α-(1→]. Имеет место переменное O-ацетилирование в положениях 7 и 9 в сиаловой кислоте данного сахарида [24]. Сахарид N. Meningitidis серогруппы Y подобен сахариду серогруппы W135, за исключением того, что повторяющаяся дисахаридная единица включает глюкозу вместо галактозы [→4)-D-Neup5Ac(7/9ОAc)-α-(2→6)-D-Glc-α-(1→]. Также имеет место переменное O-ацетилирование в положениях 7 и 9 в сиаловой кислоте данного сахарида.
Композиции согласно изобретению включают смеси сахаридных антигенов. Предпочтительно, композиции включают 2, 3, 4 или более различных сахаридных антигенов. Антигены могут происходить из таких же самых или антигенно отличающихся патогенов. Предпочтительно, композиции согласно изобретению включают сахаридные антигены из более чем одной серогруппы N. Meningitidis, напр., композиции могут включать сахариды-конъюгаты из серогрупп А+С, A+W135, A+Y, C+W135, C+Y, W135+Y, A+C+W135, A+C+Y, C+W135+Y, A+C+W135+Y, и т.д. Предпочтительные композиции включают сахариды из сегогрупп С и Y. Другие предпочтительные композиции включают сахариды из серогрупп С, W135 и Y. Особенно предпочтительные композиции включают сахариды из серогрупп А, С, W135 и Y.
В том случае, когда смесь включает менингококковые сахариды из серогруппы А и, по крайней мере, один сахарид другой серогруппы, соотношение (в/в (весовое соотношение)) сахарида МеnА с любым сахаридом другой серогруппы может быть более 1 (напр., 2:1, 3:1, 4:1, 5:1, 10:1 или более). Соотношения между 1:2 и 5:1 являются предпочтительными, как и соотношения между 1:1,25 и 1:2,5. Предпочтительными соотношениями (в/в) для сахаридов из серогрупп A:C:W135:Y являются: 1:1:1:1; 1:1:1:2; 2:1:1:1; 4:2:1:1; 8:4:2:1; 4:2:1:2; 8:4:1:2; 4:2:2:1; 2:2:1:1; 4:4:2:1; 2:2:1:2; 4:4:1:2 и 2:2:2:1.
Дальнейшие предпочтительные композиции согласно изобретению включают Hib-сахаридный конъюгат и сахаридный конъюгат из, по крайней мере, одной серогруппы N. Meningitidis, предпочтительно, из более чем одной серогруппы N. Meningitidis. Например, композиция согласно изобретению может включать Hib-сахарид и сахариды из одной или более (т.е., 1, 2, 3 или 4) серогрупп А, С, W135 и Y N. Meningitidis. Предлагаются также другие комбинации сахаридных конъюгатов из упомянутых выше патогенов.
В некоторых вариантах осуществления изобретения также предлагается комбинации конъюгатов, в которых протеин-носитель не является одним и тем же для каждого конъюгата.
Другие предпочтительные композиции согласно изобретению включают первый конъюгат и второй конъюгат. Первый конъюгат является полиэпитопным конъюгатом, как описано выше, а второй конъюгат включает сахаридный антиген, конъюгированный с протеином-носителем, отличающимся от протеина-носителя, который используется в первом конъюгате. Например, второй конъюгат может являться сахаридным антигеном, конъюгированным с носителем CRM197. Сахаридный(-ые) антиген(ы) во втором конъюгате может(-гут) быть тем(и) же самым(и) или отличаться от сахаридного(-ых) антигена(-ов) в первом конъюгате.
Получение капсулярных сахаридных антигенов
Методы получения капсулярных сахаридных антигенов хорошо известны. Например, в ссылочном документе 25 описывается получение сахаридных антигенов из N. Meningitidis. Получение сахаридных антигенов из Н. Influenzae описывается в главе 14 ссылочного документа 26. Получение сахаридных антигенов и конъюгатов из S. pneumoniae описано в уровне техники. Например, Prevenar™ представляет собой 7-валентную пневмококковую конъюгатную вакцину. Способы получения сахаридных антигенов из S. agalactiae детально описываются в ссылочных документах 27 и 28. Капсулярные сахариды могут быть очищены по известным методикам, как описано в нескольких упомянутых здесь ссылочных документах.
Сахаридные антигены могут быть химически модифицированны. Например, они могут быть модифицированы для замещения одной или более гидроксильных групп блокирующими группами. Это особенно полезно для менингококковай серогруппы А, где ацетильные группы могут быть замещены блокирующими группами для предотвращения гидролиза [29]. Такие модифицированные сахариды являются сахаридами серогруппы А по смыслу настоящего изобретения.
Сахариды могут быть химически модифицированы по отношению к капсулярному сахариду, обнаруживаемому в природе. Например, сахарид может быть де-O-ацетилирован (частично или полностью), де-N-ацетилирован (частично или полностью), N-пропионирован (частично или полностью), и т.д. Де-ацетилирование можно осуществить до, во время или после конъюгирования, но предпочтительно до конъюгирования. В зависимости от конкретного сахарида, де-ацетилирование может влиять, а может не влиять на иммуногенность, напр., в вакцине NeisVac-C™ используется де-O-ацетилированный сахарид, в то время как в Menjugate™ - ацетилированный, но обе вакцины являются эффективными. Влияние де-ацетилирования и т.д. может быть оценено рутинными анализами.
Капсулярные сахариды могут быть использованы в форме олигасахаридов. Традиционно их получают фрагментированием очищенного капсулярного полисахарида (напр., гидролизом), за которым обычно следует очистка фрагментов желаемого размера. Фрагментирование полисахаридов предпочтительно осуществляют таким образом, чтобы получить окончательную среднюю степень полимеризации (DP) в олигосахариде менее чем 30. DP удобно измерять ионообменной хроматографией или колориметрическими анализами [30].
В случае, если проводят гидролиз, гидролизат обычно измеряют, чтобы удалить короткие олигосахариды [31]. Этого можно достичь различными путями, такими как ультрафильтрация с последующей ионообменной хроматографией. Для серогруппы А meningococcus предпочтительно удаляют олигосахариды со степенью полимеризации, менее или равной 6, а для серогрупп W135 и Y предпочтительно удаляют олигосахариды со степенью полимеризации менее чем примерно 4.
Конъюгаты: Носитель-Сахарид
Конъюгаты согласно изобретению могут включать небольшие количества свободного (т.е. неконъюгированного) носителя. Когда в композиции согласно изобретению данный протеин-носитель присутствует как в свободной, так и конъюгированной форме, неконъюгированная форма, предпочтительно, составляет не более 5% от общего количества протеина-носителя в композиции в целом и, более предпочтительно, присутствует в количестве менее 2% (по весу).
После конъюгации свободные и конъюгированные сахариды можно разделять. Существует много подходящих методов, включая гидрофобную хроматографию, тангенциальную ультрафильтрацию, диафильтрацию и т.д. [см. также ссылочные документы 32 и 33, и т.д.].
Может быть применена любая реакция конъюгации, с любым подходящим линкером, когда это необходимо. Предпочтительным является присоединение сахаридного антигена к носителю через -NH2-группу, напр., в боковой цепи лизинового или аргининового остатка в протеине-носителе. В случае, когда сахарид имеет свободную альдегидную группу, он может реагировать с амином носителя для формирования конъюгата посредством восстановительного аминирования. Присоединение может также осуществляться через -SH-группу, напр., в боковой цепи цистеинового остатка. Альтернативно, сахаридный антиген может быть присоединен к носителю через линкерную молекулу.
В типичном случае сахарид активируют или функционализируют до конъюгации. При активировании могут использоваться, например, цианилирующие агенты, такие как CDAP (напр., 1-циано-4-диметиламинопиридиний тетрафтороборат [34, 35 и т.д.]. В других подходящих методиках используются карбодиимиды, гидразиды, активные эфиры, норборан, р-нитробензойная кислота, N-гидроксисукцинимид, сульфо-N-гидроксисукцинимид (S-NHS), 1-(3-деметиламинопропил)-3-этилкарбодиимид (EDC), O-(N-сукцинимидил)N,N,N',N'тетраметил уроний тетрафтороборат (TSTU) (см. также введение в ссылочном документе 36).
Линкеры
Связывание через линкерную группу может быть выполнено, используя любую известную процедуру, например процедуры, описанные в ссылочных документах 37 и 38. Один тип связвывания предусматривает восстановительное аминирование сахарида, присоединение полученной аминогруппы к одному концу линкерной группы адипиновой кислоты и последующее присоединение протеина-носителя к другому концу линкерной группы адипиновой кислоты [39, 40]. Другие линкеры включают В-пропионамидо [41], нитрофенил-этиламин [42], галоацильные галогеновые соединения [43], гликозидные связи [44], 6-аминокапроновую кислоту [45], алкогольдегидразу (ADH) [46], части С2-С4 [47] и т.д. В качестве альтернативы использования линкера может быть применено прямое связывание. Прямые связывания с протеином могут включать окисление полисахарида с последующим восстановительным аминированием с помощью протеина, как описано, например, в ссылочных документах 48 и 49.
Предпочтительным является процесс, включающий введение в сахарид аминогрупп (напр., посредством замещения терминальных =O-групп на -NH2) с последующим получением производных с помощью адипинового диэфира (напр., N-гидроксисукцинимидо-диэфира адипиновой кислоты) и реакцию с протеином-носителем.
Для обеспечения соединения первой группы с аминогруппой сахарида и второй группы с носителем (в типичном случае для соединения с амином носителя) может быть использован бифункциональный линкер.
В этом случае первая группа бифункционального линкера должна быть способной реагировать с аминогруппой (-NH2) на сахариде. В типичном случае эта реакция включает электрофильное замещение водорода амина. Вторая группа бифункционального линкера должна быть способной реагировать с аминогруппой на носителе. Эта реакция в типичном случае также включает электрофильное замещение амина.
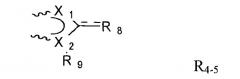
Таким образом, в случае, когда в реакции как с сахаридом, так и с носителем учавствуют амины, предпочтительно использовать бифункциональный линкер формулы X-L-X, где две Х-группы являются одинаковыми и могут реагировать с аминами, a L представляет собой связывающую часть в линкере. Предпочтительной Х-группой является N-оксисукцинимид. L предпочтительно имеет состав L'-L2-L', где L' - карбонил. Предпочтительными L2-группами являются прямые алкильные цепочки с 1-10 атомами углерода (напр., С1, С2, С3, C4, C5, С6, С7, C8, C9, С10), напр., -(СН2)4-.
Другими Х-группами являются те, которые образуют эфиры, когда соединяются с HO-L-ОН, такие как норборан, р-нитробензойная кислота и сульфо-N-гироксисукцинимид.
Другие бифункциональные линкеры для использования в данном изобретении включают акрилоилгалиды (напр,, хлорид) и галоацилгалиды.
Как правило, линкер может добавляться к модифицированному сахариду в молярном избытке.
После конъюгации свободные и конъюгированные сахариды могут быть разделены. Существует много подходящих методов, включая гидрофобную хроматографию, тангенциальную ультрафильтрацию, диафильтрацию и т.д. [см. также ссылочные документы 50 и 51, и т.д.].
В тех случаях, когда композиция согласно изобретению включает деполимеризованный сахарид, предпочтительно, чтобы деполимеризация предшествовала конъюгированию.
Другие антигены
Композиции согласно изобретению могут включать один или более (напр., 2, 3, 4, 5, 6, 7, 8, 9, 10 или более) других антигенов, таких как:
А. Бактериальные Антигены
Бактериальные антигены, подходящие для использования в изобретении, включают протеины, полисахариды, липополисахариды и визикулы наружних мембран, которые можно выделить, очистить или произвести из бактерий. Кроме того, бактериальные антигены могут включать бактериальные лизаты и инактивированные бактериальные препараты. Бактериальные антигены можно получить с помощью рекомбинантной экспрессии. Предпочтительно, бактериальные антигены включают эпитопы, которые располагаются на поверхности бактерий во время, по крайней мере, одной стадии их жизненного цикла. Предпочтительно, бактериальные антигены сохраняются в многочисленных серотипах. Бактериальные антигены включают антигены, происходящие из одной или более бактерий, перечисленных ниже, и ниже также приведены примеры специфических антигенов.
Neisseria meningitidis: менингококковые антигены могут включать протеины (такие, которые указаны в ссылочных документах 52-58), сахариды (включая полисахарид, олигосахарид или липополисахарид) или визикулы наружних мембран [59-62], очищенные или произведенные из серогрупп N. Meningitidis, таких как А, С, W135, Y и/или В. Менингококковые протеиновые антигены могут быть выбраны из адгезинов, аутопереносчиков, токсинов, поглощающих железо протеинов и связанных с мембраной протеинов (предпочтительно, интегральных наружных протеинов мембран). См. также ссылочные документы 63-71.
Streptococcus pneumoniae: антигены S. pneumoniae могут включать сахарид (включая полисахарид или олигосахарид) и/или протеин из S. pneumoniae. Протеиновые антигены могут быть выбраны, например, из протеина, идентифицированного в любом из ссылочных документов 72-77. Протеины S. pneumoniae могут быть выбраны из Полигистидинтриадного семейства (PhtX), семейства Холин-связывающих протеинов (СbрХ), усеченных СbрХ, семейства LytX, усеченных LytX, химерных протеинов: усеченный СbрХ- усеченный LytX, пневмолизина (Ply), PspA, PsaA, Sp128, Sp101, Sp130, Sp125 или Sp133. См. также ссылочные документы 78-84.
Streptococcus pyogenes (группа A Streptococcus): антигены Streptococcus группы А могут включать протеин, идентифицированный в ссылочном документе 85 или 86 (включая GAS40), соединение фрагментов GAS М-протеинов (включая те, которые описаны в ссылочных документах 87-89), фибронектин-связывающий протеин (Sfb1), Стрептококковый ассоциированный с гемом протеин (Shp) и Стрептолизин S (SagA). См. также ссылочные документы 85, 90 и 91.
Moraxella catarrhalis: антигены Moraxella включают антигены, идентифицированные в ссылочных документах 92 и 93, антигены, представляющие собой белок из мембранных везикул наружной поверхности (HMW-OMP), С-антиген и/или LPS. См. также ссылочный документ 94.
Bordetella pertussis: антигены pertussis включают голотоксин коклюша (РТ) и нитевидный гамагглютинин (FHA) из В. pertussis, необязательно, также в комбинации с пертактином и/или антигеном агглютиногенов 2 и 3. См. также ссылочные документы 95 и 96.
Staphylococcus aureus: антигены S. aureus включают капсулярные полисахариды типов 5 и 8 S. aureus, необязательно, конъюгированные с нетоксичным рекомбинантным экзотоксином A Pseudomonas aeruginosa, таким как StaphVAX™, или антигены, происходящие из протеинов поверхности, инвазинов (лейкоцидина, киназ, гиалуронидазы), поверхностных факторов, которые ингибируют поглощение фагоцитов (капсула, протеин А), каротеноидов, каталазных продуктов, протеина А, коагулазы, фактора свертывания крови и/или мембранно-разрушающих токсинов (при необходимости, детоксифицированных), которые лизируют мембраны эукариотических клеток (гемолизинов, лейкотоксина, лейкоцидина). См. также ссылочный документ 97.
Staphylococcus epidermis: антигены S. epidermidis включают ассоциированный со слизью антиген (SAA).
Clostridium tetani (столбняк): антигены столбняка включают токсоид столбняка (ТТ), предпочтительно используемый в качестве протеина-носителя в соединии/конъюгированного с композициями согласно настоящему изобретению.
Corynebacterium diphtheriae (дифтерия); дифтерийные антигены включают дифтерийный токсин или его детоксифицированный мутанты, такие как CRM197. Для комбинации/совместного введения/конъюгирования с композициями согласно настоящему изобретения дополнительно подразумеваются антигены, способные к модулированию, ингибированию или связанные путем АДФ-рибозилирования. Эти дифтерийные антигены могут использоваться как протеины-носители.
Haemophilus influenzae: антигены Н. influenzae включают сахаридный антиген из типа В или протеин D [98].
Pseudomonas aeruginosa: антигены Pseudomonas включают эндотоксин А, Wzz-протеин и/или белки визикул наружних мембран, включая белок F визикул наружних мембран (OprF) [99].
Legionella pneumophila. Бактериальные антигены могут происходить из Legionella pneumophila.
Streptococcus agalactiae (группа В Streptococcus): антигены Streptococcus группы В включают протеиновые антигены, идентифицированные в ссылочных документах 85 и 100-103. Например, антигены включают протеины GBS80, GBS104, GBS276 и GBS322.
Neisseria gonorrhoeae: гонококковые антигены включают Роr (или порин)-протеин, такой как PorB [104], транспортный связывающий протеин, такой как ТbрА и TbpB [105], протеин мутности (такой как Ора), протеин модифицируемый восстановлением (Rmp) и препараты визикул наружних мембран (OMV) [106]. См. также ссылочные документы 52-54 и 107.
Chlamydia trachomatis: антигены С. trachomatis включают антигены, происходящие из серотипов А, В, Ва и С (возбудитель трахомы, причина слепоты), серотипов L1, L2 и L3 (ассоциированных с Lymphogranuloma venereum) и серотипов D-K. Антигены С. trachomatis могут также включать антиген, идентифицированный в ссылочных документах 103 и 108-110, включая РерА (СТ045), LcrE (CT089), ArtJ(CT381), DnaK (СТ396), СТ398, OmpH-подобный (СТ242), L7/L12 (СТ316), OmcA (CT444), AtosS (CT467), CT547, Eno (CT587), HrtA (CT823) и MurG (CT761). См. также ссылочный документ 111.
Treponema pallidum (сифилис): антигены сифилиса включают TmpA-антиген.
Haemophilus ducreyi (вызывающий мягкий шанкр); антигены Ducreyi включают протеин наружних мембран (DsrA).
Enterococcus faecalis или Enterococcus faecium: антигены выключают трисахаридный повтор или другие происходящие из Enterococcus антигены, идентифицированные в ссылочном документе 112.
Helicobacter pylori: антигены H. pylori включают Cag, Vac, Nap, HopX, HopY и/или уреазный антиген [113-123].
Staphylococcus saprophyticus: антигены включают гемагглютинин 160 кДа из S. saprophyticus.
Yersinia enterocolitica: антигены включают LPS [124].
Escherichia coli: антигены E.coli могут происходить из штаммов энтеротоксикогенной Е. coli (ЕТЕС), энтероаггрегативной Е. coli (EAggEC), диффузионно адгезирующей Е. coli (DAEC), энтеропатогенной Е. coli (EPEC) и/или энтерогеморрагической E. coli (EHEC).
Bacillus anthracis (сибирская язва): антигены В. anthracis необязательно детоксифицируют и могут быть выбраны из А-компонентов (летальный фактор (LF) и фактор водянки (EF)), которые оба могут иметь общий В-компонент, известный как защитный антиген (РА). См. ссылочные документы 125-127.
Yersinia pestis (чума): антигены чумы включают F1-капсулярный антиген [128], LPS [129], V-антиген [130].
Mycobacterium tuberculosis: туберкулезные антигены включают липопротеины, LPS, BCG-антигены, слитый протеин антигена 85В (Ag85B) и/или ESAT-6, необязательно в составе катионных липидных везикул [131], Mycobacterium tuberculosis (Mtb) антигены, ассоцированные с изоцитрат дегидрогеназой [132], и/или МРТ51-антигены [133].
Rickettsia: антигены включают протеины наружной мембраны, включая протеин А и/или В наружной мембраны (OmpB) [134], LPS, антиген, состоящий из поверхностного белкового протеина (SPA) [135].
Listeria monocytogenes: бактериальные антигены могут происходить из Listeria monocytogenes.
Chlamydia pneumoniae: антигены включают те, которые идентифицированы в ссылочных документах 108 и 136-141.
Vibrio cholerae: антигены включают протеиназные антигены, в частности липополисахариды Vibrio cholerae II, O1 Inaba O-специфичные полисахариды, V. cholera 0139, антигены вакцины 1ЕМ108 [142] и/или токсин Zonula occludens (Zot).
Salmonella typhi (лихорадка брюшного тифа): антигены включают капсулярные полисахариды, предпочтительно конъюгаты (Vi, напр., vax-TyVi).
Borrelia burgdorferi (болезнь Лайма): антигены включают липопротеины (такие как OspA, OspB, Osp С и Osp D), другие поверхностные протеины, такие как OspE-связанные протеины (Erps), декорин-связывающие протеины (такие как DbpA) и антигенно вариабильные VI-протеины, такие как антигены, ассоциированные с Р39 и Р13 (интегральный протеин мембраны, [143]), и VlsE-протеин антигенной изменчивости [144].
Porphyromonas gingivalis: антигены включают протеин наружней мембраны (ОМР). См. также ссылочный документ 145.
Klebsiella: антигены включают ОМР, включая ОМР А, или полисахарид, при необходимости конъюгированный с токсоидом столбняка.
Другие бактериальные антигены могут быть капсулярными антигенами, сахаридными антигенами или протеиновыми антигенами любой из упомянутых выше бактерий. Кроме того, бактериальные антигены могут также включать препарат везикул наружней мембраны (OMV). Дополнительно, антигены включают живые, аттенюированные и/или очищенные разновидности любой из вышеупомянутых бактерий. Антигены, используемые в настоящем изобретении, могут происходить из грамотрицательных и/или грамположительных бактерий. Антигены, используемые в настоящем изобретении, могут происходить из аэробных и/или анаэробных бактерий.
В. Вирусные Антигены
Вирусные антигены, подходящие для использования в данном изобретении, включают инактивированный (или убитый) вирус, аттенюированный вирус, препараты расщепленного вируса, препараты очищенных субъединиц, вирусные протеины, которые могут быть выделены, очищены или произведены из вируса, и Вирусоподобные Частицы (VLPs). Вирусные антигены могут быть произведены из вирусов, размноженных на клеточной культуре или другом субстрате. Альтернативно, вирусные антигены могут быть экспрессированы рекомбинантно. Вирусные антигены предпочтительно включают эпитопы, которые расположены на поверхности вируса во время, по крайней мере, одной стадии его жизненного цикла. Предпочтительно, вирусные антигены сохраняются в многочисленных серотипах или изолятах. Вирусные антигены включают антигены, происходящие из одного или более вирусов, перечисленных ниже, и ниже также приведены примеры специфических антигенов.
Ортомиксовирус: вирусные антигены могут происходить из ортомиксовируса, такого как Influenza А, В и С. Ортомиксовирусные антигены могут быть выбраны из одного или более вирусных протеинов, включая гемагглютинин (НА), нейраминидазу (NA), нуклеопротеин (NP), протеин матрикса (M1), мембранный протеин (М2), один или более транскриптазных компонентов (РВ1, РВ2 и РВ3). Предпочтительные антигены включают НА и NA.
Антигены Influenza могут происходить из межпандемических (ежегодных) штаммов гриппа. Альтернативно, антигены гриппа могут происходить из штаммов, способных вызывать вспышки пандемии (т.е., штаммов гриппа с новым гемагглютинином по сравнению с гемагглютинином в штаммах, циркулирующих в данное время, или штаммов гриппа, которые являются патогенными для представителей птиц и имеют способность передаваться горизонтально в человеческой популяции, или штаммов гриппа, которые являются патогенными для человека).
Вирусы Paramyxoviridae: вирусные антигены могут происходить из вирусов Paramyxoviridae, таких как Пневмовирусы (RSV), Парамиксовирусы (PIV) и Морбилливирусы (кори) [146-148].
Пневмовирус: вирусные антигены могут происходить из Пневмовируса, такого как Респираторный синцитиальный вирус (RSV), Респираторный синцитиальный вирус крупного рогатого скота, Вирус пневмонии мышей и Вирус ринотрахеита индеек. Предпочтительно, пневмовирусом является респираторно-синцитиальный вирус (RSV). Пневмовирусные антигены могут быть выбраны из одного или более следующих протеинов, включая поверхностные протеины Слияния (F), Гликопротеин (G) и Малый Гидрофобный протеин (SH), матриксные протеины М и М2, нуклеокапсидные протеины N, Р и L и неструктурые протеины NS1 и NS2. Предпочтительные пневмовирусные антигены включают F, G и М. См., например, ссылочный документ 149. Пневмовирусные антигены могут также входить в состав или произведенными из химерных вирусов. Например, химерные RSV/PIV-вирусы могут включать компоненты как RSV, так и PIV.
Парамиксовирус: вирусные антигены могут происходить из Парамиксовируса, такого как вирус Парагриппа типов 1-4 (PIV), Свинки, вирус Сендай, Симиан-вирус 5, вирус Парагриппа крупного рогатого скота и вирус Ньюкаслской болезни. Предпочтительно, Парамиксовирус представляет собой PIV или вирус Свинки. Парамиксовирусные антигены могут быть выбраны из одного или более следующих протеинов: Гемагглютинин-Нейраминидаза (HN), слитые протеины F1 и F2, Нуклеопротеин (NP), Фосфопротеин (Р), Большой протеин (L) и Матриксный протеин (М). Предпочтительные парамиксовирусные протеины включают HN, F1 и F2. Парамиксовирусные антигены могут также входить в состав или произведенными из химерных вирусов. Например, химерные RSV/PIV-вирусы могут включать компоненты как RSV, так и PIV. Коммерчески доступные про