Способ прогнозирования развития профессиональных злокачественных новообразований кожи у работников производства стекловолокна
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к молекулярно-генетической диагностике в онкологии, и касается способа прогнозирования развития профессиональных злокачественных новообразований кожи у работников производства стекловолокна. Из периферической венозной крови выделяют ДНК, проводят анализ dup16bp полиморфизма 3 интрона и Arg72Pro полиморфизма 4 экзона гена ТР53. При выявлении сочетания генотипов *Arg/*Pro и *W/*dup16 прогнозируют риск развития злокачественных новообразований кожи. При обнаружении генотипов *Arg/*Arg и *W/*W прогнозируют устойчивость к формированию заболевания. Изобретение обеспечивает получение прогностических критериев развития злокачественных новообразований кожи или устойчивости к ним у работников производства стекловолокна на основе молекулярно-генетических маркеров. 3 табл., 2 пр.
Реферат
Изобретение относится к медицине, а именно к области молекулярной биологии и генетики и может быть использовано в онкологии для прогнозирования развития злокачественных новообразований кожи у работников производства стекловолокна, подвергшихся воздействию замасливателей в условиях нагревающего микроклимата.
Ежегодно в мире регистрируется рост новых случаев злокачественных новообразований и смертей от них.
Определенный вклад в формировании злокачественных новообразований вносит профессионально обусловленный рак. Развитие промышленности, производство новых химических веществ сопровождается все большим числом контингента, контактирующего с неблагоприятными производственными факторами, вызывающими развитие профессиональных онкологических заболеваний. Замасливатели представляют собой эмульсии или водные растворы, содержащие до 20-25 химических веществ. Ряд из них (эпихлоргидрин, формальдегид, акрилонитрил) канцерогенны для человека.
В процессе производства непрерывного стекловолокна, операторы подвергаются комбинированному (паро-газоаэрозольная смесь компонентов нескольких замасливателей) и комплексному воздействию химических агентов (одновременное ингаляционное и эпикутанное поступление в организм в результате обильного загрязнения замасливателями кожных покровов) в сочетании с пылью стекловолокна и нагревающим микроклиматом. У рабочих клинические изменения на коже рук однотипные и характеризуются четкой локализацией процесса на местах непосредственного соприкосновения с производственными раздражителями. На коже пальцев кистей и предплечий на фоне выраженной сухости и неравномерности пигментации определяются очаги ограниченного гиперкератоза с бородавчатыми разрастаниями. По истечении ряда лет у больных наступает малигнизация патологического процесса на коже. Таким образом, у рабочих наблюдается закономерность формирования рака кожи через промежуточные стадии гиперпигментации и ограниченного гиперкератоза, что обосновывает отнесение ограниченного гиперкератоза к предраку высокой степени риска.
Известен способ прогнозирования развития метахронного рака кожи, характеризующийся тем, что определяют флюориметрически содержание витамина Е в лимфоцитах периферической крови, при уровне содержания витамина Е, равном или выше 18,9 усл.ед., прогнозируют возможность развития метахронно развивающихся очагов рака кожи [патент RU 2241232, 2004 г.].
Ведущими факторами в детерминации онкологического риска являются воздействие неблагоприятных факторов окружающей среды и нарушения в системе поддержания стабильности клеточного генома. Одним из ключевых генов, обеспечивающих регуляцию клеточного деления и поддержания стабильности генома, является ген-онкосупрессор TP 53, локализованный на 17 хромосоме. При повреждении ДНК белок р53 блокирует прогрессию клеточного цикла в контрольных точках, препятствуя, таким образом, репликации ДНК до репарации повреждения. В случае невозможности репарации белок р53 запускает механизм апоптоза [Kastan MB, Onyekwere О, Sidransky D at al. Participation of p53 protein in the cellular response to DNA damage. // Cancer Res. - 1991. - V.51, №23. - P.6304-6311].
Ген белка p53 {TP53) включает более 19 полиморфизмов, из которых три считаются наиболее функционально значимыми: в 4-м экзоне и в 3-м и 6-м интронах. Полиморфизм в 72-м кодоне 4-го экзона, обуславливающий замену аминокислоты аргинина (Arg) на пролин (Pro), связан с регуляцией апоптических механизмов, с нарушением которых ассоциировано развитие онкологических заболеваний, таких как рак легкого, кожи, шейки матки [Wu X., Zhao Н., Amos C.I. et al. P53 genotypes and haplotypes associated with lung cancer susceptibility and ethnicity. // J. Natl. Cancer Inst. 2002. Vol.94. №9. P. - 681-690]. В ряде исследований показано, что *Arg-форма TP 53 значительно более эффективно, чем *Pro-форма, запускает программированную клеточную смерть [Dumont P., Leu J.I., Della Pietra A.C. 3rd et al. The codon 72 polymorphic variants of p53 have markedly different apoptotic potential. Nat. Genet. // 2003. Vol.33 №3. P. - 357-365]. Полиморфизм гена TP53 в 3-м интроне обусловлен дупликацией 16 пар нуклеотидов (dup 16 bp), может влиять на эффективность эспрессии гена и, как следствие, приводить к снижению апоптического индекса и эффективности репарации ДНК. Рядом авторов были обнаружены ассоциации неблагоприятного (минорного) аллеля по полиморфизму в 3 интроне с различными онкологическими заболеваниями [Wang-Gohrke S., Becher Н., Kreienberg R. et al. Intron 3 16 bp duplication polymorphism of p53 is associated with an increased risk for breast cancer by the age of 50 years. // Pharmacogenetics. 2002. Vol.12, №3. P. - 269-272]. Установлено, что полиморфизм данного интрона приводит к снижению эффективности экспрессии гена и может быть причастен к нарушению процессов активации транскрипции генов-мишеней, необходимых для остановки клеточного цикла и запуска апоптоза [Liang Н, Lunec J. Characterisation of a novel p53 downregulated promoter in intron 3 of the human MDM2 oncogene. // Gene. 2005. Vol.361. P.112-118]. В работе Wu и соавт. было обнаружено выраженное снижение показателей апоптотического индекса и эффективности репарации ДНК лимфобластных клеток по мере увеличения числа минорных аллелей в каждом локусе гена ТР53 [Wu X., Zhao Н., Amos C.I. et al. P53 genotypes and haplotypes associated with lung cancer susceptibility and ethnicity. // J. Natl. Cancer Inst. - 2002. - Vol.94. - №9. P.681-690]. Несомненно, различия в апоптотической активности белка р53 оказывают влияние на эффективность предотвращения развития патологий и свидетельствуют о функциональной значимости генотипических комбинаций гена ТР53.
Известен способ прогнозирования развития меланомы (злокачественная опухоль, развивающаяся из меланоцитов кожи) в европейских популяциях, заключающийся в том, что проводят анализ Arg72Pro полиморфизма гена ТР53, при выявлении носительства генотипа *Arg/*Arg прогнозируют повышенный риск развития меланомы (OR=1,28; 95% СI 1,05-1,55) [Chunying LI, Kexin chen, Zhengsheng Liu et al. Polymorphisms of TP53 Arg72Pro, but not p73 G4C14>A4TA4 and p21 Ser31Arg, contribute to risk of cutaneus melanoma. // J Invest Dermatol. - 2008. - V.128. - N.6. - P.1585-1588]. Данный способ взят за прототип. Однако исследования предрасположенности к развитию эпителиальных злокачественных опухолей кожи (базальноклеточный рак, плоскоклеточная карцинома) не выявили связи ассоциации Arg72Pro полиморфизма гена ТР53 с заболеванием [Almquist LM, Kagaras MR, Welsh MM et al. The role of TP53 and MDM2 polymorphisms in TP53 mutagenesis and risk of non-melanoma skin cancer].
Задачей изобретения является разработка способа прогнозирования развития злокачественных новообразований кожи у работников, контактирующих с комплексом химических веществ.
Технический результат - получение прогностических критериев риска развития злокачественных новообразований кожи у работников производства стекловолокна на основе выявления молекулярно-генетических маркеров.
Указанный технический результат достигается тем, что из лимфоцитов периферической венозной крови выделяют ДНК, проводят анализ полиморфизма dup 16 bp d в 3 интроне и Arg72Pro полиморфизма 4 экзона гена ТР53, при выявлении сочетания генотипов *Arg/*Pro-*W/*dup16 прогнозируют риск развития злокачественных новообразований кожи, при определении гомозиготных генотипов *Arg/*Arg в 4-м экзоне и *W/*W в 3-м интроне прогнозируют устойчивость к формированию злокачественных новообразований кожи.
Предлагаемый способ осуществляется следующим образом.
Венозную кровь в объеме 5 мл забирают в пробирки, содержащие ЭДТА в качестве антикоагулянта, и тщательно перемешивают. Для выделения ДНК используют метод выделения ДНК из крови фенольно-хлороформной экстракцией, описанный Мэтью [Mathew С.С. The isolation of high molecular weight eukaryotic DNA. // Methods in Molecular Biology. / Ed. Walker J.M., N.Y., L.: Human Press. - 1984. - V.2. - P.31-34].
1. Кровь в пробирке с консервантом тщательно перемешивается и переливается в центрифужный стакан на 50 мл, туда же добавляют 30 мл охлажденного лизирующего буфера, содержащего 320 мМ сахарозы, 1% раствор тритона Х-100, 5 мМ MgCl2, 10 мМ трисНСl (рН 7,6).
2. Смесь центрифугируют 20 мин при 4000 об/мин, при 4°С.
3. Надосадочную жидкость сливают, добавляют 15 мл лизирующего буфера, перемешивают с осадком, центрифугируют 10 мин при 4000 об/мин, при 4°С.
4. Надосадочную жидкость сливают, к получившемуся осадку приливают 0,5 мл 25 мМ ЭДТА, рН 8,0, суспензируют.
5. К суспензии добавляют 40 мкл 10% SDS и протеиназу К (концентрация - 10 мг/мл). Смесь для лизиса оставляют на ночь в термостате при температуре 37°С.
Далее проводят фенол-хлороформную экстракцию ДНК с последующим осаждением 96% этанолом и центрифугированием в течение 10 мин при 10000 об/мин Образовавшийся осадок ДНК растворяют в деионизированной воде, раствор хранят при -20°С.
Оценка полиморфизмов гена ТР53 проводят с помощью полимеразной цепной реакции (ПНР) - (dup 16 bp d в 3 интроне) и ПЦР-ПДРФ (полиморфизм длины рестрикционных фрагментов) анализа (Arg72Pro полиморфизм 4 экзона). ПЦР проводят в амлификаторе «Терцик» фирмы ДНК-Технология. При этом для каждого из полиморфизмов используют специфические праймеры и условия реакции. Последовательности специфических праймеров представлены в таблице 1. ПЦР проводят в объеме 25 мкл следующего состава: по 6 пмоль каждого праймера, четыре дезоксинуклеозидтрифосфата (каждый в концентрации 0,2 мМ), 1 мкл геномной ДНК, Taq-полимеразу («Sileks»), буфер для Taq-полимеразыи и необходимое количество деионизированной воды до объема 25 мкл. Режим амплификации следующий: денатурация (94°С, 5 мин) - 1 цикл; денатурация (94°С, 30 сек), отжиг (60, 61°С, 40 сек) и элонгация (72°С, 30 сек) - 30 циклов; конечная элонгация (72°С, 5 мин) - 1 цикл.
Для рестрикционного анализа продукты ПЦР подвергают обработке рестриктазой Bshl236I («Fermentas)» в течение 6 часов. На реакцию рестрикции берут 5 мкл ампликона, 0,5 рестриктазы (3-4 Ед) и 1 мкл 10Х буфера для рестриктазы.
Результаты амплификации и рестрикции оценивают с помощью вертикального электрофореза в 6-8% полиакриламидном геле (исходное соотношение акриламида и метиленбисакриламида 29:1) при напряжении 200-300 В (10 В/см). По окончании электрофореза гель окрашивают раствором бромистого этидия (0.1 мкг/мл) в течение 15 минут с последующей визуализацией в ультрафиолетовом свете на трансиллюминаторе. Размер фрагментов определяют с помощью стандарта массы 500 п.о. - Ladder фирмы «Fermentas». О наличии в образце определенных аллельных вариантов судят по появлению в геле фрагментов с размерами, указанными в таблице 1.
Нами были исследованы образцы ДНК у 67 больных с гиперкератозом и раком кожи, которые по профессии были операторами получения непрерывного стекловолокна ОАО «Стеклонит». У 20 человек из обследованных установлен рак кожи, у 47 - диагностирован профессиональный гиперкератоз кистей и предплечий. Группу сравнения составили 42 практически здоровых оператора получения непрерывного стекловолокна со стажем работы более 10 лет.
Ассоциацию генотипов с развитием заболевания выявляли, сравнивая выборки больных и здоровых индивидов по частоте одного признака с использованием критерия χ2 с поправкой Йетса на непрерывность. Если абсолютное число наблюдений хотя бы в одной ячейке таблицы было 5 и менее, то применялся точный критерий Фишера. Статистически значимыми считали различия при р<0.05.
Относительный риск заболевания по конкретному признаку вычисляли как соотношение шансов (OR -odds ratio). Для этого используют формулу, предложенную Бландом [Bland J.M., Altman D.G. / The odds ratio // Br. Med. J. - 2000. - Vol.320. - P.1468]:
OR=(a×d)/(b×c),
где a - частота генотипа в выборке больных, b - частота генотипа в контрольной выборке, с - сумма частот остальных генотипов в выборке больных, d - сумма частот остальных генотипов в контрольной выборке.
Значение OR=1 показывало отсутствие ассоциации, значение OR>1 рассматривали как положительную ассоциацию заболевания с признаком («фактор риска»), OR<1 - как отрицательную ассоциацию («фактор устойчивости»).
В ходе исследования нами проанализировано распределение генотипов полиморфизмов гена ТР53 в общей выборке больных с профессиональным гиперкератозом и раком кожи, а также в группе сравнения для выяснения их взаимосвязи с риском развития онкологических заболеваний кожи. По исследуемым локусам отклонения от равновесия Харди-Вайнберга в изученных группах обнаружено не было.
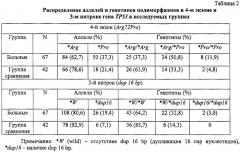
При изучении распределения Arg72Pro полиморфизма гена ТР53 показано, что частота встречаемости генотипа *Arg/*Arg значительно ниже у группы больных (37,3%), чем у здоровых рабочих (61,9%; χ2=5,32, р=0,021; OR=0,37). Кроме того, частота *Pro аллеля у больных в 1,74 раза выше (χ2,35, р=0,02). Значение OR свидетельствует об ассоциации *Pro аллеля с риском возникновения онкологических заболеваний кожи профессионального генеза (OR=2,18, 95% CI 1,16-4,09).
В группе здоровых рабочих выявлено существенное повышение частоты гомозиготных генотипов *W/*W по 3-му интрону (85,7%) против 64,2%, р=0,026; OR=0,30, 95% CI 0,11-0,81) при снижении частоты гетерозиготных генотипов *W/*dup16 (14,3% против 32,8%), р=0,053). При этом в группе больных обнаружено значимое повышение частоты неблагоприятного (минорного) аллеля *dub16 по сравнению с контрольной выборкой (χ2=5,26, р=0,022; OR=3,13, 95% CI 1,23-7,97) (таблица 2).
Для исследованных групп был также выполнен анализ генотипических комбинаций Arg72Pro и dup 16 bp полиморфизмов гена ТР53. Из 7 различных сочетаний генотипов двух локусов статистически значимые различия между выборками были обнаружены для комбинации гетерозиготных генотипов *Arg/*Pro-*W/*dup16. Было выявлено статистически значимое повышение частоты данной комбинации генотипов у больных по сравнению с контролем (22,4% и 4,8%, соответственно; χ2=4,82, р=0,028). При сочетании гетерозиготных генотипов *Arg/*Pro-*W/*dup16 вероятность развития заболевания повышается примерно в 5 раз (OR=5,76, 95% CI 1,15-38,83), что дает возможность рассматривать данную комбинацию как рисковую (таблица 3).
Таким образом, установлено, что минорные аллели гена ТР53 *Pro и *dup16 ассоциированы с повышенным риском развития заболевания и негативное влияние минорных аллелей усиливается при их совместном наследовании. Сочетание генотипов *Arg/*Pro-*W/*dup16 гена ТР53 является фактором, повышающим риск развития онкологических заболеваний кожи профессионального генеза у операторов непрерывной нити стекловолокна. Носительство гомозиготных генотипов *Arg/*Arg в 4-м экзоне и *W/*W в 3-м интроне гена ТР53, напротив, ассоциировано с пониженным риском развития онкопатологий.
Пример 1
Больной М., 1948 г. р., находился на диспансерном наблюдении в ФГУН УфНИИ медицины труда и экологии человека Роспотребнадзора с 2002 г. с диагнозом ограниченный гиперкератоз кистей и предплечий. Работал оператором получения непрерывного стекловолокна на ОАО «Стеклонит» в течение 18 лет.
Проведено исследование по предлагаемой методике. Установлено: является носителем сочетания генотипов *Arg/*Pro-*W/*dup16. В отношении развития злокачественных новообразований кожи прогноз неблагоприятный.
При осмотре при очередном освидетельствовании, в центре наиболее крупных гиперкератозов обнаружены язвочки с воспалительным валиком по периферии. Больной направлен в Республиканский онкологический диспансер, где была проведена биопсия пораженного участка. При гистологическом исследовании выявлен ороговевший плоскоклеточный рак. Проведено иссечение опухоли, лучевая терапия.
Пример 2. Больной Т., 1963 г. р., работает оператором получения непрерывного стекловолокна на ОАО «Стеклонит» в течение 15 лет. Находился на стационарном лечении в ФГУН УфНИИ медицины труда и экологии человека Роспотребнадзора с диагнозом ВСД смешанного типа, цервикалгия, хроническая пояснично-крестцовая радикулопатия. Проведено исследование по предложенной методике. Установлено: является носителем гомозиготных генотипов *Arg/*Arg и *W/*W гена ТР53. В отношении развития злокачественных новообразований кожи прогноз благоприятный. При осмотре кожных покровов патологии не выявлено.
Способ оценки предрасположенности к развитию профессиональных злокачественных новообразований кожи, характеризующийся тем, что из периферической венозной крови выделяют ДНК, проводят анализ полиморфизма dup 16 bp в 3 интроне и Arg72Pro полиморфизма 4 экзона гена ТР53, при выявлении сочетания генотипов *Arg/*Pro-*W/*dup16 прогнозируют риск развития злокачественных новообразований кожи, при определении гомозиготных генотипов *Arg/*Arg в 4-м экзоне и в 3-м интроне прогнозируют устойчивость к формированию злокачественных новообразований кожи.