Фармацевтическая композиция, обладающая стресс-протекторным действием, и способ профилактики и лечения функциональных или стресс-индуцированных нарушений
Иллюстрации
Показать всеИзобретение относится к фармацевтической композиции, обладающей стресс-протекторным действием, которая включает пептид R1-Lys1-Arg2-Pro3-R2 [SEQ ID NO:1] или R1-Lys1-Arg2-Arg3-Pro4-R2 [SEQ ID NO:2], где R1=NH2 или СН3СО и R2=ОН или NH2, и к способу профилактики и/или лечения функциональных или стресс-индуцированных нарушений, возникающих при экстремальных воздействиях. 2 н. и 1 з.п. ф-лы, 9 табл., 7 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к биохимии, конкретнее к биологически активным пептидам, обладающим стресс-протекторной активностью, которые могут найти применение в медицине и фармакологии.
Предшествующий уровень техники
Стресс (от английского stress - напряжение) - это одна из общих неспецифических нервно-гуморальных реакций организма на действие "чрезвычайных" раздражителей (стрессоров), которая в основном определяется деятельностью гипоталамуса, гипофиза и коры надпочечников (Selye H. The physiology and pathology of exposure to stress. Montreal, 1950; Selye H. The stress of life. N. Y., 1956). Биологический смысл и назначение стресса - повысить общую сопротивляемость, неспецифическую устойчивость живой системы по отношению к действующему стимулу и другим стрессорам. Клинически стресс проявляется в виде общего адаптационного синдрома. Общий адаптационный синдром, как и всякая реакция, имеет свои закономерности развития и состоит из трех стадий: 1) реакция тревоги, 2) стадия резистентности, 3) стадия истощения.
Стрессоры - внешние или внутренние воздействия, приводящие к возникновению стрессовых состояний. К ним могут относиться сильные физические и психические травмы, кровопотеря, мышечные нагрузки, инфекции. Действие стрессоров приводит к увеличению секреции гипоталамического кортикотропин-рилизинг-гормона, который, по воротной системе сосудов, поступает в переднюю долю гипофиза и стимулирует здесь секрецию адренокортикотропного гормона (кортикотропина, АКТГ). Кортикотропин выделяется в кровь, достигает коры надпочечников и стимулирует образование в ее клетках глюкокортикоидов. В результате происходит централизация кровообращения: повышенное поступление крови в мышцы и уменьшение кровоснабжения периферических тканей (Charmandari E., Tsigos С., Chrousos G. Endocrinology of the stress response. // Annu. Rev. Physiol. - 2005. - V.67. - P.259-84).
Избыточное выделение гормонов надпочечников, вызванное продолжительным или чрезмерно интенсивным действием стрессора, может привести к патологическим процессам (некрозам, подавлению воспалительных реакций, которые являются важным биологически барьером, ограничивающим распространение инфекции в организме т.д.) и развитию болезни адаптации (Seres J., Stancikova M., Svik K. et al. Effects of chronic food restriction stress and chronic psychological stress on the development of adjuvant arthritis in male long evens rats. // Ann N Y Acad Sci. - 2002. - V.966. - P.315-9). Когда организм ослаблен или стрессорное воздействие оказывается чрезвычайно сильным, адаптационные возможности организма снижаются.
Многие исследователи возлагают большие надежды на возможность коррекции ответа организма на стрессор с помощью экзогенных антиоксидантных препаратов, которые препятствуют развитию патологических процессов, инициированных стресс-факторами (Terao Т., Mizuki Т., Ohji Т. et al. Antidepressant effect of lithium in patients with systemic lupus erythematosus and cerebral infarction, treated with corticosteroid. // Br J Psychiatry. - 1994. - V.164. - P.109-11). Поэтому разработка новых эффективных и безопасных средств, способных повышать устойчивость организма к стрессору - это важная и актуальная задача современной биохимии и фармакологии.
В настоящее время биологически активные пептиды, производные природных пептидных гормонов, рассматривают как потенциальные лекарственные средства нового класса. Такие качества пептидов, как быстрая реакция организма на их введение, практически полное отсутствие токсичности, а также тот факт, что продуктами деградации пептидов являются аминокислоты, все больше привлекают внимание фармакологов и клиницистов во всем мире. В связи с тем, что эндогенные пептидные гормоны осуществляют несколько функций в организме, применение их в качестве лекарственных препаратов затруднительно. Поэтому основной задачей при конструировании новых лекарственных средств на базе природных пептидов является синтез селективно действующих аналогов с узким спектром действия, устойчивых к ферментативному расщеплению.
К сожалению, в данной области защиты организма от стрессора препаратов на основе пептидов мало. Необходимо расширение ассортимента безопасных и эффективных лекарственных средств, чтобы удовлетворить потребности всех групп населения, в том числе беременных и кормящих женщин, детей младшего возраста, водителей.
Известен препарат под торговым названием семакс (Метионил-глутамил-гистидил-фенилаланил-пролил-глицил-пролин NH2-Met1-Gln2-His3-Phe4-Pro5-Gly6-Pro7-OH) - синтетический аналог фрагмента кортикотропина 4-10 (а.с. СССР №939440, кл. С07С 103/52, опублик. 30.06.1982), обладающий выраженными антигипоксическими свойствами, свойством корригировать изменения в системе биогенных аминов (серотонина в стволе мозга и селезенке, адреналина и норадреналина в надпочечниках) в постреанимационном периоде после геморрагического шока (Bastrikova N.A., Shestakova S.V., Antonova S.V. et al. The biogenic amine content of rat tissues in the post resuscitation period following hemorrhagic shock and the effect of the preparation semax. // Patol. Fiziol. Eksp. Ter. - 1999. - №3. - P.19-22). В условиях нервно-психического утомления семакс облегчает концентрацию внимания, улучшает операторскую деятельность, способствует сохранению и ускоряет восстановление умственной работоспособности. Семакс улучшает адаптацию организма к гипоксии, церебральной ишемии, наркозу и другим повреждающим последствиям (Ашмарин И.П., Левицкая Н.Г., Каменский А.А., Мясоедов Н.А. Семакс - новое лекарственное средство для коррекции кровообращения мозга, гипоксических состояний и повышения умственной трудоспособности. // Фарматека. - 1997. - №4. - С.32-33).
Однако, действие этого препарата в условиях гипобарической гипоксии, холодового и теплового воздействия не изучено. Кроме того, для получения этого пептида требуется дорогой синтез.
Известен пептид глутамил-аспартил-глицин общей формулы NH2-Glu1-Asp2-Gly3-OH, обладающий стресс-протекторным действием (патент РФ 2304444, опубл. 20.08.2007). Применение пептида при внутримышечном или интраназальном введении позволяет регулировать уровень биогенных аминов в коре головного мозга и крови, влияя на экспрессию гена c-fos в различных структурах головного мозга и снижая активность энкефалиназ в крови, осуществляя таким образом стресс-протекторное действие.
Однако стресс-протекторную активность пептида глутамил-аспартил-глицин исследовали только на модели эмоционального стресса «открытое поле» и осмотического стресса. Действие этого пептида в условиях гипобарической гипоксии или геморрагического шока, теплового и холодового стресса неизвестно.
Известны кортикотропинподобные циклопептиды I и II, имеющие следующую аминокислотную последовательность: Cyclo(Gly1-Lys2-Val3-Leu4-Lys5-Lys6-Arg7-Arg8)n, где n=2-3, обладающие стресс-протекторной активностью (патент РФ №2330860, опубл. 10.08.2008). Однако эти пептиды требуют сложного и дорогого синтеза.
Известен пептид иммунокортин NH2-Val1-Lys2-Lys3-Pro4-Gly5-Ser6-Ser7-Val8-Lys9-Val10-OH (Mitin Y.V., Navolotskaya E.V. et al. Synthesis and properties of the peptides corresponding to the ACTH-like sequence of human immunoglobulin G1 Int. // J.Peptide Protein Res. - 1993. - V.41 - P.517-521). Однократная внутримышечная инъекция иммунокортина крысам в дозе 10 мкг/кг приводит к снижению содержания кортикостерона в надпочечниках и крови. Однако для получения этого пептида требуется дорогой синтез.
Известны пептиды Lys-Arg-Pro (патент US 4677840 А, 18.08.1987), обладающие гипотензивной активностью, и Lys-Arg-Arg-Pro (Ковалицкая Ю.А. и др. "Синтетический пептид KKRR, соответствующий фрагменту 15-18 адренокортикотропного гормона человека, является его антагонистом». Биоорганическая химия, 2008, т.34, №1, с.29-34). Однако стресс-протекторная активность этих пептидов неизвестна.
Задача, на решение которой направлено предлагаемое изобретение, состоит в расширении ассортимента эффективных средств, повышающих устойчивость организма к стрессовому воздействию и получаемых простым синтезом.
Поставленная задача решается тем, что предложена фармацевтическая композиция, обладающая стресс-протекторным действием, характеризующаяся тем, что в качестве активного начала содержит эффективное количество пептида R1-Lys1-Arg2-Pro3-R2 [SEQ ID NO:1] или R1-Lys1-Arg2-Arg3-Pro4-R2 [SEQ ID NO:2], где R1=NH2 или CH3CO и R2=ОН или NH2, или смесь этих пептидов в любом сочетании и соотношении и фармацевтически приемлемый носитель в форме, подходящей для интраназального введения.
Предложен также способ профилактики и/или лечения функциональных или стресс-индуцированных нарушений, возникающих при экстремальных воздействиях, заключающийся во введении пациенту фармацевтической композиции, содержащей в качестве активного начала эффективное количество пептида R1-Lys1-Arg2-Pro3-R2 [SEQ ID NO:1] или R1-Lys1-Arg2-Arg3-Pro4-R2 [SEQ ID NO:2], где R1=NH2 или CH3CO и R2=ОН или NH2, или смесь этих пептидов в любом сочетании и соотношении в дозе 0,1-20 мкг/кг массы тела, по крайней мере, один раз в день в течение периода, необходимого для достижения терапевтического эффекта. Сущность изобретения заключается в том, что экспериментальным путем было установлено, что указанные пептиды способны нормализовать содержание кортикостероидов и катехоламинов в надпочечниках и плазме крови крыс при таких формах стресса, как геморрагический шок и гипобарическая гипоксия.
Изобретение иллюстрируют примеры.
Пример 1. Химический синтез пептида NH2-Lys1-Arg2-Pro3-OH
Химический синтез пептида NH2-Lys1-Arg2-Pro3-ОН осуществляли методом твердофазного синтеза пептидов с последовательным наращиванием пептидной цепи (Schnolzer М, Alewood Р, Jones A, Alewood D, Kent SBH. In situ neutralization in Boc-chemistry solid phase peptide synthesis. Rapid, high yield assembly of difficult sequences. // Int. J. Peptide Protein Res. - 1992. - V.40. - P.180-193). Защищенный пептид получали по методике in situ на соответствующих амино-ацил полимерах с емкостью 0,7 ммоль/г, используя синтезатор Applied Biosystems 430А. В качестве постоянных защитных групп использовали мезитилен-2-сульфонильную (для аргинина) и 2-хлорбензилоксикарбонильную (для лизина). Трет-бутилоксикарбонильную группировку использовали в качестве временной защиты альфа аминогрупп. На стадии промежуточного деблокирования, ее удаляли 25% раствором трифторуксусной кислоты в хлористом метилене. Удаление боковых защитных группировок и отщепление пептида от полимера проводили под действием безводного фтористого водорода в присутствии м-крезола. Пептид NH2-Lys1-Arg2-Pro3-OH очищали с помощью препаративной обращенно-фазовой хроматографии (использовали хроматограф Gilson, Франция, колонку Prep. Nova-Pak HR С 18, 49×300 мм, зернистость 6 мкм). Полученный пептид охарактеризовывали данными аналитической обращено-фазовой высокоэффективной жидкостной хроматографии, аминокислотного анализа и масс-спектрального анализа.
N-концевое ацетилирование Lys пептида CH3CO-Lys1-Arg2-Pro3-NH2 проводили следующим образом: 0,5 г хорошо промытого и высушенного пептидилполимера помещали в силанизированную колбу, добавляли 20 мл 50% раствора трифторуксусной кислоты в хлористом метилене и выдерживали при перемешивании 40 мин. Пептидилполимер отфильтровывали, промывали хлористым метиленом (3×10 мл), 5% диизопропилкарбодиимидом в хлористом метилене (2×10 мл), хлористым метиленом (2×10 мл), диметилформамидом (2×10 мл), добавляли N-ацетилмидазол (20 экв.) в 3 мл диметилформамида. Выдерживали 2 часа, периодически встряхивая. Отмывали полимер в той же последовательности, как и после деблокирования, и снова повторяли конденсацию N-ацетилмидазолом. Удаляли реагенты, отмывали пептидилполимер и высушивали в вакууме.
Амидирование С-концевой аминокислоты Pro пептида СН3СО-Lys1-Arg2-Pro3-NH2 осуществляли с использованием остатка амидной смолы Rink (Boc-form, 0.45 мМ Вос/г, Applied Biosystems, Foster city, USA). Для этого с амидного остатка удаляли защитную группировку (как описано выше), затем присоединяли соответствующую С-концевую Boc-Pro-OBzl (2×3 экв.), суспензию перемешивали при комнатной температуре до окончания реакции. Повторное связывание со второй парой было растянуто до окончания реакции конденсации, реакцию прекращали добавлением диметиламинопиридина (0.1 экв.) на 20-й минуте.
Пример 2. Химический синтез пептида NH2-Lys1-Arg2-Arg3-Pro4-ОН
Все стадии химического синтеза и очистки пептида NH2-Lys1-Arg2-Arg3-Pro4-ОН проводили, как описано выше (см. пример 1), включая защиту концевых групп пептида (CH3CO-Lys1-Arg2-Arg3-Pro4-NH2), за исключением того, что стадии наращивания цепи производили до завершения синтеза требуемого пептида.
Пример 3. Определение аминокислотного состава пептидов NH2-Lys1-Arg2-Pro3-OH, CH3CO-Lys1-Arg2-Pro3-NH2 и NH2-Lys1-Arg2-Arg3-Pro4-OH, CH3CO-Lys1-Arg2-Arg3-Pro4-NH2
Для определения аминокислотного состава пептидов использовали аминокислотный анализатор 4151 Alpha Plus Biochrom (LKB, Швеция) и интегратор 2220 Recording Integrator Bromma (LKB, Швеция).
Для приготовления гидролизата взвешивали 1 мг исследуемого образца пептида, помещали его в ампулу, прибавляли 1 мл 6N HCl и запаивали. Ампулу выдерживали в термостате при 110°С в течение 22 часов. Затем ампулу вскрывали, содержимое переносили в круглодонную колбу и упаривали на роторном испарителе. Остаток растворяли в 0,5 мл стартового буфера, рН 2,2. Объем запускаемого образца составлял 10-50 мкл. Аминокислотный состав рассчитывали при сравнении хроматограмм образца и стандартной калибровочной смеси аминокислот.
Структуру очищенного вещества подтверждали масс-спектрометрическим анализом. Масс-спектры получали на MALDI-времяпролетном масс-спектрометре Voyager-DE BioSpectrometry Workstation (Per Sepetive Biosystems, США) с идентификацией положительных ионов в рефлекторном режиме. В качестве матрицы использовали α-циано-4-гидроксикоричную кислоту (10 мг/мл) в 50%-ном (v/v) ацетонитриле, содержащем 0,1%-ную (v/v) трифторуксусную кислоту. Для калибровки прибора использовали стандартную смесь пептидов с диапазоном 700-3500 Да (Bruker Daltonik, Германия).
Было установлено, что аминокислотный состав пептидов NH2-Lys1-Arg2-Pro3-ОН, CH3CO-Lys1-Arg2-Pro3-NH2 и NH2-Lys1-Arg2-Arg3-Pro4-OH, СН3СО-Lys1-Arg2-Arg3-Pro4-NH2 соответствует теоретическому. Основные характеристики синтезированных пептидов приведены в таблице 1.
| Таблица 1 | |||||
| Пептид | Время выхода, мин | Чистота по данным ВЭЖХ, % | Данные аминокислотного анализа | Молекулярная масса по данным масс-спектрального анализа | Выход, % |
| NH2-Lys1-Arg2-Arg3-Pro4-OH, СН3СО-Lys1-Arg2-Arg3-Pro4-NH2 | 6,77 | >99 | Pro 1.04; Lys 1.00; Arg 1.98 | 556,0 | 70 |
| NH2-Lys1-Arg2-Pro3-ОН, СН3СО-Lys1-Arg2-Pro3-NH2 | 8,25 | >99 | Pro 1.00; Lys 1.02; Arg 0.99 | 399,5 | 80 |
Содержание примесей в синтетических препаратах не превышало 4%.
Пример 4. Изучение связывания пептидов NH2-Lys1-Arg2-Pro3-OH, CH3CO-Lys1-Arg2-Pro3-NH2 и NH2-Lys1-Arg2-Arg3-Pro4-OH, СН3СО-Lys1-Arg2-Arg3-Pro4-NH2 c мембранами коры надпочечников крысы для установления механизма действия этих пептидов с помощью метода радиолигандного анализа
Для оценки способности пептидов NH2-Lys1-Arg2-Pro3-OH, CH3CO-Lys1-Arg2-Pro3-NH2 и NH2-Lys1-Arg2-Arg3-Pro4-OH, CH3CO-Lysl-Arg2-Arg3-Pro4-NH2 связываться с рецептором кортикотропина мембран коры надпочечников крысы была изучена активность каждого пептида в тесте ингибирования связывания [3Н]кортикотропина (11-24) с мембранами коры надпочечников крыс. Согласно данным Капас и соавт. (Kapas S., Cammas F.M., Hinson J.P., et al. Agonist and receptor binding properties of adrenocorticotropin peptides using the cloned mouse adrenocorticotropin receptor expressed in a stably transfected HeLa cell line. // Endocrinology. - 1996. - V.137. - P.3291-3294) кортикотропин (11-24) активно ингибирует связывание 125I-меченого кортикотропина с клонированным рецептором гормона АКТГ (МС2-R-меланокортиновым рецептором подтипа 2), но не вызывает достоверных изменений внутриклеточной концентрации 3',5'-циклического аденозинмонофосфата (цАМФ), т.е. фрагмент 11-24 является антагонистом рецептора кортикотропина.
Для получения [3H]кортикотропина (11-24) использовали реакцию высокотемпературного твердофазного каталитического изотопного обмена (ВТКИО) (Zolotarev Y.A., Dadayan A.K., Bocharov E.V., et al. New development in the tritium labelling of peptides and proteins using solid catalytic isotopic exchange with spillover-tritium. // Amino Acids. - 2003. - V.24. - P.325-33). Включение трития в пептид рассчитывали с использованием жидкостного сцинтилляционного счета. Удельная активность [3Н]кортикотропина (11-24) после очистки составляла 22 Ки/ммоль.
Мембраны из коры надпочечников крыс выделяли по методике (Dal Farra С., Zsurger, N., Vincent, J-P., et al. Binding of a pure 125I-monoiodoleptin analog to mouse tissues: a developmental study. // Peptides. - 2000. - V.21. - P.577-587). Концентрацию белка определяли с помощью метода Лоури, используя в качестве стандарта бычий сывороточный альбумин (Lowry O.H., Rosebbrough N.J., Farr O.L., et al. Protein measurement with the Folin phenol reagent. // J. Biol. Chem. - 1951. - V.193. - P.265-275).
Реакцию связывания [3Н]кортикотропина (11-24) с мембранами проводили в 50 мМ Tris-HCl-буферном растворе, рН 7,5, по следующей схеме: во все стеклянные силиконизированные пробирки вносили 100 мкл меченого пептида [3H]кортикотропина (11-24), концентрации 10 нМ. В три контрольные пробирки вносили 100 мкл буфера. В опытные пробирки добавляли 100 мкл немеченого пептида, разведенного в буфере в концентрации 10-12, 10-11, 10-10,10-9, 10-8, 10-7, 10-6 М по три повтора для каждой концентрации. В качестве немеченых пептидов использовали CH3CO-Lys1-Arg2-Arg3-Pro4-NH2, NH2-Lys1-Arg2-Arg3-Pro4-OH и NH2-Lys1-Arg2-Pro3-OH, CH3CO-Lysl-Arg2-Pro3-NH2. После внесения немеченного пептида в пробирку добавляли 800 мкл свежеприготовленной суспензии мембран (0,2 мг белка/мл). Все пробирки инкубировали при 4°С в течение 1 ч. По окончании инкубации реакционную смесь фильтровали через стекловолокнистые фильтры GF/C («Whatman», Англия). Фильтры трижды промывали по 5 мл ледяного физиологического раствора. Радиоактивность на фильтрах подсчитывали с помощью жидкостного сцинтилляционного счетчика LS 5801 («Beckman», США). Контрольные показатели принимали за общее связывание, а опытные за неспецифическое связывание. Величину специфического связывания [3H]кортикотропина (11-24) с мембранами определяли по разности между его общим и неспецифическим связыванием и выражали в молях на 1 мг белка.
Константу ингибирования (Ki) определяли по формуле Ki=[I]50/(1+[L]/Kd), где [L] - молярная концентрация [3H]кортикотропина (11-24); Kd - равновесная константа диссоциации комплекса [3H]кортикотропин (11-24) - рецептор; [I]50 - концентрация немеченого пептида, вызывающая 50%-ное ингибирование специфического связывания меченого пептида (Cheng, Y.C., Prusoff, W. Mouse ascites sarcoma 180 thymidylate kinase. General properties, kinetic analysis, and inhibition studies. // Biochemistry. - 1973. - V.12. - P.2612-9). Величину [I]50 определяли графически на основании кривой ингибирования (график зависимости % ингибирования от молярной концентрации ингибитора).
Значение Kd определяли предварительно. Реакцию связывания [3H]кортикотропина (11-24) с мембранами проводили в 50 мМ Tris-HCl-буферном растворе, рН 7,5, по следующей схеме: в стеклянные силиконизированные пробирки вносили 100 мкл [3H]кортикотропина (11-24) в концентрации 10-10, 10-9, 10-8, 10-7 М, по шесть повторов для каждой концентрации (три контрольные пробирки и три опытные). В контрольные пробирки вносили 100 мкл буфера (эти данные будут приняты за общее связывание), в опытные - 10-3 М раствора немеченого пептида кортикотропина (11-24) в буфере (эти данные будут приняты за неспецифическое связывание) и 800 мкл свежеприготовленной суспензии мембран (0,2 мг белка/мл). Пробирки инкубировали при 4°С в течение 1 ч. По окончании инкубации реакционную смесь фильтровали через стекловолокнистые фильтры GF/C («Whatman», Англия). Фильтры трижды промывали 5 мл ледяного физиологического раствора. Радиоактивность на фильтрах подсчитывали с помощью жидкостного сцинтилляционного счетчика LS 5801 («Beckman», США). Величину специфического связывания [3Н]кортикотропина (11-24) с мембранами определяли по разности между его общим и неспецифическим связыванием и выражали в молях на 1 мг белка. Для определения параметров специфического связывания меченого пептида с мембранами (равновесной константы диссоциации Kd и Bmax - максимальной связывающей способности в расчете на 1 мг белка) строили графики зависимости отношения молярных концентраций связанного (В) и свободного (F) меченого пептида от молярной концентрации связанного меченого пептида (В) (Chang K.-J., Jacobs S., Cuatrecasas P. Quantitative aspects of hormone-receptor interactions of high affinity. Effect of receptor concentration and measurement of dissociation constants of labeled and unlabeled hormones. // Biochim. Biophys. Acta. - 1975. - V.406. - P.294-303). Неспецифическое связывание [3H]кортикотропина (11-24) в этих условиях составляло 15,3±2,2% от величины его общего связывания. Анализ специфического связывания [3H]кортикотропина (11-24) с мембранами коры надпочечников крысы в координатах Скэтчарда показал, что меченый пептид взаимодействует с одним типом рецепторов кортикотропина, Kd 1,9±0,1 нМ.
Параллельно в качестве потенциальных ингибиторов связывания меченого кортикотропина (11-24) были протестированы немеченые кортикотропин (4-10), соматостатин, β-эндорфин, [Met5]энкефалин. Результаты экспериментов, представленные в таблице 2, показывают, что пептиды CH3CO-Lys1-Arg2-Arg3-Pro4-NH2, NH2-Lys1-Arg2-Arg3-Pro4-OH и NH2-Lys1-Arg2-Pro3-OH, CH3CO-Lys1-Arg2-Pro3-NH2 способны с высоким сродством связываться с рецептором кортикотропина на мембранах коры надпочечников крысы: Ki составила 2,1 2,0 и 2,4 2,3 нМ для пептидов CH3CO-Lys1-Arg2-Arg3-Pro4-NH2, NH2-Lys1-Arg2-Arg3-Pro4-OH и NH2-Lys1-Arg2-Pro3-OH, CH3CO-Lys1-Arg2-Pro3-NH2 соответственно. Для сравнения приведены данные фрагмента кортикотропина 11-24, который ответственен за связывание гормона с рецептором.
| Таблица 2 | ||
| Пептид | IC50*, нМ | Ki*, нМ |
| Кортикотропин (11-24) Lys-Pro-Val-Gly-Lys-Lys-Arg-Arg-Pro-Val-Lys-Val-Tyr-Pro | 11.3±0.1 | 1.8±0.1 |
| NH2-Lys1-Arg2-Arg3-Pro4-OH | 12.6±0.2 | 2.0±0.1 |
| NH2-Lys1-Arg2-Pro3-OH | 15.1±0.3 | 2.4±0.2 |
| СН3СО-Lys1-Arg2-Arg3-Pro4-NH2 | 13.4±0.2 | 2.1±0.1 |
| CH3CO-Lys1-Arg2-Pro3-NH2 | 14.7±0.3 | 2.3±0.2 |
| Кортикотропин (4-10) | >10000 | >10000 |
| Соматостатин | >10000 | >10000 |
| β-Эндорфин | >10000 | >10000 |
| [Met5]энкефалин | >10000 | >10000 |
| *Приведены данные ± SEM (стандартная ошибка среднего) двух независимых экспериментов. |
Пример 5. Определение влияния АКТГ(1-24) и пептидов NH2-Lys1-Arg2-Arg3-Pro4-OH и NH2-Lysl-Arg2-Pro3-OH на аденилатциклазную активность в мембранах коры надпочечников крысы
Активность аденилатциклазы определяли с помощью α[32P]АТФ по известному методу (Saltarelli D, Fischer S, Gacon G. Modulation of adenylate cyclase by guanine nucleotides and Kirsten sarcoma virus mediated transformation. // Biochem. Biophys. Res. Commun. - 1985. - V.127. - P.318-325).
Состав среды для проведения реакции: 40 мМ Трис-HCl, рН 7,4, содержащий 50 мкМ АТФ, 4 мМ цАМФ, 12 мМ фосфоенолпируват, пируваткиназу (2 мкг/мл).
20 мкл суспезии мембран (50-100 мкг белка) вносили в стеклянные силиконизированные конические пробирки, находящиеся в ледяной бане, добавляли α[32P]АТФ (200000-500000 имп/мин) в 30 мкл среды и 50 мкл пептида NH2-Lys1-Arg2-Pro3-OH (опыт 1), или NH2-Lys1-Arg2-Arg3-Pro4-OH (опыт 2), взятых в концентрации 0,1, 1,0, 10,0, 100,0 и 1000,0 нМ, или такой же объем буфера (контроль). Опытные и контрольные пробирки переносили в термостат и выдерживали при 34°С в течение 45 мин. Реакцию останавливали добавлением 0,5 М HCl. После этого пробирки помещали в кипящую водяную баню на 15 мин, а затем переносили в ледяную баню и добавляли в каждую по 100 мкл 1,5 М имидазола. Содержимое каждой пробирки пропускали через отдельную колонку с 1 см3 Al2O3 по Брокману II (Sigma-Aldrich, США) и промывали 5 мл дистиллированной воды. Активность фермента определяли по убыли субстрата и выражали в нмоль цАМФ, образовавшегося за 10 мин, на 1 мг белка мембран коры надпочечников.
Данные о влиянии АКТГ(1-24), пептидов NH2-Lys1-Arg2-Arg3-Pro4-OH и NH2-Lys1-Arg2-Pro3-OH на аденилатциклазную активность в мембранах коры надпочечников крысы представлены в таблице 3. Результаты показывают, что пептиды NH2-Lys1-Arg2-Arg3-Pro4-OH и NH2-Lys1-Arg2-Pro3-OH в концентрации 0,1-1000 нМ не влияют на активность фермента, в то время как АКТГ(1-24) подавляет ее.
| Таблица 3 | |||
| Концентрация пептида (нМ) | Аденилатциклазная активность (цАМФ нмоль/1 мг белка за 10 мин) | ||
| АКТГ (1-24) | NH2-Lys1-Arg2-Arg3-Pro4-OH | NH2-Lys1-Arg2-Pro3-OH | |
| контроль | 1.43±0.12 | ||
| 0.1 | 1.47±0.15 | 1.42±0.12 | 1.46±0.13 |
| 1 | 1.82±0.17 | 1.50±0.18 | 1.48±0.15 |
| 10 | 2.23±0.19 | 1.52±0.14 | 1.44±0.18 |
| 100 | 2.68±0.24 | 1.43±0.12 | 1.49±0.16 |
| 1000 | 2.56±0.16 | 1.40±0.12 | 1.42±0.18 |
| В таблице приведены данные трех независимых экспериментов ± SEM. |
Пример 6. Определение влияния пептидов CH3CO-Lys1-Arg2-Pro3-NH2 и CH3CO-Lys1-Arg2-Arg3-Pro4-NH2 на уровень кортикостероидов и катехоламинов в крови и надпочечниках на моделях острой геморрагии и гипобарической гипоксии у крыс in vivo
В экспериментах использовали половозрелых самцов крыс линии Wistar массой 180-200 г по 10 крыс в контрольной и каждой из опытных групп.
Моделью острой геморрагии служила 1-часовая артериальная гипотензия. Для ее создания у наркотизированных нембуталом в дозе 40 мг/кг крыс через катетер в хвостовой артерии производили взятие крови до достижения среднего артериального давления 40 мм ртутного столба. До начала кровопотери животным внутривенно вводили гепарин (0,5 мл, 50 ЕД/мл) для предотвращения свертывания крови во время проведения длительного эксперимента.
По истечении времени гипотензии крыс реанимировали путем внутриартериального введения взятой крови. Сразу после восполнения кровопотери проводили внутривенную инфузию одного из исследуемых пептидов СН3СО-Lys1-Arg2-Pro3-NH2 (в дозе 1 или 10 мкг/кг/мин в течение 10 мин) или СН3СО-Lys1-Arg2-Arg3-Pro4-NH2 (в дозе 1 или/10 мкг/кг/мин в течение 10 мин) или аналогичного объема (0,8 мл) физиологического раствора (ФР) через яремную вену (контроль 1, ФР).
Поскольку, как правило, регуляторные пептиды имеют каскадный механизм действия, и их влияние может сказываться через длительное время после введения, декапитацию животных и взятие материала для биохимических исследований проводили на 1-е и 7-е сутки. Контрольной группе животных проводили полную операцию без геморрагического шока. Значения биохимических показателей в этой (контрольной) группе принимали за 100%.
Для создания условий развития острой гипобарической гипоксии крыс (половозрелых самцов линии Wistar массой 180-200 г по 10 животных в контрольной и каждой из опытных групп) помещали в барокамеру с давлением 154 мм ртутного столба, соответствующем атмосферному давлению на высоте 11500 м от уровня моря, и выдерживали в этих условиях до принятия ими бокового положения. Каждый из исследуемых пептидов CH3CO-Lys1-Arg2-Pro3-NH2 или СН3СО-Lys1-Arg2-Arg3-Pro4-NH2 вводили крысам одной опытной группы интраназально в дозе 0,1 или 1 мкг/кг массы тела животного, причем каждую дозу вводили за 1 и 24 часа до "подъема". Параллельно крысам контрольной группы вводили физиологический раствор (ФР) (контроль 1, ФР). Декапитацию животных и взятие материала для биохимических исследований проводили на 1-е и 7-е сутки после "подъема". Значения биохимических показателей в контрольной группе (без шока) принимали за 100%.
Содержание глюкокортикоидов (11-оксикортикостероидов) в надпочечниках и крови определяли по методу (Navolotskaya, E.V., Vanina, V.I., Zolotarev, et al. Synthetic peptide immunocortin stimulates the production of 11-oxycorticosteroides by rat adrenal cortex through ACTH receptors. // Regulatory Peptides. - 2004. - V.119. - P.99-104), принцип которого основан на способности 11-оксикортикостероидов флуоресцировать после их обработки смесью серной кислоты и этилового спирта (3:1, по объему).
Гормоны из ткани надпочечников экстрагировали с помощью хлороформа. Содержание флуоресцирующих продуктов измеряли на флуориметре "Hitachi 850" (Япония) при λ (длине волны) 530 нм (λ возбуждающего света = 470 нм). Количество 11-оксикортикостероидов определяли по калибровочной кривой и выражали в микрограммах на 1 г ткани. Для статистической обработки результатов использовали t-критерий Стьюдента.
Содержание катехоламинов в надпочечниках определяли по методу (Metcalf, G. A rapid method for the simultaneous determination of noradrenaline, dopamine and 5HT in small samples of brain tissue. // Anal. Biochem. - 1974. - V.57. - P.316-320).
Экстракцию катехоламинов из ткани надпочечников проводили последовательной обработкой гомогената ткани надпочечников кислым n-бутанолом и смесью n-гептана и воды (4,5:1, по объему). Затем к водной фазе добавляли 2 М ацетат натрия, содержащего 0,2% ЭДТА и алюминий по Брокману I (Sigma-Aldrich, США). После центрифугирования (5 мин при 2000g) сорбент промывали водой, переносили в 0,5 М фосфатный буфер, рН 6,0, содержащий 0,75% ЭДТА, и помещали на 15 минут в шейкер для элюирования катехоламинов, а затем снова центрифугировали.
Флуоресцирующие продукты катехоламинов получали с помощью тригидроксииндольной реакции (Chang C.C. A sensitive method for spectrophotofluorometric assay of catecholamines. // Int. J. Neuropharmacol. - 1961. - V.3. - P.643-649).
Измерение флуоресценции проводили на флуориметре "Hitachi 850" (Япония) для адреналина при λ=500 нм и возбуждающем свете λ=410 нм и для норадреналина при λ=485 и λ=385 нм соответственно. Количество адреналина и норадреналина определяли по калибровочной кривой и выражали в микрограммах на 1 г гомогенизированной ткани надпочечников.
Достоверность различий экспериментальных данных между контролем и опытом оценивали по t-критерию Стьюдента.
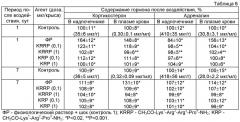
В таблицах 4 и 5 представлены данные о влиянии пептидов СН3СО-Lys1-Arg2-Pro3-NH2 и CH3CO-Lys1-Arg2-Arg3-Pro4-NH2 на содержание 11-оксикортикостероидов и катехоламинов в надпочечниках и плазме крови крыс в на 1-е и 7-е сутки постреанимационного периода после геморрагического шока.
Как видно из этих таблиц, через 1 сутки после геморрагического шока уровень 11-оксикортикостероидов в надпочечниках и плазме контрольной группы 1 (шок + ФР) животных возрастал на 59 и 48% соответственно. Через 7 суток содержание 11-оксикортикостероидов в надпочечниках и плазме снижалось, оставаясь выше контрольного уровня (без шока) на 19% и 31% соответственно.
Введение пептидов CH3CO-Lys1-Arg2-Pro3-NH2 и CH3CO-Lys1-Arg2-Arg3-Pro4-NH2 в дозе 1 мкг/кг приводило к уменьшению содержания 11-оксикортикостероидов в надпочечниках и плазме как через 1, так и через 7 суток, увеличение дозы этих пептидов до 10 мкг/кг сопровождалось снижением уровня гормонов во всех изученных случаях до контрольных значений (без шока).
Как видно из таблиц 4 и 5, через 1 сутки после геморрагического шока концентрация адреналина и норадреналина в надпочечниках снижалась по сравнению с контрольным уровнем (без шока) на 38% и 22% соответственно. Через 7 суток после шока эти показатели были близки к контрольным значениям (без шока).
Напротив, через 1 час после геморрагического шока содержание адреналина в плазме возрастало на 79%, а через 7 суток превышало контрольный уровень (без шока) на 24%. Резкое снижение содержания адреналина в надпочечниках через 1 час после шока и одновременный рост его в плазме свидетельствует об увеличении секреции гормона из надпочечников в кровь. Каждый из исследуемых пептидов в дозах 1 и 10 мкг/кг предотвращал данный эффект: содержание адреналина в надпочечниках и плазме через 1 и 7 суток после геморрагического шока было близко к контролю (без шока).
Таким образом, пептиды CH3CO-Lys1-Arg2-Pro3-NH2 и CH3CO-Lys1-Arg2-Arg3-Pro4-NH2 в дозах 1 и 10 мкг/кг оказывают значительное корригирующее действие на содержание 11-оксикортикостероидов и катехоламинов в надпочечниках и плазме крови крыс, подвергнутых геморрагическому шоку.
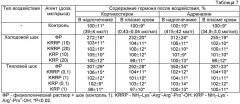
В таблице 6 приведены результаты исследования влияния пептидов СН3СО-Lys1-Arg2-Pro3-NH2 и CH3CO-Lys1-Arg2-Arg3-Pro4-NH2 на содержание 11-оксикортикостероидов и адреналина в надпочечниках и плазме крови крыс в на 1-е и 7-е сутки после гипобарической гипоксии. Видно, что характер изменений содержания гормонов в надпочечниках и плазме после "подъема" был таким же, как и в случае геморрагического шока. Интраназальное введение пептидов СН3СО-Lys1-Arg2-Pro3-NH2 и CH3CO-Lys1-Arg2-Arg3-Pro4-NH2 в дозах 0,1 и 1 мкг/кг за 1 и 24 часа до "подъема" нормализовало содержание 11-оксикортикостероидов и адреналина в надпочечниках и плазме крови крыс, подвергнутых гипоксии.
Таким образом, синтетические пептиды CH3CO-Lys1-Arg2-Pro3-NH2 и СН3СО-Lys1-Arg2-Arg3-Pro4-NH2 оказывают корригирующее действие на уровень 11-оксикортикостероидов и катехоламинов в надпочечниках и плазме крови крыс при таких формах стресса, как геморрагический шок и гипобарическая гипоксия.
Пример 7. Определение влияния пептидов NH2-Lys1-Arg2-Pro3-OH и NH2-Lys1-Arg2-Arg3-Pro4-OH на уровень кортикостероидов и катехоламинов в надпочечниках и содержание свободного гистамина и активности диаминоксидазы в сердечной мышце на моделях холодового и теплового шока у крыс in vivo
Для экспериментов брали половозрелых самцов линии Wistar массой 180-200 г по 10 животных в контрольной и каждой из опытных групп.
Для создания модели холодового шока крыс опытных групп выдерживали в состоянии свободного плавания в кювете с водой при температуре 4°C в течение 3 минут.
Для теплового воздействия животных опытных групп помещали в вентилируемую термокамеру при температуре 40°С на 1 час. Растворы исследуемых пептидов NH2-Lys1-Arg2-Pro3-OH (в дозе 10 или 20 мкг/животное) или NH2-Lys1-Arg2-Arg3-Pro4-OH (в дозе 10 или 20 мкг/животное) или физиологический раствор (контроль 1) вводили интраназально три раза за 3, 2 и 1 сутки до шока. В контрольной группе животных термическому воздействию не подвергали. Значения биохимических показателей в контрольной группе принимали за 100%.
Содержание глюкокортикоидов (11-оксикортикостероидов, КС) и катехоламинов в надпочечниках и плазме крови крыс определяли, как описано выше (пример 6).
Содержание свободного гистамина в сердечной мышце крыс определяли по методу (Romberg A.L., Hakanson R. A simplified procedure for the fluorometric determination of histamine in rat stomach. // Agents Actions. - 1984. - V.14. - P.195-199), а активность фермента диаминоксидазы (ДАО) - по методу (Leyton G.B. А simple routine method for mono and diamine oxidase estimation in human serum. // Pathology. - 1981. - V.13. - P.327-333).
Для экстракции гистамина ткань надпочечников гомогенизировали в 0,4 N хлорной кислоте, гомогенат центрифугировали. К 4 мл надосадочной жидкости добавляли смесь 0,5 мл 5 N NaOH и 10 мл n-бутанола, содержащую 1,5 г NaCl. Затем после 5-минутного встряхивания смесь центрифугировали и из водной фазы, содержащей гистамин, отбирали аликвоту (2 мл) для проведения реакции конденсации с о-фталевым альдегидом (1%-ный раствор в метаноле, 4 мин).
Флуоресценцию 11-оксикортикостероидов измеряли на флуориметре "Hitachi 850" (Япония) при λ=450 нм и возбуждающем свете с λ=365 нм. Количество гистамина определяли по калибровочной кривой и выражали в микрограммах на 1 г ткани. Активность диаминоксидазы ДАО оценивали по убыванию субстрата (гистамина) и выражали в мкг гистамина за 1 час в 1 г ткани.
При статистической обработке результатов достоверность различий между опытом и контролем оце