Способ хирургического лечения артериовенозной мальформации головного мозга
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно нейрохирургии. Проводят суперселективную катетеризацию приводящего сосуда АВМ, через который вводят взвесь гепасфер. Для приготовления взвеси во флакон, содержащий 50 мг сухого вещества гепасфер с первоначальным размером 50-100 мкм, вводят 5 мл физиологического раствора и 5 мл водорастворимого неионного контрастного вещества. После введения в компартмент АВМ взвеси гепасфер осуществляют промывание микрокатетера 20 мл физиологического раствора с гепарином, а затем 20 мл 5% раствора глюкозы. Проводят приготовление клеевой смеси гистоакрила с липоидолом в разведении от 1:3 до 1:4. Приготовленную смесь гистоакрила с липоидолом вводят в компартмент АВМ через тот же микрокатетер и тот же приводящий сосуд до возникновения рентгеноскопических признаков ретроградного тока смеси. Способ повышает степень надежности эмболизации АВМ головного мозга. 5 ил., 1 пр.
Реферат
Изобретение относится к области медицины, а именно нейрохирургии, и может быть использовано для эндоваскулярного лечения пациентов с артериовенозной мальформацией (АВМ) головного мозга.
Известен способ хирургического лечения АВМ головного мозга путем введения через приводящий сосуд в компартмент АВМ эндоваскулярно-клеевой композиции этилен-винил-алкоголь-кополимера (оникса) в сочетании с диметилсульфоксидом (Taki W, Yonekawa Y, Iwata H, Uno A, Yamashita К, Amemiya H. A new liquid material for embolization of arteriovenous malformations. // AJNR. - 1991. - Vol.11. - P.163-168). Оникс относится к числу неадгезирующих в просвете микрокатетера эмболизирующих агентов, что дает возможность его введения в компартмент АВМ в большем объеме по сравнению с другими эмболизатами.
Недостатки способа:
1) длительное рентгеновское облучение, небезвредное как для больного, так и для оперирующего хирурга;
2) токсическое воздействие эмболизата на организм больного, особенно в случаях введения оникса в больших объемах. При расположении АВМ в труднодоступных и функционально значимых зонах головного мозга, затрудняющих их хирургическое удаление после эмболизации, наличие большого объема полимеризованного в компартменте АВМ оникса само по себе может явиться причиной раздражения и формирования эпилептической активности головного мозга;
3) обязательным требованием для эмболизации АВМ ониксом является проведение операции в условиях общей анестезии (эндотрахеального наркоза и миорелаксации). Это, с одной стороны, резко ограничивает интраоперационный контроль неврологического статуса в ходе эмболизации и возможность своевременного принятия мер для коррекции тактики хирургического лечения при подозрении на развитие неврологических осложнений, с другой - увеличивает материальные затраты по ведению анестезиологического обеспечения.
Известен способ хирургического лечения АВМ головного мозга, включающий эндоваскулярную эмболизацию АВМ цианоакрилатом (гистоакрилом) с растворителем липоиодолом (Jafar J.J., Davis A.J., Berenstein A., Choi L.S. Kupersmith M.J. The effect of embolization with N-butyl-cianoacrilate prior to surgical resection of cerebral arteriovenous malformations // J. Neurosurgery. - 1993. - Vol.78. - №1. - P.60-69). Гистоакрил является адгезирующим в просвете микрокатетера эмболизирующим агентом. Степень адгезии в микрокатетере зависит от степени разведения гистоакрила с липоиодолом: чем выше разведение, тем ниже адгезия, и наоборот. При применении гистоакрила не требуется проведения общей анестезии и создается возможность интраоперационной оценки неврологического статуса в ходе эмболизации компартмента АВМ. Длительность рентгеновского облучения при эмболизации гистоакрилом меньше, чем при эмболизации ониксом.
Недостатки способа:
1) токсическое воздействие гистоакрила на организм больного;
2) сложность определения степени разведения гистоакрила липоидолом, что обуславливает в ряде случаев неэффективность и неадекватность эмболизации АВМ данным способом.
Введение в приводящий сосуд гистоакрила с низкой степенью разведения является более предпочтительным с точки зрения уменьшения побочных токсических явлений, но оно сопровождается тем, что гистоакрил может недостаточно полимеризоваться в приводящих артериях и собственной сосудистой сети компартмента АВМ, а также «вымываться» из него, адгезируясь уже на стенках церебральных вен, либо мелких сосудов системы малого круга кровообращения. При несанкционированной эмболизации вен возникает затруднение венозного оттока из АВМ, повышение давления в приводящих сосудах, грубая перестройка гемодинамики в АВМ и, как следствие, возникновение внутричерепной гипертензии либо внутричерепного кровоизлияния. Частичная миграция гистоакрила в легкие может послужить причиной формирования очаговой инфаркт-пневмонии.
Введение же через приводящий сосуд гистоакрила с высокой степенью концентрации может привести к ранней полимеризации эмболизата в просвете микрокатетера на этапе выхода гистоакрила из него и попадания в приводящую артерию и компартмент АВМ в очень незначительном объеме. В результате может потребоваться замена микрокатетера в связи с преждевременным «заклеиванием» его кончика гистоакрилом, повторная катетеризация того же приводящего сосуда и эмболизация компартмента АВМ, что увеличивает время рентгеновского облучения и материальные затраты на эмболизацию компартмента АВМ.
Наиболее близким к заявляемому способу является способ хирургического лечения АВМ головного мозга с помощью гепасфер (Do Y., Hori S., Zhou W., Liu Y. Embolization of a cerebral arteriovenous malformation with HepaSphere. // Chinese Journal of Plastic Surgery - 2009. - Vol.25. - №3. - P.193-196), принятый за прототип. Через приводящий сосуд в компартмент АВМ эндоваскулярно суперселективно вводят гепасферы. Гидрофильная поверхность и сферическая форма гепасфер препятствует их слипанию (адгезии) при прохождении через микрокатетер, что облегчает их доставку к компартменту АВМ. Введение гепасфер приводит к замедлению скорости кровотока в теле АВМ и уменьшению ее объема, и создает условия для нормализации кровообращения в интактных смежных областях головного мозга. Применение гепасфер не требует проведения общей анестезии. Гепасферы не адгезируются в просвете микрокатетера, обладают минимальной токсичностью для организма больного, а частота неврологических осложнений не превышает таковой при применении других эмболизатов.
Недостатки прототипа: недостаточная степень радикальности и надежности эмболизации АВМ гепасферами, так как происходит миграция части введенных гепасфер через сосудистую сеть АВМ в венозное русло и далее в сосуды системы малого круга кровообращения. Возникает необходимость проведения повторных эмболизаций через один и тот же приводящий сосуд, что увеличивает время рентгеновского облучения и общие затраты на эндоваскулярное лечение больных с АВМ.
Изобретение направлено на создание способа хирургического лечения АВМ головного мозга, обеспечивающего повышение эффективности лечения за счет повышения степени радикальности и надежности эмболизации АВМ.
Указанный технический результат при осуществлении изобретения достигается тем, что в известном способе хирургического лечения АВМ головного мозга, включающем эндоваскулярное суперселективное введение в приводящий сосуд в АВМ гепасфер, особенность заключается в том, что после введения взвеси гепасфер, в тот же сосуд вводят смесь гистоакрила с липоиодолом до возникновения признаков ретроградного тока смеси. Кроме того, 50 мг гепасфер с начальным размером 50-100 мкм смешивают с 5 мл физиологического раствора и 5 мл водорастворимого неионного контрастного вещества, а гистоакрил с липоидолом смешивают в пропорции от 1:3 до 1:4.
Способ осуществляется следующим образом.
Во время эндоваскулярной операции проводят суперселективную катетеризацию приводящего сосуда АВМ. После того как было принято решение о проведении эмболизации компармента АВМ через выбранный приводящий сосуд, производят подготовку взвеси гепасфер. Во флакон, содержащий 50 мг сухого вещества гепасфер с первоначальным размером 50-100 мкм, с целью набухания гепасфер вводят 5 мл физиологического раствора и 5 мл водорастворимого неионного контрастного вещества (например, омнипак-300). После этого начинают интенсивно смешивать в течение 10 минут все введенные компоненты путем встряхивания флакона до возникновения однородной аморфной массы. За указанный период времени гепасферы, увеличиваясь за счет набухания, достигают заданного необходимого размера (200-400 мкм). Затем взвесь гепасфер вводят суперселективно через выбранный приводящий сосуд в компармент АВМ.
После введения взвеси гепасфер осуществляют промывание микрокатетера 20 мл физиологического раствора с гепарином, а затем 20 мл 5% раствора глюкозы. Проводят приготовление клеевой смеси гистоакрила с липоидолом в разведении от 1:3 до 1:4. Приготовленную смесь гистоакрила с липоидолом вводят через тот же микрокатетер и тот же приводящий сосуд в компартмент АВМ до возникновения рентгеноскопических признаков ретроградного тока смеси. Затем микрокатетер удаляют. Благодаря наличию на поверхности положительно заряженного полимера гепасферы образуют избирательные прочные связи с отрицательно заряженными ионами смеси гистоакрила с липоиодолом, что обеспечивает быстрое формирование стойкого конгломерата (гистоакрила с липоиодолом и гепасферами) в компартменте АВМ, препятствующего «вымыванию» гепасфер и смеси гистоакрила с липоиодолом в венозное русло и сосуды системы малого круга кровообращения. Возможность использования смеси гистоакрила с липоидолом с более низкой концентрацией объясняется тем, что скорость кровотока в приводящем сосуде и компартменте АВМ после введения гепасфер замедляется, а формирование стойких связей между гепасферами и гистоакрилом значительно ускоряет процесс его полимеризации, снижает степень нежелательной миграции фрагментов гистоакрила и гепасфер в венозное русло, что обеспечивает большую управляемость введения гистоакрила в указанном разведении. В связи с этим необходимость в приготовлении клеевой смеси гистоакрила с лиопоидолом более высокой концентрации (от 1:2 до 1:3), как это практикуется при изолированном применении гистоакрила при эмболизации высокопотоковых АВМ, отпадает.
Способ разработан в РНХИ им. проф. А.Л.Поленова и прошел клинические испытания при лечении 28 больных с АВМ головного мозга. Всем больным выполнены эндоваскулярные суперселективные операции согласно заявляемому способу, которые привели к стойкому и полному выключению компартмента АВМ и приводящего сосуда из кровообращения.
Приводим пример - выписку из истории болезни.
Больная Г., 29 лет, и/б №1559-2008, №1129-2009, №758-2010
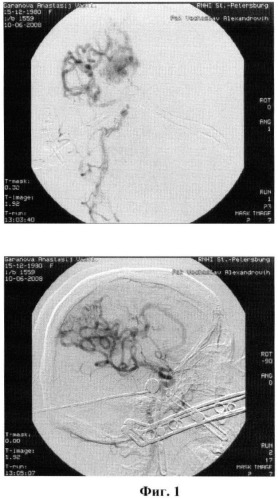
Диагноз: АВМ правого полушария головного мозга. По данным церебральной ангиографии кровоснабжение полиафферентной АВМ осуществляется через приводящие гипертрофированные длинные ветви правых средней и передней мозговых артерий с выраженным венозным сбросом крови в базальные вены мозга, верхний сагиттальный синус, прямой синус (Фиг.1). АВМ соответствует IV-V типу по классификации Spetzler-Martin.
При первой и второй госпитализациях больной в условиях седации-анальгезии без применения миорелаксации и глубокой анестезии, при сохранении спонтанного дыхания, в правую внутреннюю сонную артерию установили направляющий катетер. После этапной катетеризации двух приводящих теменных ветвей правой средней мозговой артерии (Фиг.2) выполнили суперселективную эмболизацию компартмента АВМ смесью гистоакрила с липоидолом в разведении 1:3 общим объемом 0.6 мл. Гистоакрил преимущественно зафиксировался в приводящем сосуде, в меньшей степени - в теле мальформации. После эмболизации из указанных ветвей было достигнуто парциальное выключение из кровообращения небольшого компартмента АВМ. Больная была выписана по месту жительства с рекомендацией повторной госпитализации через 9 месяцев.
Таким образом, применение клеевой смеси гистоакрила с липоиодолом для эмболизации АВМ оказалось неэффективным.
При третьей госпитализации больной была выполнена хирургическая операция согласно заявляемому способу: эндоваскулярная суперселективная эмболизация компартмента АВМ гепасферами в сочетании со смесью гистоакрила с липоидолом.
В условиях седации-анальгезии без применения миорелаксации и глубокой анестезии, при сохранении спонтанного дыхания, в правую внутреннюю сонную артерию установили направляющий катетер. При ангиографии сохраняется заполнение АВМ из гипертрофированных ветвей правой средней и передней мозговых артерий (Фиг.3). Определяются следы гистоакрила в проекции правой теменной доли, введенного при предыдущих эмболизациях АВМ. Выполнена катетеризация приводящего сосуда АВМ из гипертрофированной правой перикаллезной мозговой артерии. При суперселективной ангиографии отмечали контрастирование компартмента АВМ с выраженным венозным сбросом (Фиг.4). Для создания эмболизата использовали 5 мл физиологического раствора и 5 мл омнипака-300 и 50 мг сухого вещества гепасфер. Приготовленную взвесь гепасфер вводили через катетеризированный приводящий сосуд в указанный компартмент АВМ.
После введения взвеси гепасфер проводили непрерывное промывание микрокатетера 20 мл физиологического раствора с гепарином, а затем 20 мл 5% раствора глюкозы. Затем через тот же микрокатетер в тот же приводящий сосуд вводили приготовленную клеевую смесь гистоакрила с липоидолом в разведении 1:3 общим объемом 0.8 мл до возникновения рентгеноскопических признаков ретроградного тока. Фрагменты гистоакрила, образуя с гепасферами прочное соединение, интенсивно оседали в компартменте АВМ, в результате чего практически полностью удалось избежать нежелательной миграции гистоакрила в венозное русло и достичь выключения большого компартмента АВМ из кровообращения. При контрольной правосторонней каротидной ангиографии (Фиг.5) контрастирования компартмента АВМ из правой перикаллезной артерии не выявлено, тень эмболизата не только в просвете приводящего сосуда, но и в теле АВМ.
Таким образом, благодаря введению взвеси гепасфер и смеси гистоакрила с липоиодолом удалось достичь эффективного и надежного выключения АВМ из кровообращения.
Способ хирургического лечения артериовенозной мальформации головного мозга, включающий эндоваскулярное суперселективное введение в приводящий сосуд артериовенозной мальформации взвеси гепасфер, отличающийся тем, что после введения взвеси, состоящей из 50 мг гепасфер с начальным размером 50-100 мкм, 5 мл физиологического раствора и 5 мл водорастворимого неионного контрастного вещества, в тот же сосуд вводят смесь гистоакрила с липоиодолом, смешанной в пропорции от 1:3 до 1:4, до возникновения признаков ретроградного тока смеси.