Пиримидиновые производные
Иллюстрации
Показать всеИзобретение относится к новым замещенным производным пиримидина, обладающим свойствами ингибитора активности рецептора домена инсерции киназы (KDR), или их фармацевтически приемлемым солям. В формуле (1):
каждый из X и Y независимо представляет собой О, NR, где R представляет собой Н; Z представляет собой CR', где R' представляет собой Н или галоген; V, U и Т вместе представляют собой
или каждый из R1, R2, R3, R4 и R6 независимо представляет собой Н, галоген, циано, C1-10алкил; значения R5 приведены в формуле изобретения; R7 представляет собой С1-10алкил. Изобретение также относится к способу лечения связанного с ангиогенезом расстройства, такого как рак или возрастная макулярная дегенерация. 5 н. и 11 з.п. ф-лы, 318 пр.
Реферат
Перекрестная ссылка на родственные заявки
Настоящая заявка заявляет приоритет предварительной заявки на патент США, серийный № 60/911921, поданной 16 апреля 2007 года. Содержание предшествующей заявки, таким образом, включается сюда в качестве ссылки во всей ее полноте.
Уровень техники
Ангиогенез представляет собой физиологический процесс роста новых кровеносных сосудов из уже существующих сосудов. Он имеет место у здорового субъекта при залечивании ран, то есть, при восстановлении кровотока в ткани после операции или инсульта.
Избыточный рост кровеносных сосудов может запускаться определенным патологическим состоянием, таким как рак, возрастная макулярная дегенерация, ревматоидный артрит и псориаз. В результате новые кровеносные сосуды вводятся в болезненные ткани и разрушают нормальные ткани. При раке новые кровеносные сосуды также позволяют опухолевым клеткам попадать в кровоток и осаждаться в других органах.
Сосудистый эндотелиальный фактор роста (VEGF), гомодимерный гликопротеин и его рецепторы, например рецептор домена инсерции киназы (KDR), составляют важный путь ангиогенеза. Исследования показали, что ингибирование KDR приводит к апоптозу эндотелиальных клеток и, таким образом, к подавлению ангиогенеза. Смотри Rubin M. Tuder, Chest, 2000; 117: 281. По этой причине ингибиторы KDR являются потенциальными кандидатами для лечения связанных с ангиогенезом заболеваний.
Сущность изобретения
Настоящее изобретение основывается на обнаружении того, что ряд пиримидиновых соединений ингибирует активность KDR.
Один из аспектов настоящего изобретения описывает пиримидиновые соединения следующей формулы (I):
(I),
в которой каждый из X и Y независимо представляет собой O, S или NR, где R представляет собой H, алкил, алкенил, алкинил, арил, циклоалкил, гетероциклоалкил, гетероарил, алкилкарбонил, алкоксикарбонил, аминокарбонил или аминосульфонил; Z представляет собой CR' или N, где R' представляет собой H, галоген, нитро, циано, гидроксил, алкокси, арилокси, алкил, алкенил, алкинил, арил, циклоалкил или гетероциклоалкил; V, U и T вместе представляют собой
или
каждый из R1, R2, R3, R4 и R6 независимо представляет собой H, галоген, нитро, амино, циано, гидрокси, алкил, алкенил, алкинил, арил, циклоалкил, гетероциклоалкил, гетероарил, алкокси, алкилтио, алкилкарбонил, карбокси, алкоксикарбонил, карбониламино, сульфониламино, аминокарбонил или аминосульфонил; R5 представляет собой алкил, циклоалкил, гетероциклоалкил, арил или гетероарил и R7 представляет собой алкил.
В отношении формулы (I) одна из подгрупп соединений соответствует тому, что R1, R2, R3 и R4 представляет собой H и R5 представляет собой арил или гетероарил, необязательно замещенный галогеном, нитро, амино, циано, гидрокси, алкилом, алкенилом, алкинилом, арилом, циклоалкилом, гетероциклоалкилом, гетероарилом, алкокси, алкилтио, алкилкарбонилом, карбокси, алкоксикарбонилом, сульфонилом, карбониламино, сульфониламино, аминокарбонилом или аминосульфонилом. Другая подгруппа соответствует тому, что X представляет собой O или NH; Y представляет собой NH; V, U и T вместе представляют собой
при этом R6 может представлять собой H и R7 может представлять собой метил; или Z представляет собой CR', при этом R' представляет собой H, галоген или алкил.
Термин "алкил" в описании относится к углеводороду с прямой или разветвленной цепью, содержащему 1-10 атомов углерода. Примеры алкильных групп включают, но не ограничиваясь этим, метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил. Термин "алкокси" относится к -O-алкилу.
Термин "арил" относится к содержащей 6 атомов углерода моноциклической, содержащей 10 атомов углерода бициклической, содержащей 14 атомов углерода трициклической ароматической кольцевой системе, где каждое кольцо может иметь 1-4 заместителя. Примеры арильных групп включают, но не ограничиваясь этим, фенил, нафтил и антраценил.
Термин "циклоалкил" относится к насыщенной и частично ненасыщенной циклической углеводородной группе, имеющей 3-12 атомов углерода. Примеры циклоалкильных групп включают, но, не ограничиваясь этим, циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептил и циклооктил.
Термин "гетероарил" относится к ароматической 5-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической кольцевой системе, имеющей один или несколько гетероатомов (таких как O, N или S). Примеры гетероарильных групп включают пиридил, фурил, имидазолил, бензимидазолил, пиримидинил, тиенил, хинолинил, индолил и тиазолил. Термин "гетероаралкил" относится к алкильной группе, замещенной гетероарильной группой.
Термин "гетероциклоалкил" относится к неароматической 5-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической кольцевой системе, имеющей один или несколько гетероатомов (таких как O, N или S). Примеры гетероциклоалкильных групп включают, но не ограничиваясь этим, пиперазинил, пирролидинил, диоксанил, морфолинил и тетрагидрофуранил. Гетероциклоалкил может представлять собой сахаридное кольцо, например, глюкозил.
Алкил, циклоалкил, гетероциклоалкил, арил, гетероарил и алкокси, упоминаемые в описании, включают как замещенные, так и незамещенные остатки. Примеры заместителей включают, но не ограничиваясь этим, галоген, гидроксил, амино, циано, нитро, меркапто, алкоксикарбонил, амидо, карбокси, алкансульфонил, алкилкарбонил, карбамидо, карбамил, карбоксил, тиоуреидо, тиоцианато, сульфонамидо, алкил, алкенил, алкинил, алкилокси, арил, гетероарил, циклоалкил, гетероциклоалкил, в которых алкил, алкенил, алкинил, алкилокси, арил, гетероарил, циклоалкил и гетероциклоалкил могут дополнительно замещаться.
Пиримидиновые соединения, описанные выше, включают их фармацевтически приемлемые соли, гидраты и пролекарства, если это возможно.
Другой аспект настоящего изобретения описывает способ лечения связанного с ангиогенезом расстройства (например, рака или возрастной макулярной дегенерации). Способ включает введение субъекту, имеющему такое расстройство, эффективного количества одного или нескольких описанных выше пиримидиновых соединений.
Еще в одном аспекте настоящее изобретение описывает способ ингибирования активности рецептора домена инсерции киназы посредством приведения в контакт рецептора с эффективным количеством пиримидинового соединения формулы (II):
в которой R1 представляет собой H, алкил, алкенил, алкинил, арил, циклоалкил, гетероциклоалкил или гетероарил; каждый из R2 и R3 независимо представляет собой H, галоген, нитро, амино, CN, гидрокси, алкил, алкенил, алкинил, арил, циклоалкил, гетероциклоалкил, гетероарил, алкокси, алкилкарбонил, карбокси или алкоксикарбонил; каждый из X и Y независимо представляет собой O, S или NR4, где R4 представляет собой H, алкил, алкенил, алкинил, арил, циклоалкил, гетероциклоалкил, гетероарил, алкилкарбонил, алкоксикарбонил, аминокарбонил или аминосульфонил; и Ar представляет собой арил или гетероарил.
В отношении формулы (II) одна из подгрупп соединений соответствует тому, что Ar представляет собой индолил, индазолил, бензоимидазолил или бензоксазолил; X представляет собой O или NH и Y представляет собой NH; или R1 представляет собой арил или гетероарил, необязательно замещенный галогеном, нитро, амино, циано, гидрокси, алкилом, алкенилом, алкинилом, арилом, циклоалкилом, гетероциклоалкилом, гетероарилом, алкокси, алкилтио, алкилкарбонилом, карбокси, алкоксикарбонилом, сульфонилом, карбониламино, сульфониламино, аминокарбонилом или аминосульфонилом.
Иллюстративные соединения 1-317 показаны ниже в разделе "Подробное описание".
Еще один аспект настоящего изобретения описывает способ ингибирования ангиогенеза или лечения возрастной макулярной дегенерации посредством введения субъекту, нуждающемуся в этом, эффективного количества пиримидинового соединения формулы (II), как описано выше.
Также в рамках настоящего изобретения находятся (1) композиция, содержащая одно или несколько пиримидиновых соединений, описанных выше, и фармацевтически приемлемый носитель для использования при лечении связанного с ангиогенезом расстройства (такого, например, как рак или возрастная макулярная дегенерация), и (2) применение одного или нескольких пиримидиновых соединений для получения лекарственного препарата для лечения расстройства.
Подробное описание одного или нескольких вариантов осуществления настоящего изобретения приводятся ниже в данном документе. Другие признаки, цели и преимущества настоящего изобретения будут понятны из описания и формулы изобретения.
Подробное описание
Соединения, описанные выше, могут быть синтезированы из коммерчески доступных исходных материалов с помощью способов, хорошо известных в данной области. Так, например, можно заменить уходящие группы (например, хлорид, п-TsO, MeS или MeSO2) на активных N2, N4 положениях соответствующего пиримидинового соединения нуклеофильными группами, такими как амино или гидроксил, например, посредством реакции сочетания Бухвальда-Хартвига. Замещение может быть сначала осуществлено либо в N2 положении, либо в N4 положении.
Соединения, полученные таким образом, могут дополнительно модифицироваться в их периферийных положениях с получением желаемых соединений.
Преобразования химии синтеза, пригодные для использования при синтезе желаемых пиримидиновых соединений, описываются, например, в R. Larock, Comprehensive Organic Transformations, VCH Publishers (1989); T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley and Sons (1999); L. Fieser and M. Fieser, Fieser and Fieser's Reagents for Organic Synthesis, John Wiley and Sons (1994); и L. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995) и в их последующих изданиях.
Перед использованием соединения могут быть очищены с помощью колоночной хроматографии, высокоэффективной жидкостной хроматографии, кристаллизации или других пригодных для использования способов.
Пиримидиновые соединения, описанные выше, когда они приводятся в контакт с KDR, ингибируют активность этого рецептора. Эффективное количество одного или нескольких из этих соединений может по этой причине использоваться для ингибирования ангиогенеза и лечения субъекта, имеющего связанное с ангиогенезом расстройство.
Термин "эффективное количество" относится к количеству пиримидинового соединения, которое требуется для оказания предполагаемого воздействия на субъекта. Эффективные количества могут изменяться, как ясно специалисту в данной области, в зависимости от способа введения, используемого наполнителя и от возможности совместного использования с другими агентами. Термин "лечение" относится к введению одного или нескольких описанных выше пиримидиновых соединений субъекту, который имеет связанное с ангиогенезом расстройство или имеет симптом такого расстройства, или имеет предрасположение к такому расстройству, с целью излечения, заживления, ослабления, облегчения, изменения, устранения, улучшения, оздоровления расстройства или влияния на расстройство, симптомы расстройства или на предрасположенность к расстройству.
Для осуществления этого способа композиция, имеющая одно или несколько из пиримидиновых соединений по настоящему изобретению, может вводиться перорально, парентерально, посредством ингаляции посредством спрея или посредством имплантированного резервуара. Термин "парентеральный", как используется в описании, включает подкожную, чрескожную, внутривенную, внутримышечную, интраартикулярную, интраартериальную, интрасиновиальную, интрастернальную, интратекальную, внутрираневую и интракраниальную технологию инъекции или вливания.
Пероральная композиция может представлять собой любую перорально приемлемую дозированную форму, включая, но не ограничиваясь этим, таблетки, капсулы, эмульсии и водные суспензии, дисперсии и растворы. Обычно используемые носители для таблеток включают лактозу и кукурузный крахмал. Смазывающие агенты, такие как стеарат магния, как правило, также добавляют к таблеткам. Для перорального введения в форме капсулы, пригодные для использования разбавители включают лактозу и высушенный кукурузный крахмал. Когда водные суспензии или эмульсии вводятся перорально, активный ингредиент может суспендироваться или растворяться в масляной фазе, в сочетании с эмульгирующими или суспендирующими агентами. Если это желательно, могут добавляться определенные подслащивающие, ароматизирующие или подкрашивающие агенты.
Стерильная композиция для инъекций (например, водная или масляная суспензия) может приготавливаться в соответствии с технологией, известной в данной области, с использованием соответствующих диспергирующих или смачивающих агентов (таких, например, как Tween 80) и суспендирующих агентов. Стерильный препарат для инъекций может также представлять собой стерильный раствор или суспензию для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, таком, например, как раствор в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые могут использоваться, находятся маннитол, вода, раствор Рингера и изотонический раствор хлорида натрия. В дополнение к этому, стерильные фиксированные масла обычно используют в качестве растворителя или суспендирующей среды (например, синтетические моно- или диглицериды). Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, являются пригодными для использования при получении препаратов для инъекций, постольку, поскольку они представляют собой природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, в особенности в их полиоксиэтилированных формах. Эти масляные растворы или суспензии могут также содержать разбавитель или дисперсант на основе длинноцепочечного спирта или карбоксиметилцеллюлозу, или сходные диспергирующие агенты.
Композиция для ингаляций может быть получена в соответствии с технологией, хорошо известной в области приготовления фармацевтических препаратов, и может быть получена в виде растворов в физиологическом растворе с использованием бензилового спирта или других соответствующих консервантов, усилителей поглощения для повышения биологической доступности, фторуглеродов и/или других солюбилизирующих или диспергирующих агентов, известных в данной области.
Композицию для местного применения можно приготавливать в форме масла, крема, лосьона, мази и тому подобного. Соответствующие носители для композиции включают растительные или минеральные масла, белый петролят (белый мягкий парафин), жиры или масла с разветвленной цепью, животные жиры и высокомолекулярные спирты (больше чем C12). Предпочтительные носители представляют собой такие, в которых активный ингредиент является растворимым. Также могут быть включены эмульгаторы, стабилизаторы, увлажнители и антиоксиданты, а также агенты, придающие цвет или аромат, если это желательно. В дополнение к этому, в этих препаратах для местного применения могут использоваться вещества, способствующие проникновению через кожу. Примеры таких усилителей можно найти в патентах США № 3989816 и 4444762. Кремы предпочтительно приготавливают из смеси минерального масла, полуэмульгирующего пчелиного воска и воды, в которой смешивается смесь активного ингредиента, растворенного в малом количестве масла, такого как миндальное масло. Пример такого крема представляет собой крем, который содержит примерно 40 частей воды, примерно 20 частей пчелиного воска, примерно 40 частей минерального масла и примерно 1 часть миндального масла. Мази могут приготавливаться посредством смешивания раствора активного ингредиента в растительном масле, таком как миндальное масло, с теплым мягким парафином и предоставления смеси возможности для охлаждения. Пример такой мази представляет собой мазь, которая содержит примерно 30% мас. миндального масла и примерно 70% мас. белого мягкого парафина.
Носитель в фармацевтической композиции должен быть "приемлемым" в том смысле, что он совместим с активными ингредиентами препарата (и предпочтительно, способен стабилизировать его) и не является вредным для субъекта, которого лечат. Например, солюбилизирующие агенты, такие как циклодекстрины (которые образуют конкретные, более растворимые комплексы с одним или несколькими активными пиримидиновыми соединениями экстракта), могут использоваться в качестве фармацевтических носителей для доставки активных ингредиентов. Примеры других носителей включают коллоидную двуокись кремния, стеарат магния, целлюлозу, натрийлаурилсульфат и D&C Yellow #10.
Соответствующие анализы in vitro могут использоваться для предварительной оценки эффективности описанных выше пиримидиновых соединений при ингибировании активности KDR или при ингибировании активности VEGF. Соединения могут дополнительно исследоваться на их эффективность при лечении связанного с ангиогенезом расстройства с помощью анализа in vivo. Например, соединения могут вводиться животному (например, на модели мыши), имеющему рак, и их терапевтические воздействия затем оцениваются. На основе этих результатов могут также определяться соответствующий диапазон дозировок и способ введения.
Без дополнительного уточнения, предполагается, что приведенное выше описание дает адекватную возможность для осуществления настоящего изобретения. Следующие далее конкретные примеры, по этой причине, должны рассматриваться только лишь как иллюстративные и не ограничивающие остальное описание каким-либо образом.
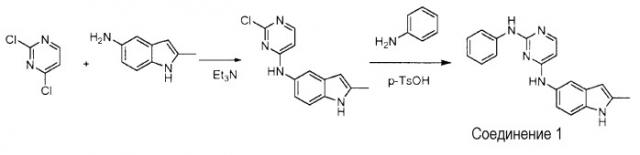
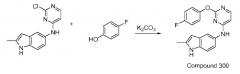
Пример 1: Синтез N4-(2-метил-1H-индол-5-ил)-N2-фенилпиримидин-2,4-диамина (соединение 1)
Et3N (1 ммоль) добавляют к раствору 2,4-дихлорпиримидина (1 ммоль) и 5-амино-2-метилиндола (1 ммоль) в 5 мл EtOH. Реакционную смесь нагревают с обратным холодильником в течение 5 часов. После удаления растворителя в вакууме и добавления H2O, смесь экстрагируют EtOAc. Органические слои объединяют, промывают насыщенным раствором NaCl, сушат над безводным Na2SO4 и концентрируют в вакууме. Полученный остаток очищают с помощью колоночной хроматографии с получением N-(2-хлорпиримидин-4-ил)-2-метил-1H-индол-5-амина с выходом 80%.
N-(2-хлорпиримидин-4-ил)-2-метил-1H-индол-5-амин (0,1 ммоль) и анилин (0,1 ммоль) растворяют в 0,5 мл ДМФ. К нему добавляют п-TsOH моногидрат (0,2 ммоль). Реакционную смесь перемешивают при 60°C в течение 5 часов, разбавляют водой и экстрагируют этилацетатом. Органический слой последовательно промывают водой и насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют. Полученный остаток очищают с помощью колоночной хроматографии с получением указанного в заголовке продукта с выходом 85%.
1H ЯМР (CD3OD 400 МГц): δ 7,831 (д, J=6,0 Гц, 1H), 7,633 (т, J=8,0-7,6 Гц, 3H), 7,262 (т, J=8,4-7,6 Гц, 3H), 7,064 (д, J=6,8 Гц, 1H), 6,995 ((т, J=7,6-7,2 Гц, 1H), 6,133 (т, J=6,4-2,0 Гц, 2H), 2,439 (с, 3H); MS (m/e): 384,2 (M+1).
Примеры 2-283: Синтез соединений 2-283
Соединения 2-283, каждое, синтезируют способом, подобным тому, который описан в примере 1.
| Соединение | Наименование/структура | 1H ЯМР (400 МГц, δ м.д.)/MS |
| 2 | N2-(3-этинилфенил)-N4-(2-метил-1H-индол-5-ил)пиримидин-2,4-диамин | (CD3OD): 7,848 (д, J=6,8 Гц, 1H), 7,730 (с, 1H), 7,704 (д, J=8,0 Гц, 1H), 7,507 (с, 1H), 7,275 (д, J=8,0 Гц, 1H), 7,200 (т, J=8,0 Гц, 1H), 7,093-7,036 (м, 2H), 6,639 (м, 2H), 2,425 (с, 3H); MS (m/e): 340,4 (М+1) |
| 3 | N2-(3-бромфенил)-N4-(2-метил-1H-индол-5-ил)пиримидин-2,4-диамин | (CD3OD): 7,879 (с, 1H, 7,784 (J=6,0 Гц, 1H), 7,437 (ушир., 1H), 7,373 (с, 1H), 7,255 (д, J=8,8 Гц, 1H), 7,079 (ушир., 2H), 6,968 (д, J=8,4 Гц, 1H), 6,133 (с, 1H), 6,041 (д, J=6,4 Гц,, 1H), 2,400 (с, 3H); MS (m/e): 394,3 (M) |
| 4 | N2-(3-фторфенил)-N4-(2-метил-1H-индол-5-ил)пиримидин-2,4-диамин | (CD3OD): 7,923 (с, 1H), 7,759 (д, J=6,0 Гц, 1H), 7,641 (д, J=8,0 Гц, 1H), 7,397 (с, 1H), 7,247 (д, J=8,4 Гц, 1H), 7,179-7,053 (м, 1H), 6,963 (д, J=8,4 Гц, 1H), 6,575 (т, J=8,0 Гц, 1H), 6,125 (с, 1H), 6,044 (д, J=6,0 Гц, 1H), 2,395 (с, 3H); MS (m/e): 334,2 (М+1) |
| 5 | N2-(3-хлорфенил)-N4-(2-метил-1H-индол-5-ил)пиримидин-2,4-диамин | (CD3OD): 7,838 (д, J=6,8 Гц, 1H), 7,746 (с, 1H), 7,526 (ушир., 2H), 7,298 (д, J=8,4 Гц, 1H), 7,212 (т, J=8,0 Гц, 1H), 7,102 (д, J=8,4 Гц, 1H), 7,001 (д, J=8,0 Гц, 1H), 6,217 (д, J=6,0 Гц, 1H), 6,133 (с, 1H), 2,436 (с, 3H); MS (m/e): 350,2 (М+1) |
| 6 | N4-(2-метил-1H-индол-5-ил)-N2-(3-(трифторметил)фенил) пиримидин-2,4-диамин | (CD3OD): 8,045 (д, J=7,2 Гц, 1H), 7,788 (д, J=6,0 Гц, 2H), 7,529 (с, 1H), 7,366 (д, J=6,8 Гц, 1H), 7,276 (д, J=8,4 Гц, 1H), 7,228 (д, J=7,2 Гц, 1H), 7,083 (д, J=1,2 Гц, 1H), 6,190 ((д, J=6,4 Гц, 1H), 6,115 (с, 1H), 2,440 (с, 3H), MS (m/e): 384,2 (M+1) |
| 7 | N4-(2-метил-1H-индол-5-ил)-N2-(3-(метилсульфонил)фенил)пиримидин-2,4-диамин | (CD3OD): 11,471 (с, 1H), 9,461 (с, 1H), 9,364 (с, 1H), 8,441 (с, 1H), 8,236 (с, 1H), 7,988 (д, J=5,6 Гц, 1H), 7,396 (M,, 5H), 7,303 (д, J=8,4 Гц, 1H), 6,255 (д, J=5,6 Гц, 1H), 3,111 (с, 3H), 2,456 (с, 3H), MS (m/e): 393,2 (М+1) |
| 8 | N2-(3-метоксилфенил)-N4-(2-метил-1H-индол-5-ил)пиримидин-2,4-диамин | (CD3OD): 8,050 (с, 1H), 7,943 (д, J=6,0 Гц, 1H), 7,440-7,362 (м, 3H), 7,293 (с, 1H), 7,223 (т, J=8,0 Гц, 2H), 7,122 (д, J=7,6 Гц, 1H), 7,0211 (д, J=6,8 Гц, 1H), 6,808 (с, 1H), 6,680 (д, J=6,4 Гц, 1H), 6,222 (с, 1H), 6,068 (д, J=5,6 Гц, 1H), 3,790 (с, 3H), 2,472 (с, 3H); MS (m/e): 345,9 (М+1) |
| 9 | этил 1-(3-(4-(2-метил-1H-индол-5-иламино)пиримидин-2-иламино)бензил)пиперидин-4-карбоксилат | (CD3OD): 8,019 (с, 1H), 7,889 (д, J=5,6 Гц, 1H), 7,554 (с, 1H), 7,399 (д, J=8,0 Гц, 1H), 7,328 (д, J=8,4 Гц, 1H), 7,278 (т, J=8,0 Гц, 1H), 7,101 (д, J=8,0 Гц, 1H), 7,002 (д, J=7,2 Гц, 1H), 6,180 (д, J=6,0 Гц, 1H), 6,141 (с, 1H), 4,166 (кв., J=7,2 Гц, 1H), 3,586 (с, 2H), 2,973-2,943 (м, 2H), 2,462 (с, 3H), 2,316 (ушир., 1H), 2,089 (м, 2H), 1,939-1,885 (м, 2H), 1,741-1,653 (м, 2H), 1,272 (т, J=7,2 Гц, 2H); MS (m/e): 485,4 (M+1) |
| 10 | N2,N4-бис(2-метил-1H-индол-5-ил)пиримидин-2,4-диамин | (CD3OD): 7,675 (д, J=6,4 Гц, 1H), 7,625 (с, 1H), 7,577 (ушир., 1H), 7,266-7,219 (м, 2H), 7,068-7,051 (м, 1H), 6,116 (д, J=6,0 Гц, 1H), 6,072 (с, 1H), 6,014 (с, 1H), 2,435 (с, 3H), 2,425 (с, 3H); MS (m/e): 369,3 (М+1) |
| 11 | N2-(1H-индазол-5-ил)-N4-(2-метил-1H-индол-5-ил)пиримидин-2,4-диамин | (CD3OD): 12,385 (с, 1H), 10,928 (с, 1H), 9,120 (с, 1H), 9,003 (с, 1H), 8,259 (с, 1H), 7,920 (д, J=6,0 Гц, 1H), 7,758 (с, 1H), 7,667 (с, 1H), 7,541 (д, J=8,8 Гц, 2H), 7,399 (д, J=8,8 Гц, 1H), 7,242 (д, J=8,8 Гц, 1H), 7,15l (д, J=8,8 Гц,,1H), 6,142 (д, J=6,0 Гц, 1H), 6,017 (с, 1H), 2,389 (с, 3H), MS (m/e): 356,3 (М+1) |
| 12 | N2-(1H-бензо[d]имидазол-5-ил)-N4-(2-метил-1H-индол-5-ил)пиримидин-2,4-диамин | (CD3OD): 10,853 (с, 1H), 9,033 (с, 1H), 8,956 (с, 1H), 8,077 (ушир., 2H), 7,925 (д, J=6,0 Гц, 1H), 7,736 (с, 1H), 7,533 (д, J=8,0 Гц, 1H), 7,444 (д,, J=8,8 Гц, 1H), 7,214-7,144 (м, 2H), 6,131 (д, J=6,0 Гц, 1H), 6,020 (с, 1H), 2,372 (с, 3H); MS (m/e): 356,3 (М+1) |
| 13 | N2-(2-метоксифенил)-N4-(2-метил-1H-индол-5-ил)пиримидин-2,4-диамин | (CD3OD): 8,496 (с, 1H), 8,002 (д, J=6,0 Гц, 2H), 7,446 (с, 1H), 7,047 (дд, J=8,8 Гц, J=2,4 Гц, 1H), 6,981-6,957 (м, 2H), 6,913-6,771 (м, 1H), 6,889 (с, 1H), 6,243 (с, 1H), 6,083 (д, J=6,0 Гц, 1H), 3,910 (с, 3H), 2,490 (с, 3H), MS (m/e): 346,2 (М+1) |
| 14 | N2-(2-хлорфенил)-N4-(2-метил-1H-индол-5-ил)пиримидин-2,4-диамин | (CD3OD): 8,385 (д, J=6,0 Гц, 1H), 7,914 (с, 1H), 7,849 (с, 1H), 7,325 (д, J=7,6 Гц, 1H), 7,237 (д, J=8,4 Гц, 1H), 7,182 (т, J=7,6 Гц, 1H), 6,945-6,870 (м, 2H), 6,119 (с, 1H), 6,070 (д, J=6,0 Гц, 1H), 2,397 (с, 3H); MS (m/e): 350,1 (М+1) |
| 15 | N2-(2-бромфенил)-N4-(2-метил-1H-индол-5-ил)пиримидин-2,4-диамин | (CD3OD): 10,860 (с, 1H), 9,204 (с, 1H), 8,140 (д, J=8,4 Гц, 1H), 7,916 (д, J=5,6 Гц, 2H), 7,651 (д, J=7,6 Гц, 2H), 7,334 (т, J=7,6 Гц, 1H), 7,184 (д, J=8,8 Гц, 1H), 7,038 (ушир., 2H), 6,192 (д, J=6,0 Гц, 1H), 6,012 (с, 1H), 2,369 (с, 3H); MS (m/e): 394,3 (M) |
| 16 | N2-(4-фторфенил)-N4-(2-метил-1H-индол-5-ил)пиримидин-2,4-диамин | (CD3OD): 10,889 (с, 1H), 9,256 (с, 1H), 9,245 (с, 1H), 7,966 (д, J=5,6 Гц, 1H), 7,752 (м, J=8,4-3,6 Гц, 2H), 7,236 (д, J=5,4 Гц, 1H), 7,133 (м, J=8,4-3,6 Гц, 3H), 6,086 (д, J=5,6 Гц, 1H), 6,050 (с, 1H), 2,402 (с, 3H); MS (m/e): 334,2 (М+1) |
| 17 | метил 2-(4-(4-(2-метил-1H-индол-5-иламино)пиримидин-2-иламино)фенил)ацетат | (CD3OD): 10,907 (с, 1H), 9,132 (с, 1H), 9,015 (с, 1H), 7,914 (с, 1H), 7,713 (д, J=6 Гц, 1H), 7,498 (д, J=6,8 Гц, 1H), 7,217 (д, J=7,2 Гц, 1H), 7,127 (м, 4H), 6,149 (д, (д, J=6 Гц, 1H), 6,067 (с, 1H), 2,384 (с, 3H), 2,272 (с, 3H), 1,288 (с, 2H), MS (m/e): 387,2 (М+1) |
| 18 | N4-(2-метил-1H-индол-5-ил)-N2-(4-феноксифенил)пиримидин-2,4-диамин | (CD3OD): 10,855 (с, 1H), 9,098 (с, 1H), 9,065 (с, 1H), 7,909 (д, J=5,6 Гц, 1H), 7,786 (д, J=8 Гц, 2H), 7,365 (т, J=7,6 Гц, 2H), 7,346 (с, 1H), 7,201 (д, J=8,8 Гц, 1H), 7,086 (м, 2H), 6,962 (д, 8 Гц, 2H), 6,895 (д, J=8 Гц,2H), 6,137 (д, J=5,6 Гц, 1H), 6,021 (с, 1H), 2,33l (с, 3H), MS (m/e): 407,5 (М+1) |
| 19 | N2-(4-метоксифенил)-N4-(2-метил-1H-индол-5-ил)пиримидин-2,4-диамин | (CD3OD): 11,097 (с, 1H), 9,479 (с, 1H), 9,243 (с, 1H), 8,090 (д, J=6 Гц, 1H), 7,923 (с, 1H), 7,822 (м, 2H), 7,420 (д, 8,8 Гц, 1H), 7,307 (с, 1H), 7,025 (д, J=8,8 Гц, 2H), 6,340 (м, 1H), 6,265 (с, 1H), 3,941 (с, 3H), 2,591 (с, 3H); MS (m/e): 345,4 (М+1) |
| 20 | N4-(2-метил-1H-индол-5-ил)-N2-(4-(2-морфолиноэтокси)фенил)пиримидин-2,4-диамин | (CD3OD): 10,899 (с, 1H), 9,074 (с, 1H), 8,823 (с, 1H), 7,869 (д, J=6 Гц, 1H), 7,713 (с, 1H), 7,621 (д, J=8,8 Гц, 2H), 7,200 (д, J=8,4 Гц, 1H), 7,080 (с, 1H), 6,784 (м, 2H), 6,101 (д, J=5,6 Гц, 1H), 6,025 (c? 1H), 4,034 (т, J=5,6 Гц, 2H), 3,585 (т, J=4,8 Гц, 4H), 2,679 (т, J=5,6 Гц, 2H), 2,475 (т, J=6,4 Гц, 4H), 2,375 (с, 3H); MS: 444,5 (М+1) |
| 21 | N2-(3,4-дифторфенил)-N4-(2-метил-1H-индол-5-ил)пиримидин-2,4-диамин | (CD3OD): 11,234 (c, 1H), 9,886 (с, 1H), 9,754 (с, 1H), 7,966 (д, J=5,6 Гц, 2H), 7,752 (с, 1H), 7,393 (м, J=8,4-3,6 Гц, 3H), 7,133 (д, J=5,6 Гц, 1H), 6,251 (д, J=4,5 Гц, 1H), 6,19 (с, 1H), 2,402 (с, 3H); MS (m/e): 352,2 (М+1) |
| 22 | N2-(3,5-диметилфенил)-N4-(2-метил-1H-индол-5-ил)пиримидин-2,4-диамин | (CD3OD): 10,863 (с, 1H), 9,051 (с, 1H), 8,841 (с, 1H), 7,905 (д, J=6 Гц, 1H), 7,633 (с, 1H), 7,361 (с, 1H), 7,207 (м, 2H), 6,507 (с, 1H), 6,118 (д, J=5,6 Гц, 1H), 6,032 (с, 2H), 2,370 (с, 3H), 2,171 (с, 6H); MS (m/e): 343,4 (М+1) |
| 23 | 2-(4-(2-метил-1H-индол-5-иламино)пиримидин-2-иламино)этанол | (CD3OD): 7,939 (д, J=8,0 Гц, 1H), 6,923 (д, J=6,8 Гц, 2H), 6,437 (с, 1H), 6,328 (д, J=7,6 Гц, 2H), 6,218 (с, 1H), 6,231 (д, J=5,6 Гц, 1H), 5,726 (д, J=7,2 Гц, 1H), 3,735 (т, J=7,2-6,4 Гц, 3H), 3,225 (т, J=6,8-5,6 Гц, 3H), 2,247 (с, 3H); MS (m/e): 384,1 (M+1) |
| 24 | N4-(2-метил-1H-индол-5-ил)-N2-(2-морфолиноэтил)пиримидин-2,4-диамин | (CD3OD): 7,796 (д, J=6,0 Гц, 1H), 7,497 (с, 1H), 7,246 (д, J=8,8 Гц, 1H), 7,076 (д, J=2,8 Гц, 1H), 6,148 (с, 1H), 5,625 (д, J=4,8 Гц, 1H), 3,760 (м, J=3,2-2,8 Гц, 4H), 3,165 (т, J=3,2-2,4, 2H), 2,619 (т, J=2,0-08 Гц, 2H), 2,447 (м, J=2,0-1,2 Гц, 4H), 2,317 (с, 3H), MS (m/e): 353,2 (M+1) |
| 25 | N-циклопропил-2-(3-(4-(2-метил-1H-индол-5-иламино)пиримидин-2-иламино)фенил)ацетамид | (ДМСО-d6,): 7,920 (д, J=5,6 Гц, 1H), 7,700 (м, 2H), 7,546 (с, 1H), 7,220 (д, J=8,0 Гц, 1H), 7,120 (м, 2H), 6,778 (д, J=8,0 Гц, 1H), 6,200 (д, J=6,0 Гц, 1H), 6,066 (с, 1H), 3,027 (с, 2H ), 2,593 (м, 1H), 2,380 (с, 3H), 0,608 (м, 2H), 0,404 (м, 2H), MS (m/e): 413,5 (М+1) |
| 26 | N2-(3-(2-(диметиламино)этилсульфонил)фенил)-N4-(2-метил-1H-индол-5-ил)пиримидин-2,4-диамин | (CD3OD): 8,237 (с, 1H), 8,042 (д, J=6,8 Гц, 1H), 7,867 (д, J=6,0 Гц, 1H), 7,477 (с, 1H), 7,465 (ушир., 2H), 7,253 (д, J=8,8 Гц, 1H), 7,028 (д, J=8,0 Гц, 1H), 6,141 (д, J=5,6 Гц, 1H), 6,088 (с, 1H), 3,230 (т, J=7,6 Гц, 2H), 2,666 (т, J=7,2 Гц, 2H), 2,409 (с, 3H), 2,165 (с, 6H); MS: 451,4 (М+1) |
| 27 | N4-(2-метил-1H-индол-5-ил)-N2-(3-(1-(метилсульфонил)пиперидин-4-илокси)фенил)пиримидин-2,4-диамин | (ДМСО-d6): 10,976 (с, 1H), 9,240 (с, 1H), 9,036 (с, 1H), 7,054-8,014 (м, 7H), 6,401-6,564 (м, 1H), 6,114-6,278 (м, 1H), 6,012-6,073 (м, 1H), 4,224-4,383 (м, 1H), 3,110-3,209 (м, 2H), 2,770-2,886 (м, 2H), 2,370 (с, 3H), 1,806-1,970 (м, 2H), 1,578-1,712 (м, 1H); MS (m/e): 493,5 (М+1) |
| 28 | N-(3-(4-(2-метил-1H-индол-5-иламино)пиримидин-2-иламино)фенил)метансульфонамид | (CD3OD): 7,856 (д, J=6,0 Гц, 1H), 7,652 (с, 1H), 7,543 (с, 1H), 7,432 (дд, J=8,4 Гц, 1H), 7,271 (д, J=8,4 Гц, 1H), 7,196 (т, J=8,0 Гц, 1H), 6,882 (дд, J=8,0 Гц, 2H), 6,130 (д, J=6,0 Гц, 2H), 2,440 (с, 3H), 2,172 (с, 3H); MS (m/e): 409,3 (М+1) |
| 29 | N4-(2-метил-1H-индол-5-ил)-N2-(3-(2-морфолиноэтокси)фенил)пиримидин-2,4-диамин | (ДМСО-d6): δ 10,825 (с, 1H), 9,023 (с, 1H), 8,986 (с, 1H), 7,927 (д, J=5,6 Гц, 1H), 7,703 (с, 1H), 7,429 (с, 1H), 7,351 (д, J=2,4 Гц, 1H), 7,208 (д, J=8,8 Гц, 1H), 7,076 (м, J=8 Гц, 2H), 6,469 (дд, J=8, 2,4 Гц, 1H), 6,118 (д, J=2 Гц, 1H), 6,057 (с, 1H), 3,933 (т, J=5,6 Гц, 2H), 3,551 (т, J=4,8 Гц, 4H), 2,591 (т, J=5,6 Гц, 2H), 2,40l (т, J=4,8 Гц, 4H), 2,379 (с, 3H); MS (m/e): 444,5 (М+1) |
| 30 | N2-(3-(3-(диметиламино) пропокси)фенил)-N4-(2-метил-1H-индол-5-ил)пиримидин-2,4-диамин | (CD3OD): 10,836 (с, 1H), 9,021 (с, 1H), 8,983 (с, 1H), 7,926 (д, J=6 Гц, 1H), 7,691 (с, 1H), 7,419 (с, 1H), 7,345 (д, J=8,4 Гц, 1H), 7,212 (д, J=8,4 Гц, 1H), 7,079 (м, 2H), 6,444 (дд, J=8, 2,4 Гц, 1H), 6,118 (д, J=6 Гц, 1H), 6,062 (с, 1H), 3,835 (т, J=6 Гц, 2H), 2,317 (с, 3H), 2,318 (т, J=7,2 Гц, 2H), 2,154 (с, 6H), 1,767 (т, J=7,2 Гц, 2H); MS (m/e): 416,5 (М+1) |
| 31 | 2-(3-(4-(2-метил-1H-индол-5-иламино)пиримидин-2-иламино)фенокси)этанол | (CD3OD): 10,902 (с, 1H), 9,087 (с, 1H), 8,986 (с, 1H), 7,917 (д, J=4 Гц, 1H), 7,683 (с, 1H), 7,405 (м, 2H), 7,227 (м, 1H), 7,104 (м, 1H), 6,458 (д, J=8 Гц, 1H), 6,141 (с, 1H), 6,050 (м, 2H), 5,594 (м, 1H), 3,873 (т, J=5,6 Гц, 2H), 3,653 (т, J=6 Гц, 2H), 2,376 (с, 3H); MS (m/e): 375,4 (М+1) |
| 32 | 2-(2-(4-(2-метил-1H-индол-5-иламино)пиримидин-2-иламино)фенокси)этанол | (CD3OD): 10,851 (с, 1H), 9,117 (с, 1H), 8,431 (д, J=8,0 Гц, 1H), 7,938 (д, J=6,0 Гц, 1H), 7,869 (с, 1H), 7,689 (ушир., 1H), 7,228 (д, J=8,8 Гц, 1H), 6,983-7,053 (м, 2H), 6,836-6,923 (м, 2H), 6,147 (д, J=6,0 Гц, 1H), 6,079 (с, 1H), 5,137 (т, J=5,6 Гц, 1H), 4,061 (кв., J=11,2 Гц, 1,2 Гц, 2H), 3,767 (кв., J=9,6 Гц, 5,6 Гц, 2H), 2,389 (с, 3H); MS (m/e): 376,3 (М+1) |
| 33 | N4-(2-метил-1H-индол-5-ил)-N2-(2-(2-морфолиноэтокси)фенил) пиримидин-2,4-диамин | (CD3OD): 10,845 (с, 1H), 9,112 (с, 1H), 8,377 (д, J=7,6 Гц, 1H), 7,935 (д, J=6,0 Гц, 1H), 7,823 (с, 1H), 7,647 (ушир., 1H), 7,219 (д, J=8,8 Гц, 1H), 7,061 (д, J=8 Гц, 2H), 6,889-6,950 (м, 2H), 6,147 (д, J=6,0 Гц, 1H), 6,074 (с, 1H), 4,182 (т, J=6,0 Гц, 2H), 3,592 (т, J=4,8 Гц, 4H), 2,692 (т, J=5,2 Гц, 2H), 2,471 (ушир., 4H), 2,388 (с, 3H); MS (m/e): 445,3 (М+1) |
| 34 | N-метил-3-(4-(2-метил-1H-индол-5-иламино)пиримидин-2-иламино)бензамид | (ДМСО-d6): δ 11,015 (с, 1H), 10,776 (с, 1H), 10,593 (с, 1H), 8,493 (д, J=4 Гц, 1H), 7,938 (м, 2H), 7,803 (д, J=2 Гц, 1H), 7,651 (м, 2H), 7,374 (м, 1H), 7,210 (м, 2H), 6,467 (м, 1H), 6,046 (с, 1H), 2,779 (д, 4,4 Гц, 3H), 2,379 (с, 3H); MS (m/e): 373,4 (М+1) |
| 35 | 3-(4-(2-метил-1H-индол-5-иламино)пиримидин-2-иламино)-N-(2-(пиперидин-1-ил)этил)бензамид | (CD3OD): 10,832 (с, 1H), 9,156 (с, 1H), 9,056 (с, 1H), 8,157 (с, 1H), 8,054 (с, 1H), 7,946 (м, 2H), 7,700 (ушир., 1H), 7,319 (м, 2H), 7,199 (м, 2H), 6,159 (с, 1H), 6,052 (с, 1H), 3,180 (т, J=5,6 Гц, 2H), 2,378 (с, 3H), 1,480 (с, 6H), 1,372 (с, 4H), 1,229 (с, 2H), MS (m/e): 469,6 (М+1) |
| 36 | N-(2-(диметиламино)этил)-3-(4-(2-метил-1H-индол-5-иламино)пиримидин-2-иламино)бензамид | (CD3OD): 10,846 (с, 1H), 9,149 (с, 1H), 9,077 (с, 1H), 8,181 (т, J=5,6 Гц, 1H), 8,036 (м, 2H), 7,934 (м, 1H), 7,706 (ушир., 1H), 7,340 (м, 1H), 7,270 (м, 1H), 7,203 (м, 1H), 7,137 (м, 1H), 6,160 (д, J=5,6 Гц, 1H), 6,054 (с, 1H), 3,313 (т, J=6,4 Гц, 2H), 3,175 (т, J=5,6 Гц, 2H), 2,376 (с, 3H), 2,175 (с, 6H), MS (m/e): 429,5 (М+1) |
| 37 | N2-(3-(4-метоксифенил)-1H-пиразол-5-ил)-N4-(2-метил-1H-индол-5-ил)пиримидин-2,4-диамин | (ДМСО-d6): δ 12,354 (с, 1H), 10,911 (с, 1H), 8,985 (ушир., 2H), 7,901 (с, 1H), 7,599 (ушир., 2H), 7,259 (д, J=8,4 Гц, 1H), 7,037 (с, 1H), 6,941-6,913 (м, 2H), 6,099 (ушир., 2H), 3,787 (с, 3H), 2,493 (с, 3H); MS (m/e): 412,8 (М+1) |
| 38 | N-(3-этинилфенил)-4-(2-метил-1H-индол-5-илокси)пиримидин-2-амин | (CD3OD): 8,190 (д, J=6,0 Гц, 1H), 8,098 (с, 1H), 7,612 (с, 1H), 7,489 (д, J=8,0 Гц, 1H), 7,339-7,284 (м, 2H), 7,053 (т, J=8,4 Гц, 1H), 6,937 (дд, J=8,4 Гц, 2,0 Гц, 2H), 6,294 (д, J=6,0 Гц, 2H), 6,262 (с, 1H), 2,495 (с, 3H); MS (m/e): 341,1 (М+1) |
| 39 | N-(4-метоксифенил)-4-(2-метил-1H-индол-5-илокси)пиримидин-2-амин | (CD3OD): 8,198 (д, J=6,4 Гц, 1H), 7,974 (с, 1H), 7,363-7,283 (м, 2H), 6,935 (м, 2H), 6,742 (т, J=8,4 Гц, 1H), 6,260 (с, 1H), 6,200 (д, J=5,6 Гц, 1H), 3,771 (с, 3H), 2,493 (с, 3H), MS (m/e): 347,2 (М+1) |
| 41 | 4-(2-метил-1H-индол-5-илокси)-N-(4-феноксифенил)пиримидин-2-амин | (CD3OD): 8,201 (д, J=5,6 Гц, 1H), 7,373 (м, J=8,8-5,2 Гц, 4H), 7,188 (д, J=2,0 Гц, 1H), 7,081 (т, J=7,2-6,8 Гц, 1H), 6,989 (д, J=3,2 Гц, 2H), 6,890 (д, J=8,4 Гц, J=2,0 Гц, 1H), 6,644 (д, J=9,2 Гц, 2H), 6,323 (д, J=6,4 Гц, 1H), 6,137 (с, 1H), 2,376 (с, 3H), MS (m/e): 409,3 (M+1) |
| 42 | N-(3-метоксифенил)-4-(2-метил-1H-индол-5-илокси)пиримидин-2-амин | (CD3OD): 8,236 (д, J=5,2 Гц, 1H), 7,983 (с, 1H), 7,314-7,283 (м, 2H), 7,239 (ушир., 1H), 7,063 (т, J=8,0 Гц, 1H), 6,981 (д, J=8,0 Гц, 1H), 6,981 (дд, J=8,8 Гц, 2,0 Гц, 1H), 6,528 (д, J=8,0 Гц, 1H), 6,278-6,253 (м, 1H), 3,571 (с, 1H), 2,493 (с, 3H), MS (m/e): 347,2 (М+1) |
| 43 | 4-(2-метил-1H-индол-5-илокси)-N-(3-(3-(тиоморфолино-1',1'-диоксид)пропокси)фенил)пиримидин-2-амин | CD3OD): 8,298 (с, 1H), 7,996 (д, J=5,6 Гц, 1H), 7,385 (д, J=8,4 Гц, 1H), 7,197 (т, J=8,0 Гц, 1H), 7,094 (д, J=8,4 Гц, 2H), 6,791 (с, 1H), 6,543 (д, J=8,0 Гц, 1H), 6,333 (с, 1H), 5,995 (д, J=6,0 Гц, 1H), 5,321 (с, 1H), 3,974 (т, J=5,6 Гц, 1H), 3,077 (м, 8H), 2,699 (т, J=6,8 Гц, 1H), 2,468 (с, 3H), 1,926 (т, J=6,8 Гц, 2H); |
| 44 | N-метил-3-(4-(2-метил-1H-индол-5-илокси)пиримидин-2-иламино)бензамид | (ДМСО-d6): 11,130 (с, 1H), 9,631 (с, 1H), 8,324 (д, J=4,2 Гц, 1H), 8,309 (с, 1H), 7,994 (с, 1H), 7,741 (с, 1H), 7,308 (д, J=9,2 Гц, 1H), 7,219 (д, J=1,6 Гц, 1H), 7,052 (т, J=2,0-0,8 Гц, 2H), 6,932 (м, 1H), 6,272 (д, J=3,6 Гц, 1H), 6,140 (д, J=4,2 Гц, 1H), 5,249 (с, 1H), 2,801 (с, 3H), 2,437 (с, 3H), 2,401 (м, 2H); MS (m/e): 374,3 (M+1) |
| 45 | трифтор-N-(4-(4-(2-метил-1H-индол-5-илокси)пиримидин-2-иламино)фенил)метансульфонамид | (ДМСО-d6): 11,248 (с, 1H), 9,304 (с, 1H), 9,153 (с, 1H), 7,960 (с, 1H), 7,913 (д, J=6,0 Гц, 1H), 7,543 (д, J=4,4 Гц, 2H), 7,132 (д, J=8,4 Гц, 1H), 7,063 (м, 1H), 6,910 (т, J=3,6 Гц, 2H), 6,217 (с, 1H), 6,106 (т, J=1,6-2,4 Гц, 1H), 2,411 (с, 3H) MS (m/e): 464,4 (M+1) |
| 46 | (S)-4-(2-метил-1H-индол-5-илокси)-N-(3-(пирролидин-3-илокси)фенил)пиримидин-2-амин | (ДМСО-d6): 11,122 (с, 1H), 9,515 (с, 1H), 8,306 (д, J=5,6 Гц, 1H), 7,156-7,332 (м, 4H), 6,951 (т, J=8,0 Гц, 1H), 6,827 (дд, J=8,4 Гц, 2,0 Гц, 1H), 6,427 (дд, J=8,4 Гц, 2,0 Гц, 1H), 6,267 (д, J=6,0 Гц, 1H), 6,139 (с, 1H), 6,639 (м, 2H), 4,652-4,711 (м, 1H), 2,964-3,154 (м, 4H), 2,401 (с, 3H), 1,958-1,993 (м, 1H), 1,825-1,898 (м, 1H); MS (m/e): 402,4 (М+1) |
| 47 | N-метил-3-(4-(2-метил-1H-индол-5-илокси)пиримидин-2-иламино)Бензолсульфонамид | (CDCl3): 8,290 (д, 1H), 8,115 (с, 1H), 7,994 (с, 1H), 7,504 (д, J=8, 1H), 7,409 (м, 2H), 7,247 (д, J=8, 1H), 6,958 (м, J=10,8), 6,403 (д, J=5,6, 1H), 6,254 (с, 1H), 2,505 (с, 3H), 2,478 (д, J=5,6, 3H), MS (m/e): 410,1 (М+1) |
| 48 | N-(4-(4-(2-метил-1H-индол-5-илокси)пиримидин-2-иламино)фенил)метансульфонамид | (CD3OD): 11,204 (с, 1H), 9,120 (с, 1H), 8,837 (с, 1H), 7,959 (д, J=5,6 Гц, 1H), 7,791 (д, J=6,8 Гц, 2H), 7,144 (с, 1H), 7,026 (д, J=7,6 Гц, 2H), 6,922 (д, J=7,2 Гц, 1H), 6,210 (с, 1H), 6,115 (с, 1H), 4,007 (с, 3H), 2,405 (с, 3H); MS (m/e): 358,2 (М+1) |
| 49 | 2-(3-(4-(2-метил-1H-индол-5-илокси)пиримидин-2-иламино)фенил)-N-(2-морфолиноэтил)ацетамид | (CD3OD): 11,211 (с, 1H), 8,935 (с, 1H), 8,760 (с, 1H), 7,959 (т, J=8,8-5,6 Гц, 2H), 7,376 (с, 1H), 7,276 (д, J=7,6 Гц, 1H), 7,120 (т, J=8,8-4,4 Гц, 1H), 6,896 (т, J=8,0 Гц, 2H), 6,403 (т, J=2,0-1,6 Гц, 1H), 6,205 (с, 1H), 6,004 (с, 1H), 3,560 (с, 3H), 2,405 (с, 3H); MS (m/e): 364,2 (M+1) |
| 50 | 4-(2-метил-1H-индол-5-илокси)-N-(3-(2-(метилсульфонил)этокси)фенил)пиримидин-2-амин | (CD3OD): 8,345 (с, 1H), 8,049 (с, 1H), 7,915 (д, J=6,0 Гц, 1H), 7,826 (с, 1H), 7,58 (д, J=8,8 Гц, 1H), 7,535 (м, J=7,2-6,8 Гц, 1H), 7,433 (д, J=7,6 Гц, 2H), 7,103 (д, J=7,6 Гц, 1H), 6,241 (с, 1H), 2,460 (с, 3H); MS (m/e):402,2 (М+1) |
| 51 | N-метил(3-(4-(2-метил-1H-индол-5-илокси)пиримидин-2-иламино)фенил)метансульфонамид | 11,217 (с, 1H), 8,998 (с, 1H), 8,789 (с, 1H), 7,947 (д, J=5,6 Гц, 1H), 7,595 (м, J=7,8-1,6 Гц, 2H), 7,133 (д, J=8,0 Гц, 2H), 7,000, (с, 1H), 6,721 (д, J=2,8 Гц, 1H), 6,211 (с, 1H), 6,021 (с, 1H), 2,403 (с, 3H), 2,346 (с, 3H);MS (m/e): 380,2 (M+1) |
| 52 | N4-(4-фтор-2-метил-1H-индол-5-ил)-N2-(3-фторфенил)пиримидин-2,4-диамин | (CD3OD): 11,234 (с, 1H), 9,256 (с, 1H), 8,898 (с, 1H), 7,966 (д, J=5,6 Гц, 1H), 7,752 (д, J=8,4 Гц, 1H), 7,393 (т, J=8,4 Гц, 1H), 7,133 (м, J=8,4-3,6 Гц, 3H), 6,612 (т, J=7,6-1,2 Гц, 1H), 6,239 (с, 1H), 6,050 (с, 1H), 2,402 (с, 3H); MS (m/e): 352,2 (М+1) |
| 53 | N2-(3-хлорфенил)-N4-(4-фтор-2-метил-1H-индол-5-ил)пиримидин-2,4-диамин | (CD3OD): 11,221 (с, 1H), 8,965 (с, 1H), 8,775 (с, 1H), 7,927 (д, J=6,0 Гц, 1H), 7,619 (д, J=8,0 Гц, 2H), 7,128 (м, J=8,0-7,6 Гц, 2H), 6,958 (д, J=7,8 Гц, 2H), 6,210 (с, 1H), 2,411 (с, 3H); MS (m/e): 368,2 (m/e) (М+1) |
| 54 | 2-(4-(4-фтор-2-метил-1H-индол-5-иламино)пиримидин-2-иламино)бензонитрил | (CD3OD): 11,2 |