Новая парентеральная композиция карбамазепина
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к фармацевтической промышленности, и касается комплекса включения карбамазепина-циклодекстрина, который можно применять для парентерального введения карбамазепина. Комплекс включения карбамазепина-циклодекстрина получают смешиванием модифицированного циклодекстрина и карбамазепина в физиологически приемлемой жидкости. Модифицированные циклодекстрины включают 2-гидроксипропил-бета-циклодекстрин и сульфонилциклодекстрины. Физиологически приемлемая жидкость включает стерильную изотоническую воду, лактат Рингера, D5W (5% декстрозу в воде), физиологический солевой раствор и аналогичные жидкости, подходящие для парентерального введения. 3 н. и 21 з.п. ф-лы, 9 табл., 9 пр., 7 ил.
Реферат
Родственные заявки
Настоящая заявка испрашивает приоритет предварительной заявки на патент США 60/722692, поданной 30 сентября 2005 г.
Предпосылки изобретения
Карбамазепин, или 5Н-дибенз[b,f]азепин-5-карбоксамид, представляет собой широко используемое противоэпилептическое средство. Оно имеется в США в виде жевательных таблеток торгового наименования тагретол RTM по 100 мг, таблеток по 200 мг и суспензии 100 мг/5 мл, предназначенных для перорального введения в качестве средства для лечения эпилепсии или в виде специфического анальгетического средства для лечения невралгии тройничного нерва. Другие торговые наименования включают экветрол, карбатрол, тегретол XR и эпитол. Имеются также дженериковые варианты этих пероральных лекарственных форм. Лекарственные формы включают карбатрол, имеющийся в дозах 100, 200 и 300 мг, и тегретол XR, имеющийся в дозах 100, 200 и 400 мг.
Как показано в таблице 1, рекомендуемые уровни поддерживающей дозировки у взрослых и детей в возрасте старше 12 лет составляют 800-1200 мг/д, хотя у взрослых использовали до 2400 мг/д. У детей в возрасте от 6 до 12 лет уровень поддерживающей дозировки составляет обычно 20-30 мг/кг/д, а у детей в возрасте менее чем 6 лет уровень поддерживающей дозировки составляет обычно 10-20 мг/кг/д.
| Таблица 1 | ||
| Маркированная дозировка для пероральных лекарственных форм карбамазепина | ||
| Возраст | Рекомендуемая суточная поддерживающая доза | Частота введения (для композиций немедленного высвобождения) |
| <6 лет | 10-20 мг/кг | 2-4 дозы/д |
| 6-12 лет | 20-30 мг/кг максимальная доза 1000 мг | 2-4 дозы/д |
| Дети >12 лет | 400-1200 мг1600-2400 мг | 2-4 дозы/д |
| Взрослые с эпилепсией | 800-1200 мг некоторым пациентам требуется 1500-2400 мг | 3-4 дробные дозы |
| Взрослые с невралгией тройничного нерва | 400-800 мг максимальная доза 1200 мг | 2 дозы/д |
| Взрослые с биполярным расстройством | Дозы более чем 1600 мг не были изучены | 2 дозы/дпримечание: по поводу биполярного расстройства утвержден только экветрол, композиция продолжительного высвобождения |
По поводу сложных частичных судорог (височнодолевых, психомоторных) карбамазепин представляет собой широко используемый противосудорожный препарат. Его эффективность также доказана при лечении генерализованных тонических-клонических (больших) судорог. Карбамазепин также применялся при лечении простых частичных (очаговых или джексоновских) судорог и у пациентов со смешенными видами судорог, которые включают указанные выше или другие частичные или генерализованные судороги. Он не применяется при лечении малых эпилетических припадков (малых припадков).
В дополнение к его доказанной эффективности карбамазепин во многих отношениях имеет более благоприятный профиль с точки зрения частоты и тяжести побочных эффектов, чем другие противосудорожные препараты. Таким образом, карбамазепин оказывает меньший седативный эффект и вызывает меньшее нарушение интеллектуальной функции, чем другие противоэпилептические препараты, такие как фенобарбитал, примидон и фенитоин. Кроме того, карбамазепин не ускоряет развитие гипертрофии десен, гирсутизма, угревой сыпи или других нежелательных эффектов, связанных с фенитоином. Эти свойства помогли сделать карбамазепин препаратом выбора у женщин и детей.
Применение карбамазепина осложняется неполным, медленным и вариабельным всасыванием; обширным связыванием с белками и индукцией его собственного метаболизма (из документа Spina E. Chapter 21 in Antiepileptic Drugs 5th edition. Lippincott, Williams & Wilkins, Philadelphia, 2002 pp 236-246 и приведенные в документе ссылки). По ранее проведенным оценкам абсолютная биодоступность (процентная доля дозы, которая достигает кровотока) для таблеток немедленного высвобождения и продолжительного высвобождения находилась в интервале 75-85%, хотя отсутствие внутривенной композиции мешало систематическому исследованию степени и вариабельности всасывания между пациентами.
В патенте США № 5231089, выданном Bodor, упомянуто отсутствие инъецируемой композиции для карбамазепина с указанием, что не было точной информации, относящейся к абсолютной биодоступности препарата. Кроме того, отсутствие инъецируемой композиции для карбамазепина означает, что нет способа обеспечения неотложной терапии карбамазепином нуждающемуся в ней пациенту, как происходит, когда пациенты повергаются хирургическому вмешательству, имеют определенные желудочно-кишечные заболевания, находятся без сознания или имеют судороги, препятствующие пероральному введению препарата, или которые требуют быстрого восстановления стационарных уровней в плазме.
Отсутствие внутривенной композиции создает у пациентов, получающих лечение карбамазепином (иногда именуемого в настоящем документе CBZ) существенный медицинский риск. Внезапное прекращение лечения CBZ по любой причине может подвергнуть индивидуума потенциально угрожающим жизни судорожным неотложным состояниям. Единственной альтернативой является назначение пациенту другого препарата, который имеется в виде внутривенной композиции. Воздействие новых медикаментозных средств подвергает пациента побочным реакциям и неизвестной эффективности.
Циклодекстрины, иногда именуемые декстринами Schardinger, были выделены Villiers в 1891 г. в качестве продукта пищеварения Bacillus amylobacter на картофельном крахмале. Основы химии циклодекстринов были заложены Schardinger в период с 1903 по 1911 г. Однако до 1970 г. в лабораторных условиях можно было получить лишь небольшие количества циклодекстринов, и высокие производственные затраты мешали использованию циклодекстринов в промышленности. В последние годы были достигнуты резкие усовершенствования в производстве и очистке циклодекстринов, и циклодекстрины стали гораздо дешевле, делая посредством этого возможным промышленное применение циклодекстринов.
Циклодекстрины представляют собой циклические олигосахариды с гидроксильными группами на внешней поверхности и пустой полостью в центре. Их наружная поверхность является гидрофильной и поэтому они обычно растворимы в воде, но полость имеет липофильный характер. Самыми часто встречающимися циклодекстринами являются альфа-циклодекстрин, бета-циклодекстрин и гамма-циклодекстрин, состоящие соответственно из 6, 7 и 8 альфа-1,4-связанных глюкозных звеньев. Количество этих звеньев определяет размер полости.
Циклодекстрины способны образовывать комплексы включения с широким разнообразием гидрофобных молекул путем захвата всей молекулы («молекулы-гостя») или некоторой ее части в пустую полость. Стабильность полученного комплекса зависит от того, насколько хорошо молекула-гость пригнана к полости циклодекстрина. Обычные производные циклодекстринов образуются алкилированием (например, метил-и-этил-бета-циклодекстрин), или гидроксиалкилированием гидроксиэтил- производных альфа, бета- и гамма-циклодлекстрина, или замещением первичных гидроксильных групп сахаридами (например, глюкозил- и мальтозил-бета-циклодекстрин). Гидроксипропил-бета-циклодекстрин и его получение добавлением пропиленоксида к бета-циклодекстрину, и гидроксиэтил-бета-циклодекстрин и его получение добавлением этиленоксида к бета-циклодекстрину были описаны в патенте Gramera et al. (патент США № 3459731, выданный в августе 1969 г.) более 35 лет тому назад.
Хотя циклодекстрины использовались для увеличения растворимости, скорости растворения и/или устойчивости большого количества соединений, известно также, что имеется много препаратов, образованием комплексов с циклодекстринами или невозможно, или не дает преимуществ. См. J. Szejtli, Cyclodextrins in Drug Formulations: Part II, Pharmaceuticak Technology, 24-38, August, 1991. Несмотря на эту возможность фармацевтического использования определенные циклодекстрины имеют ограничения.
Циклодекстрины и их производные представляют собой большей частью кристаллические твердые вещества. За концентрацией некоторых циклодекстринов в почечной ткани следует образование кристаллов, вызывающее некротическое повреждение клеток. Несмотря на образование растворимых в воде комплексов клатрата применение кристаллических комплексов циклодекстрина с лекарственными препаратами было в целом ограничено их сублингвальным или местным введением.
Патенты США №№ 5134127 и 5376645, описания которых включено в настоящий документ посредством ссылки, направлены на новые производные циклодекстринов, в частности сульфоалкильные производные циклодекстринов. В частности, раскрытые в настоящем документе сульфоалкильные производные циклодекстринов проявляют более низкую нефротоксичность, в то же время проявляя высокую растворимость в воде.
Настоящее изобретение, наряду с другими аспектами, основано на определении того, что устойчивые комплексы включения карбамазепина с циклодекстринами имеют высокую растворимость в воде относительно не образовавшего комплексы препарата. К удивлению и неожиданно комплексы включения карбамазепина-циклодекстрина по изобретению приводят к получению инъецируемой композиции, обеспечивающей существенные выгоды и преимущества перед другими композициями карбамазепина. Например, комплексы включения карбамазепина-циклодекстрина по настоящему изобретению являются полностью биологически доступными, доставляя 100% дозы в кровоток согласованным и прогнозируемым образом, что не имеет место с твердыми пероральными лекарственными формами. Также, в отличие от твердых лекарственных форм, комплексы включения карбамазепина-циклодекстрина по настоящему изобретению можно вводить пациенту, страдающему генерализованными тоническими-клоническими или другими острыми судорогами через периферический, а не пероральный путь. Комплексы включения карбамазепина-циклодекстрина по настоящему изобретению удовлетворяют существенную неудовлетворенную медицинскую потребность в стабильной инъецируемой композиции карбамазепина, которая преодолевает ограничения плохо растворимых и вариабельно абсорбируемых пероральных композиций.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение предоставляет комплекс включения карбамазепина-циклодекстрина, который можно применять для парентерального введения карбамазепина, включающий карбамазепин, связанный в комплекс с модифицированным циклодекстрином. Предпочтительно, модифицированный циклодекстрин представляет собой сульфоалкил-циклодекстрин. Предпочтительный модифицированный циклодекстрин представляет собой сульфобутилэфир-7-бета-циклодекстрин. Комплекс включения предпочтительно имеет концентрацию от приблизительно 5 до приблизительно 50 мг/мл карбамазепина, а предпочтительнее концентрацию приблизительно 10 мг/мл карбамазепина.
В другом аспекте настоящего изобретения предоставляется комплекс включения карбамазепина-циклодекстрина, который можно использовать для парентерального введения карбамазепина, при котором дозировка составляет от приблизительно 30% до приблизительно 100% пероральных поддерживающих доз, или предпочтительно приблизительно от 65% до 75% пероральных поддерживающих доз.
В еще одном аспекте настоящее изобретение предоставляет комплекс включения карбамазепина-циклодекстрина, который можно использовать для парентерального введения карбамазепина, имеющего период полувыведения от приблизительно 8 до приблизительно 65 ч, а предпочтительнее имеющий период полувыведения приблизительно 24 ч. В другом варианте осуществления настоящее изобретение предлагает комплекс включения карбамазепина-циклодекстрина, который можно использовать для парентерального введения карбамазепина, имеющего площадь под кривой динамики во времени концентрации в плазме (AUC) от приблизительно 70% до приблизительно 130% AUC для пероральной лекарственной формы карбамазепина, а предпочтительнее имеющий AUC от приблизительно 80% до приблизительно 125% AUC для пероральной лекарственной формы карбамазепина. В еще одном варианте осуществления настоящее изобретение предлагает комплекс включения карбамазепина-циклодекстрина, который можно использовать для парентерального введения карбамазепина, имеющего минимальную концентрацию в плазме (Cmin) от приблизительно 70% до приблизительно 130% Cmin для пероральной лекарственной формы карбамазепина, а предпочтительнее имеющего Cmin от приблизительно 80% до приблизительно 125% Cmin для пероральной лекарственной формы карбамазепина.
В еще одном аспекте настоящее изобретение предоставляет комплекс включения карбамазепина-циклодекстрина, который можно использовать для парентерального введения карбамазепина, имеющего интервал внутривенного введения 1 раз/4-12 ч, предпочтительнее имеющий интервал внутривенного введения 1 раз/6 ч, а еще предпочтительнее имеющий интервал внутривенного введения 1 раз/8 ч.
В другом варианте осуществления настоящее изобретение предоставляет способ введения комплекса включения карбамазепина-циклодекстрина, который можно использовать для парентерального введения карбамазепина, включающий:
1) предоставление комплекса включения карбамазепина-циклодекстрина; и
2) внутривенное вливание комплекса нуждающемуся в нем пациенту через каждые 4-12 ч.
Предпочтительно, период вливания длится в течение от приблизительно 5 до приблизительно 60 мин, предпочтительнее в течение 30 мин, и еще предпочтительнее в течение 5 мин. Предпочтительно, вливание производится 1 раз/6 ч или в другом аспекте 1 раз/8 ч.
В еще одном варианте осуществления настоящее изобретение предоставляет способ получения комплекса включения карбамазепина-циклодекстрина смешиванием модифицированного циклодекстрина и карбамазепина в физиологически приемлемой жидкости для образования комплекса включения карбамазепина-циклодекстрина. В другом аспекте способ, кроме того, включает стадию стерилизации комплекса включения карбамазепина-циклодекстрина. Предпочтительно, физиологически приемлемая жидкость является изотоничной. Предпочтительно, модифицированный циклодекстрин представляет собой сульфоалкил-циклодекстрин. Модифицированный циклодекстрин предпочтительнее представляет собой сульфобутилэфир-7-бета-циклодекстрин.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
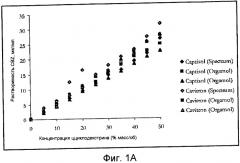
На фиг.1 показана фазовая растворимость карбамазепина как функция концентрации циклодекстрина при окружающей температуре в лаборатории. Фиг.1А представляет составленные данные растворимости. Фиг.1В представляет усредненные данные растворимости.
На фиг.2 показано наложение данных DCS/TGA (дифференциальной сканирующей калориметрии/термогравиметрического анализа) препарата карбамазепина Оргамол партии #899954.
На фиг.3 показано наложение данных DCS/TGA препарата карбамазепина Спектрум партии #SA0491.
На фиг.4 показаны наблюдаемые и прогнозируемые профили изменения со временем концентрации в плазме после внутривенного введения 100 мг карбамазепина с использованием 3-компартментной фармакокинетической модели.
На фиг.5 показаны имитированные профили изменения со временем концентрации в плазме карбамазепина после различной длительности вливания. Средняя внутривенная доза=150 мг, с допущением средней корригированной внутривенной дозы F=0,7. Параметры модели представляют собой типичные величины параметров по трехкомпартментной модели.
На фиг.6 показано воздействие длительности вливания на Cmax,ss после внутривенного введения карбамазепина.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение направлено на комплекс включения карбамазепина-циклодекстрина, который можно применять для парентерального введения карбамазепина.
Используемый в настоящем документе термин «парентеральное» представлен в его обычном и привычном значении в области путей введения фармацевтических препаратов. В соответствии с руководством по стандартным данным оценки и исследования лекарственных препаратов Администрации пищевых продуктов и лекарственных средств (Данные CDER, Номер элемента C-DRG-00301; Название элемента данных: Путь введения) «парентеральный» относится к введению путем инъекции, вливания или имплантации. Инъекция и вливания включают введение в вену (внутривенное), в артерию (внутриартериальное), в мышцу (внутримышечное) и в брюшину (внутрибрюшинное). Предусмотрено также внутрилегочное (введение внутрь легких или в бронхи) и интраназальное (введение в носовую полость или через нос). Любой соответствующий путь введения, указанный в приведенном выше документе Администрации пищевых продуктов и лекарственных средств, специально включен в объем настоящего изобретения, и ничто в настоящем описании не должно рассматриваться как ограничивающее те пути введения, которые можно было бы использовать для комплекса включения карбамазепина-циклодекстрина по настоящему изобретению.
В одном варианте осуществления комплекс включения карбамазепина-циклодекстрина получают смешиванием модифицированного циклодекстрина и карбамазепина в физиологически приемлемой жидкости. Модифицированный циклодекстрин включает 2-гидроксипропил-бета-циклодекстрин и сульфоалкилциклодекстрины. Конкретнее, сульфоалкилциклодекстрины представляют собой те, которые описаны и раскрыты в патентах США №№ 5134127 и 5376645. Физиологически приемлемая жидкость включает стерильную изотоническую воду, лактат Рингера, D5W (5% декстроза в воде), физиологический солевой раствор и аналогичные жидкости, подходящие для парентерального введения.
После получения смеси модифицированного циклодекстрина и карбамазепина смесь можно стерилизовать. Стерилизацию можно проводить способами, хорошо известными средним специалистам в данной области, такими как автоклавированием или стерильной фильтрацией, таким как пропускание через фильтр с размером пор 0,22 мкм. После стерилизации комплекс включения карбамазепина-циклодекстрина можно непосредственно упаковывать в стерильные ампулы, контейнеры для жидкостей, подходящих для внутривенного введения, или комплекс можно лиофилизировать для длительного хранения в соответствии с методиками, хорошо известными в данной области.
Комплекс включения карбамазепина-циклодекстрина можно получить так, чтобы концентрация карбамазепина находилась в диапазоне от 1 мг/мл до 50 мг/мл, предпочтительнее от 1 мг/мл до 10 мг/мл, и наиболее предпочтительно приблизительно 10 мг/мл. Изменения концентрации карбамазепина в комплексе включения карбамазепина-циклодекстрина по настоящему изобретению обычно осуществляется изменением количества карбамазепина, используемого при получении комплекса включения, как описано в других разделах настоящего документа.
Комплекс включения карбамазепина-циклодекстрина можно вводить парентерально одной дозой до 1600 мг или предпочтительно до 500 мг, предпочтительнее дробными дозами от 20 до 500 мг, а наиболее предпочтительно дробными дозами от 75 до 400 мг. Дозировка зависит от показания, по которому получает лечение пациент, а также от взаимодействий с другими препаратами, которые может принимать пациент, и другими клиническими соображениями, хорошо известными лечащему врачу.
Комплекс включения карбамазепина-циклодекстрина по настоящему изобретению имеет биодоступность 100% и период полувыведения приблизительно 24 ч. Итоговые концентрации в плазме после внутривенного введения обоснованно прогнозируемы, причем каждая доза 1 мг/кг вызывает увеличение концентрации CBZ на 0,75±0,2 мг/л. Учитывая среднюю пероральную биодоступность 65-75%. Первоначальная внутривенная заместительная доза составит 65-75% поддерживающей дозы пациента, хотя некоторый подбор последующих внутривенных доз может быть необходим в зависимости от действительной пероральной биодоступности CBZ пациента. Эта схема дозировки выбрана для обеспечения того, чтобы действительные концентрации CBZ оставались в пределах терапевтического диапазона, в то же время минимизируя риск побочных явлений, связанных с повышенными концентрациями CBZ в конце вливания.
Комплекс включения карбамазепина-циклодекстрина по настоящему изобретению предпочтительно имеет определенные фармакокинетические параметры, статистически аналогичные параметрам пероральных лекарственных форм CBZ. Например, комплекс включения карбамазепина-циклодекстрина предпочтительно имеет минимальную концентрацию в плазме (Cmin) приблизительно от 70% до приблизительно 130% Cmin пероральной лекарственной формы CBZ, а предпочтительнее приблизительно от 80% до приблизительно 125% Cmin пероральной лекарственной формы CBZ. Аналогичным образом, комплекс включения карбамазепина-циклодекстрина имеет площадь под кривой динамики во времени концентрации в плазме (AUC) приблизительно от 70% до приблизительно 130% AUC пероральной лекарственной формы CBZ, а предпочтительнее приблизительно от 80% до приблизительно 125% AUC пероральной лекарственной формы CBZ. Работники средней квалификации в области фармацевтических композиций хорошо знакомы с этими принципами, которые дополнительно объясняются в Руководстве Администрации пищевых продуктов и лекарственных средств для промышленности, озаглавленном «Статистические подходы к установлению биоэквивалентности» от января 2001 г., см. www.fda.gov/cder/guidance/3616fnl.htm0.
Общую суточную внутривенную (в/в) дозу можно вводить в виде четырех равных доз 1 раз/6 ч, вливаемых в течение периода до 60 мин или предпочтительно в течение 30 мин, или предпочтительнее в течение 15 мин. Как хорошо известно в данной области, длительность вливания и интервалы введения можно подбирать в зависимости от клинических соображений в пределах квалификации лечащего врача. Например, в ситуации, когда желательно быстрое возвращение к стационарным уровням CBZ, длительность вливания может составлять лишь 2-5 мин посредством в/в одномоментного или в/в болюсного введения нуждающемуся в нем пациенту. В других вариантах осуществления общую суточную в/в дозу можно вводить в виде трех равных доз 1 раз/8 ч, вливаемых в течение периода до 60 мин или предпочтительно в течение 30 мин или предпочтительнее в течение 15 мин. В еще одном варианте осуществления введение может быть непрерывным или может осуществляться с использованием регулируемого пациентом устройства, которое обеспечивает возможность контролируемого дозирования на требуемой основе. Другие схемы дозирования хорошо известны в данной области, и их могут легко определить фармацевты и врачи, имеющие опыт работы в данной области, например, с учетом возраста пациента, показания, дробной дозы и общей суточной дозировки.
В других вариантах осуществления комплексы включения карбамазепина-циклодекстрина по настоящему изобретению можно вводить ректальным, пероральным или интраназальным путями тем пациентам, которые или не переносят парентеральное введение, или которые настолько молоды, что парентеральное введение невозможно. Кроме того, те пациенты, которые могут получить композицию по настоящему изобретению посредством энтерального пути, получат выгоды по существу полной биодоступности относительно имеющихся в настоящее время твердых пероральных лекарственных форм. Энтеральное введение не требует изменения композиции по настоящему изобретению, поскольку комплексы включения карбамазепина-циклодекстрина можно доставлять непосредственно энтерально. Маскирующие вкус композиции, хорошо известные в данной области, можно применять для модификации композиций, предназначенных для перорального введения, для устранения любого неприятного вкуса. Однако маскировка вкуса связана скорее с выполнением пациентом назначенного лечения, чем связана с эффективностью настоящего изобретения для энтерального введения.
Комплексы включения карбамазепина-циклодекстрина по настоящему изобретению можно вводить млекопитающему, нуждающемуся в лечении CBZ. Слово «млекопитающее» приведено в его общем и обычном значении в данной области и включает людей. Соответственно, комплексы включения карбамазепина-циклодекстрина по настоящему изобретению можно применять в ветеринарии, а также при лечении патологических состояний у людей. В отношении лечения людей комплексы включения карбамазепина-циклодекстрина по настоящему изобретению особенно хорошо подходят для введения детям, потому что данная композиция не требует перорального пути введения.
Комплексы включения карбамазепина-циклодекстрина по настоящему изобретению можно применять по любому показанию, по которому применяется CBZ. Например, применение CBZ показано по поводу судорожных расстройств, таких как частичные судороги со сложными симптомами (психомоторные, височнодолевая эпилепсия), генерализованные тонические-клонические (большие) судороги, смешанные судорожные типы других частичных или генерализованных судорог. CBZ также показан по поводу невралгии тройничного нерва (болезненный тик), например, для лечения боли, связанной с истинной невралгии тройничного нерва и биполярных расстройств. CBZ также оказывает благоприятный эффект при языкоглоточной невралгии. Другие виды применения включают лечение нейрогенного несахарного диабета; определенных психиатрических расстройств, включающих шизоаффективное заболевание, депрессию, ажитацию, поведенческие расстройства, связанные с деменцией, устойчивой шизофренией и синдромом нарушения контроля с нарушением функции лимбической системы; алкогольной абстиненции; фибромиалгии; нейропатии; эпилептического статуса и стойких судорожных расстройств.
Хотя комплексы включения карбамазепина-циклодекстрина по настоящему изобретению обеспечивают сниженную токсичность и 100% биодоступность, по сравнению с другими парентеральными композициями карбамазепина, такими как композиция PEG-400. Кроме того, комплексы по настоящему изобретению менее нефротоксичны, в то же время обеспечивая аналогичную растворимость и скорость растворения комплексов карбамазепина-циклодекстрина.
Дополнительные детали предпочтительных вариантов осуществления настоящего изобретения иллюстрируются в следующих примерах, которые не следует рассматривать как ограничивающие.
ПРИМЕРЫ
Пример 1 - Получение комплекса включения карбамазепина-циклодекстрина
450 г гидроксипропил-бета-циклодекстрина (HPBCD) растворяли в 2,0 л деионизированной воды для получения 22,5% мас./об. раствора. К этому раствору добавляли 20 г карбамазепина (CBZ), меченого 13С, 15N [закупленного у компании Cambridge Isotope Laboratories (CIL), 50 Frontage Road, Andover, Massachusetts 01810]. Полученную смесь перемешивали в течение 24 ч при комнатной температуре (20-25ºС). Через 24 ч раствор подвергали стерилизующей фильтрации через стерилизационный фильтр Durapore с размером пор 0,22 мкм в стерильный приемник. Ранее стерилизованные ампулы затем заполняли и запаивали при продувке азотом. Заполненные ампулы хранили при 2-8ºС. Полученный комплекс включения имел концентрацию CBZ приблизительно 10 мг/мл.
Пример 2 - Испытание стабильности
Ампулы, содержащие 10,1 мг/мл комплекса включения карбамазепина-циклодекстрина, брали для исследований стабильности при комнатной температуре, и образцы брали 1 раз/6 мес. CBZ выявляли ВЭЖХ с использованием УФ выявления при 215 нм. Результаты представлены в таблице 2.
| Таблица 2 | |||
| Стабильность внутривенного раствора стабильно меченого карбамазепина | |||
| Дата испытания | Исходная концентрация во флакончике | % извлечения | Продукт разложения CBZ: иминостилбин |
| 31.05.05 | 10,1 мг/мл | 104,65% | Не выявлен |
| 10.11.04 | 10,1 мг/мл | 97,07% | Не выявлен |
| 02.05.04 | 10,1 мг/мл | 96,67% | Не выявлен |
Пример 3 - Фармакокинетика внутривенно и перорально введенного карбамазепина у пациентов, получающих поддерживающее лечение
Постоянные катетеры помещали в вены предплечья испытуемых индивидуумов. Затем в течение 10 мин вливали одну дозу 100 мг стабильно меченого (не радиоактивного) CBZ (SL-CBZ). В конце вливания вводили обычную утреннюю дозу перорального CBZ индивидуума, менее 100 мг. Артериальное давление, частоту сердечных сокращений и дискомфорт в участке вливания контролировали во время и в течение 1 ч после вливания. Один образец крови брали перед вливанием и 12 образцов брали в течение последующих 96 ч. Плазму отделяли от крови и анализировали, используя анализ LC-MS (жидкостной хроматографией - масс спектрометрией) для выявления CBZ и CBZ-эпоксида, активного метаболита, и глюкуронидированного метаболита, который является неактивным. Несвязанный CBZ измеряли после ультрафильтрации. Данные концентрации карбамазепина в динамике во времени анализировали, используя некомпартментный подход фармакокинетическим программным обеспечением, WinNONLIN.
Использовали утвержденный LC-MS для выявления SL-CBZ, CBZ и их соответствующих эпоксидных метаболитов. Карбамазепин-d10 (CBZ-d10, изотопы C/D/N, Quebec, Canada) использовали в качестве внутреннего стандарта. CBZ анализировали аналогично тому, как описано Osterloh и Bertilsson (Osterloh J, Bertilsson L. The absence of isotopic effect during the elimination of deuterium labeled carbamazepine in the rat. Life Sci. 1978;23:83-7). Для получения стандарта для CBZ-глюкуронида его выделяли из мочи пациентов, получавших монотерапию CBZ, с использованием процедуры, аналогичной ранее опубликованной процедуре Sinz MW, Remmel RP. Analysis of lamotrigine and lamotrigine 2-N-glucuronide in guinea pig blood and urine by reserved-phase ion-pairing liguid chromatography. J Chromatogr. 1991;571:217-30. 0,5 мл аликвотного количества плазмы пациента и 10 мкл внутреннего стандарта добавляли к контрольной пробе плазмы и экстрагировали 3 объемами этилацетата. После встряхивания и центрифугирования органический слой удаляли и выпаривали в атмосфере газообразного азота до сухости. Затем каждый образец повторно растворяли добавлением 25 мкл этилацетата. В образцах плазмы измеряли содержание несвязанного и общего CBZ, CBZ-глюкуронида и CBZ-Е LCMS. Несвязанный препарат отделяли от связанной фракции ультрафильтрацией. Подвижная фаза состоит из 50% 0,05 М аммонийацетатного буфера, рН 4,7, 50% МеОН при скорости потока 0,4 мл/мин, на обращенно-фазной колонке С-18. Для мониторинга выбранного иона (SIM) сигналы при m/z 237 (CBZ), 239 (13C15N2-CBZ), 253 (CBZ-эпоксид), 255 (13C15N2-CBZ-эпоксид) и 247 (CBZ-d10) измеряли с использованием основанного на персональном компьютере программного обеспечения Hewlett-Packard Chem-Station®. Нижний предел выявления CBZ составляет 0,05 мкг/мл. Способ LC-MS был утвержден для определения [13C15N]-карбамазепина, карбамазепина и их 10,11-эпоксидных метаболитов в плазме человека. По интервалу концентрации от 1,5 до 12 мкг/мл процентный коэффициент дисперсии составил ≤5%.
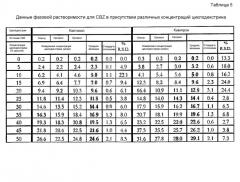
В таблице 3 представлены фармакокинетические параметры по 76 индивидуумам. Для индивидуумов в настоящем исследовании диапазон пероральной суточной дозы CBZ находился в интервале от 100 мг до 2400 мг. Как видно, абсолютная биодоступность перорального CBZ во время поддерживающей терапии сосредотачивается вокруг 70-75%, причем у 30 из 56 индивидуумов биодоступность составляет ниже 70%. Вариабельность биодоступности также является существенной в интервале от 0,35 до 1,65. Очень вариабельная биодоступность может быть показателем отсроченного высвобождения препарата из различных пероральных композиций CBZ немедленного и длительного высвобождения или в результате продолжительного всасывания из лекарственной формы длительного высвобождения в последующий интервал дозирования. Объем распределения в стационарном состоянии (VSS) составляет 1,24±0,439 л/кг. Это ранее неизвестная величина (ввиду отсутствия в/в композиции), которая теперь дает возможность точного дозирования в/в композиции для получения целевых концентраций CBZ в плазме, как может потребоваться при начале лечения у пациентов, у которых пероральная терапия была прервана на 12 или более часов.
Другим клинически важным наблюдением является удлиненный период полувыведения CBZ в условиях стационарного состояния. Определенная величина составила 25,8 ч (интервал от 8,79 до 64,6 ч), в отличие от указанного диапазона от 12 до 17 ч во вкладыше упаковки для Tagretol® и Carbatrol®. Наиболее вероятным объяснением этого различия является использование в/в раствора SL-CBZ в настоящем исследовании, что обеспечило возможность точной характеристики выведения в течение 2-3 периодов полувыведения, в то время как индивидуумы продолжали принимать назначенные и пероральные дозы CBZ. Продленные периоды полувыведения, наблюдавшиеся у взрослых лиц, ограничат колебания концентраций CBZ после в/в введения 1 раз/6 ч, дополнительно снижая риск субтерапевтических концентраций CBZ.
| Таблица 3 | |||||||||
| Резюме фармакокинетики карбамазепина | |||||||||
| Возраст (лет) | Масса тела (кг) | F | Т1/2 (ч) | AUCss (перорально) (мкг·ч/мл) | AUC 0-∞ (мкг·ч/мл) | VSS (л/кг) | CL (л/ч/кг) | CLSS- (л/ч/кг) | |
| N | 76 | 76 | 70 | 76 | 70 | 76 | 76 | 76 | 70 |
| Средняя величина | 46,9 | 81,7 | 0,742 | 25,8 | 89,5 | 38,2 | 1,24 | 0,040 | 0,045 |
| (стандартное отклонение) | (15,7) | (17,7) | (0,29) | (11,2) | (29,3) | (15,3) | (0,439) | (0,015) | (0,024) |
| Минимальная величина | 19,0 | 48,0 | 0,348 | 8,79 | 28,5 | 14,9 | 0,612 | 0,013 | 0,0087 |
| Медиана | 45,0 | 82,0 | 0,670 | 24,6 | 87,2 | 36,5 | 1,13 | 0,036 | 0,041 |
| Максимальная величина | 87,0 | 151 | 1,65 | 64,6 | 168 | 94,5 | 3,17 | 0,089 | 0,122 |
| Примечание: Величины F, AUCss (перорально) и CLSS/F включали только 70 лиц ввиду 6 индивидуумов, получавших только утреннюю в/в дозу CBZ. Интервал пероральной суточной дозы CBZ находился в диапазоне от 100 до 2400 мг. |
В настоящем исследовании использовали композицию 2-гидроксипропил-β-циклоксидекстрина для солюбилизирующего препарат агента SL-CBZ. Фармакокинетические данные, полученные в настоящем исследовании, хотя специально и не предназначенные для определения полной заместительной схемы в/в дозирования, могут помочь в установлении целевой дозы для настоящего исследования. Результаты настоящего исследования демонстрируют широкий диапазон величин биодоступности CBZ среди индивидуумов, у некоторых из которых рассчитанные величины биодоступности были более чем 100%. В результате, при введении доз индивидуумам в последующем исследовании была выбрана величина биодоступности 70%. Эта величина аналогична медиане величины F (67%), определенной у индивидуумов, которым CBZ вводили в/в в настоящем исследовании (n=76). Использование медианной величины биодоступности для коррекции дозы для в/в ведения CBZ в настоящем исследовании оправдывается допущением, что действительная биодоступность у индивидуумов не должна быть больше чем 100%, особенно на уровнях стационарного дозирования. Величина 70% находится между рассчитанной средней величиной F 75% и действительной медианной величиной рангового порядка 67% и обеспечивает возможность соответствующего, рассчитываемого подбора в/в дозы. Типичный индивидуум должен затем получить суточную в/в дозу. Которая составляет 70% суточной пероральной дозы этого индивидуума. Это может дать концентрации CBZ в плазме от в/в дозы, которые сравнимы с концентрациями, которые у большинства индивидуумов могут быть получены в результаты перорального введения. Таким образом, результаты настоящего исследования предоставляют исходные данные по безопасности и переносимости комбинации карбамазепина-циклодекстрина у индивидуумов, наряду с предоставлением данных, которые можно использовать для расчета соответствующей дозы и интервала введения для заместительной в/в терапии.
Пример 4 - Получение стандартного раствора CBZ
Оборудование
Устройства ВЭЖХ Shimadzu с автоматическим пробоотборником, насосами, дегазаторами, УФ детектором, колонковой печью, регуляторами устройств и системным программным обеспечением Shimadzu Class VP;
Микровесы Cahn;
Аналитические весы Shimadzu AY-120l;
Измеритель рНб Orion pH/ISE Модель #420 A;
Вихревая мешалка Labnet VX100;
Центрифуга Eppendorf 5415 D;
Устройство для ультразвуковой обработки Fisher Scientific FS30;
Вибратор LabQuake.
| Материалы | ||
| Материал | Изготовитель | № лота |
| Карбамазепин | Spectrum | SAO491 |
| Карбамазепин | Orgamol | 899954 |
| Кавилтрон 82004 | Cargill | H3M134P |
| Каптизол | Cydex | CY03A020535 |
| Ацетонитрил | Fisher | 031168 |
| Очищенная вода |
Получение стандартного раствора CBZ (0,05 мг/мл)
Отвесить 5 мг CBZ