Бактериальный экстракт против респираторных расстройств и способ его получения
Иллюстрации
Показать всеИзобретение относится к области медицины и фармации и представляет собой иммуностимулирующий экстракт из одного или более бактериальных видов, выбранных из Moraxella catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes и Streptococcus sanguinis, где во время приготовления указанного экстракта один или более бактериальных штаммов лизируют при рН более чем 12 и экстракт обрабатывают с тем, чтобы удалить нуклеиновые кислоты; и где экстракт не вызывает появления прионного заболевания при введении пациенту, где экстракт содержит менее чем 100 мкг/мл нуклеиновой кислоты, где экстракт содержит химически модифицированный сахарид, включая химически модифицированный липополисахарид, и где по меньшей мере одна аминокислота, которую выбирают из аспарагиновой кислоты, глутаминовой кислоты, серина, гистидина, аланина, аргинина, тирозина, метионина, фенилаланина и лизина, является рацемизированной, по меньшей мере, на 10%. Изобретение не вызывает риска или исключает риск прионного заболевания при введении пациенту, то есть обеспечивает максимальную безопасность и эффективность, 7 н. и 41 з.п. ф-лы, 12 пр., 10 ил.
Реферат
Описание изобретения
Настоящая заявка заявляет приоритет временной заявки на патент США № 60/904789, зарегистрированной 5 марта 2007 года.
Область техники, к которой относится изобретение
Настоящее изобретение относится к экстрактам из бактериальных штаммов, пригодным для использования в качестве лечения для таких показаний, как респираторные расстройства, к композициям, содержащим экстракты, и к способам получения экстрактов с использованием сред, которые не вызывают риска появления прионного заболевания.
Уровень техники и сущность изобретения
Настоящее изобретение относится к композициям, содержащим бактериальные экстракты, пригодные для использования при лечении медицинских состояний, таких как респираторные расстройства. Экстракты могут содержать бактериальные лизаты культур, выбранных из следующих видов:
Moraxella (Branhamella) catarrhalis, Moraxella (Moraxella) catarrhalis, Haemophilus influenzae, Klebsiella pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcus sanguinis, Staphylococcus Hemolyticus, Enterococcus faecalis, Streptococcus mutans, Streptococcus anginosus, Streptococcus mitis, Streptococcus salivarius (aka. Streptococcus viridans), Neisseria sicca, Hemophilus parainfluenzae, Actinobacillus (Hemophilus) actinomycetemcomitans и Eikenella corrodens.
В некоторых вариантах осуществления экстракты содержат, по меньшей мере, один штамм из каждого из упоминаемого выше видов бактерий, в то время как в других вариантах осуществления один или более конкретных штаммов из тех, которые перечислены выше, могут удаляться или замещаться одним или более различными штаммами. Некоторые варианты осуществления настоящего изобретения содержат экстракт, полученный из каждого из следующих бактериальных штаммов: Moraxella (Branhamella) catarrhalis 3622, Moraxella (Branhamella) catarrhalis 3625, Moraxella (Branhamella) catarrhalis I-045, Haemophilus influenzae 8467, Klebsiella pneumoniae ssp., ozaenae 5050, Klebsiella pneumoniae 204, Klebsiella pneumoniae 5056, Staphylococcus aureus I-049, Staphylococcus aureus I-050, Staphylococcus aureus I-051, Staphylococcus aureus I-052, Staphylococcus aureus I-053, Staphylococcus aureus I-054, Streptococcus (Diplococcus) pneumoniae 7465, Streptococcus (Diplococcus) pneumoniae 7466, Streptococcus (Diplococcus) pneumoniae 7978, Streptococcus (Diplococcus) pneumoniae 10319, Streptococcus pyogenes 8191, Streptococcus sanguinis I-046, Streptococcus sanguinis I-047, Streptococcus sanguinis I-048, Staphylococcus Hemolyticus 11042, Enterococcus faecalis 103015, Streptococcus mutans 10449, Streptococcus anginosus 10713, Streptococcus mitis 12261, Streptococcus salivarius 102503, Neisseria sicca 103345, Haemophilus parainfluenzae 7857, Actinobacillus (Hemophilus) actinomycetemcomitans 52.105, и Eikenella corrodens 10596. Эти штаммы хранятся в соответствии с Будапештским договором. Штаммы, показанные в списке с номером, содержащим I, индексируются Collection Nationale de Culture des Microorganismes Institute Pasteur, 25 rue du Dr. Roux, 75724 Paris, France. Все другие штаммы индексируются National Collection of Type Cultures in London.
В некоторых вариантах осуществления один или более конкретных штаммов, перечисленных выше, могут отсутствовать или замещаться другим штаммом такого же вида или другого вида бактерий. Например, в некоторых вариантах осуществления один или более штаммов из Staphylococcus Hemolyticus 11042, Enterococcus faecalis 103015, Streptococcus mutans 10449, Streptococcus anginosus 10713, Streptococcus mitis 12261, Streptococcus salivarius 102503, Neisseria sicca 103345, Haemophilus parainfluenzae 7857, Actinobacillus (Hemophilus) actinomycetemcomitans 52.105 и Eikenella corrodens 10596, или даже все они, могут отсутствовать. В других вариантах осуществления могут отсутствовать один или более штаммов из Moraxella, Klebsiella, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes или Streptococcus sanguinis. Кроме того, для облегчения гидролизации может также использоваться штамм Lactobacillus или другие штаммы бактерий.
Экстракты могут быть получены способом щелочного лизирования после того, как клетки выращивают до соответствующей оптической плотности в культурной среде. В некоторых вариантах осуществления каждую из бактерий выращивают в среде, которая не вызывает риска появления заболевания, родственного прионному, или риска других заболеваний, которые могут передаваться через проглатывание продуктов, полученных из среды на животной основе. Например, в некоторых вариантах осуществления для выращивания клеток используется среда на растительной основе, такая как среда на основе сои. В других вариантах осуществления для роста клеток может использоваться синтетическая среда. Еще в других вариантах осуществления среда может содержать биологические экстракты, такие как экстракт дрожжей и лошадиная сыворотка, которые также не дают рисков появления таких заболеваний.
Лизаты могут также фильтроваться для удаления нуклеиновых кислот и клеточных остатков больших размеров. Вследствие фильтрации в некоторых вариантах осуществления, количество нуклеиновой кислоты, присутствующей в экстрактах, менее чем 100 мкг/мл. В некоторых вариантах осуществления несолюбилизированные соединения, такие как остатки оболочек клеток, и недостаточно деградированные липополисахариды (LPS) также удаляют фильтрацией. Следовательно, в некоторых вариантах осуществления полученный экстракт содержит растворимые молекулярные компоненты и не содержит значительных количеств нерастворимого материала или материала в виде частиц.
Сахаридные компоненты могут консервироваться в экстрактах, включая липополисахаридные (LPS) компоненты. В течение процесса лизирования сахариды могут химически модифицироваться, например расщепляться на более мелкие структуры или замещаться другими функциональными группами.
Рацемизация аминокислот в течение процесса лизирования также создает D-аминокислоты из существующих в природе L-аминокислот, находящихся в природных белках. D-аминокислоты могут быть полезны при увеличении биологической доступности экстрактов, поскольку белки, состоящие в основном или частично из D-аминокислот, не перевариваются эффективно в кишечнике у млекопитающих. Таким образом, антигенные молекулы в экстрактах, которые химически модифицируются во время лизирования, чтобы они содержали D-аминокислоты, остаются в организме пациента в течение продолжительного времени, делая потенциально возможным более сильное иммуностимулирующее действие.
Хотя бактериальные экстракты используются в литературе для стимулирования иммунной системы против заболеваний дыхательной системы, имеется необходимость в лучшей стандартизации и контроле этих экстрактов, чтобы сделать их более безопасными, более эффективными и более долгодействующими. Например, ранее считалось, что сахаридные компоненты, включая потенциально токсичные липополисахаридные (LPS) компоненты, должны удаляться из бактериальных экстрактов по причинам безопасности. (См., например, патент США № 5424287). Однако настоящее изобретение предусматривает способ, который приводит в результате к химической модификации компонентов LPS, достаточной для того, чтобы сахариды безопасно удерживались. Удерживание этих компонентов может улучшить эффективность, а также обеспечить дополнительные антигены для экстрактов.
Например, авторы обнаружили, что подбор pH и времени лизирования делает возможным достаточное разложение потенциально аллергенных или токсичных компонентов клеточных оболочек. Известные ранее условия лизирования при более низких pH или более коротком времени, в противоположность этому, дают экстракты, в которых компоненты клеточных оболочек и LPS недостаточно модифицируются химически. (См., например, патент GB 2021415 A). Полученные экстракты являются слишком аллергенными, чтобы безопасно вводиться пациентам. В целом, авторы обнаружили, что продукты, лизируемые при слишком низких pH и/или при слишком коротком времени, имеют более высокую токсичность, более низкую экстракцию белка и более низкую фильтруемость.
Способ фильтрации может также влиять на свойства полученного экстракта в некоторых случаях, поскольку размер пор фильтра и, иногда, химические свойства поверхности фильтра, могут изменять типы материалов, которые удаляются и удерживаются. Например, некоторые варианты осуществления настоящего изобретения используют способ фильтрации, который удерживает определенные сахариды, но удаляет другие молекулярные компоненты, такие как нуклеиновые кислоты.
Таким образом, настоящее изобретение предусматривает параметры, которые стандартизуют бактериальные экстракты, чтобы помочь в поддержании соответствующей безопасности и эффективности.
Краткое описание чертежей
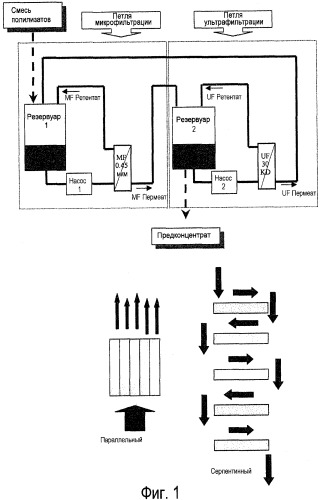
Фиг.1. Блок-схема системы проточной фильтрации вдоль потока (TFF) для получения бактериальных экстрактов после лизирования бактерий. Блок-схема показывает две различные конфигурации для фильтров: параллельный режим, где все фильтры работают одновременно, и серпентинный режим, где фильтры конфигурируются в последовательном режиме.
Фиг.2. Продуцирование IL-6 и TNF-α PBMC человека, инкубируемыми с последовательными разбавлениями очищенной смеси экстрактов из примеров 2.2, 3.6, 3.7, 3.8, 3.9 и 3.10.
Фиг.3. Выживание мышей, провоцируемых вирусом H1N1, в течение 3 недель после инфицирования. Тест Мак-Немара: *p=0,023 для исследования при лечении 10 мг по сравнению с контролем.
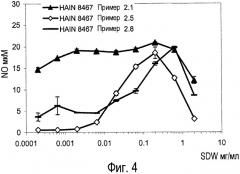
Фиг.4. Влияние концентрации NaOH, количества биомассы (выраженной в граммах сухой массы на миллилитр) и продолжительности лизирования (в часах) на биологическую активность очищенных экстрактов HAIN 8467 (примеры 2.1, 2.5, 2.8) при биологическом анализе макрофагов грызунов с помощью оксида азота.
Фиг.5. Биологический анализ макрофагов грызунов с помощью оксида азота для очищенной смеси экстрактов Diplococcus pneumonia (пример 3.6).
Фиг.6. Биологическая активность экстрактов примера 3.1 и примера 3.3 (отмеченных как 3a и 3c, соответственно) в биологическом анализе макрофагов грызунов с помощью оксида азота.
Фиг.7. Биологическая активность очищенной смеси экстрактов из примеров 2.2, 3.6, 3.7, 3.8, 3.9 и 3.10 биологическом анализе макрофагов грызунов с помощью оксида азота.
Фиг.8. Влияние экстракта в соответствии с настоящим изобретением на секрецию гистамина из мастоцитов крысы, стимулируемых соединением 48/80.
Фиг.9. Средние общие значения для колониеобразующих единиц (CFU) в тканях (a) мочевого пузыря и (b) почки для различных экспериментальных групп.
Фиг.10. Влияние одного из вариантов осуществления настоящего изобретения на модели инфекции Escherichia coli для штамма мышей, невосприимчивых к LPS. Фигура показывает данные от проточной цитометрии (a) с маркерами CD14 в зависимости от FoxP3 и (b) TCR в зависимости от FoxP3, левые панели показывают необработанные ткани, в то время как правые панели показывают обработанные ткани.
Подробное описание изобретения
Определения
Экстракт. Экстракт, как здесь определено, обозначает материал, полученный после лизирования одного или более бактериальных штаммов. В некоторых случаях экстракт получают только из одного штамма, в то время как в других случаях экстракт представляет собой смесь экстрактов из нескольких различных штаммов.
Щелочное лизирование. Это способ лизирования бактериальных клеток при основных условиях.
Лизат. Как здесь используется, этот термин означает экстракт бактерий, полученный от процедуры лизирования клеток.
Фильтрация. Способ фильтрации, как здесь описано, обозначает прохождение экстракта или смеси экстрактов через один или более фильтров, таких как микрофильтры (то есть микрофильтрацию) или ультрафильтры (то есть ультрафильтрацию). Такая фильтрация может не удалять обязательно 100% компонентов, предназначенных для удаления. В некоторых случаях фильтрацию повторяют за несколько проходов или циклов.
Начальный pH. Этот термин обозначает pH, измеренный при начале процедуры, такой как бактериальное лизирование или фильтрация.
Сахариды. Сахарид, как здесь определено, включает моносахариды, дисахариды, а также сахариды больших размеров, такие как линейные и разветвленные полисахариды. Сахариды также включают замещенные или химически модифицированные сахариды, такие как липополисахариды (LPS), и их химически модифицированные варианты.
D-аминокислоты. Этот термин относится к аминокислотам, которые существуют в правовращательной изомерной форме, в противоположность биосинтетически полученным L-аминокислотам, которые существуют в левовращательной изомерной форме.
Рацемизация. Это термин показывает, по меньшей мере, частичную химическую модификацию L-аминокислот до D-аминокислот.
Среда, которая исключает риск появления заболеваний на прионной основе, обозначает культурную среду, используемую на любой стадии получения экстрактов, которая не содержит материалов, таких как сыворотка или мясные экстракты, взятых от животных, таких как коровы или овцы, или от любого другого животного, которые могут передавать заболевания на прионной основе. Примеры таких сред включают среды на растительной основе или синтетические химически определенные среды, а также среды с использованием лошадиной сыворотки или среды, содержащие материалы, взятые от видов животных, которые не передают прионные заболевания. Примеры заболеваний на прионной основе включают, например, заболевание коровьего бешенства, почесуху и заболевание Крейцфельда-Якоба.
Неживотная среда представляет собой среду, которая не содержит компонентов, полученных от животных. Примеры включают среды на растительной основе (то есть растительные среды), такие как соевая среда, и синтетические среды.
Лечение, как здесь используется, обозначает как лечение текущих инфекций, так, например, и других состояний, а также предотвращение или защиту, например, от развития новых инфекций.
Субъект, как здесь используется, обозначает любой животный субъект, включая субъектов млекопитающих, таких как люди и домашние млекопитающие.
Понятно, что конкретные бактериальные штаммы, идентифицируемые здесь и используемые в настоящем изобретении, могут включать штамм, полученный от исходного депозита, упоминаемого здесь, или его генетического клона, включая штаммы, которые повторно депонированы в более позднее время с различными кодовыми наименованиями депонентов, но которые считаются генетически таким же штаммом как исходная депонированная версия.
Все числа, используемые здесь, являются приблизительными, принимая во внимание ошибки, неизбежные при их измерениях, округление и значимые цифры.
Получение экстрактов
Бактериальные экстракты по настоящему изобретению могут быть получены посредством ферментации с последующим тепловым дезактивированием и щелочным лизированием и фильтрацией. Для каждого штамма, для получения достаточного количества материала, ферментирование культуры может начинаться от рабочей маточной серии с последующей инокуляцией в контейнерах для ферментирования больших размеров.
Используемые среды могут быть одинаковыми для каждого вида. Однако для усиления роста некоторых видов могут вводиться вспомогательные факторы роста. В некоторых вариантах осуществления среду, которая исключает риск появления заболевания на прионной основе, можно использовать для выращивания, по меньшей мере, некоторых или для всех штаммов. Примеры включают неживотные среды, такие как среды на растительной основе и синтетические среды. Другие примеры включают среду, которая включает лошадиную сыворотку или другой животный экстракт, который отбирают у видов животных, которые не вызывают опасности появления прионного заболевания, в противоположность штаммам, выращенным в присутствии бычьей сыворотки или мясных экстрактов, которые могут давать такие риски. В некоторых вариантах осуществления к среде может добавляться дипептид Ala-Gin. Авторы наблюдают, что в некоторых вариантах осуществления дипептид Ala-Gin служит как стимулятор роста для бактериальной культуры.
После ферментации биомасса от каждого штамма или от множества штаммов может дезактивироваться с помощью тепловой обработки, концентрирования и замораживания. Клеточный материал может лизироваться с помощью ионов гидроксида, таких как от NaOH. В некоторых вариантах осуществления может лизироваться концентрация биомассы от 2 до 130 г/л бактериальной сухой массы, такая как от 20 до 120 г/л, или от 5 до 90 г/л, или от 10 до 50 г/л, или от 40 до 90 г/л. (Концентрация биомассы приводится здесь как бактериальная сухая масса на литр лизирования. Концентрацию биомассы измеряют посредством сушки 5 мл материала в малой фарфоровой чашке при 105°C до тех пор, пока он не достигнет постоянной массы, а затем регистрируют массу в граммах на литр). Например, штаммы Haemophilus могут лизироваться при концентрации биомассы 15-90 г/л, такой как от 40 до 90 г/л, например, 40, 50, 60, 70, 80 или 90 г/л или в более узких диапазонах, ограниченных этими концентрациями (то есть 40-50, 70-90, и т.п.). Штаммы Streptococcus, например, могут лизироваться при 10-90 г/л, например, при 10, 20, 30, 40, 50, 60, 70, 80 или 90 г/л, или в более узких диапазонах, ограниченных этими концентрациями. Штаммы Moraxella могут лизироваться, например, при 5-60 г/л, или при 10-60 г/л, или при 15-40 г/л, например, при 5, 10, 20, 30, 40, 50 или 60 г/л, или в более узких диапазонах, ограниченных этими концентрациями. Штаммы Klebsiella могут лизироваться, например, при 10-50 г/л, например, 25-50 г/л, или 10, 20, 30, 40 или 50 г/л, или в более узких диапазонах, ограниченных этими концентрациями. Штаммы Staphylococcus могут лизироваться, например, при 30-90 г/л, например, 30, 40, 50, 60, 70, 80 или 90 г/л, или в более узких диапазонах, ограниченных этими концентрациями. Штаммы Neisseria могут лизироваться, например, при 5-60 г/л, например, при 5, 10, 20, 30, 40, 50 или 60 г/л, или в более узких диапазонах, ограниченных этими концентрациями.
В некоторых вариантах осуществления для лизирования может использоваться концентрация гидроксида от 0,01 н. до 1,2 н., например, от 0,1 до 1 н., или от 0,05 н. до 0,4 н., например, 0,05, 0,1, 0,15, 0,2, 0,25, 0,3, 0,35 или 0,4 н., или в более узких диапазонах, ограниченных этими концентрациями, или от 0,5 н. до 1,0 н., например, 0,5, 0,6, 0,7, 0,8, 0,9 или 1,0 н., или в более узких диапазонах, ограниченных этими концентрациями. Концентрация основания может использоваться с тем, чтобы получить начальный pH 12 или выше, pH более чем 12, pH более чем 12,5, или, например, pH от pH 12,0 до pH 13,4 или от pH 12,6 до 13,4. Например, для штаммов Streptococcus, концентрация гидроксида может составлять 0,1-0,7 н. или 0,2-0,5 н., например, 0,2, 0,3, 0,4 или 0,5 н., или в более узких диапазонах, ограниченных этими концентрациями. Для штаммов Moraxella или Haemophilus, она может составлять 0,05-0,7 н. или 0,15-0,5 н., например, 0,15, 0,2, 0,25, 0,3, 0,35, 0,4, 0,45 или 0,5 н., или в более узких диапазонах, ограниченных этими концентрациями. Для штаммов Klebsiella или Staphylococcus, она может составлять 0,1-0,7 н. или 0,15-0,4 н., например, 0,15, 0,2, 0,25, 0,3, 0,35, или 0,4 н., или в более узких диапазонах, ограниченных этими концентрациями.
Температура лизирования может составлять от 30 до 60°C, например, от 30-40°C, или от 35-40°C, например, 37°C. Время лизирования может изменяться от 20 часов или от 40 часов до нескольких дней, например, составлять 2, 3, 4, 5, 6, 7, 8, 9 или 10, или даже 15 дней. Например, для штаммов Haemophilius, Streptococcus, Moraxella и Staphylococcus может использоваться время 5-9 дней, а для штаммов Klebsiella и Neisseria, время 7-10 дней. В некоторых вариантах осуществления могут использоваться температуры лизирования 30-40°C или 35-40°C, например, 37°C, для каждого из штаммов, и лизирование может осуществляться в течение периода от 72 до 210 часов (3-9 дней), например, 3 дней, 4, 5, 6, 7, 8 и 9 дней или находиться в пределах часов или дней, ограниченных этими временами (например, 3-4 дня, 8-9 дней и т.п.). Понятно, что эти диапазоны времени включают любую долю от количества дней, часов или минут в них.
В некоторых вариантах осуществления, когда используют более одного штамма из одного и того же бактериального рода, штаммы могут лизироваться вместе или по отдельности. Штаммы могут смешиваться до или после лизирования.
Экстракты могут очищаться с помощью центрифугирования и/или фильтрации. Например, лизаты могут центрифугироваться при 9000×g, затем один или более циклов фильтрации на 0,2-микронном фильтре могут использоваться для очистки экстракта. В некоторых случаях могут использоваться последовательные заходы фильтрации на фильтрах с большими размерами пор с последующей фильтрацией на 0,2-микронном фильтре. Способы ультрафильтрации также могут использоваться, чтобы помочь в экстрагировании растворимых материалов из экстракта, например, рециркулируя пермеат от ультрафильтрации для дополнительной микрофильтрации.
В некоторых вариантах осуществления способ проточной фильтрации вдоль потока (TFF) может использоваться для фильтрования экстрактов и для экстрагирования солюбилизированных молекул из клеточных остатков больших размеров. (См. фиг.1). (См., например, Separations Technology, Pharmaceutical and Biotechnology Applications, Wayne P. Olson, Editor. Interpharm Press, Inc., Buffalo Grove, IL, USA, p.126 to 135 - ISBN:0-935184-72-4). В начале такого способа TFF разбавленный бактериальный лизат может храниться в первом резервуаре. Начинается работа петли микрофильтрации (MF), и продукт прокачивают, и полученный ретентат от MF рециклируют, в то время как пермеат от MF переносят во второй резервуар.
После достижения соответствующего уровня концентрации начинается работа петли ультрафильтрации (UF). Пермеат от UF можно рециркулировать обратно в первый резервуар для непрерывной экстракции солюбилизированного соединения из лизата, в то время как ретентат от UF может храниться во втором резервуаре. В течение непрерывной экстракции объемы в резервуарах 1 и 2 могут устанавливаться с помощью регулирования скоростей потока пермеатов от микрофильтрации и ультрафильтрации.
Несколько таких циклов экстракции могут осуществляться с помощью либо TFF, либо других способов фильтрации. В вариантах осуществления, которые используют TFF, в конце последнего цикла, петля ультрафильтрации может выключаться и петля микрофильтрации может работать одна, и пермеат от MF переносится в резервуар 2.
Петля микрофильтрации может соединяться с фильтрами с размерами пор от 1,2 микрон до 0,1 микрон, такими как фильтры с размерами пор от 0,65 до 0,2 микрон или 0,45 микрон. Поперечный поток может составлять от 1000 литров/часов·м2 (LHM) до 3000 LHM, например, 1500-2500 LHM, или 2000 LHM, при перепаде давления на мембране (TMP) от 0,6 до 2 бар, например, 0,8-1,5 бар, или 1,0 бар. Петля ультрафильтрации может соединяться с фильтрами с размерами пор, соответствующими от 10 КДа до 1000 КДа, например, от 10 КДа до 100 КДа или от 10 КДа до 30 КДа, или от 30 КДа до 100 КДа. Поперечный поток может составлять в пределах между 30 LHM и 1000 LHM, например, 20-500 LHM с TMP от 0,2 до 1,5 бар, например, 0,4-1,2 бар, или 0,5 бар.
5-20 объемов диафильтрации можно использовать для экстрагирования солюбилизированных соединений из бактериальных клеточных оболочек. В некоторых вариантах осуществления используется 8-15 объемов. Следовательно, например, в некоторых вариантах осуществления может использоваться 5-15 циклов фильтрации, в некоторых случаях 8-15 циклов, например, 8, 9, 10, 11, 12, 13, 14 или 15 циклов.
После фильтрации экстракты могут дополнительно концентрироваться или центрифугироваться, если это желательно. Например, может осуществляться дополнительная микрофильтрация с использованием фильтра с более мелкими порами, такого как 0,2-микронный фильтр. После фильтрации выход солюбилизированных белков, измеренный согласно Lowry, может составлять более чем 50% или может составлять более чем 60%, или может составлять от 50 до 90%, или может составлять, например, 60-90%. После фильтрации экстракт может лиофилизироваться перед приготовлением его для использования.
В некоторых вариантах осуществления настоящего изобретения может выбираться группа условий лизирования, применяемых для одного или нескольких бактериальных штаммов. От 40 до 90 г/л, или 40, 50, 60, 70, 80 или 90 г/л Haemophilus influenzae NCTC 8467 может лизироваться в течение 72-200 часов, например, 72, 96, 120, 150 или 200 часов. От 10 до 95 г/л одного или нескольких штаммов Streptococcus, например, 10, 20, 40, 60, 80, 90 или 95 г/л может лизироваться для 72-210 часов, например, 72, 96, 120, 150 или 200 часов. От 15 до 80 г/л одного или нескольких штаммов Diplococcus, например, 15, 20, 30, 40, 50, 60, 70 или 80 г/л, может лизироваться в течение 72-210 часов, например, 72, 96, 120, 150 или 200 часов. От 10 до 50 г/л одного или нескольких штаммов Klebsiella, например, 10, 15, 20, 25, 30, 35, 40, 45 или 50 г/л, может лизироваться в течение 72-210 часов, такие как 72, 96, 120, 150 или 200 часов. От 5 до 60 г/л одного или нескольких штаммов Neisseria, например, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55 или 60 г/л, может лизироваться в течение 72-210 часов, например, 72, 96, 120, 150 или 200 часов. От 30 до 90 г/л одного или нескольких штаммов Staphilococcus, например, 30, 40, 50, 60, 70, 80, или 90 г/л может лизироваться в течение 72-210 часов, например, 72, 96, 120, 150, 200 часов. В каждом из этих вариантов осуществления лизирование может осуществляться при 35-40°C, например, при 37°C. Кроме того, могут использоваться условия либо "умеренного", либо "сильного" лизирования для каждого штамма, образующего экстракт, или для группы сходных штаммов. Как здесь используется, условия "умеренного" лизирования относятся к концентрации ионов гидроксида от 0,05 до 0,4 н., например, 0,1, 0,2, 0,3 или 0,4 н. вместе с параметрами биомассы, времени и температуры, приведенными чуть выше для каждого типа штамма (например, 35-40°C, 40-90 г/л биомассы и 72-200 часов для Haemophilus influenzae NCTC 8467). Как здесь используется, условия "сильного" лизирования относятся к концентрации ионов гидроксида от 0,5 до 1 н., например, 0,5, 0,6, 0,7, 0,8, 0,9 и 1 н., вместе с параметрами времени, температуры и биомассы для каждого штамма, приведенными чуть выше. В некоторых вариантах осуществления как сильное, так и умеренное лизирование могут осуществляться с получением продуктов, совместно смешанных.
В некоторых вариантах осуществления настоящего изобретения экстракт может быть получен из нескольких бактериальных штаммов, например, по меньшей мере, из одного грам-отрицательного и, по меньшей мере, из одного грам-положительного штамма. Бактериальные штаммы от одинаковых или различных видов могут смешиваться до или после лизирования. В некоторых вариантах осуществления штаммы могут смешиваться, например, для получения 1-40 об.% каждого из них в смеси или 15-30 об.% от каждого рода бактерий. В некоторых вариантах осуществления экстракт может содержать продукты лизирования, например, от 2, 3, 4, 5 или 10 различных генераций бактерий. Например, смесь из 5 генераций может содержать штаммы Haemophilus, Moraxella, Klebsiella, Staphylococcus, Streptococcus, включая Streptococcus sanguinis, pyogenes и pneumoniae. Некоторые штаммы Streptococcus pneumoniae также известны, например, как штаммы Diplococcus. В некоторых таких вариантах осуществления из 5 родов смесь может содержать от 5 до 15 об.% Haemophilus, например, 7-10%, или 7, 8 или 9%; от 5 до 15 об.% Diplococcus, например, 7-10% или 7, 8 или 9%; от 5 до 20 об.% Streptococcus, например, 7-15%, или 8, 9, 10, 11 или 12%; от 10 до 30 об.% Klebsiella, например, 15-25%, или 16, 17, 18, 19, 20, 21, 22, 23 или 24%; от 10 до 30 об.% Staphylococcus, например, 15-25%, или 16, 17, 18, 19, 20, 21, 22, 23 или 24%; и от 20 до 40 об.% Neisseria, например, 25-35%, или 26, 27, 28, 29, 30, 31, 32, 33 или 34%.
Химические свойства бактериальных экстрактов
Некоторые варианты осуществления в соответствии с настоящим изобретением могут содержать, например, 5-75 мг/мл белков, или 10-65 мг/мл, или 20-45 мг/мл, или 5-40 мг/мл, или 5-20 мг/мл, или 5-10 мг/мл, или 6-8 мг/мл белков, или находиться в диапазоне с крайними точками от 5, 6, 8, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70 или 75 мг/мл; 1,5 до 2,5 мг/мл свободных аминокислот (A.A.), или 1,5 до 2 мг/мл, или 2 до 2,5 мг/мл свободных A.A., или находиться в диапазоне с крайними точками от 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4 или 2,5 мг/мл свободных A.A., вычисленных по глутаминовой кислоте (147,1 г/моль); и от 0,3 до 4,5 мг/мл полисахаридов и моносахаридов, или от 0,3 до 4 мг/мл, или от 0,4 до 4 мг/мл, или от 0,5 до 3,5 мг/мл, или от 0,6 до 3 мг/мл или от 0,3 до 1 мг/мл, или находиться в диапазоне с крайними точками от 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0 или 4,5 мг/мл полисахаридов и моносахаридов, так, например, как от 0,4 до 0,5 мг/мл. Например, некоторые варианты осуществления содержат примерно от 6 до 8 мг/мл белков, от 1,5 до 2,5 мг/мл свободных аминокислот (A.A.), вычисленных по глутаминовой кислоте (147,1 г/моль) и/или примерно от 0,4 до 0,5 мг/мл полисахаридов и моносахаридов. Концентрацию белка измеряют с помощью анализа согласно Lowry в соответствии со способом 2 из European Pharmacopoeia 2.5.33. Концентрацию сахара анализируют после кислотного гидролиза и дериватизации в соответствии с D. Herbert et al., Meth. Microbiol. 5B: 266 et seq. (1971). Концентрацию глутамата (глутаминовой кислоты) измеряют посредством преобразования аминокислот в изоиндольные производные и измерения коэффициента поглощения на 340 нм, в соответствии с Roth M., Fluorescence reaction for amino acids, Anal.Chem., 43, 880-882, (1971).
В некоторых вариантах осуществления концентрация эквивалентов LPS, на основе хромогенного исследования с использованием лизата амебоцитов Limulus (LAL), менее чем 1000 нг/мл или менее чем 500 нг/мл, менее чем 200 нг/мл или менее чем 100 нг/мл.
Лизирование бактерий в соответствии с настоящим изобретением может приводить в частичному гидролизу белков, а также к деаминированию, деамидированию и частичной рацемизации аминокислот из L в D. В одном из аналитических исследований экстракта в соответствии с настоящим изобретением наблюдают пики, представляющие, каждый, D-аспарагиновую кислоту, D-глутаминовую кислоту, D-серин, D-метионин, D-гистидин, D-аланин, D-аргинин, D-фенилаланин, D-тирозин, D-лейцин и D-лизин. Процент D-аминокислот этих видов в этом исследовании находится в пределах от 3% до 40%. Следовательно, некоторые варианты осуществления настоящего изобретения делают возможной рацемизацию одного или нескольких соединений из серина, треонина, гистидина, аланина, аргинина, тирозина, фенилаланина, лейцина и лизина, также как и всех упоминаемых выше аминокислот, или любого выбора из более чем одной, но менее чем всех из указанных выше аминокислот, таких, например, как аланин, фенилаланин и лизин. В некоторых вариантах осуществления по меньшей мере, 10% одной или более из указанных выше аминокислот может рацемизироваться из D в L. В других вариантах осуществления может рацемизироваться, по меньшей мере, 40% одной или более из указанных выше аминокислот.
Лизирование бактерий в соответствии с настоящим изобретением может приводить к уменьшению молекулярной массы компонентов молекул от 0 до 300 кДа и от 0 до 100 кДа, или от 0 до 60 кДа, вызванному гидролизом.
Биологические активности бактериальных экстрактов
Экстракты в соответствии с настоящим изобретением могут быть эффективными при лечении пациентов, страдающих от развития медицинских состояний или имеющих риск их появления, таких как респираторные расстройства и аллергические реакции или состояния. Экстракты в соответствии с настоящим изобретением могут быть эффективными при лечении, например, инфекции верхних и нижних дыхательных путей, атопического дерматита, назофарингита, синусита, фарингита, тонзиллита, ларингита, трахеита, ларингофарингита, гриппа, пневмонии, бронхопневмонии, бронхита, инфекций нижних дыхательных путей, аллергического ринита, аллергической астмы, ринита, назофарингита, фарингита, синусита, тонзиллита, ларингита, ларинготрахеита, бронхита, обструктивного легочного заболевания с острой инфекцией нижних дыхательных путей и обструктивного легочного заболевания с тяжелым обострением.
Биологическая активность экстрактов может определяться с помощью нескольких анализов. Например, анализ с помощью мононуклеарных клеток периферической крови (PBMC) исследует продуцирование цитокинов IL-6 из PBMC и может осуществлять скрининг способности экстракта к стимулированию иммунной системы. Например, в некоторых вариантах осуществления измеренная концентрация IL-6 in vitro в супернатантах PBMC, стимулируемых экстрактами по настоящему изобретению, находится в пределах от 2000 пг/мл до 70000 пг/мл, от 2000 пг/мл до 50000 пг/мл, от 2000 пг/мл до 30000 пг/мл, от 2000 пг/мл до 20000 пг/мл, от 2000 пг/мл до 10000 пг/мл, или от 5000 пг/мл до 70000 пг/мл, от 5000 пг/мл до 50000 пг/мл, от 5000 пг/мл до 30000 пг/мл, от 5000 пг/мл до 25000 пг/мл, или от 5000 пг/мл до 10000 пг/мл или от 15000 пг/мл до 25000 пг/мл. Когда LPS используют как контрольный агонист (при 0,01 мкг/мл), полученные значения находится в пределах, в зависимости от донора, от 5000 мкг/мл до 70000 мкг/мл.
Исследование оксида азота у грызунов (NO) измеряет продуцирование NO макрофагами грызунов, которое также указывает на иммунное стимулирование. Например, макрофаги продуцируют NO, чтобы убивать вторгающиеся бактерии. В некоторых вариантах осуществления активность in vitro закиси азота (NO) для вариантов осуществления настоящего изобретения исследуемая при концентрации в пределах от 0,001 мг/мл до 10 мг/мл растворимой сухой массы, обеспечивает максимальную реакцию в пределах от 3 мкМ до 100 мкМ оксида азота или от 3 мкМ до 90 мкМ, от 3 мкМ до 80 мкМ, от 3 мкМ до 70 мкМ, от 3 мкМ до 60 мкМ, от 3 мкМ до 50 мкМ, от 3 мкМ до 40 мкМ, от 3 мкМ до 30 мкМ, от 3 мкМ до 20 мкМ, от 3 мкМ до 10 мкМ, или от 5 мкМ до 80 мкМ, от 5 мкМ до 60 мкМ, от 5 мкМ до 40 мкМ, от 5 мкМ до 20 мкМ или от 10 мкМ до 80 мкМ, от 10 мкМ до 70 мкМ, от 10 мкМ до 50 мкМ, от 10 до 30 мкМ или от 10 мкМ до 15 мкМ, или она находится в диапазоне с крайними точками от 3, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 100 мкМ.
Активности, наблюдаемые in vitro на мононуклеарных клетках периферической крови человека и макрофагах грызунов, могут зависеть от таких параметров, как количество сухой массы бактериальной биомассы для лизирования, то есть от "исходного материала" для лизирования, от продолжительности щелочного лизирования и от начального процента NaOH или начального pH, используемого при лизировании.
Сочетание исследований активности in vitro, таких как с помощью PBMC и NO, с определением концентраций LPS, таким как с помощью LAL, также может обеспечить получение информации относительно баланса активности и риска появления токсичности для данного бактериального экстракта.
Экстракты по настоящему изобретению могут также быть активными против аэрозольных инфекций вируса гриппа, таких как инфекция A/PR/8/34 (H1N1). В одном из исследований, например, экстракт в соответствии с настоящим изобретением способен придавать полную иммунную защиту мышам при дозе 10 мг/мышь, если судить по смертности, титрованию вируса в легких, по клиническим симптомах и по титрам антител. В противоположность этому, только 70% контрольных животных пережили инфекцию.
В качестве другого примера, частота выживания за 13 дней после провоцирования, по меньшей мере, 8 мышей, имеющих восприимчивость к LPS дикого типа, Salmonella thyphimurium, составляет, по меньшей мере, 60%, когда этих мышей впервые лечат в течение 10 дней эффективными количествами некоторых вариантов осуществления настоящего изобретения. Доза Salmonella thyphimurium для провоцирования может выбираться так, что нелеченые мыши или мыши, которых лечат водой или пустым контрольным препаратом, содержащим наполнители, но не экстракт, имеют частоту выживания 60% или меньше, например, 50% или меньше. В некоторых случаях частота выживания для мышей, которых лечат экстрактом, составляет, по меньшей мере, 70%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, или, по меньшей мере, 95%.
Кроме того, варианты осуществления настоящего изобретения могут также ингибировать секрецию гистамина мастоцитами, стимулируемыми соединением 48/80, статистически значимого уровня, как показано подробно ниже. Например, варианты осуществления настоящего изобретения могут показывать значение IC-50 при анализе с помощью мастоцитов, стимулируемых соединением 48/80, например, в пределах между 0,0005 и 0,01 мг/мл, например, между 0,0005 и 0,005 мг/мл или между 0,001 и 0,01 мг/мл, или между 0,002 и 0,008 мг/мл, или между 0,004 и, например, 0,006 мг/мл.
Композиции, содержащие бактериальные экстракты
Смесь лиофилизированных экстрактов может приготавливаться множеством различных способов для возможного введения. Например, могут быть получены пероральные таблетки, капсулы, пилюли, а также жидкие препараты или аэрозоли. Препараты для вливания или инъекции также могут быть получены. Варианты осуществления настоящего изобретения могут приготавливаться, например, как твердые дозированные формы или жидкие дозированные формы. Примеры твердых дозированных форм могут включать, например, таблетки, например, таблетки с покрытием, жевательные таблетки, шипучие таблетки, сублингвальные таблетки, гранулы, порошки или капсулы), содержащие экстракт и, необязательно, одну или несколько пищевых и/или диетических добавок. Твердые дозированные формы могут также содержать разбавители, наполнители и/или другие эксципиенты. Могут добавляться другие компоненты наполнителей, такие как консерванты, красители, ароматизирующие вещества и подсластители. Является также возможным приготовление порошков или препаратов в форме гранул. Жидкие дозированные формы, такие как растворы, сиропы, суспензии или капли, также могут использоваться для перорального способа введения.
Рабочие примеры