Способ подготовки шихты для получения керамического биодеградируемого материала
Иллюстрации
Показать всеИзобретение относится к области медицинского материаловедения и может быть использовано при создании материалов для травматологии и ортопедии, челюстно-лицевой хирургии и хирургической стоматологии, а также в качестве носителей для лекарственных средств. Предложенный способ включает синтез октакальциевого фосфата из малорастворимого фосфата кальция в ацетатном буферном водном растворе CH3COOH/CH3COONa при температуре в интервале 55-65°С и рН 5,5-5,8, отделение осадка, промывание осадка, сушку осадка и термообработку. В качестве малорастворимого соединения используют брушит с влажностью 5-55%, соотношение «брушит/буферный раствор» по массе лежит в интервале 1/80-1/100. Продолжительность синтеза составляет 30-60 минут. Термообработку порошка проводят в интервале 400-700°С в течение 1-2 часов, используя внесение порошка в печь, предварительно разогретую до температуры термообработки. Брушит предварительно синтезируют, а срок хранения брушита после синтеза составляет 0,1-24 часа. Технический результат изобретения - получение шихты на основе фосфатов кальция с показателем однородности фазового распределения в интервале 20-40 нм для получения керамического биодеградируемого материала, состоящего из пирофосфата кальция и трикальцийфосфата, с показателем однородности фазового распределения в интервале 50-100 нм. 1 з.п. ф-лы, 1 табл., 1 пр.
Реферат
Изобретение относится к области медицинского материаловедения, может быть применено при создании материалов для использования в травматологии и ортопедии, челюстно-лицевой хирургии и хирургической стоматологии, а также для использования в качестве носителей лекарственных средств.
Пирофосфат кальция Ca2P2O7 (ПФК) и трикальцийфосфат Са3(PO4)2 (ТКФ) являются биодеградируемыми материалами наряду с другими фосфатами кальция, в которых мольное соотношение Са/Р менее 1,67. Период времени деградации ТКФ при испытаниях in vivo составляет около 6 месяцев, а период времени деградации ПФК составляет около 3 месяцев. Сроки биодеградацииа (а - биодеградация материла - явление, при котором под действием среды живого организма происходит деградация материала, т.е. уменьшение массы, изменение структуры, изменение химического состава, растворение) - биорезорбированияb (b - биорезорбирование материала - явление, при котором компоненты материала после деградации под действием среды организма (межклеточной жидкости, специальных клеток) используются организмом как источник энергии или для формирования новых тканей) материала in vivo в каждом рассматриваемом случае зависят от индивидуальных особенностей обмена веществ отдельного пациента. Поэтому заданное (или регулируемое) сочетание резорбируемых фаз в материале имплантата будет служить основой для учета индивидуальных особенностей пациента.
Основным принципом при создании биоматериалов для костных имплантатов первого поколения было соблюдение идентичности химического и фазового состава таких материалов костной ткани или ее неорганической составляющей [1]. В качестве основы для создания биоматериалов для костных имплантатов рассматривали гидроксиапатит Са10(PO4)6(ОН)2 (ГАП), поскольку неорганическая составляющая костной ткани представлена в основном карбонат гидроксиапатитом (КГАП). Однако КГАП не единственный фосфат кальция, присутствующий в организме. Биодеградируемые фосфаты кальция, такие как кальцийдефицитный гидроксиапатит (Са-ДГАП) и гидратированный ПФК, используемые для создания костных имплантатов, были обнаружены в суставах или мягких тканях пациентов с артритом или артрозом при нарушении обмена веществ [2]. Образование данных фосфатов обусловлено присутствием ионов кальция, ортофосфат-ионов и пирофосфат-ионов, участвующих в обмене веществ организма. При правильном обмене веществ данные ионы не образуют малорастворимых соединений, являющихся признаком заболеваний.
Развитие регенеративного подхода лечения заболеваний костной ткани указывает на целесообразность использования биодеградируемых (биорезорбируемых) фосфатов кальция при разработке материалов для костных имплантатов.
Традиционной стадией при получении керамических композиционных материалов является подготовка исходной однородной порошковой смеси - шихты, пасты или суспензии в зависимости от предпочтительного способа формования: прессования, пластического формования или литья соответственно [3]. Исходная однородная порошковая шихта представляет собой смесь прекурсоров целевых фаз. После формования, обеспечивающего придание заготовке желаемой формы, изделие обжигают, используя требуемый температурный режим, характеризующийся скоростью нагрева, температурой обжига, временем выдержки при конечной температуре, используемой атмосферой обжига.
Прекурсорами для фазы ТКФ в керамическом композиционном материале являются порошки Са-ДГАП или аморфный фосфат кальция (АФК-1,5), которые, как и ТКФ, имеют мольное соотношение Са/Р=1,5 [4]. Однако контроль дефицита по кальцию в Са-ДГАП осложнен и определяется как соотношением Са/Р используемых растворимых солей кальция или фосфатов, так и замещением на группы СО3 2-, которое трудно контролируется, так как идет по двум позициям, способствуя формированию карбонатгидроксиапатита, имеющего дефицит по кальцию (Са-ДГАП) двух типов А или Б, а чаще смешанного А-Б типа. Получение АФК-1,5 возможно при снижении температуры синтеза ниже 20°С, уменьшении времени остаривания и использовании рН ниже 7. Основным недостатком АФК-1,5 является то, что он образуется в виде гелеобразной трудно фильтруемой массы, которая затем требует длительной сушки. Благодаря проявляющимся вяжущим свойствам после сушки АФК-1,5 образует продукт, который даже после дезагрегации не становится высокодисперсным. Твердофазный синтез ТКФ может быть осуществлен из различных двухкомпонентных смесей. Каждый компонент такой смеси имеет соотношение Са/Р, отличающееся от такового в ТКФ в большую и меньшую сторону. Химический состав и массовое соотношение компонентов в смеси выбирают таким образом, чтобы обеспечить соотношение Са/Р=1,5, соответствующее ТКФ. Примерами таких двухкомпонентных смесей являются смеси, состоящие из СаО и (NH4)2HPO4, СаСО3 и H3PO4, Са(ОН)2 и CaHPO4, Са10(PO4)6(ОН)2 и Ca2P2O7 [5]. Твердофазный синтез способствует формированию грубозернистых порошков и не может быть применен для подготовки активных к спеканию порошков, необходимых для получения керамики.
Прекурсором фазы ПФК может быть измельченная стеклянная фритта в системе СаО-P2O5 [6, 7]. Однако в процессе варки фосфатного стекла, как правило, происходит неконтролируемое улетучивание P2O5, которое приводит к изменению соотношения Са/Р. Ортофосфаты кальция с соотношением Са/Р=1, т.е. брушит CaHPO4·2H2O или монетит CaHРO4 также могут быть рассмотрены в качестве прекурсоров фазы ПФК. Однако после синтеза частицы имеют пластинчатую форму, которую ПФК наследует после термообработки [8]. АФК-1 с соотношением Ca/P=1 или гидратированный ПФК Ca2P2O7·2H2O также могут быть использованы в качестве прекурсоров фазы ПФК в керамическом материале. При синтезе этих соединений из растворов в качестве исходных солей используют растворимые пирофосфаты натрия, калия и аммония и растворимые соли кальция. Данный подход позволяет синтезировать порошок гидратированного АФК1 с мольным соотношением Са/Р=1, состоящий из частиц с формой близкой к изометричной [9]. Однако использование солей натрия или кальция при синтезе фосфатов кальция из растворов неизбежно приводит адсорбции на поверхности частиц ФК и к захвату сопутствующих продуктов синтеза, которые даже будучи хорошо растворимыми трудно удаляются из порошка с размером индивидуальных кристаллитов порядка 30-100 нм [10]. Применение синтеза АФК-1 (Са/Р=1) из пирофосфата аммония ограниченно отсутствием на рынке данного химического реактива с удовлетворительными характеристиками [11].
Одним из традиционных методов подготовки шихты для получения керамического композиционного материала является тщательное смешивание порошковых прекурсоров целевых фаз, предпочтительно синтезированных одним из химических способов. В композиционных керамических материалах на основе фосфатов кальция (ФК) целевые фазы образуются или путем термической конверсии или в результате протекания гетерофазных реакций между исходными компонентами шихты при нагревании [12]. Однако порошковые прекурсоры в той или иной степени агрегированы. И это не позволяет достичь высокой степени гомогенности смесей даже на уровне размера индивидуальных частиц (кристаллитов), который для ФК, синтезированных из растворов, составляет 30-50 нм (30-50·10-9 м). Обычно, даже с применением высокоэнергетического оборудования (например, планетарной мельницы) при смешивании порошковых прекурсоров - химически синтезированных порошков, гомогенность порошковых смесей оценивается на уровне от 1-15 мкм (1-15·10-6 м), что соответствует наиболее вероятному размеру агрегатов порошков ФК, синтезированных методом химического осаждения из растворов. При получении некоторых видов керамики, например на основе стабилизированного или частично стабилизированного диоксида циркония, представляющих собой твердый раствор стабилизатора (оксидов кальция, магния, иттрия и т.п.) в ZrO2, или керамики эвтектического состава в системе Al2O3-ZrO2(Y2O3) для достижения высокого уровня фазовой гомогенности применяют метод совместного осаждения нерастворимых соединений, например гидроксидов. Но при получении керамики на основе большинства неорганических оксидных порошков такой метод неприменим, т.к. условия осаждения различных нерастворимых соединений (прекурсоров заданных фаз) существенно отличается. Фосфаты кальция не являются исключением. Так, например, область устойчивого существования ГАП находится в интервале рН 6-12, брушита - 2-6, а ТКФ вообще не может быть синтезирован из раствора [13, 14, 15]. Следовательно, метод совместного осаждения не может быть применен при подготовке шихты для получения керамического биодеградируемого материала на основе ТКФ и ПФК.
Ранее был рассмотрен способ получения композиционного керамического биодеградируемого материала, содержащего ПФК и ТКФ, на основе порошковой смеси, состоящей из гидроксиапатита (ГАП) и монетита CaHPO4, представляющего собой дегидратированный брушит [16], включающий подготовку шихты, представляющей собой смесь синтезированных из растворов порошков ФК, формование и обжиг. Недостатком этого способа является как невозможность достижения высокой степени фазовой однородности шихты, так и использование в качестве одного из компонентов шихты брушита [17] или монетита [16]. Из-за удаления воды при конверсии этих веществ в ПФК при обжиге керамики велика вероятность формирования неоднородной микроструктуры керамического биодеградируемого материала с повышенной пористостью.
Еще один способ получения композиционного керамического биодеградируемого материала, содержащего ПФК и ТКФ представлен в заявке [18]. В данном способе при подготовке одного из компонентов шихты проводили термообработку с высокой скоростью нагрева. Высокой скорости нагрева достигали, внося синтезированный порошок брушита в предварительно разогретую печь. Интенсивное выделение большого объема газообразной воды, содержащегося в кристаллической структуре брушита (CaHPO4·2H2O), обеспечивает дополнительное термическое диспергирование частиц порошка. Уровень гомогенности (однородности) фазового состава этого керамического материала определяется размером зерна и составляет 1-2 мкм (1-2·10-6 м). В данном случае высокая степень гомогенизации фаз внутри отдельного зерна керамического материала также не наблюдается.
По данным научной и патентной литературы для обжига керамики на основе ФК применяют температуры в интервале 600-1300°С [19, 20, 21, 22, 23, 24]. В некоторых случаях верхняя граница температуры обжига может быть ограничена необходимостью предотвратить возможность протекания фазового перехода со значительными объемными изменениями [5]. Ниже температуры 600°С процесс спекания в синтетических ФК протекает с небольшой скоростью [25, 26].
Предварительная термообработка порошков ФК была использована в ряде исследований для так называемого «огрубления» порошков, т.е. для увеличения размера частиц, синтезированных осаждением из растворов. Спекание оксидных порошков с размером частиц порядка 1 мкм хорошо изучено, предсказуемо и практически не вызывает проблем при получении керамики. Получение керамики из порошков с размером частиц много меньше микрона или порошков с размером частиц менее 100 нм достаточно проблематично и является предметом многочисленных исследований не только при получении керамики из порошков ФК, но и при получении керамики на основе других соединений.
Таким образом, подготовка компонентов шихты для получения керамического композиционного материала на основе ФК включает синтез порошка (т.е. получение суспензии, отделение осадка, сушку продукта, дезагрегацию), термообработку и дезагрегацию порошка после термообработки. При этом термообработку используют или для огрубления порошка (более управляемый процесс спекания), для удаления воды из кристаллической структуры (предотвращение излишней пористости после обжига) или перевода гидратированного прекурсора фазы композиционного материла в негидратированную форму (например, CaHPO4 в Ca2P2O7 или Ca2P2O7·2H2O в Ca2P2O7); для дополнительного термического деспергирования при выделении больших объемов газообразной воды, содержащейся в структуре прекурсора (например, Ca2P2O7·2H2O или Ca2P2O7·2H2O). Подготовка шихты включает смешивание порошков (прекурсоров индивидуальных фаз) на одной из стадий дезагрегации, так как технически и дезагрегация и смешивание реализуются с использованием одного и того же оборудования (например, планетарной мельницы).
Среди обширного списка ФК особое внимание привлекает октакальциевый фосфат Ca8(HPO4)2(PO4)4·5H2O (ОКФ), мольное соотношение Са/Р которого составляет 1.33. Кристаллическая структура ОКФ представляет собой совокупность чередующихся слоев, аналогичных по структуре СаДГАП (или трикальцийфосфат гидрату Са3(PO4)2·xH2O) и брушиту CaHPO4·2H2O. И химическая формула ОКФ «Ca8(HPO4)2(PO4)45H2O» может быть записана как «2(Са3(PO4)2·0,5H2O)·2(CaHPO4·2H2O)» [27].
Исследование продуктов термолиза ОКФ, содержащего карбоксилат-ионы, показало, что после термообработки при температуре выше 600°С в течение 5 часов образуются ГАП, ТКФ и ПФК [28]. Данный факт свидетельствует о том, что выбранный режим термообработки не обеспечивает достижения фазовой однородности порошка.
Фазовый состав керамики после термообработки при 900°С в течение 3 часов, полученной из порошка ОКФ, синтезированного в присутствии лимонной кислоты, был представлен ПФК и ТКФ [29]. Однако рассматриваемый синтез из растворов в присутствии различных количеств лимонной кислоты, как пишут авторы, позволяет получить после синтеза хорошо закристаллизованный бифазный, а в некоторых случаях и многофазный порошок. Согласно принципу наследования структурой керамики структуры порошка отсутствие фазовой однородности порошка после синтеза указывает на невозможность достижения высокой степени фазовой однородности керамики после обжига.
В научной литературе можно найти множество публикаций, описывающих синтез ОКФ, который, как правило, применяют для лечения костных дефектов, в виде гранул, или применяют как компонент композиционных материалов с полимерной матрицей. В таких работах ОКФ рассматривается в качестве прекурсора ГАП, образующегося после имплантации в процессе взаимодействия со средой организма in vivo или с аналогами межтканевой жидкости in vitro. Вследствие близости кристаллических структур этих фосфатов ОКФ трансформируется в ГАП при взаимодействии со средой организма млекопитающего или при испытаниях in vitro [30, 31].
Все многообразие способов синтеза ОКФ можно разделить на несколько больших групп:
- синтез из водных растворов [29, 32, 33] или из суспензий малорастворимого соединения (например, СаСО3) [34];
- гидролиз малорастворимых ФК [35];
- синтез из водных растворов в присутствии SBFc, полиэлектролитов и других органических добавок [29, 36, 37, 38, 39];
- гидролиз малорастворимых соединений (ТКФ [40], АФК [41, 42], брушита [43, 44]) в присутствии полиэлектролитов, других органических добавок или в растворах, имитирующих среду организма [45].
Синтез ОКФ из водных растворов производят, используя в качестве растворимых солей кальция ацетата, хлорида, нитрата, иодида [46], Са(H2PO4)2·H2O [29], а в качестве растворимых фосфатов смесь Na2HPO4/NaH2PO4, KH2PO4. Для поддержания требуемого уровня рН используют растворы КОН, HCl [47], NH4OH [48], трисбуфера, иных буферных растворов. Недостатками способов синтеза из растворов являются использование разбавленных растворов, обуславливающих низкую производительность (малый выход целевого продукта), а также фазовая неоднородность синтезированного продукта, содержащего наряду с ОКФ другие ФК.
Гидролиз малорастворимых ФК (например, ТКФ) также проводят с использованием буферных растворов (например, ацетатного буфера СН3СООН/CH3COONa) для поддержания заданного рН среды [49].
Наиболее близким к предлагаемому изобретению является способ [49], включающий гидролиз 2 ммоль малорастворимого ФК в 18 мл ацетатного буферного водного раствора СН3СООН/CH3COONa с рН в интервале 3,9-4,7 в течение 3-24 часов при 50-70°С, отделение осадка октакальциевого фосфата ОКФ от маточного раствора, промывание осадка, сушку при 50°С в течение 24 часов. Недостатком данного способа является большой размер (до 10 мкм) частиц исходного порошка малорастворимого ФК, в качестве которого используют ТКФ, что отрицательно сказывается на степени фазовой однородности порошка ОКФ после синтеза и термообработки. Кроме того, растворимость ТКФ хотя и больше чем, например, у ГАП, но все-таки достаточно низкая, а это требует увеличения продолжительности процесса гидролиза.
Целью настоящего изобретения является разработка способа подготовки шихты с пoкaзaтeлeмd (с SBF - simulated body fluid, d - в настоящем описании «показатель однородности фазового распределения» означает протяженность каждой из фаз в нм) однородности фазового распределения в интервале 20-40 нм для получения керамического биодеградируемого материала, состоящего из ПФК и ТКФ, с показателем однородности фазового распределения в интервале 50-100 нм.
Цель была достигнута настоящим изобретением.
Способ подготовки шихты для получения керамического биодеградируемого материала, включающий синтез октакальциевого фосфата из малорастворимого фосфата кальция в ацетатном буферном водном растворе CH3COOH/CH3COONa при температуре в интервале 55-65°С, отделение осадка, промывание осадка, сушку осадка и термообработку, отличающийся тем, что в качестве малорастворимого соединения используют брушит с влажностью 5-55%, рН синтеза лежит в интервале 5,5-5,8, соотношение «брушит/буферный раствор» по массе лежит в интервале 1/80-1/100, продолжительность синтеза составляет 30-60 минут, а термообработку порошка проводят в интервале 400-700°С в течение 1-2 часов, используя внесение порошка в печь, предварительно разогретую до температуры термообработки. При этом срок хранения брушита после синтеза составляет 0,1-24 часа.
Порошок брушита CaHPO4·2H2O синтезируют в соответствии с реакцией (1) из водных растворов нитрата кальция и гидрофосфата аммония с концентрацией 1М-2М.
Концентрации исходных растворов, как нитрата кальция, так и гидрофосфата аммония, лежат в интервале 1М-2М. Концентрация реагентов в водном растворе менее 1М делает данную стадию менее производительной. Концентрация реагентов в водном растворе более 2М приводит к формированию слишком густой суспензии брушита в маточном растворе, что затрудняет ее перемешивание.
После фильтрования осадок промывают 5-8 раз дистиллированной водой. Меньшее количество промываний не позволяет удалить сопутствующий продукт реакции до допустимого уровня. Промывание осадка более 8 раз нецелесообразно, т.к. допустимый уровень содержания сопутствующего продукта реакции уже достигнут, а дополнительное промывание увеличивает время подготовки порошка брушита.
После промывания осадок брушита отфильтровывают на бумажном фильтре до влажности 55% и в период 0,1-24 часа после синтеза переносят в подготовленный буферный раствор СН3СООН/CH3COONa с рН в интервале 5,5-5,8e (e - данный интервал рН поддерживается, если используют ацетатный буферный раствор, в котором концентрация для СН3СООН и для CH3COONa составляет 0,1М) и температуре 55-65°С при массовом соотношении дисперсная фаза (брушит)/ дисперсионная среда (буферный раствор) в интервале 1/80-1/100. Синтез ОКФ из малорастворимого фосфата кальция брушита осуществляется в результате протекания реакции гидролиза (взаимодействия вещества с водой), являющейся частным случаем большой группы реакций протолитического взаимодействия (2).
По крайней мере, требуется некоторое время (не менее 6 мин, т.е. 0,1 часа), чтобы отделить синтезированный порошок брушита от маточного раствора и промыть его. В том случае, если порошок хранится до внесения в буферный раствор более 24 часов, его влажность становится ниже 5%, а это не позволяет провести синтез (реакцию гидролиза брушита с образованием однофазного ОКФ) в течение 30-60 мин. При рН меньшем 5,5 и температуре меньшей, чем 55°С существуют условия для существования как ОКФ, так и брушита. При рН большем 5,8 и температуре выше 65°С создаются условия для формирования ГАП. Отклонение от указанных интервалов температур и рН в большую или меньшую сторону может привести к образованию смеси ФК, что не позволит рассматривать синтезированный порошок в качестве промежуточного продукта, позволяющего после термообработки получить шихту с высоким показателем однородности фазового распределения. Применение более концентрированной суспензии, чем с соотношением «брушит/буферный раствор» 1/80 не позволит поддержать необходимый для получения однофазного продукта (ОКФ) интервал рН. Применение более разбавленной суспензии, чем с соотношением брушит/буферный раствор 1/100 нецелесообразно и просто увеличивает объем реакционной смеси. Взаимодействие брушита и буферного раствора продолжительностью менее 30 минут недостаточно, так как не весь внесенный в буферный раствор брушит превращается в ОКФ. Взаимодействие брушита и буферного раствора продолжительностью более 60 минут нецелесообразно, поскольку конверсия брушита в ОКФ уже завершена и возможно протекание процессов растворения-кристаллизации, ведущих к увеличению размера частиц ОКФ.
Осадок ОКФ отделяют от маточного раствора фильтрованием. Затем осадок для удаления адсорбированных ионов буферного раствора промывают 5-8 раз. Меньшее количество промываний не позволяет удалить адсорбированные ионы буферного раствора после реакции гидролиза до допустимого уровня. Промывание осадка более 8 раз нецелесообразно, т.к. допустимый уровень содержания адсорбированных ионов уже достигнут, а дополнительное промывание увеличивает время подготовки порошка ОКФ.
После отделения ОКФ от буферного раствора и промывания осадок сушат в тонком слое. ОКФ после сушки дезагрегируют в ацетоне в планетарной мельнице. Дезагрегированный порошок подвергают термообработке в интервале 400-700°С в течение 1-2 часов, используя внесение порошка в печь, предварительно разогретую до температуры термообработки. Термообработка при температуре ниже 400°С в течение 2 часов не обеспечивает полной термической конверсии ОКФ в продукт, состоящий из ПФК и ТКФ с высоким показателем однородности фазового распределения. Термообработка при температуре выше 700°С в течение 1 часа приводит к укрупнению частиц вследствие припекания частиц порошка ФК друг к другу и снижению активности порошка ФК к спеканию.
По данным [29] в порошковой системе на основе ОКФ при нагревании протекают последовательно химические реакции 3-5. В данной работе отмечается, что процесс спекания порошковых заготовок на основе ОКФ протекает в интервале 750-1150°С.
Предлагаемый в настоящем изобретении температурный режим, при котором порошок ОКФ вносится в предварительно разогретую печь, обеспечивает как дополнительное термическое диспергирование, так и создает условия для формирования порошка ФК (ПФК/ТКФ) с высоким показателем однородности фазового состава. При этом частичка порошка представляет собой композит с равномерно распределенными фазами ПФК и ТКФ. Протяженность данных фаз (показатель однородности фазового распределения) составляет 20-40 нм. Особенностью продуктов термической конверсии ОКФ по предложенному температурному режиму, представляющих собой смесь ПФК и ТКФ, является высокая степень гомогенизации, поскольку прекурсоры данных фаз представляют собой чередующиеся кристаллографические слои химических соединений, аналогичных по структуре СаДГАП (или трикальцийфосфатгидрату Са3(PO4)2·xH2O) и брушиту CaHPO4·2H2O.
После охлаждения полученный в результате термической конверсии продукт дезагрегируют и используют для формования образцов.
Шихту с высоким показателем фазовой однородности прессуют в виде балочек 10×5×3 мм, а затем обжигают при температуре 1000-1100°С в течение 1-3 часов.
Обжиг материала при температуре ниже 1000°С с выдержкой при этой температуре менее 1 часа не обеспечивает получения в достаточной степени спеченного материала. Обжиг при температуре выше 1100°С с выдержкой при этой температуре более 3 часов ведет к деградации микроструктуры керамического материала, связанного с аномальным ростом зерен.
Использование шихты с высоким показателем однородности фазового распределения позволяет при использовании указанного режима обжига получать керамический биодеградируемый материал, состоящий из ПФК и ТКФ, с показателем однородности фазового распределения в интервале 50-100 нм.
Изобретение иллюстрируется примером.
Пример
Синтез брушита проводят, приливая 1 л 1,5М водного раствора нитрата кальция Са(NO3)2 водного раствора гидрофосфата аммония NH4HPO4 к 1 л 1,5М при комнатной температуре в соответствии с реакцией (1). При сливании растворов формируется буферная смесь, которая обладает рН 5,5-5,6 [17].
После фильтрования полученный осадок промывают дистиллированной водой 6 раз. После промывания осадок брушита отфильтровывают на бумажном фильтре до влажности 55%. Через 12 часов после синтеза порошок брушита с влажностью 30% массой 13 г (10 г брушита и 3 г воды) переносят в подготовленный буферный раствор СН3СООН/CH3COONa объемом 900 мл с рН 5,6f (f - интервал рН 5,5-5,8 поддерживается, если используют ацетатный буферный раствор, в котором концентрация для СН3СООН и для CH3COONa составляет 0,1М) и температуре 60°С при массовом соотношении дисперсная фаза (брушит)/дисперсионная среда (буферный раствор), равном 1/90, для проведения реакции гидролиза.
Продолжительность синтеза (взаимодействия брушита и буферного раствора), обеспечивающее образование ОКФ, составляет 45 минут.
Осадок ОКФ отделяют от маточного раствора фильтрованием. Затем осадок для удаления адсорбированных ионов буферного раствора промывают 6 раз.
После отделения ОКФ от буферного раствора осадок сушат в тонком слое. ОКФ после сушки дезагрегируют в ацетоне в планетарной мельнице. Дезагрегированный порошок подвергают термообработке при 550°С в течение 1,5 часов, используя внесение порошка в печь, предварительно разогретую до температуры термообработки.
После охлаждения полученный в результате термической конверсии продукт дезагрегируют и используют для формования образцов. Шихту с высоким показателем фазовой однородности прессуют при давлении 100 МПа в виде балочек 10×5×3 мм, а затем обжигают при температуре 1050°С в течение 3 часов.
Использование шихты с высоким показателем однородности фазового распределения позволяет при указанном режиме обжига получать керамической биодеградируемый материал, состоящей из ПФК и ТКФ, с показателем однородности фазового распределения в интервале 50-100 нм.
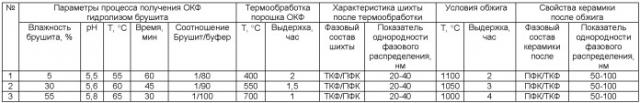
Аналогично были изготовлены образцы керамического биодеградируемого материала, состоящего из ПФК и ТКФ с показателем однородности фазового распределения в интервале 50-100 нм (см. таблицу).
Таким образом, экспериментальные данные, представленные в таблице, показывают, что применение заявленного способа позволяет получить шихту на основе фосфатов кальция с показателем однородности фазового распределения в интервале 20-40 нм для получения керамического биодеградируемого материала, состоящего из ПФК и ТКФ, с показателем однородности фазового распределения в интервале 50-100 нм.
Литература
1. Navarro M., Michiardi A., Castan О., Planell J.A. Biomaterials in orthopaedics // J.R. Soc. Interface. - 2008. - Vol.5. - P.1137-1158.
2. J.A.Al-Tubaikh Internal Medicine - An Illustrated Radiological Guide: Chapter 7 Rheumatology, Springer Berlin Heidelberg, 2010, pp.265-268.
3. Будников П.П., Полубояринов Д.Н. Химическая технология керамики и огнеупоров. Стройиздат, Москва, 1972, 552 с.
4. Raynaud S., Champion E., Bernache-Assolant D., Thomas P. Calcium Phosphate apatites with variable Ca/P atomic ratio. Part I. Synthesis, characterization and Thermal stability of Powders // Biomaterials. - 2002. - V.23. - P.1065-1072.
5. Каназава Т. Неорганические фосфатные материалы: Пер. с яп. - Киев: Наукова думка, 1998. - 298 с.
6. Сафина M.Н., Сафронова Т.В., Лукин Е.С., Керамика на основе фосфатов кальция с пониженной температурой спекания, содержащая резорбируемую фазу // Стекло и керамика, 2007, №7, с.19-24.
7. Takami Akio; Kondo Kazuo Phosphate of calcium ceramics // US pat 4376168, March 8, 1983.
8. A.Cuneyt Tas, "Chemical Processing of CaHPO4·2H2O: Its Conversion to Hydroxyapatite, J. Am. Ceram. Soc., 87 [12], 2195-2200, (2004).
9. Сафронова Т.В., Путляев В.И., Шехирев М.А., Третьяков Ю.Д. Способ получения активного к спеканию порошка пирофосфата кальция // №2008149275 от 16.12.2008, www.fips.ru.
10. Сафронова Т.В. Фазовый состав керамики на основе порошков гидроксиапатита кальция, содержащих сопутствующие продукты реакции синтеза // Стекло и керамика, 2009. - №4. - С.21-24.
11. www.sigma-aldrich.com.
12. Итоговый отчет по проекту РФФИ 07-08-00576 «Фазовые превращения в системе CaO-P2O5 как инструмент формирования микроструктуры композитов на основе фосфатов кальция» www.grantexpress.rfbr.ru.
13. Paul Wencil Brown «Phase Relationships in the Ternary System CaO-P205-H20 at 25°C» // J. Am. Cer. Soc., 75 [1] (1992).
14. Roger I. Martin and Paul W. Brown «Phase Equilibria Among Acid Calcium Phosphates» // J. Am. Cer. Soc., 80 [5] (1997).
15. Sergey V. Dorozhkin, Matthias Epple Biological and Medical Significance of Calcium Phosphates // Angew. Chem. Int. Ed. 2002, 41, 3130-3146.
16. Сафронова Т.В., Путляев В.И., Шехирев М.А., Кузнецов А.В. Композиционная керамика, содержащая биорезорбируемую фазу // Стекло и керамика, 2007, №3, с.31-35.
17. Safronova Т.V., Kuznetsov A.V., Korneychuk S.A., Putlyaev V.I., Shekhirev М.А. Calcium phosphate powders synthesized from solution with [Ca2+]/[PO4 3-]=1 for bioresorbable ceramics // Central European Journal of Chemistry, в печати 2009 г.
18. Сафронова Т.В., Путляев В.И., Шехирев М.А., Третьяков Ю.Д. Способ получения керамического биодеградируемого материала, состоящего из пирофосфата кальция и трикальцийфосфата №2008152281 от 30.12.2008.
19. US Patent 6312468 Best, et al Silicon-substituted apatites and process for the preparation thereof, 2001.
20. US Patent 4917702 Scheicher, et al Bone replacement material on the basis of carbonate and alkali containing calciumphosphate apatites, 1990.
21. US Patent 6582672 Bonfield, et al Method for preparation of carbonated hydroxyapatite compositions, 2003.
22. US Patent 6585946 Bonfield, et al Process for the preparation magnesium and carbonate substituted hydroxyapatite, 2003.
23. US Patent 6090732 Ito, et al Zinc-doped tricalcium phosphate ceramic material, 2000.
24. US Patent 4149893 Aoki, et al Ortopedic and dental implant ceramic composition nd process for preparing same, 1979.
25. Raynaud, S., Champion, E., Bernache-Assollant, D., Thomas, P., Calcium phosphate apatites with variable Ca/P atomic ratio I. Sinthesis, Characterisation and thermal stability of powders. Biomaterials, 2002, 23, 1065-1072.
26. Raynaud, S., Champion, E., Bernache-Assollant, D., Thomas, P., Calcium phosphate apatites with variable Ca/P atomic ratio II. Calcination and sintering. Biomaterials, 2002, 23, 1073-1080.
27. W.E.Brown, M.Mathew and M.S.Tung Crystal chemistry of octacalcium phosphate // Prog. Cryst. Growth Charact. 1981, Vol.4, pp.59-87.
28. Kiyoko Sakamoto, Shunro Yamaguchi, Motoki Kaneno, Ichiro Fujihara, Katsuhiko Satoh, Yoshiaki Tsunawaki Synthesis and thermal decomposition of layered calcium phosphates including carboxylate ions // Thin Solid Films 517 (2008) 1354-1357].
29. Mitsionis A.I., Vaimakis T.C., Trapalis С.С. The effect of citric acid on the sintering of calcium phosphate bioceramics // Ceram. Int. (2009), doi:10.1016/j.ceramint.2009.09.034.
30. Suzuki O., Kamakura S., Katagiri Т., Nakamura M., Zhao В., Honda Y., Kamijo R. Bone formation enhanced by implanted octacalcium phosphate involving conversion into Ca-deficient hydroxyapatite // Biomaterials 27 (2006) 2671-2681.
31. Murakami Y., Honda Y., Anada Т., Shimauchi H., Suzuki O. Comparative study on bone regeneration by synthetic octacalcium phosphate with various granule sizes // Acta Biomaterialia 6 (2010) 1542-1548.
32. Tarasevich В.J., Chusuei С.С., Allara D.L. Nucleation and Growth of Calcium Phosphate from Physiological Solutions onto Self-Assembled Templates by a Solution-Formed Nucleus Mechanism // J. Phys. Chem. В 2003, 107, 10367-10377.
33. Mayumi Iijima, Hideo Kamemizu, Nobukazu Wakamatsu, Takayasu Goto, Yutaka Doi, Yutaka Moriwaki Efects of Ca addition on the formation of octacalcium phosphate and apatite in solution at pH 7.4 and at 37°C//Journal of Crystal Growth 193 (1998) 182-188.
34. Shiho Ishihara, Takuya Matsumoto, Takamasa Onoki, Taiji Sohmura, Atsushi Nakahira New concept bioceramics composed of octacalcium phosphate (OCP) and dicarboxylic acid-intercalated OCP via hydrothermal hot-pressing // Materials Science and Engineering С 29 (2009) 1885-1888.
35. Hans E. Lundager Madsen Influence of foreign metal ions on crystal growth and morphology of brushite (CaHPO4, 2H2O) and its transformation to octacalcium phosphate and apatite // Journal of Crystal Growth 310 (2008) 2602-2612.
36. Bigi A., Bracci В., Panzavolta S., Iliescu M., Plouet-Richard M., Werckmann J., Cam D. Morphological and Structural Modifications of Octacalcium Phosphate Induced by Poly-L-Aspartate / CRYSTAL GROWTH & DESIGN 2004 V.4, №1, 141-146.
37. Bigi A., Boanini E., Cojazzi G., Falini G., Panzavolta S. Morphological and structural investigation of octacalcium phosphate hydrolysis in the presence of polyacrylic acids: Effect of relative molecular weights // CRYSTAL GROWTH & DESIGN 2001 V.1, №3, 239-244.
38. Bigi A., Boanini E., Bracci В., Falini G., Rubini K. Interaction of acidic poly-amino acids with octacalcium phosphate // Journal of Inorganic Biochemistry 95 (2003) 291-296.
39. He-Ping Wang, Xiao-Jing Feng, Bao-Di Gou, Tian-Lan Zhang, Shan-Jin Xu, Kui Wang Effects of LDL, cholesterol, and their oxidized forms on the precipitation kinetics of calcium phosphates // Clinical Chemistry 49:12 2027-2036 (2003).
40. Bigi A., Boanini E., Botter R., Panzavolta S., Rubini K. α-Tricalcium phosphate hydrolysis to octacalcium phosphate: effect of sodium polyacrylate // Biomaterials 23 (2002) 1849-1854].
41. Pazit Bar-Yosef Ofir, Ruti Govrin-Lippman, Nissim Garti, and Helga Fu.. redi-Milhofer The Influence of Polyelectrolytes on the Formation and Phase Transformation of Amorphous Calcium Phosphate // CRYSTAL GROWTH& DESIGN 2004 VOL.4, NO.1 177-183.
42. M.S.Tung and W.E. Brown An Intermediate State in Hydrolysis of Amorphous Calcium Phosphate //Calcif. Tissue Int. (1983) 35:783-790.
43. Woo-Kul Lee, Jea-Seung Ко, Hyun-Man Kirn Effect of Electrostatic Interaction on the Adsorption of Globular Proteins on Octacalcium Phosphate Crystal Film // Journal of Colloid and Interface Science 246, 70-77 (2002).
44. Stephan Graham and Paul W. Brown The low temperature formation of octacalcium phosphate // Journal of Crystal Growth 132 (1993) 215-225.
45. Selen Mandel, A. Cuneyt Tas, Brushite (CaHPO4·2H2O) to octacalcium phosphate (Ca8(HPO4)2(PO4)4·5H2O) transformation in DMEM solutions at 36.5oC, // Materials Science & Engineering С (2009), doi: 10.1016/j.msec.2009.10.009.
46. D.G.A.Nelson 1 and J.D.McLeanHigh-Resolution Electron Microscopy of Octacalcium Phosphate and its Hydrolysis Products // Calcif Tissue Int (1984) 36:219-232.
47. M.S.Tung and W.E.Brown An Intermediate State in Hydrolysis of Amorphous Calcium Phosphate // Calcif. Tissue Int. (1983) 35:783-790.
48. Т.Kikawa а, О.Kashimoto b, H.Imaizumi с, S.Kokubun d, O.Suzuki Intramembranous bone tissue response to biodegradable octacalcium phosphate implant // Acta Biomaterialia 5 (2009) 1756-1766.
49. A.Nakahira, S. Aoki, K.Sakamoto, S. Yamaguchi Synthesis and evaluation of various layered octacalcium phosphates by wet-chemical processing // J. mater sci.: mater. In med, 12 (2001) 793-800.
1. Способ подготовки шихты для получения керамического биодеградируемого материала, включающий синтез октакальциевого фосфата из малорастворимого фосфата кальция в ацетатном буферном водном растворе СН3СООН/СН3СООNa при температуре в интервале 55-65°С, отделение осадка, промывание осадка, сушку осадка и термообработку, отличающийся тем, что в качестве малорастворимого соединения используют брушит с влажностью 5-55%, рН синтеза лежит в интервале 5,5-5,8, соотношение «брушит/буферный раствор» по массе лежит в интервале 1/80-1/100, продолжительность синтеза составляет 30-60 мин, а термообработку порошка проводят в интервале 400-700°С в течение 1-2 ч, используя внесение порошка в печь, предварительно разогретую до температуры термообработки.
2. Способ подготовки шихты для получения керамического биодеградируемого материала по п.1, в котором срок хранения малорастворимого фосфата кальция брушита после синтеза составляет 0,1-24 ч.