Синтез и способы применения производных пироглутаминовой кислоты
Иллюстрации
Показать всеИзобретение относится к новым соединениям формулы
где R1 означает -ОН; R2, R3 и R4 означают Н; X означает фармацевтически приемлемый анион, такой как Br; Y означает группу формулы VIa:
где пунктирная линия вместе с атомом азота образует незамещенный 6-членный гетероарил; X определен выше. Соединения могут быть использованы в фармацевтической композиции, ингибирующей рост опухоли или усиливающей иммунный ответ. Описан способ получения соединения I, которое дополнительно включает R1-ORa, где Ra означает незамещенный С1-8алкил; R2 означает -(O=)C-O-Ra, где Ra означает незамещенный С1-8алкил. Описаны промежуточные соединения и их использование для получения соединения I. 7 н. и 11 з.п. ф-лы, 7 схем, 29 табл., 4 ил., 16 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новому синтезу производных пироглутаминовой кислоты, их выделенным оптически активным стереоизомерам и их смесям, а также к способам их применения и к новым промежуточным соединениям для их синтеза. Настоящее изобретение также относится к применению в терапевтических целях указанных производных пироглутаминовой кислоты, их оптически активных стереоизомеров и их смесей.
УРОВЕНЬ ТЕХНИКИ
В европейском патенте ЕР 0768308 В1 описаны смеси стереоизомеров производных пироглутаминовой кислоты, предназначенные для стимуляции иммунного биологического ответа, имеющие следующую общую формулу:
в которой R1, R2 и R3 могут являться водородом или -C(=О)Ме, а A может являться Cl-, CH3COO- или HO-. Описанный в данном патенте способ получения указанных соединений включает взаимодействие L-серина с молярным избытком уксусного ангидрида и пиридина при высокой температуре. Таким образом, как описано в указанном документе, различные стереоизомеры никогда не выделялись, а описанные в данном патенте анализы in vivo и in vitro проводили со смесями, включающими все четыре возможных оптически активных стереоизомера вместе. Не было описано какого-либо признака относительно чистых или обогащенных смесей индивидуальных стереоизомеров. Кроме того, не приводили какого-либо признака относительно выделения различных оптически активных стереоизомеров из описанной смеси.
Квалифицированному специалисту известно, что различные оптически активные стереоизомеры соединения могут обладать различными или даже противоположными эффектами. Например, соединение может обладать терапевтическими эффектами, в то время как его энантиомер может быть токсичным. Примеры таких случаев известны квалифицированному специалисту. Декстрометорфан является противоотечным средством, тогда как левометорфан представляет собой сильнодействующий наркотик.
| Декстрометорфан | Левометорфан |
Также известно различное действие энантиомеров пергексилина in vivo.
| S-Пергексилин | R-Пергексилин |
Оба вещества являются модуляторами сердечного ритма, однако один из энантиомеров метаболизируется более медленно и накапливается в организме, что вызвало множество смертельных случаев в 80-е годы.
Вероятно, наиболее трагичным и известным примером является талидомид, который вводили в форме рацемической смеси беременным женщинам для снятия утреннего недомогания.
| S-талидомид | R-талидомид |
В то время как R-талидомид был эффективен, тератогенный эффект S-талидомида был обнаружен позже.
Поэтому при поиске новых соединений с ценными терапевтическими свойствами обычно нужно проводить испытание с использованием энантиомерно чистых стереоизомеров, чтобы выбрать наиболее активные энантиомеры и/или отказаться от потенциально токсичных. Таким образом, существует потребность в обеспечении выделенных стереоизомеров производных пироглутаминовой кислоты.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает способ получения производных пироглутаминовой кислоты, их оптически активных стереоизомеров и их смесей. Способ включает использование оптически активного стереоизомера-предшественника производного пироглутаминовой кислоты, который может быть легко выделен и впоследствии изменен с получением требуемого оптически активного стереоизомера.
В частности, авторы настоящего изобретения предложили синтез, в котором различные промежуточные соединения выделяют, в случае необходимости, с требуемой стереохимией. Указанные промежуточные продукты могут быть дополнительно изменены с целью получения требуемого производного пироглутаминовой кислоты в форме требуемого по существу чистого стереоизомера либо в форме смеси стереоизомеров. Авторы настоящего изобретения исходят из энантиомерно чистого соединения формулы IV, получая затем диастереомерные промежуточные соединения и конечные продукты, которые могут быть легко выделены и очищены. Используя соединение формулы IV с требуемой стереохимией можно получить промежуточные соединения в форме по существу чистых стереоизомеров или в форме смеси стереоизомеров. Указанное соединение формулы IV может быть синтезировано с использованием энантиомерно чистой глутаминовой кислоты.
Таким образом, согласно одному из аспектов настоящее изобретение относится к способу получения по существу чистого стереоизомера соединения формулы I или их смесей, который включает реакцию соединения формулы IV и соединения формулы V с получением по существу чистого стереоизомера соединения формулы III или их смесей; превращение указанного по существу чистого стереоизомера соединения формулы III или их смесей в по существу чистый стереоизомер соединения формулы II или их смеси; и, наконец, взаимодействие указанного по существу чистого стереоизомера соединения формулы II или их смесей с соединением формулы HX, в результате чего получают требуемое производное пироглутаминовой кислоты формулы I в виде по существу чистого стереоизомера или их смеси.
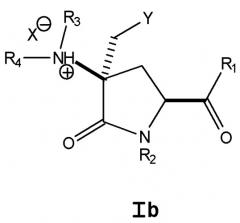
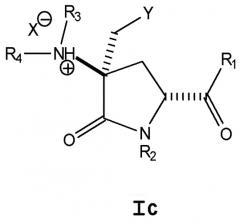
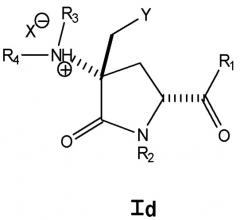
Следующий аспект настоящего изобретения относится к по существу чистому стереоизомеру соединения формулы I (то есть Ia, Ib, Ic или Id). Некоторые композиции, включающие смеси по существу чистых стереоизомеров соединения формулы Ia, Ib, Ic и/или Id, составляют следующий аспект настоящего изобретения, например композиция, включающая стереоизомеры формулы Ia, Ib, Ic и/или Id, при условии, что указанная композиция не содержит одновременно смеси всех четырех стереоизомеров следующих соединений:
(i) гидрохлорид 1-(3-амино-5-карбокси-2-оксопирролидин-3-илметил)пиридинийхлорида или
(ii) гидрохлорид 1-(1-ацетил-3-амино-5-карбокси-2-оксопирролидин-3-илметил)пиридинийхлорида.
Следующий аспект настоящего изобретения относится к по существу чистому стереоизомеру соединения формулы III или их смесям. Способ получения указанного соединения составляет дополнительный аспект настоящего изобретения.
Следующий аспект настоящего изобретения относится к способу получения по существу чистого стереоизомера соединения формулы II или по существу чистого стереоизомера указанного соединения формулы I. По существу чистый стереоизомер соединения формулы II (то есть IIа, IIb, IIc или IId) составляет дополнительный аспект настоящего изобретения. Некоторые композиции, включающие смеси по существу чистых стереоизомеров формулы IIа, IIb, IIc и/или Iid, также составляют следующий аспект настоящего изобретения.
Следующий аспект настоящего изобретения относится к некоторым фармацевтическим композициям, включающим соединение, выбранное из группы соединений формулы Ia, Ib, Ic, Id и их смесей, а также фармацевтически приемлемый наполнитель.
Следующий аспект настоящего изобретения относится к применению соединения, выбранного из группы соединений формулы Ia, Ib, Ic, Id и некоторых из их смесей, в получении композиции для профилактики или лечения опухолей.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг. 1 представлен график, показывающий ингибирующий эффект изомеров (1-4), оцененный по росту опухолевых клеток Renca по сравнению с плацебо (P.S.) [пример 6], выраженный в средних значениях площади поверхности опухолей.
На фиг. 2 представлен график, показывающий ингибирующий эффект изомеров (1-4), оцененный по росту опухолевых клеток Renca по сравнению с плацебо (P.S.) [пример 6], выраженный в средних значениях объема опухолей.
На фиг. 3 представлен график, показывающий ингибирующий эффект изомеров (1-4), оцененный по росту опухолевых клеток Renca по сравнению с плацебо (P.S.) [пример 6], выраженный в средних значениях площади поверхности опухолей.
На фиг. 4 представлен график, показывающий ингибирующий эффект изомеров (1-4), оцененный по росту опухолевых клеток Renca по сравнению с плацебо (P.S.) [пример 6], выраженный в средних значениях объема опухолей.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
В целях облегчения понимания настоящего изобретения значения некоторых понятий и выражений, используемых в контексте изобретения, включены в настоящее описание.
"Алкил" относится к радикалу c линейной или разветвленной углеводородной цепью, состоящему из атомов углерода и водорода, не содержащему какой-либо ненасыщенности, содержащему 1-12, предпочтительно от одного до восьми атомов углерода и который присоединен к остальной части молекулы посредством одинарной связи, например метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, н-пентил и т.д. Алкильные радикалы необязательно могут быть замещены одним или более заместителями, такими как галоген, гидрокси, алкокси, O-пропил, O-бензил, О-бензоат, карбокси, циано, карбонил, ацил, алкоксикарбонил, амино, имино, нитро, меркапто и алкилтио.
"Алкенил" относится к радикалу c линейной или разветвленной углеводородной цепью, состоящему из атомов углерода и водорода, содержащему, по меньшей мере, одну ненасыщенную связь, содержащему 1-12, предпочтительно от одного до восьми атомов углерода и который присоединен к остальной части молекулы посредством одинарной связи, например метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, н-пентил и т.д. Алкильные радикалы необязательно могут быть замещены одним или более заместителями, такими как галоген, гидрокси, алкокси, O-пропил, O-бензил, О-бензоат, карбокси, циано, карбонил, ацил, алкоксикарбонил, амино, имино, нитро, меркапто и алкилтио.
"Алкокси" относится к радикалу формулы O-алкил, где алкил определен выше, например метокси, этокси, пропокси и т.д.
"Арил" относится к ароматическому углеводородному радикалу, такому как фенил, нафтил или антрацил. Арилзамещенный радикал необязательно может быть замещен одним или более заместителями, такими как гидрокси, меркапто, галоген, алкил, фенил, алкокси, галогеналкил, нитро, циано, диалкиламино, аминоалкил, ацил и алкоксикарбонил, определенными в настоящем описании.
"Арилокси" относится к радикалу формулы -О-арил, где арил был определен выше. Некоторыми примерами арилоксисоединений являются -О-фенил, -O-п-толил, -O-м-толил, -O-o-толил или -O-нафтил.
"Амино" относится к радикалу формулы -NH2, -NHRa, -NRaRb, где Rа и Rb независимо выбраны из замещенного или незамещенного алкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного алкенила, замещенного или незамещенного циклоалкенила, замещенного или незамещенного арила, замещенного или незамещенного аралкила или замещенного или незамещенного гетероциклила; или Rа и Rb вместе образуют замещенный или незамещенный гетероцикл, замещенный или незамещенный циклоалкил или замещенный или незамещенный циклоалкенил.
"Аралкил" относится к арилзамещенной группе, связанной с алкильной группой, такой как бензил и фенетил.
"Карбоксиэфир" относится к -CO2Ra, где Rа выбран из замещенного или незамещенного алкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного алкенила, замещенного или незамещенного циклоалкенила, замещенного или незамещенного арила, замещенного или незамещенного аралкила или замещенного или незамещенного гетероциклила.
"Циклоалкил" относится к насыщенному карбоциклическому кольцу, содержащему от 3 до 8 атомов углерода.
"Циклоалкенил" относится к карбоциклическому кольцу, содержащему от 3 до 8 атомов углерода и, по меньшей мере, одну ненасыщенную связь.
"Гетероциклил" относится к стабильному 3-15-членному кольцу, которое состоит из атомов углерода и одного-пяти гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, предпочтительно 4-8-членному кольцу с одним или более гетероатомами, более предпочтительно 5- или 6-членному кольцу с одним или более гетероатомами. В соответствии с целями настоящего изобретения гетероцикл может быть моноциклической, бициклической или трициклической кольцевой системой, которая может включать конденсированные кольцевые системы; при этом атомы азота, углерода или серы в гетероциклическом радикале могут быть необязательно окислены; атом азота может быть необязательно четвертичным; а гетероциклический радикал может быть частично или полностью насыщенным или ароматическим. Примеры соответствующих гетероциклов включают, помимо прочих, азепины, бензимидазол, бензотиазол, фуран, изотиазол, имидазол, индол, пиперидин, пиперазин, пурин, хинолин, тиадиазол, тетрагидрофуран.
"Гетероарил" относится к гетероциклической группе, в которой, по меньшей мере, одно из колец является ароматическим кольцом.
"Защитная группа" относится к группе, которая блокирует органическую функциональную группу и может быть удалена в контролируемых условиях. Защитные группы, их относительная реакционная способность и условия, в которых они остаются инертными, известны квалифицированному специалисту. В данной связи приведена ссылка на Greene and Wuts "Protective Groups in Organic Synthesis", John Wiley & Sons, Inc., New York, 1999.
Ссылки, приведенные в настоящем описании по поводу замещенных групп в соединениях настоящего изобретения, относятся к определенной молекуле, которая может быть замещена по одному или нескольким доступным положениям одним или несколькими подходящими группами, например галогеном, таким как фтор, хлор, бром и йод; циано; гидроксил; нитро; азидо; алканоилом, таким как C1-C6 алканоильная группа, такая как ацил и т.п.; карбоксамидо; алкильными группами, включая группы, содержащие от 1 до приблизительно 12 атомов углерода или от 1 до приблизительно 6 атомов углерода, а более предпочтительно 1-3 атома углерода; алкенильными и алкинильными группами, включая группы, содержащие одну или более ненасыщенных связей и от 2 до приблизительно 12 атомов углерода или от 2 до приблизительно 6 атомов углерода; алкоксигруппами, содержащими одну или более кислородных связей и от 1 до приблизительно 12 атомов углерода или от 1 до приблизительно 6 атомов углерода; арилоксигруппами, такими как феноксигруппы; алкилтиогруппами, включая группы, содержащие одну или более тиоэфирных связей и от 1 до приблизительно 12 атомов углерода или от 1 до приблизительно 6 атомов углерода; алкилсульфинильными группами, включая группы, содержащие одну или более сульфинильных связей и от 1 до приблизительно 12 атомов углерода или от 1 до приблизительно 6 атомов углерода; алкилсульфонильными группами, включая группы, содержащие одну или более сульфонильных связей и от 1 до приблизительно 12 атомов углерода или от 1 до приблизительно 6 атомов углерода; аминоалкильными группами, такими как группы, содержащие один или более атомов N и от 1 до приблизительно 12 атомов углерода или от 1 до приблизительно 6 атомов углерода; карбоциклическим арилом, содержащим 6 или более атомов углерода, в частности фенилом или нафтилом и аралкилом, таким как бензил. Если не указано иное, необязательно замещенная группа может иметь заместитель в каждом замещаемом положении группы, причем каждая замена независима от другой.
Понятие "фармацевтически приемлемый анион" относится к любому аниону, который способен образовывать фармацевтически приемлемую соль в присутствии соответствующего противоположно заряженного катиона. Примеры фармацевтически приемлемых анионов включают Cl-, Br-, I-, F-, SO4 2-, ацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, анион яблочной кислоты, анион миндальной кислоты, метансульфонат, п-толуолсульфонат и т.д. Другие примеры фармацевтически приемлемых анионов могут быть известны квалифицированному специалисту.
Понятие "фармацевтически приемлемые соли" относится к любой фармацевтически приемлемой соли, которая при введении реципиенту способна к образованию (прямому или косвенному) соединения, описанного в настоящем документе. Однако следует понимать, что фармацевтически неприемлемые соли также включены в объем изобретения, так как могут использоваться при получении фармацевтически приемлемых солей. Получение солей может быть осуществлено способами, известными в уровне техники.
Например, фармацевтически приемлемыми солями соединений, приведенных в настоящем описании, могут являться соли присоединения кислот, соли присоединения основания или соли металлов, а также они могут быть синтезированы из исходного соединения, которое содержит основную или кислую группу, обычными химическими способами. Обычно такие соли получают, например, путем взаимодействия свободных кислотных или основных форм указанных соединений со стехиометрическим количеством соответствующего основания или кислоты в воде или в органическом растворителе или в смеси обоих. Обычно предпочтительными являются неводные среды, такие как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил. Примеры солей присоединения кислот включают соли присоединения минеральных кислот, такие как, например, гидрохлорид, гидробромид, гидроиодид, сульфат, нитрат, фосфат, а также соли присоединения органических кислот, такие как, например, ацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, соль яблочной кислоты, соль миндальной кислоты, метансульфонат и п-толуолсульфонат. Примеры солей присоединения оснований включают неорганические соли, такие как, например, аммониевые, а также органические основные соли, такие как, например, этилендиамин, этаноламин, N,N-диалкиленэтаноламин, триэтаноламин, глюкамин и основные соли аминокислот. Примеры солей металлов включают, например, соли натрия, калия, кальция, магния, алюминия и лития.
Термин "Энантиомерно обогащенный" применяется к смеси энантиомеров, которая относится к смеси энантиомеров соединения, в котором один из энантиомеров присутствует в большем количестве, чем другой энантиомер. Таким образом, энантиомерно обогащенные смеси имеют энантиомерный избыток больше 0% по отношению к одному из энантиомеров смеси, предпочтительно больше 20%, предпочтительно больше 40%, предпочтительно больше 70%, более предпочтительно больше 80%, более предпочтительно больше 90% и более предпочтительно больше 95%.
"Энантиомерно чистое" соединение можно рассматривать как смесь двух энантиомеров, имеющих энантиомерный избыток больше 95%, предпочтительно больше 98%, более предпочтительно больше 99%, более предпочтительно больше 99,5%.
"По существу чистое" соединение в настоящей заявке на патент можно отнести к соединению, имеющему чистоту выше 95%, предпочтительно выше 98%, более предпочтительно выше 99%, более предпочтительно выше 99,5%.
"Стереоизомер" в настоящей заявке на патент можно отнести к соединениям, состоящим из тех же атомов и связанным той же последовательностью связей, но имеющим различные пространственные структуры, которые не являются эквивалентными.
"Азотсодержащий нуклеофил" относится к молекуле, содержащей, по меньшей мере, один атом азота, по меньшей мере, с одной свободной парой электронов, причем указанная пара электронов способна к образованию связи с электрофильной (электронодефицитной) группой другой молекулы или внутри одной и той же молекулы. Примеры азота, содержащего нуклеофилы - первичные, вторичные или третичные амины, незамещенные атомы азота, являющиеся частью гетероцикла, даже атом азота амидной группы, при некоторых обстоятельствах, может взаимодействовать как нуклеофил.
В ЕР 0768308 В1 описано получение смесей стереоизомеров производных пироглутаминовой кислоты.
Все попытки разделения смеси стереоизомеров, описанных в ЕР 0768308 В1, с выделением по существу чистых соединений оказались неудачными. Следуя экспериментальной части указанного изобретения, 5% соединения, идентифицированного в вышеуказанном европейском патенте как BLAS-236(Cl) (гидрохлорид 1-(3-амино-5-карбокси-2-оксопирролидин-3-илметил)пиридинийхлорида)
BLAS-236(Cl)
было получено в виде смеси всех четырех возможных стереоизомеров.
Кроме того, его непосредственный предшественник BLAS-320(Ac) (ацетат 1-(1-ацетил-3-ацетиламино-5-карбокси-2-оксопирролидин-3-илметил)пиридиния)
BLAS-320(Ac)
синтезировали с использованием различных методик. Соединение формулы BLAS-320(Ac) было получено в виде смеси стереоизомеров, которую невозможно очистить, главным образом из-за трудностей, связанных с растворимостью (соединение BLAS-320(Ac) растворялось только в воде и метаноле).
Более того, в соединении формулы BLAS-320(Ac) пробовали заменить противоион ацетат другими анионами, но неудачно. Кроме того, пытались преобразовать (или прямой синтез) и далее очистить соединение формулы BLAS-320(Ac) в его сложноэфирное производное. Во всех случаях полученные неочищенные смеси было невозможно очистить.
Ввиду вышеизложенных фактов было понято, что описание ЕР 0768308 В1 было недостаточным для получения требуемых по существу чистых стереоизомеров производных пироглутаминовой кислоты, описанных в указанном документе. Поэтому был разработан совершенно иной метод.
Синтез по существу чистых стереоизомеров соединения формулы I и их смесей
В одном из аспектов изобретение относится к способу, в дальнейшем называемому способ получения по существу чистого стереоизомера соединения формулы I:
в которой
R1 выбран из -ОН, -ORa, где Ra выбран из замещенного или незамещенного алкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного алкенила, замещенного или незамещенного циклоалкенила, замещенного или незамещенного арила, замещенного или незамещенного аралкила или замещенного или незамещенного гетероциклила;
R2, R3 и R4 независимо выбраны из водорода, защитной группы азота, которая гидролизуется в кислых условиях или фталамидом;
X представляет собой фармацевтически приемлемый анион; и
Y представляет собой органический остаток, выбранный из
(i) N-содержащей группы формулы VIa
в которой
пунктирная линия вместе с атомом азота образует замещенный или незамещенный гетероарил и
X определен выше; или
(ii) N-содержащей группы формулы VIb
в которой
X определен выше; и
Rа и Rb независимо выбраны из замещенного или незамещенного алкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного алкенила, замещенного или незамещенного циклоалкенила, замещенного или незамещенного арила, замещенного или незамещенного аралкила или замещенного или незамещенного гетероциклила; или
Rа и Rb вместе с атомом азота, с которым они соединены, образуют замещенный или незамещенный гетероцикл;
или их смесей;
который включает
a) взаимодействие энантиомерно чистого соединения формулы IV
в которой R1 и R2 определены выше;
или их смесей;
с соединением формулы V
в которой R4 определен выше;
с получением по существу чистого стереоизомера соединения формулы III,
в которой R1, R2 и R4 определены выше;
или их смесей;
b) превращение указанного по существу чистого стереоизомера соединения формулы III или их смеси в по существу чистый стереоизомер соединения формулы II
в которой
R1, R2 и R4 определены выше;
R5 выбран из отрицательного заряда или R3, где R3 определен выше; и
Y представляет собой N-содержащий органический остаток, выбранный из
(i) когда R5 является отрицательным зарядом, Y представляет собой N-содержащий органический остаток формулы VIIa
в которой
пунктирная линия вместе с атомом азота образует замещенный или незамещенный гетероарил; или
(ii) когда R5 представляет собой R3, Y представляет собой N-содержащий органический остаток, выбранный из
(ii.a) N-содержащей группы формулы VIIb
в которой Ra и Rb определены выше; или
(ii.b) N-содержащий органический остаток формулы VIIc
в которой
пунктирная линия вместе с атомом азота образует замещенный или незамещенный гетероарил; и
Z представляет собой фармацевтически приемлемый анион;
или их смесей; и
c) взаимодействие указанного по существу чистого стереоизомера соединения формулы II или их смесей с кислотными средами, включающими кислоту формулы HX, в которой X определен так же, как и выше, с получением указанного по существу чистого стереоизомера соединения формулы I или их смесей.
Роль защитных групп азота, которые гидролизуются в кислых условиях (R2, R3 и/или R4), состоит в защите функциональности азота до стадии c) (превращения соединений формулы II в соединения формулы I путем взаимодействия указанного соединения формулы II с соединением формулы HX). Любая защитная группа азота, которая может защитить атом азота до стадии c), подходит для настоящего изобретения. Предпочтительные защитные группы азота, которые гидролизуются в кислых условиях, включают группы, которые могут гидролизоваться в ходе стадии c) с одновременным образованием соли или двойной соли, в результате чего получают соединение формулы I. Таким образом, в ходе стадии c) с атомов азота в молекуле снимается защита, и соль или двойная соль образуется в одной стадии синтеза. Однако согласно настоящему изобретению образование соли или двойной соли одновременно со снятием защиты с атомов азота не является существенным. Поэтому согласно варианту осуществления изобретения образование соли или двойной соли и снятие защиты с атомов азота могут потребовать более одной стадии.
Согласно предпочтительному варианту осуществления группы защиты азота, которые гидролизуются в кислых условиях, выбраны из карбаматов формулы -(O=)C-O-Ra, в которой Ra имеет то же значение, как и выше, в которой Ra предпочтительно представляет собой бензил, -C(CH3)3 или -CH2CH3; или сульфонат формулы -(O=)S(=O)-Ra, в которой Ra имеет то же значение, как и выше, в которой предпочтительно Ra представляет собой -CH3 или тозилат.
Другие защитные группы, которые гидролизуются в кислых условиях, известны квалифицированному специалисту; см. справочники, такие как Greene and Wuts "Protective Groups in Organic Synthesis", John Wiley & Sons, Inc., New York, 1999.
Когда, по меньшей мере, один из R2, R3 и R4 представляет собой фталамид, перед образованием соли или двойной соли необходимо провести дополнительную стадию (перед стадией c)), включающую восстановление или реакцию с гидразином (для более подробной информации по поводу удаления фталамидной группы см. Greene and Wuts "Protective Groups in Organic Synthesis", John Wiley & Sons, Inc., New York, 1999).
Исходное соединение формулы IV способа настоящего изобретения может находиться в форме энантиомерно чистого соединения (т.е. R или S) или в форме смеси энантиомеров (R и S), необязательно обогащенной одним из них. Используемое в настоящем описании понятие "смесь энантиомеров" включает любую смесь двух энантиомеров, в эквимолярных или неэквимолярных соотношениях, а также включает не только рацемические смеси указанных двух энантиомеров, но и смеси, обогащенные любым из указанных энантиомеров.
Когда соединение формулы IV находится в форме энантиомерно чистого соединения, вышеуказанная реакция может привести к получению двух продуктов (стереоизомеров), один из которых соответствует атаке с β-плоскости, а другой соответствует атаке с α-плоскости. В данном случае реакция показывает низкую стереоселективность, при этом из каждого энантиомера соединения формулы IV получают смесь двух возможных соединений (стереоизомеров).
Таким образом, согласно конкретному варианту осуществления соединение формулы IV находится в форме энантиомерно чистого соединения. Если в качестве исходного вещества используется S-изомер соединения формулы IV, в реакции образуется в основном смесь соединения формулы IIIa:
в которой R1, R2 и R4 определены выше; и
соединения формулы IIIb:
в которой R1, R2 и R4 определены выше.
Итак, когда используемый изомер соединения формулы IV представляет собой S-стереоизомер, в итоге обычно будет образовываться соединение формулы III в форме смеси соответствующих стереоизомеров формулы IIIa и IIIb. В случае необходимости указанное соединение формулы III в форме указанной смеси стереоизомеров может быть выделено обычными способами (например, на силикагеле, путем перекристаллизации и т.д.) с получением смеси IIIa и IIIb в эквимолярном или неэквимолярном соотношении. В качестве альтернативы, если необходимо, указанную смесь стереоизомеров формулы IIIa и IIIb можно обработать с помощью стандартных методов (например, с помощью перекристаллизации, хроматографии и т.д.) с разделением каждого стереоизомера и получением стереоизомеров формулы IIIa и IIIb в виде энантиомерно чистых соединений.
Кроме того, если в качестве исходного вещества используется R-изомер соединения формулы IV, в реакции образуется в основном смесь соединения формулы IIIc:
в которой R1, R2 и R4 определены выше;
и соединения формулы IIId:
в которой R1, R2 и R4 определены выше.
Итак, когда используемый изомер соединения формулы IV представляет собой R-стереоизомер, в итоге обычно будет образовываться соединение формулы III в форме смеси соответствующих стереоизомеров формулы IIIc и IIId. Как упомянуто выше, в случае необходимости указанное соединение формулы III в форме указанной смеси стереоизомеров может быть выделено обычными способами с получением смеси IIIc и IIId в эквимолярном или неэквимолярном соотношении, или, в качестве альтернативы, указанную смесь стереоизомеров можно обработать с помощью стандартных методов с разделением каждого стереоизомера и получением стереоизомеров формулы IIIc и IIId в виде энантиомерно чистых соединений.
Хотя это и может показаться недостатком, авторы настоящего изобретения обнаружили, что соединения в смеси, получаемой в итоге из реакции соединения формулы IV с соединением формулы V, могут быть легко разделены на соответствующие по существу чистые стереоизомеры соединения формулы III, т.е. IIIa, IIIb, IIIc или IIId. Это позволяет осуществить синтез по существу чистых стереоизомеров соединения формулы I, что является одним из аспектов настоящего изобретения.
Согласно другому конкретному варианту осуществления соединение формулы IV находится в форме смеси двух возможных энантиомеров (R или S), необязательно энантиомерно обогащенной одним из указанных энантиомеров. В таких случаях получаемое в результате соединение формулы III выбрано из смеси IIIa, IIIb, IIIc и IIId (в эквимолярном или неэквимолярном соотношении), смеси IIIa и IIIс в эквимолярном или неэквимолярном соотношении или смеси IIIb и IIId в эквимолярном или неэквимолярном соотношении.
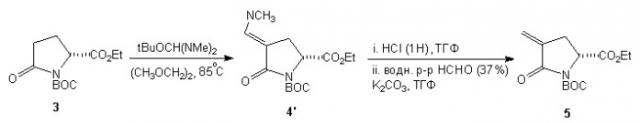
Соединение формулы IV может быть получено способами, известными из уровня техники. Например, один из способов синтеза, используемый авторами настоящего изобретения, описан на схеме 1. Глутаминовая кислота 1 (в данном случае D-глутаминовая кислота) может быть превращена в соединение формулы 2, как описано у Silverman, R.B.; Levy, M.A., J. Org. Chem. 1980, 45, 815. Вторая стадия включает защиту азота амидной группы с использованием известного способа (Flyn, D.L., et al., J. Org. Chem., 1983, 48, 2424) с получением соединения формулы 3. Затем две следующих стадии включают вначале замещение 2-пирролидона в 3-м положении диметиламинометиловой группой, в результате чего образуется соединение 4 [которое фактически является смесью двух диастереомеров, так как хиральный центр в 3 положении в способе не контролируют], а также кватернизацию при помощи MeI с последующим отщеплением, что приводит к получению соединения формулы 5 (соединение формулы IV, в котором R1 представляет собой -OEt, а R2 представляет собой BOC), что уже было описано в работе Panday, S.K.; Griffart-Brunel, D.; Langlois, N.; Tetrahedron Lett., 1994, 35, 6673. В данном случае полученное соединение формулы IV имеет R-конфигурацию. Если требовалось получить S-конфигурацию, в качестве исходного вещества использовали L-глутаминовую кислоту (так как в соответствии с общим представлением соединение 5 имеет ту же конфигурацию, что и исходная глутаминовая кислота).
Схема 1
Первый вариант вышеуказанного способа синтеза соединения 5 включает превращение глутаминовой кислоты 1 (в данном случае D-глутаминовой кислоты) в пироглутаминовую кислоту формулы 1', как описано в работе Lennox, J.R.; Turner, S.C.; Rapoport, H. J. Org. Chem. 2001, 66, 7078-7083. Затем указанная пироглутаминовая кислота формулы 1' превращается в описанное выше соединение формулы 2 путем этерификации в присутствии этанола и SOCl2 (см. схему 2).
Схема 2
Второй вариант вышеуказанного способа синтеза соединения 5 включает превращение соединения формулы 2 в соединение формулы 3 с помощью DMAP в качестве основания и ацетонитрила (MeCN) в качестве растворителя.
Третий вариант вышеуказанного способа синтеза соединения 5 включает превращение соединения формулы 3 в соединение формулы 4' посредством реакции с tBuOCH(NMe2)2 (реактив Бредерека). Указанное соединение формулы 4' превращается в соединение формулы 5 в двух последовательных стадиях. Сначала посредством реакции соединения формулы 4' с разбавленной HCl, затем реакции полученного соединения с водным раствором HCHO (37%) в присутствии неорганического основания, как описано в WO 2004039314 (см. схему 3).
Схема 3
Существует множество реагентов, позволяющих получить азиридиновое кольцо, известных квалифицированному специалисту. Однако выбор реагента для синтеза спиро-азиридинов из углерод-углеродных двойных связей довольно труден. Например, использование хлорамина-T в присутствии HBr/H2О2 (L.J. Suman; B. S. Sharma; S. Bir. Tetrahedron Letters, 2004, 45, 8731) приводило не к желательному азиридину, а хлорпроизводным следующей общей формулы:
После ряда экспериментов установили, что наиболее подходящим реагентом для реакции являлся бензилиодинан формулы V. Согласно конкретному варианту осуществления R4 выбран из -(O=)C-O-C(CH3)3, -(O=)C-O-CH2CH3, -(O=)S(=O)-тозила или фталамида. В предпочтительном варианте осуществления соединение формулы V является N-тозилиминобензилиодинаном (Baron E.; O'Brien P.; Towers T.D. Tetrahedron Lett., 2002, 43, 723), который можно синтезировать по методике, описанной у Gillepia, K., Synthetic Comunn. 2001, 123.
Взаимодействие энантиомерно чистого соединения формулы IV или их смесей с соединением формулы V, в результате которого образуется по существу чистый стереоизомер соединения формулы III или их смеси, может быть проведено, в случае необходимости, в присутствии катализатора, предпочтительно катализатора на основе меди, более предпочтительно выбранного из Cu(ft)2 или Cu(acac)2, где "ft" представляет собой фталоцианин, а "acac" - ацетоацетат. Более подробную информацию относительно катализаторов и условий см. у Baron, E.; O'Brien, P.; Towers, T.D. Tetrahedron Lett., 2002, 43, 723, и S.L. Jain, B. Sain, Journal of molecular catalysis A: Chemical, 2003, 195, 283. Указанная реакция обычно выполняется в подходящем органическом растворителе при подходящей температуре, предпочтительно при температуре от 0 до 100°C. Хотя на практике в указанной реакции может использоваться любой подходящий органический растворитель (например, ацетонитрил, диметилформамид и т.д.), в конкретном варианте осуществления, когда соединение формулы IV п