Тетрагидрофуро(3,2-b)пиррол-3-оны в качестве ингибиторов катепсина к
Иллюстрации
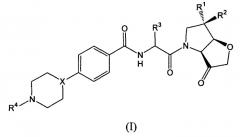
Показать всеНастоящее изобретение относится к соединениям формулы (I)
и их фармацевтически приемлемым солям, где Х представляет собой СН или N; один из R1 и R2 представляет собой Н и другой выбран из OR6, SR6, Me, Et и SOR8; R3 выбран из трет-бутилметила, втор-бутила, трет-бутила, циклопентила и циклогексила; R4 представляет собой С1-8алкил, необязательно замещенный одной С1-6алкоксигруппой; или С3-8циклоалкил, необязательно замещенный одной С1-6алкоксигруппой; R6 представляет собой С1-8алкила; и R8 представляет собой С1-8алкил, а также к фармацевтическим композициям на их основе и их применению в качестве ингибиторов катепсина К и для анализа указанных выше ингибиторов катепсина К. Предложены новые биологически активные соединения и их использование в медицине и фармацевтике. 3 н. и 11 з.п. ф-лы, 79 пр., 2 табл.
Реферат
Настоящее изобретение относится к соединениям, которые являются ингибиторами цистеинпротеиназ, фармацевтическим композициям, содержащим указанные соединения, и их применению в терапии. Более конкретно, но не исключительно, изобретение относится к соединениям, которые являются ингибиторами катепсина К и родственных цистеинпротеиназ клана СА. Такие соединения являются особенно применимыми для терапевтических лечений in vivo заболеваний, в которых принимает участие цистеинпротеиназа.
Уровень техники
Протеиназы образуют значительную группу биологических молекул, которые к настоящему времени составляют приблизительно 2% всех генных продуктов, идентифицированных после анализа нескольких завершенных программ секвенирования геномов. Протеиназы развивались для участия в огромном диапазоне биологических процессов, опосредуя их действие расщеплением амидных связей пептидов в многочисленных белках, найденных в природе. Это гидролитическое действие проводится сначала распознаванием, затем связыванием с конкретными трехмерными электронными поверхностями, обнаруживаемыми белком, который выравнивает связь для расщепления точно в каталитическом центре протеиназы. Каталитический гидролиз затем начинается посредством нуклеофильной атаки амидной связи, которую нужно расщепить либо путем аминокислотной боковой цепи самой протеиназы, либо посредством действия молекулы воды, которая связывается с протеиназой или активируется протеиназой. Протеиназы, в которых атакующим нуклеофилом является тиольная боковая цепь остатка Cys, известны как цистеинпротеиназы. Общая классификация «цистеинпротеиназы» содержит много членов, найденных в широком диапазоне организмов от вирусов, бактерий, простейших, растений и грибов до млекопитающих.
Катепсин К и в действительности многие другие крестовидные протеиназы принадлежат к семейству подобных папаину CAC1. Цистеинпротеиназы классифицируют на «кланы» на основе сходства в трехмерной структуре или консервативного расположения каталитических остатков в основной последовательности протеиназы. Кроме того, «клан» можно дополнительно классифицировать на «семейства», в которых каждая протеиназа имеет статистически значимое родство с другими членами при сравнении частей аминокислотной последовательности, которые составляют части, ответственные за активность протеиназы (см. Barrett, A.J et al., in “Handbook of Proteolytic Enzymes”, Eds. Barrett, A. J., Rawlings, N. D., and Woessner, J. F. Publ. Academic Press, 1998, for a thorough discussion).
На сегодняшний день цистеинпротеиназы классифицировали на пять кланов, СА, СВ, СС, CD и СЕ (Barrett, A. J. et al., 1998). Протеиназа из тропического фрукта папайи «папаин» образует основу клана СА, который в настоящее время содержит свыше 80 определенных и полных вводов данных в различные базы данных последовательностей со многими более ожидаемыми вводами данных из современных попыток секвенирования генома. Протеиназы клана СА/семейство С1 предположительно участвуют во многих функциях housekeeping (неспецифические физиологические клеточные функции) и процессах заболеваний, например, протеиназы человека, такие как катепсин К (остеопороз, остеоартрит), катепсин S (рассеянный склероз, ревматоидный артрит, аутоиммунные нарушения), катепсин L (метастазы), катепсин В (метастазы, артрит), катепсин F (процессирование антигена), катепсин V (отбор Т-клеток), дипептидилпептидаза I (активация гранулоцитной сериновой протеазы) или паразитарные протеиназы, такие как фальсипаин (паразит малярии (Plasmodium falciparum) и круципаин (инфекция Trypanosoma cruzi). Недавно бактериальную протеиназу, стафилопаин (инфекция S. aureus), также ориентировочно отнесли к клану СА.
Рентгеновские кристаллографические структуры являются пригодными для ряда указанных выше протеиназ в комплексе с рядом ингибиторов, например, папаина (вводы PDB, 1pad, 1pe6, 1pip, 1pop, 4pad, 5pad, 6pad, 1ppp, 1the, 1csb, 1hus), катепсина К (1au0, 1au2, 1au3, 1au4, 1atk, 1mem, 1bgo, 1ayw, 1ayu, 1n16, ln1j, 1q6k, 1snk, 1tu6), катепсина L (1cs8, 1mhw), катепсина S (1glo, 1ms6, 1npz), катепсина V (1fh0), дипептидилпептидазы I (1jgp, 1k3b), катепсина В (1gmy, 1csb), катепсина F (1m6d), крузаина (рекомбинантная форма крузипаина, см. Eakin, A. E. et al., 268(9), 6115-6118, 1993) (1ewp, 1aim, 2aim, 1F29, 1F2A, 1F2B, 1F2C), стафилопаина (1cv8). Каждая из структур проявляет сходную общую топологию активного центра, как можно было ожидать согласно их классификации «клана» и «семейства», и такое структурное сходство служит примером одного аспекта затруднений, связанных с открытием селективного ингибитора катепсина К, подходящего для применения при лечении людей. Однако тонкие различия в терминах глубины и перепутанной формы бороздки активного центра каждой протеиназы САС1 являются очевидными и их можно использовать для разработки селективного ингибитора. Кроме того, многие из современных комплексов ингибиторов (на основе субстрата) протеиназ семейства САС1 обнаруживают ряд консервативных водородных связей между ингибитором и каркасом протеиназы, которые значительно способствуют активности ингибитора. В первую очередь, бидентатная водородная связь наблюдается между Gly66(С=О) протеиназы/N-H ингибитора и Gly66(NH) протеиназы/(C=O) ингибитора, где (С=О) и (NH) ингибитора являются частями аминокислотного остатка NHCHRCO, который является составной частью элемента связывания субсайта S2 в ингибиторе (см. Berger, A. and Schecter, I. Philos. Trans. R. Soc. Lond. [Biol.], 257, 249-264, 1970 для описания номенклатуры центра связывания протеиназы). Часто наблюдают дополнительную водородную связь между основной цепью (С=О) аспарагина или аспарагиновой кислоты протеиназы (158-163, номер остатков изменяется в зависимости от протеиназы) и (N-H) ингибитора, где (N-H) ингибитора является частью элемента связывания субсайта S1 в ингибиторе. Так, мотив X-NHCHRCO-NH-Y широко наблюдают среди ингибиторов (на основе субстратов) известного уровня протеиназ САС1.
Считается, что катепсин К является важным в заболеваниях, включающих избыточную потерю массы кости и хряща. Кость состоит из белкового матрикса, включающего кристаллы гидроксиапатита. Около 90% структурного белка матрикса является коллагеном типа I, причем остальная часть включает различные неколлагеновые белки, такие как остеокальцин, протеогликаны, остеоронтин, остеонектин, тромбоспондин, фибронектин и костный сиалопротеин.
Скелетная кость не является статической структурой, но непрерывно подвергается циклу резорбции и восполнения кости. Резорбция кости выполняется остеокластами, которые являются многоядерными клетками гемопоэтической линии. Остеокласты прилипают к поверхности кости и образуют плотно герметизирующую зону. Мембрана на апикальной поверхности остеокластов складывается так, чтобы создать закрытый внеклеточный компартмент между остеокластом и костной поверхностью, которая подкисляется протонными насосами в остеокластной мембране. Протеолитические ферменты секретируются в компартмент из остеокласта. Высокая кислотность в компартменте вызывает растворение гидроксиапатита у поверхности кости, и протеолитические ферменты разлагают белковый матрикс, вызывая образование полости резорбции. После резорбции кости остеобласты продуцируют новый белковый матрикс, который затем минерализуется.
При патологических состояниях, таких как остеопороз и болезнь Педжета, цикл резорбции и восполнения кости нарушается, приводя к результирующему разрежению кости с каждым циклом. Это приводит к ослаблению кости и, следовательно, к повышенному риску перелома кости.
Катепсин К экспрессируется при высоком уровне в остеокластах и поэтому считается важным фактором для резорбции костей. Поэтому селективное ингибирование катепсина К, по-видимому, является эффективным при лечении заболеваний, включающих избыточное разрежение костей. Они включают остеопороз, заболевания десен, такие как гингивит и периодонтит, болезнь Педжета, гиперкальциемию злокачественного образования и метаболическое костное заболевание.
Помимо остеокластов высокие уровни катепсина К обнаружены также в хондрокластах синовиальной оболочки остеоартритных пациентов. Поэтому, по-видимому, ингибиторы катепсина К будут иметь применение при лечении заболеваний, включающих разрушение матрикса или хряща, в частности остеоартрита и ревматоидного артрита.
Повышенные уровни катепсина К обнаруживают также в метастатических опухолевых клетках, что позволяет предположить, что ингибиторы катепсина К могут быть также применимыми для лечения некоторых опухолевых заболеваний.
В известном уровне техники разработка ингибиторов цистеинпротеиназы для применения при лечения людей недавно стала областью интенсивной активности (см., например, Deaton, D. N. and Kumar, S., Prog. Med. Chem. 42, 245-375, 2004; Bromme, D. and Kaleta, J., Curr. Pharm. Des., 8, 1639-1658, 2002; Kim, W. and Kang, K., Expert Opin. Ther. Patents, 12(3), 419-432, 2002; Leung-Toung, R. et al. Curr. Med. Chem., 9, 979-1002, 2002; Lecaille, F. et al., Chem. Rev., 102, 4459-4488, 2002; Hernandez, A. A. and Roush, W. R., Curr. Opin. Chem. Biol., 6, 459-465, 2002). Что касается членов семейства САС1, особый акцент был сделан на разработку ингибиторов катепсинов человека, особенно катепсина К (остеопороз), катепсина S (аутоиммунные заболевания), катепсина L (метастазы), катепсина В (метастазы, артрит), катепсина F (процессирование антигена), катепсина V (отбор Т-клеток) и дипептидилпептидазы I (активация гранулоцитной сериновой протеиназы) посредством применения пептидных и пептидомиметических нитрилов (см., например, WO-A-03041649, WO-A-03037892, WO-A-03029200, WO-A-02051983, WO-A-02020485, US-A-20020086996, WO-A-01096285, WO-A-0109910, WO-A-0051998, WO-A-0119816, WO-A-9924460, WO-A-0049008, WO-A-0048992, WO-A-0049007, WO-A-0130772, WO-A-0055125, WO-A-0055126, WO-A-0119808, WO-A-0149288, WO-A-0147886), линейных и циклических пептидных и пептидомиметических кетонов (см. например, Veber, D. F. and Thompson, S. K., Curr. Opin. Drug Discovery Dev., 3(4), 362-369, 2000, WO-A-02092563, WO-A-02017924, WO-A-01095911, WO-A-0170232, WO-A-0178734, WO-A-0009653, WO-A-0069855, WO-A-0029408, WO-A-0134153 до WO-A-0134160, WO-A-0029408, WO-A-9964399, WO-A-9805336, WO-A-9850533), кетогетероциклов (см., например, WO-A-02080920, WO-A-03042197, WO-A- WO-A-03024924, WO-A-0055144, WO-A-0055124), монобактамов (см., например, WO-A-0059881, WO-A-9948911, WO-A-0109169), α-кетоамидов (см., например, WO-A-03013518), цианоамидов (WO-A-01077073, WO-A-01068645), дигидропиримидинов (см., например, WO-A-02032879) и цианоаминопиримидинов (см., например, WO-A-03020278, WO-A-03020721).
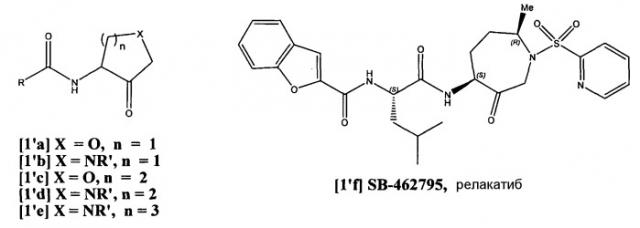
В известном уровне техники описаны сильнодействующие in vitro ингибиторы, но также подчеркивались большие трудности в разработке терапевтических ингибиторов для людей. Например, в WO-A-9850533 и WO-A-0029408 описаны соединения, которые можно называть циклическими кетонами (например, 1'a-f) и которые являются ингибиторами цистеинпротеиназ, с особым упоминанием в отношении протеиназ семейства папаина, и в качестве наиболее предпочтительного варианта осуществления, катепсина К. В WO-A-9850533 описаны соединения, затем подробно описанные в литературе как сильнодействующие ингибиторы катепсина К с хорошей пероральной биологической доступностью (Witherington, J., “Tetrahydrofurans as Selective Cathepsin K Inhibitors”, RSC meeting, Burlington House, London, 1999). Описано, что соединения WO-A-9850533 связываются с катепсином К через образование обратимой ковалентной связи между тетрагидрофуранкарбонилом и каталитическим остатком цистеина активного центра (Witherington, J., 1999). Кроме того, такие же циклические кетоновые соединения описаны в WO-A-9953039 как часть обширного описания ингибиторов цистеинпротеиназ, связанных с паразитарными болезнями, с особым указанием на лечение малярии ингибированием фальципаина.
Циклические ингибиторы катепсина К известного уровня техники
Первые циклические ингибиторы GSK были основаны на сильнодействующих, селективных и обратимых 3-амидотетрагидрофуран-4-онах [1'a], 3-амидопирролидин-4-онах [1'b], 4-амидотетрагидрофуран-3-онах [1'c], 4-амидопиперидин-3-онах [1'd] и 4-амидоазепан-3-онах [1'e, 1'f] (показаны выше) [см. (а) публикацию Marquis, R. W. et al., J. Med. Chem. 2001, 44, 725 и цитированные в ней ссылки; (b) публикацию Marquis, R. W. et al., J. Med. Chem. 2001, 44, 1380 и цитированные в ней ссылки; (c) Yamashita, D. S. et al., J. Med. Chem. 2006, 49(5), 1597-1612].
Последующие исследования показали, что циклические кетоны [1'], в частности аналоги с пятичленным кольцом [1'a] и [1'b], испытывали конфигурационную нестабильность вследствие легкой эпимеризации в центре, находящемся в α-положении к кетону [Marquis, R. W. et al., J. Med. Chem. 2001, 44, 1380; Fenwick, A. E. et al., J. Bioorg. Med. Chem. Lett. 2001, 11, 199; WO 00/69855]. Это препятствовало преклинической оптимизации ингибиторов формул [1'a-d] и привело к разработке конфигурационно более стабильного ряда азепанона [1'e], обеспечивающего создание клинического кандидата в ингибиторы катепсина К ралакатиба [1'f]. Однако литературные данные явно указывают, что азепаноны все же склонны к эпимеризации, и описано, что релакатиб [1'f'] действительно существует в виде термодинамической смеси 9:1 4-S- и 4-R-изомеров [Yamashita, D. S. et al., J. Med. Chem., 2006, 49(5), 1597-1612]. В качестве альтернативы подхода с расширением кольца, алкилирование α-атома углерода устраняет способность циклических кетонов [1'] подвергаться α-енолизации и поэтому приводит к конфигурационной стабильности. Однако исследования показали, что α-метилирование в системе 3-амидопирролидин-4-она [1'b] приводит к существенной потере в активности против катепсина К от Ki,app ≈ 0,18 до 50 нМ.
Считается, что циклические кетоновые соединения WO-A-0069855 являются улучшенными относительно соединений WO-A-9850533 вследствие присутствия β-заместителя на системе циклического кетона, который обеспечивает повышенную хиральную стабильность α-атома углерода системы циклического кетона. Однако соединения WO-A-0069855 и фактически соединения WO-A-9850533 показывают необходимость присутствия потенциального связывающего водород мотива X-NHCHRCO-NH-Y, который широко наблюдается среди ингибиторов на основе субстрата известного уровня техники протеиназ САС1.
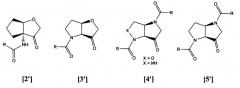
В более недавних исследованиях были изучены 5,5-бициклические системы в качестве ингибиторов протеиназ САС1, например, бициклические кетоны, N-(3-оксогексагидроциклопента[b]фуран-3а-ил)ациламиды [2'], [(a) Quibell, M.; Ramjee, M. K., WO 02/57246; (b) Watts, J. et al., Bioorg. Med. Chem. 2004, 12, 2903-2925], структуры на основе тетрагидрофуро[3,2-b]пиррол-3-она [3'] [(a) Quibell, M. WO02/57270; (b) Quibell, M. et al., Bioorg. Med. Chem., 2004, 12, 5689-5710], структуры на основе цис-6-оксогексагидро-2-окса-l,4-диазапенталена и цис-6-оксогексагидропирроло[3,2-c]пиразола [4'] [Wang, Y. et al., Bioorg. Med. Chem. Lett., 2005, 15, 1327-1331], и структуры на основе цис-гексагидропирроло[3,2-b]пиррол-3-она [5'] [a) Quibell, M. WO04/07501; (b) Quibell, M. et al., Bioorg. Med. Chem., 2005, 13, 609-625].
5,5-бициклические ингибиторы цистеинилпротеиназ САС1
Исследования показали, что вышеуказанные 5,5-бициклические системы проявляют перспективную активность в качестве ингибиторов ряда терапевтически привлекательных мишеней-цистеинилпротеиназ САС1 млекопитающих и паразитов. Кроме того, соединения 5,5-бициклического ряда являются хирально стабильными благодаря заметному энергетическому предпочтению для цис-конденсированной, а не транс-конденсированной геометрии. Такая хиральная стабильность обеспечивает основной успех по сравнению с моноциклическими системами, которые часто проявляют ограниченный потенциал для преклинической разработки вследствие хиральной нестабильности.
В заявках РСТ WO-A-02057270 и WO-A-04007501 описаны бициклические соединения, в которых хиральность α-аминокетона стабилизирована (для обзора энергетических расчетов в конденсированных циклических системах см. (a) Toromanoff, E. Tetrahedron Report No 96, 36, 2809-2931, 1980; (b) Eliel, E. L. et al. Stereochemistry of Organic Compounds, Wiley: New York, 1-1267, 1994). Эти соединения не содержат мотив X-NHCHRCO-NH-Y и все же такие соединения являются очень сильнодействующими ингибиторами для всего широкого ряда цистеинпротеиназ САС1. В частности, некоторые из соединений являются сильнодействующими и селективными ингибиторами ряда протеиназ САС1 млекопитающих и паразитов.
Совсем недавно Quibell, M. et al. (Bioorg. Med. Chem. 12, 5689-5710, 2004) описали два сильнодействующих и селективных ингибитора катепсина К, имеющих ядро тетрагидрофуро[3,2-b]пиррол-3-она вместе с данными активности in vitro и селективности in vitro. Были описаны дополнительные кинетические параметры, такие как скорости ассоциации (kon) и диссоциации (koff) фермента, а также основные физиохимические параметры, такие как стабильность в плазме и микросомах, измерения Сасо-2-проницаемости и LogD (pH7,4).
Авторы настоящего изобретения теперь обнаружили небольшую группу тетрагидрофуро[3,2-b]пиррол-3-онов, которые проявляют сильное ингибирование in vitro катепсина К человека. Заявленные соединения преимущественно проявляют также подходящие фармакокинетические свойства и очень предпочтительная подгруппа проявляет сильную активность против клеток-остеокластов человека.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Первый аспект изобретения относится к соединению формулы (I) или его фармацевтически приемлемой соли, гидрату, комплексу или пролекарству
где
X представляет собой CH или N;
один из R1 и R2 представляет собой H и другой выбран из OR6, SR6, NR6R7, N3, Ме, Et, CF3, SOR8 и SO2R8;
R3 выбран из трет-бутилметила, изопропилметила, втор-бутила, трет-бутила, циклопентила и циклогексила;
R4 представляет собой необязательно замещенный С1-8алкил или необязательно замещенный С3-8циклоалкил;
R6 и R7, каждый независимо, выбраны из Н, С1-8алкила и С3-8циклоалкила или R6 и R7 связываются вместе с атомом азота, к которому они присоединены, с образованием циклической группы; и
R8 представляет собой С1-8алкил или С3-8циклоалкил.
Как указано выше, соединения формулы (I) проявляют неожиданно высокую эффективность в отношении катепсина К человека. Действительно, все соединения, полученные до сих пор, проявляют сильное ингибирование in vitro катепсина К человека с Ki<50 нМ. Кроме того, предпочтительные соединения формулы (I) проявляют также желательные фармакокинетические свойства и сильную активность, противодействующую разновидности остеокластов, в противоположность многим ингибиторам катепсина К, известным в данной области. Кроме того, предпочтительные соединения формулы (I) проявляют также неожиданно хорошую стабильность в анализах плазмы и микросом.
Второй аспект изобретения относится к фармацевтической или ветеринарной композиции, содержащей соединение формулы (I) и фармацевтически приемлемый или ветеринарно приемлемый разбавитель, эксципиент и/или носитель.
Третий аспект изобретения относится к способу получения фармацевтической или ветеринарной композиции, указываемой выше, причем такой способ включает смешивание соединения изобретения с фармацевтически приемлемым или ветеринарно приемлемым разбавителем, эксципиентом и/или носителем.
Четвертый аспект изобретения относится к соединениям формулы (I) для применения в терапии.
Пятый аспект изобретения относится к применению соединения формулы (I) при получении лекарственного средства для лечения заболевания, выбранного из остеопороза, болезни Педжета, болезни Шагаса, малярии, заболеваний десен, гиперкальциемии, метаболического заболевания костей, заболеваний, включающих разрушение матрикса или хряща, и костных раковых нарушений, таких как метастазы костей и связанная с ними боль.
Шестой аспект изобретения относится к способу ингибирования цистеинпротеиназы в клетке, причем указанный способ включает контактирование указанной клетки с соединением формулы (I).
Седьмой аспект изобретения относится к способу ингибирования цистеинпротеиназы у субъекта, причем указанный способ включает введение субъекту фармакологически эффективного количества соединения формулы (I).
Восьмой аспект изобретения относится к способу лечения заболевания, выбранного из остеопороза, болезни Педжета, болезни Шагаса, малярии, заболеваний десен, гиперкальциемии, метаболического заболевания костей, заболеваний, включающих разрушение матрикса или хряща, и костных раковых нарушений, таких как метастазы костей и связанная с ними боль, у субъекта, причем указанный способ включает введение субъекту фармакологически эффективного количества соединения формулы (I).
Девятый аспект изобретения относится к применению соединения согласно изобретению в анализе для идентификации дополнительных соединений-кандидатов, способных ингибировать одну или несколько цистеинпротеаз.
Десятый аспект изобретения относится к применению соединения формулы (I) при подтверждении правильности известной или предполагаемой цистеинпротеазы в качестве терапевтической мишени.
Одиннадцатый аспект изобретения относится к способу получения соединения формулы (I).
ПОДРОБНОЕ ОПИСАНИЕ
Термин «алкил», применяемый здесь, включает стабильные неразветвленные или разветвленные алифатические углеродные цепи, которые могут быть необязательно замещены. Предпочтительные примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, пентил, изопентил, гексил, гептил и любые их простые изомеры. Подходящие заместители включают, например, одну или несколько групп С1-6алкокси, OH, COOH, COOMe, NH2, NMe2, NHMe, NO2, CN, CF3 и/или галоген. Кроме того, когда алкильная группа содержит два или более соседних атомов углерода, может присутствовать алкеновая группа (-СН=СН-) или алкиновая группа
(-С≡С-). Кроме того, алкильная группа может необязательно содержать один или несколько гетероатомов, например, с образованием простых эфиров, простых тиоэфиров, сульфонов, сульфонамидов, замещенных аминов, амидинов, гуанидинов, карбоновых кислот, карбоксамидов. Если гетероатом расположен у конца цепи, то он подходящим образом замещен одним или двумя атомами водорода. Например, группу CH3-CH2-O-CH2-CH2- определяют в термине «алкил» как С4алкил, который содержит в центральном положении гетероатом, тогда как группу CH3-CH2-CH2-CH2- определяют в термине «алкил» как незамещенный С4алкил.
Предпочтительно, алкильная группа представляет собой С1-8алкильную группу, более предпочтительно, С1-6алкильную группу, еще более предпочтительно, С1-4алкильную группу.
Применяемый здесь термин «циклоалкил» относится к циклической алкильной группе (т.е. карбоциклическому кольцу), которая может быть замещенной (моно- или поли-) или незамещенной. Подходящие заместители включают, например, одну или несколько групп С1-6алкил, С1-6алкокси, OH, COOH, COOMe, NH2, NMe2, NHMe, NO2, CN, CF3 и/или галоген. Предпочтительно, циклоалкильная группа представляет собой С3-8циклоалкильную группу, более предпочтительно, С3-6циклоалкильную группу, еще более предпочтительно, С3-4циклоалкильную группу. Примеры включают циклопропил, циклобутил, циклопентил, циклогексил и тому подобное. Кроме того, само карбоциклическое кольцо может необязательно содержать один или несколько гетероатомов, например, с образованием гетероциклоалкильной группы, такой как тетрагидрофуран, пирролидин, пиперидин, пиперазин или морфолин.
Термин «галоген», применяемый здесь, включает F, Cl, Br, I.
«Гетероатом», применяемый здесь, включает О, S, P и N, более предпочтительно, О, S и N.
Настоящее изобретение включает все соли, гидраты, сольваты, комплексы и пролекарства соединений данного изобретения. Предполагается, что термин «соединение» включает все такие соли, гидраты, сольваты, комплексы и пролекарства, если контекст не требует другого значения.
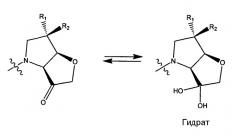
В частности, специалисту в данной области должно быть понятно, что кетоновая группа бициклического кольца соединений формулы (I) может существовать в альтернативных формах, таких как гидрат (как показано ниже), и изобретение распространяется на все такие альтернативные формы.
Аббревиатуры и символы, обычно применяемые в области пептидов и химической области, применяют здесь для описания соединений настоящего изобретения по общим инструкциям, представленным IUPAC-IUB Joint Commission on Biochemical Nomenclature, как описано в Eur. J. Biochem., 158, 9-, 1984. Соединения формулы (I) и промежуточные продукты и исходные соединения, применяемые при их получении, называют согласно правилам номенклатуры IUPAC, в которой характерные группы имеют уменьшающийся приоритет для перечисления в качестве основной группы.
В одном предпочтительном варианте осуществления соединение изобретения имеет формулу Ia
где Х, R1, R2, R3 и R4 имеют значения, указанные выше.
В более предпочтительном варианте осуществления R3 представляет собой циклогексил, так что центральной частью является аминокислота (S)-циклогексилглицин.
В одном очень предпочтительном варианте осуществления R3 представляет собой циклопентил, так что центральной частью является аминокислота (S)-циклопентилглицин.
В одном предпочтительном варианте осуществления R3 представляет собой изопропилметил, так что центральной частью является аминокислота (S)-лейцин.
В одном предпочтительном варианте осуществления R3 представляет собой трет-бутил, так что центральной частью является аминокислота (S)-трет-бутилглицин.
В другом предпочтительном варианте осуществления R3 представляет собой втор-бутил с S-конфигурацией, так что центральной частью является аминокислота (2S,3S)-изолейцин.
В другом предпочтительном варианте осуществления R3 представляет собой трет-бутилметил, так что центральной частью является аминокислота (S)-трет-бутилаланин.
В одном очень предпочтительном варианте осуществления R3 представляет собой трет-бутилметил, так что центральной частью является аминокислота (S)-трет-бутилаланин.
В одном предпочтительном варианте осуществления Х представляет собой СН.
В другом предпочтительном варианте осуществления Х представляет собой N.
В одном предпочтительном варианте осуществления R4 представляет собой незамещенную С3-6циклоалкильную группу.
В одном предпочтительном варианте осуществления R4 представляет собой С1-6алкильную группу, необязательно замещенную одной или несколькими С1-6алкоксигруппами.
Еще более предпочтительно, R4 выбран из метила, этила, н-пропила, изопропила, циклопропила, н-бутила, втор-бутила, изобутила, трет-бутила, циклобутила и 2-метоксиэтила.
Даже еще более предпочтительно, R4 выбран из метила, этила, н-пропила, изопропила, циклопропила, циклобутила и 2-метоксиэтила.
В одном предпочтительном варианте осуществления R3 выбран из трет-бутилметила, втор-бутила, трет-бутила, циклопентила и циклогексила.
В другом предпочтительном варианте осуществления R3 представляет собой циклопентил или циклогексил.
В одном предпочтительном варианте осуществления R6 и R7, каждый независимо, представляют собой Н, С1-4алкил или С3-6циклоалкил.
В более предпочтительном варианте осуществления R6 и R7, каждый независимо, выбраны из Н, метила, этила, изопропила, н-пропила, изобутила, втор-бутила, трет-бутила, циклопропила и циклобутила.
В другом предпочтительном варианте осуществления R6 и R7 связаны с образованием алкиленовой группы.
где р равно 1, 2, 3 или 4.
В одном предпочтительном варианте осуществления один из R1 и R2 представляет собой Н и другой выбран из Me, Et, CF3, OH, OMe, OEt, OnPr, OiPr, O-циклопропила, O-циклобутила, SH, SMe, SEt, SnPr, SiPr, S-циклопропила, S-циклобутила, NH2, NHMe, NHEt, NHnPr, NHiPr, NH-циклопропила, NH-циклобутила, NMe2, N3, SOMe, SOEt, SOnPr, SOiPr, SO-циклопропила, SO-циклобутила, SO2Me, SO2Et, SO2 nPr, SO2 iPr, SO2-циклопропила, SO2-циклобутила и
Более предпочтительно, один из R1 и R2 представляет собой Н и другой выбран из OH, OMe, OEt, OnPr, OiPr, O-циклопропила, O-циклобутила, SH, SMe, SEt, SnPr, SiPr, S-циклопропила, S-циклобутила, NH2, NHMe, NHEt, NHnPr, NHiPr, NH-циклопропила, NH-циклобутила, NMe2, N3, SOMe, SOEt, SOnPr, SOiPr, SO-циклопропила, SO-циклобутила, SO2Me, SO2Et, SO2 nPr, SO2 iPr, SO2-циклопропила, SO2-циклобутила и
Еще более предпочтительно, один из R1 и R2 представляет собой Н и другой выбран из OH, OMe, OEt, OnPr, OiPr, O-циклопропила, O-циклобутила, SH, SMe, SEt, SnPr, SiPr, S-циклопропила, S-циклобутила, NH2, NHMe, NHEt, NHnPr, NHiPr, NMe2 и N3.
В одном очень предпочтительном варианте осуществления
R1 представляет собой OH, OMe, OEt, SMe, NH2, NHMe, NMe2 или N3 и R2 представляет собой H или
R2 представляет собой OH, OMe, OEt, SMe, NH2, NHMe, NMe2 или N3 и R1 представляет собой H.
В еще более предпочтительном варианте осуществления
R1 представляет собой OH, OMe, OEt, NH2, NHMe, SMe или N3 и R2 представляет собой H или
R2 представляет собой OH, OMe, NH2 или N3 и R1 представляет собой H.
В одном очень предпочтительном варианте осуществления соединение выбрано из
N-((S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-4,4-диметил-1-оксопентан-2-ил)-4-(4-пропилпиперазин-1-ил)бензамида
N-((S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-4,4-диметил-1-оксопентан-2-ил)-4-(4-изопропилпиперазин-1-ил)бензамида
4-(4-циклопропилпиперазин-1-ил)-N-((S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-4,4-диметил-1-оксопентан-2-ил)бензамида
4-(4-циклобутилпиперазин-1-ил)-N-((S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-4,4-диметил-1-оксопентан-2-ил)бензамида
4-(1-циклопропилпиперидин-4-ил)-N-((S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-4,4-диметил-1-оксопентан-2-ил)бензамида
4-(1-циклобутилпиперидин-4-ил)-N-((S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-4,4-диметил-1-оксопентан-2-ил)бензамида
N-((S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-4-метил-1-оксопентан-2-ил)-4-(4-пропилпиперазин-1-ил)бензамида
N-((S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-4-метил-1-оксопентан-2-ил)-4-(4-изопропилпиперазин-1-ил)бензамида
4-(4-циклопропилпиперазин-1-ил)-N-((S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-4-метил-1-оксопентан-2-ил)бензамида
4-(4-циклобутилпиперазин-1-ил)-N-((S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-4-метил-1-оксопентан-2-ил)бензамида
4-(1-циклопропилпиперидин-4-ил)-N-((S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-4-метил-1-окспентан-2-ил)бензамида
4-(1-циклобутилпиперидин-4-ил)-N-((S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-4-метил-1-оксопентан-2-ил)бензамида
4-(4-этилпиперазин-1-ил)-N-((2S,3S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-3-метил-1-оксопентан-2-ил)бензамида
N-((2S,3S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-3-метил-1-оксопентан-2-ил)-4-(4-пропилпиперазин-1-ил)бензамида
N-((2S,3S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-3-метил-1-оксопентан-2-ил)-4-(4-изопропилпиперазин-1-ил)бензамида
4-(4-циклопропилпиперазин-1-ил)-N-((2S,3S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-3-метил-1-оксопентан-2-ил)бензамид
4-(4-циклобутилпиперазин-1-ил)-N-((2S,3S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-3-метил-1-оксопентан-2-ил)бензамида
4-(1-циклопропилпиперидин-4-ил)-N-((2S,3S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-3-метил-1-оксопентан-2-ил)бензамида
4-(1-циклобутилпиперидин-4-ил)-N-((2S,3S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-3-метил-1-оксопентан-2-ил)бензамида
4-(4-этилпиперазин-1-ил)-N-((S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-3,3-диметил-1-оксобутан-2-ил)бензамида
N-((S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-3,3-диметил-1-оксобутан-2-ил)-4-(4-пропилпиперазин-1-ил)бензамида
N-((S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-3,3-диметил-1-оксобутан-2-ил)-4-(4-изопропилпиперазин-1-ил)бензамида
4-(4-циклопропилпиперазин-1-ил)-N-((S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-3,3-диметил-1-оксобутан-2-ил)бензамида
4-(4-циклобутилпиперазин-1-ил)-N-((S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-3,3-диметил-1-оксобутан-2-ил)бензамида
4-(1-циклопропилпиперидин-4-ил)-N-((S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2Н-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-3,3-диметил-1-оксобутан-2-ил)бензамида
4-(1-циклобутилпиперидин-4-ил)-N-((S)-1-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-3,3-диметил-1-оксобутан-2-ил)бензамида
N-((S)-1-циклопентил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)-4-(4-метилпиперазин-1-ил)бензамида
N-((S)-1-циклопентил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)-4-(4-этилпиперазин-1-ил)бензамида
N-((S)-1-циклопентил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)-4-(4-пропилпиперазин-1-ил)бензамида
N-((S)-1-циклопентил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)-4-(4-изопропилпиперазин-1-ил)бензамида
N-((S)-1-циклопентил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)-4-(4-(2-метоксиэтил)пиперазин-1-ил)бензамида
N-((S)-1-циклопентил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)-4-(4-циклопропилпиперазин-1-ил)бензамида
4-(4-циклобутилпиперазин-1-ил)-N-((S)-1-циклопентил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)бензамида
N-((S)-1-циклопентил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)-4-(1-пропилпиперидин-4-ил)бензамида
N-((S)-1-циклопентил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)-4-(1-изопропилпиперидин-4-ил)бензамида
N-((S)-1-циклопентил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)-4-(1-циклопропилпиперидин-4-ил)бензамида
4-(1-циклобутилпиперидин-4-ил)-N-((S)-1-циклопентил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)бензамида
N-((S)-1-циклогексил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)-4-(4-метилпиперазин-1-ил)бензамида
N-((S)-1-циклогексил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)-4-(4-этилпиперазин-1-ил)бензамида
N-((S)-1-циклогексил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)-4-(4-пропилпиперазин-1-ил)бензамида
N-((S)-1-циклогексил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)-4-(4-изопропилпиперазин-1-ил)бензамида
N-((S)-1-циклогексил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)-4-(4-(2-метоксиэтил)пиперазин-1-ил)бензамида
N-((S)-1-циклогексил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)-4-(4-циклопропилпиперазин-1-ил)бензамида
4-(4-циклобутилпиперазин-1-ил)-N-((S)-1-циклогексил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)бензамида
N-((S)-1-циклогексил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)-4-(1-пропилпиперидин-4-ил)бензамида
N-((S)-1-циклогексил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)-4-(1-изопропилпиперидин-4-ил)бензамида
N-((S)-1-циклогексил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)-4-(1-циклопропилпиперидин-4-ил)бензамида
4-(1-циклобутилпиперидин-4-ил)-N-((S)-1-циклогексил-2-((3aS,6S,6aS)-6-гидрокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-2-оксоэтил)бензамида
N-((S)-1-((3aS,6S,6aS)-6-метокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-4,4-диметил-1-оксопентан-2-ил)-4-(4-метилпиперазин-1-ил)бензамида
4-(4-этилпиперазин-1-ил)-N-((S)-1-((3aS,6S,6aS)-6-метокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-4,4-диметил-1-оксопентан-2-ил)бензамида
N-((S)-1-((3aS,6S,6aS)-6-метокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-4,4-диметил-1-оксопентан-2-ил)-4-(4-пропилпиперазин-1-ил)бензамида
4-(4-изопропилпиперазин-1-ил)-N-((S)-1-((3aS,6S,6aS)-6-метокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-4,4-диметил-1-оксопентан-2-ил)бензамида
N-((S)-1-((3aS,6S,6aS)-6-метокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-4,4-диметил-1-оксопентан-2-ил)-4-(4-(2-метоксиэтил)пиперазин-1-ил)бензамида
4-(4-циклопропилпиперазин-1-ил)-N-((S)-1-((3aS,6S,6aS)-6-метокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-4,4-диметил-1-оксопентан-2-ил)бензамида
4-(4-циклобутилпиперазин-1-ил)-N-((S)-1-((3aS,6S,6aS)-6-метокси-3-оксодигидро-2H-фуро[3,2-b]пиррол-4(5H,6H,6aH)-ил)-4,4-диметил-1-ок