Химерный пептид для лечения фиброаденомы молочной железы
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, а именно к применению химерного пептида VP-22_p16INK4a для лечения фиброаденомы молочной железы. Химерный пептид VP-22_p16INK4a содержит две последовательности аминокислот, первая из которых включает в себя ингибитор циклиновых киназ в виде активного фрагмента p16INK4a в качестве терапевтического агента, а вторая включает в себя пептид VP22 вируса простого герпеса в качестве транспортного агента для переноса ингибитора циклиновых киназ внутрь целевых клеток. Изобретение позволяет расширить область применения химерного пептида VP-22_р16INK4а. 4 ил., 1 пр.
Реферат
Изобретение относится к лекарственным препаратам, а именно к химерным пептидам, содержащим транспортную (интернализуемую, в мировой литературе встречается также термин "cell penetrating peptides" - СРР) часть и функциональную часть, предназначенную для лечения фиброаденомы молочной железы.
Создание химерных пептидов, обладающих цитостатической и цитотоксической активностью, является перспективным направлением развития современной терапии фиброаденомы молочной железы.
Из описаний к патентам WO 2006/109092 А1 и RU 2297241 С2 на изобретение "Химерный белок для лечения злокачественных лимфом" (опубликованного 20.04.2007) известно, что одним из направлений лечения опухолевых заболеваний является использование ингибиторов циклиновых киназ, например белков семейства INK4a, влияющих на клеточный цикл. При этом также известно, что желательно, чтобы молекулярные конструкции доставлялись в клетку "адресно" и воздействовали именно на конкретный внутриклеточный сигнал или функцию. Из упомянутого документа также известно, что в зависимости от структуры разные пептиды могут по-разному накапливаться в разных компартментах клетки, что дало теоретическую возможность конструировать последовательности с целевой доставкой в различные органеллы клетки.
Химерный пептид VP-22_p16INK4a по патенту RU 2297241 С2 предназначен для лечения злокачественных лимфом и других злокачественных новообразований, однако при этом не известно о возможности его использования для лечения доброкачественных новообразований, таких как фиброаденома молочной железы.
Задачей настоящего изобретения является расширение области использования химерного пептида VP-22_p16INK4a, и применение данного пептида для лечения фиброаденомы молочной железы.
Техническим результатом изобретения является медико-биологический эффект, объективно проявляющийся при использовании данного химерного пептида и заключающийся в решении указанной задачи.
Технический результат достигается благодаря применению для лечения фиброаденомы молочной железы химерного пептида VP-22_p16INK4a, содержащего две последовательности аминокислот, первая из которых включает в себя ингибитор циклиновых киназ в виде активного фрагмента p16INK4a (аминокислотные остатки 84-103 или 84-106) в качестве терапевтического агента, а вторая включает в себя пептид VP22 (аминокислотные остатки 140-301) вируса простого герпеса в качестве транспортного агента для переноса ингибитора циклиновых киназ внутрь целевых клеток.
Химерный пептид VP-22_p16INK4a содержит следующую последовательность аминокислот: D-A-A-T-A-T-R-G-R-S-A-A-S-R-P-T-E-R-P-R-A-P-A-R-S-A-S-R-P-R-R-P-V-E-D-A-A-R-E-G-F-L-D-T-L-V-V-L-H-R-A-G-A-R (далее - SEQ ID NO. 1, подчеркнута последовательность из р16). Контроль и синхронизация событий в процессе клеточного деления осуществляется большим комплексом молекул, одним из ключевых участников данного процесса являются циклины, активирующие так называемые циклинзависимые киназы (CDK). В течение клеточного цикла происходит последовательная активация транскрипции определенного циклина с последующим образованием активного комплекса циклин-CDK. Остановка клеточного деления в контрольных (рестрикпионных) точках (G1, S, G2) осуществляется ингибированием соответствующего циклинового комплекса через специфические пептиды. Семейство пептидов, ингибирующих циклин D (контролирующий переход G1-S),относится к пептидам INK4a.
Наиболее изучен из указанной группы пептид p16INK4a. Данный пептид ингибирует активность CDK4 и CDK6, входящих в комплекс с циклином D, что препятствует фосфорилированию pRb и высвобождению E2F, и приводит к остановке клеточного цикла на границе G1-S перехода. Структурно-ункциональные исследования данного белка выявили активный фрагмент p16INK4a (аминокислоты 84-103 или 84-106), который ответственен за ингибирование CDK4 и CDK6, входящих в комплекс с циклином D.
Пептид p16INK4a играет важную роль в процессе дифференцировки и старения клеток, кроме того, данный пептид не функционален или отсутствует во многих опухолевых тканях. Для ряда доброкачественных опухолей молочной железы характерно нарушение функции пептида р16INK4а и гиперэкспрессия циклина D. Таким образом, при фиброаденоме молочной железы наблюдаются нарушения контроля рестрикционной точки R1 (G1-S перехода).
Как было указано в описании к патенту RU 2297241 С2, возможность использовать естественные ингибиторы циклиновых киназ для контроля пролиферации возникла после открытия способности некоторых белков к трансактивации. То есть белки, синтезированные в одной клетке, могли выходить из нее и, проникая в другую клетку, приводить к активации определенных генов. Исследование структуры этих белков позволило выявить короткие (от 16 до 30 аминокислот) аминокислотные последовательности, ответственные за внутриклеточный транспорт. Было показано, что добавление такой последовательности в структуру произвольного белка наделяет его свойствами внутриклеточной и внутриядерной интернализации. В настоящее время известно около 30 последовательностей таких пептидов.
Сконструированная химерная белковая молекула, несущая интернализующий фрагмент пептида VP22, и фрагмент паптида p16INK4a - ингибитора циклиновых киназ, ранее использовалась исключительно для лечения злокачественных новообразований. Однако в настоящее время существуют экспериментальные подтверждения пригодности использования химерного пептида VP-22_p16INK4a и для лечения доброкачественных новообразований молочной железы.
Возможность осуществления изобретения с реализацией указанного назначения подтверждают следующие результаты исследований.
Материалы и методы.
Работа с культурами клеток.
Клетки культивировали при 37°С в 5% атмосфере CO2 в среде DMEM (ПанЭко, Россия), содержащей 10% эмбриональной бычьей сыворотки (FSB) (ПанЭко, Россия), 10 мкг/мл антибиотика-антимикотика гентамицина (ПанЭко, Россия) и 2 мМ L-глутамина (ПанЭко, Россия).
Химерный пептид и противоопухолевые препараты растворяли в культуральной среде и добавляли к клеткам при смене среды. Эффект оценивали через 24 часа инкубации.
Краткосрочные культуры опухолей человека.
Для оценки эффективности цитотоксического воздействия химерных пептидов на клетки молочной железы человека использовали краткосрочные культуры, полученные из операционного материала фиброаденомы молочной железы и неизмененной ткани молочной железы. Краткосрочные культуры получали путем механической дезагрегации операционного материала, клетки инкубировали 24 часа при 37°С в 5% атмосфере CO2 в среде RPMI (ПанЭко, Россия), содержащей 5% эмбриональной бычьей сыворотки (FSB) (ПанЭко, Россия) и необходимые для роста составляющие. Далее проводилась замена среды на среду, содержащую химерный пептид pAntp_p16 в концентрации 40 мкМ. Эффект оценивали через 24 и 48 часов инкубации с пептидом.
При работе in vitro эффекты воздействия на клетки химерных пептидов оценивали с помощью метода проточной цитофлуориметрии (проточный цитофлуориметр DAKO Galaxy). Исследовались уровень апоптоза, количество мертвых клеток по окраске AnnexinV-PI (пропидий йодид) и количественное распределение клеток по фазам клеточного цикла по окраске PI.
Окраска на AnnexinV. Использовали набор AnnexinV KIT (Caltag laboratories L12004). Клетки отмывали от среды в холодном фосфатно-солевом буфере (PBS), ресуспендировали в 1 × Binding Buffer в концентрации 106 клеток в мл. Отбирали 100 мкл полученной суспензии и добавляли к ней 5 мкл AnnexinV-FITC и 10 мкл PI. Инкубировали в темноте при комнатной температуре 15 минут. Добавляли 400 мкл 1 × Binding Buffer и анализировали на проточном цитофлуориметре.
Окраска PI. Клетки отмывали от сыворотки двухкратным центрифугированием в 1 мл PBS (4 минуты при 2000 об/мин). Удаляли супернантант, добавляли 300 мкл PBS, по каплям добавляли 700 мкл ледяного 70% этилового спирта и оставляли при -20°С на ночь (фиксация). Зафиксированные образцы клеток осаждали центрифугированием (4 минуты при 2000 об/мин), промывали 1 мл PBS и повторяли центрифугирование. К осажденным клеткам добавляли 100 мкл PBS и 20 мкл РНКазы А (1 мг/мл) и инкубировали 30 минут при 37°С. Далее к суспензии добавляли 30 мкл PI и инкубировали 40 минут при комнатной температуре в темноте. По окончании инкубации доводили объем исследуемого образца до 1 мл с помощью PBS.
Результаты исследований терапии фиброаденомы молочной железы с использованием химерного пептида VP-22_p16INK4a поясняются следующими фигурами:
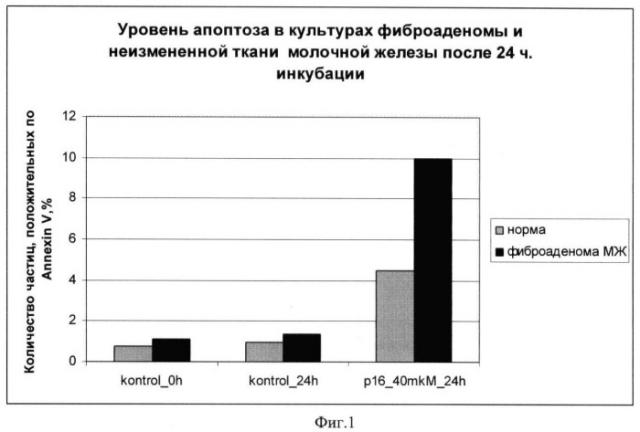
Фиг.1: уровень апоптоза в краткосрочных культурах неизмененной ткани молочной железы (норма) и фиброаденомы молочной железы при инкубации с химерным пептидом VP-22_p16INK4a в концентрации 40 мкМоль 24 часа. Средние значения по 3 экспериментам. Количество апоптотических частиц определялось, как положительные по AnnexinV при двойной окраске AnnexinV-PI;
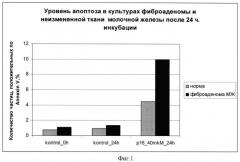
Фиг.2: цитотоксический эффект химерного пептида VP-22_p16INK4a на краткосрочные культуры неизмененной ткани (норма) молочной железы и фиброаденомы молочной железы. Средние значения количества частиц, положительных по AnnexinV, и частиц, включающих PI, при двойной окраске AnnexinV-PI по трем поставленным экспериментам. Инкубация с химерным пептидом 24 часа;
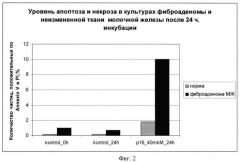
Фиг.3: цитотоксический эффект химерного пептида VP-22_p16INK4a на краткосрочные культуры неизмененной ткани (норма) молочной железы и фиброаденомы молочной железы. Средние значения количества частиц, включающих PI, при двойной окраске AnnexinV-PI по трем поставленным экспериментам. Инкубация с химерным пептидом 24 часа;
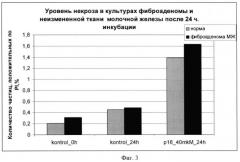
Фиг.4: уровень апоптоза в краткосрочных культурах неизмененной ткани (норма) молочной железы и фиброаденомы молочной железы при инкубации с химерным пептидом VP-22_p16INK4a в концентрации 40 мкМоль 24 и 48 часов. Средние значения по 3 экспериментам. Количество апоптотических частиц определялось, как субдиплоидный пик при окраске PI;
Пример 1. Исследование влияния химерного пептида VP-22_p16INK4a на краткосрочные культуры.
Было исследовано цитотоксическое влияние химерного пептида VP-22_p16INK4a на краткосрочные культуры, полученные из операционного материала.
Уровень апоптоза в краткосрочных культурах неизмененной ткани (норма) молочной железы и фиброаденомы молочной железы при инкубации с химерным пептидом VP-22_p16INK4a в концентрации 40 мкМоль 24 часа.
Результаты экспериментов показаны на фиг.1-4, на которых видно увеличение апоптоза в образцах фиброаденомы молочной железы по сравнению с неизмененной тканью молочной железы при использовании химерного пептида VP-22_p16INK4a.
Материалы и методы.
Работа с культурами клеток.
Клетки культивировали при 37°С в 5% атмосфере CO2 в среде DMEM (ПанЭко, Россия), содержащей 10% эмбриональной бычьей сыворотки (FSB) (ПанЭко, Россия), 10 мкг/мл антибиотика-антимикотика гентамицина (ПанЭко, Россия) и 2 мМ L-глутамина (ПанЭко, Россия).
Химерный пептид VP-22_p16INK4a и противоопухолевые препараты растворяли в культуральной среде и добавляли к клеткам при смене среды. Эффект оценивали через 24 часа инкубации.
Краткосрочные культуры неизмененной ткани молочной железы и фиброаденомы молочной железы человека.
Для оценки эффективности цитотоксического воздействия химерных пептидов на опухоли человека использовали краткосрочные культуры, полученные из операционного материала молочной железы. Краткосрочные культуры получали путем механической дезагрегации операционного материала, клетки инкубировали 24 часа при 37°С в 5% атмосфере CO2 в среде RPMI (ПанЭко, Россия), содержащей 5% эмбриональной бычьей сыворотки (FSB) (ПанЭко, Россия) и необходимые для роста составляющие. Далее проводилась замена среды на среду, содержащую химерный пептид VP-22_p16INK4a в концентрации 40 мкМ. Эффект оценивали через 24 и 48 часов инкубации с пептидом.
При работе in vitro эффекты воздействия на клетки химерных пептидов оценивали с помощью метода проточной цитофлуориметрии (проточный цитофлуориметр DAKO Galaxy). Исследовались уровень апоптоза, количество мертвых клеток по окраске AnnexinV-PI (пропидий йодид) и количественное распределение клеток по фазам клеточного цикла по окраске PI.
Окраска на AimexinV. Использовали набор AnnexinV KIT (Caltag laboratories L12004). Клетки отмывали от среды в холодном фосфатно-солевом буфере (PBS), ресуспендировали в 1 х Binding Buffer в концентрации 106 клеток в мл. Отбирали 100 мкл полученной суспензии и добавляли к ней 5 мкл AnnexinV-FITC и 10 мкл PI. Инкубировали в темноте при комнатной температуре 15 минут. Добавляли 400 мкл 1 х Binding Buffer и анализировали на проточном цитофлуориметре.
Окраска PI. Клетки отмывали от сыворотки двукратным центрифугированием в 1 мл PBS (4 минуты при 2000 об/мин). Удаляли супернантант, добавляли 300 мкл PBS, по каплям добавляли 700 мкл ледяного 70% этилового спирта и оставляли при -20°С на ночь (фиксация). Зафиксированные образцы клеток осаждали центрифугированием (4 минуты при 2000 об/мин), промывали 1 мл PBS и повторяли центрифугирование. К осажденным клеткам добавляли 100 мкл PBS и 20 мкл РНКазы А (1 мг/мл) и инкубировали 30 минут при 37°С. Далее к суспензии добавляли 30 мкл PI и инкубировали 40 минут при комнатной температуре в темноте. По окончании инкубации доводили объем исследуемого образца до 1 мл с помощью PBS.
При этом результаты на краткосрочных моделях опухолей человека получены впервые в мире. Впервые показано, что пептид со структурой VP-22_p16INK4a может быть применен для лечения фиброаденомы молочной железы.
Применение химерного пептида VP-22_p16INK4a, содержащего последовательность аминокислот SEQ ID NO. 1, для лечения фиброаденомы молочной железы.