Получение триацилглицеролов из камедей
Иллюстрации
Показать всеИзобретение относится к способу получения триацилглицеролов из камедей, отделенных от маслосодержащих продуктов. Камеди обрабатываются одним или более ферментами, обладающим активностью PLA при температуре около 40-60°C и при pH около 3-7 в течение не более чем 4 часов, что приводит к образованию лизо-фосфолипидов и свободных жирных кислот. Камеди обрабатываются одним или более ферментами, обладающими активностью PLC при температуре около 40-80°C и при pH около 8 или менее в течение не более чем 30 мин для образования диацилглицеролов и фосфатов. Полученные в результате самостоятельных реакций диацилглицеролы и свободные жирные кислоты воссоединяются в присутствии не менее одного из указанных ферментов, образуя новые молекулы триацилглицеролов. 20 з.п. ф-лы, 8 ил., 9 табл., 16 пр.
Реферат
По настоящей заявке испрашивается приоритет в отношении заявки США № 11/970270, зарегистрированной 7 января 2008 года под названием «ПОЛУЧЕНИЕ ТРИАЦИЛГЛИЦЕРОЛОВ ИЗ КАМЕДЕЙ» на имя Christopher L.G. Dayton.
Уровень техники изобретения
Настоящее изобретение относится к способу получения триацилглицеролов из камедей, которые восстанавливаются в процессе рафинации масел. Более конкретно настоящее изобретение относится к ферментативному процессу обработки различных фосфолипидов и лецитинов (известных под общим названием «камеди») из растительных масел для получения или «генерации» триацилглицеролов (триглицериды или масла). Изобретение, описанное в данном тексте, является дальнейшим этапом работы на основании изобретений, описанных в заявке на патент США № 11/668921, зарегистрированной 30 января 2007 года, и заявке на патент США № 11/853339, зарегистрированной 11 сентября 2007 года, которые принадлежат общему заявителю и введены в данный текст в виде ссылки.
Необработанные растительные масла, полученные методами прессования или экстрагирования растворителями, представляют собой сложную смесь триацилглицеролов, фосфолипидов, стеролов, токоферолов, свободных жирных кислот, следовых металлов и других минорных соединений. Для получения качественного салатного масла длительного хранения, обладающего светлым цветом и мягким вкусом, необходимо удаление фосфолипидов, свободных жирных кислот и следовых металлов. В предшествующем уровне техники было усовершенствовано подобное удаление фосфолипидов, известных как «камеди», с помощью различных методик, включая водное дегуммирование, кислотное дегуммирование, щелочное дегуммирование и ферментативное дегуммирование. Большинство из этих способов дегуммирования характеризуются значительными потерями масла вместе с отделяемыми камедями.
Вышеуказанные патентные заявки описывают способы удаления фосфолипидов из масляных композиций путем совместной обработки масляных композиций ферментами PLA (фосфолипаза А) и PLC (фосфолипаза С). Обработка двумя ферментами может быть последовательной или одновременной. Неожиданно оказалось, что кинетика ферментативных реакций ускоряется в большей степени, чем ожидалось, когда два фермента применяются вместе, чем в случаях, когда используется только какой-либо один фермент. Дополнительно было обнаружено, что реакции протекают быстрее ожидаемого при совместном использовании ферментов, даже если условия реакции не были подобраны хотя бы для одного из ферментов. Также было установлено, что при совместном использовании ферментов реакция может протекать менее чем за приблизительно 1 час, и даже может протекать за 30 мин.
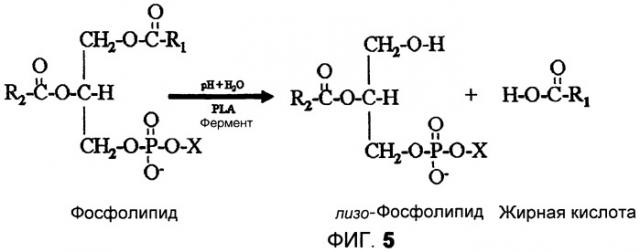
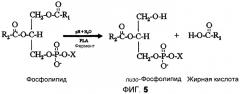
Ожидается, что в результате обработки масляных композиций ферментами PLA и PLC будут получены определенные сопутствующие продукты реакции, которые должны быть удалены из обработанного масла. Эти сопутствующие продукты включают фосфатсодержащие остатки, отщепленные от фосфолипидов ферментами PLC, свободные жирные кислоты, отщепленные от фосфолипидов ферментами PLA, и лизо-фосфолипиды, полученные в результате отщепления свободной жирной кислоты от фосфолипида. Лизо-фосфолипиды и любые фосфатсодержащие сопутствующие продукты должны быть удалены из обработанной масляной композиции, и ожидается, что другие вышеперечисленные сопутствующие продукты реакции будут удалены вместе с лизо-фосфолипидами в составе тяжелой фракции, известной как «камеди».
Патент США 5061498 относится к способу преобразования жиров и масел, который включает обработку жиров и масел, содержащих неполные глицериды, липазами двух или более типов, отличающихся специфичностью в отношении жирных кислот и/или специфичностью в отношении положения этерификации в присутствии малых количеств воды, для получения жиров и масел с низким содержанием неполных глицеридов. В раскрытом примере осуществления используется липаза P, так как она будет осуществлять реакцию в любом из трех положений остова глицерина. К композиции, содержащей неполные глицериды, может быть добавлена целевая жирная кислота, такая как олеиновая кислота, в присутствии липазы, специфичной к целевой жирной кислоте, такой как липаза F. Наличие липазы F способствует преимущественному прохождению реакции с участием предпочтительной жирной кислоты по сравнению с другими жирными кислотами, которые могут присутствовать, и наличие липазы P способствует этерификации предпочтительной жирной кислоты в любом положении на остове неполных глицеридов. Концентрация воды предпочтительно составляет менее 1500 м.д. (миллионных долей), более конкретно от 10 до 200 м.д.
Задача настоящего изобретения состоит в обеспечении способа обработки отделенных камедей для получения пригодных к употреблению масляных продуктов, которые в ином случае были бы утеряны.
Сущность изобретения
В дополнение к работе, описанной в двух вышеуказанных патентных заявках, были проведены исследования камедей, которые были отделены от масел, обработанных PLA/PLC. Ожидалось, что камеди будут содержать свободные жирные кислоты и диацилглицеролы, присутствующие в количествах, пропорциональных количеству фосфолипидов, присутствовавших в исходной масляной композиции, которые подверглись действию ферментов. Вместо этого количество свободных жирных кислот и диацилглицеролов оказалось значительно меньшим, чем ожидалось теоретически. Исходя из столь неожиданного результата был сделан вывод, что свободные жирные кислоты и диацилглицеролы, которые являлись побочными продуктами реакций фосфолипидов с PLA и PLC соответственно, реагировали друг с другом в присутствии ферментов PLA и PLC с образованием полезных триацилглицеролов, таким образом, в сущности, генерируя новые молекулы масел, которые не существовали до начала процесса обработки PLA/PLC. Благодаря этому было сделано открытие, что комбинация ферментов PLA и PLC может применяться для обработки отделенных фосфолипидов, независимо от способа отделения этих фосфолипидов, для генерации новых молекул триацилглицеролов.
Соответственно, настоящее изобретение относится к способу генерации триацилглицеролов из камеди масел, способу, включающему (a) обеспечение масляной композиции, содержащей некоторое количество масляных камедей, где указанные камеди содержат фосфолипиды, (b) отделение указанных масляных камедей от указанной масляной композиции для получения первой фракции, практически не содержащей масляных камедей, и второй фракции, содержащей указанные отделенные масляные камеди, (c) обработку указанной второй фракции одним или более ферментами с активностью PLA для образования свободных жирных кислот, (d) обработку указанной второй фракции одним или более ферментами с активностью PLC для образования диацилглицеролов, таким образом, что указанные жирные кислоты и указанные диацилглицеролы взаимодействуют друг с другом в присутствии не менее одного из указанных ферментов, образуя триацилглицеролы.
Описание фигур
На фиг.1 приведены структурные формулы фосфолипида и триацилглицерола.
На фиг.2 показаны три стереоспецифических положения фосфолипида.
На фиг.3 приведены структуры четырех распространенных функциональных групп, которые могут быть присоединены к фосфатной группе фосфолипида.
На фиг.4 показаны четыре различных сайта ферментативного воздействия в молекуле фосфолипида.
На фиг.5 показана реакция фосфолипида в присутствии фермента PLA и воды, приводящая к образованию лизо-фосфолипида и жирной кислоты.
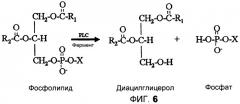
На фиг.6 показана реакция фосфолипида в присутствии фермента PLC и воды, приводящая к образованию диацилглицерола и фосфата.
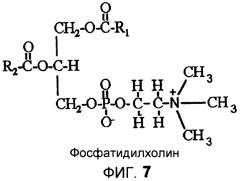
На фиг.7 приведена структурная формула фосфатидилхолина.
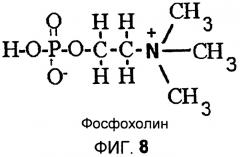
На фиг.8 приведена структурная формула фосфохолина.
Подробное описание изобретения
Почти все потери, связанные с процессом рафинации растительных масел, имеют место при удалении фосфолипидов. Как показано на фиг.1, фосфолипиды содержат фосфатную группу на одном из двух концов глицеринового остова, тогда как триацилглицерол содержит три жирных кислоты. Чтобы различить производные, используется система стереоспецифической нумерации («Sn»). На фиг.2 изображены три стереоспецифических положения фосфолипида.
Фосфатная группа фосфолипида является «гидрофильной», или «водолюбивой», что означает, что и фосфат, и функциональная группа X притягиваются к воде. Цепочки жирных кислот фосфолипида R1 и R2 являются «липофильными», или «жиролюбивыми», что означает, что они притягиваются к липидам. Так как молекула фосфолипида обладает и гидрофильной функциональной группой, и липофильными цепочками жирных кислот, то представляет собой прекрасный природный эмульгатор. Эмульгирующие свойства фосфолипидов будут приводить к удалению двух молекул фосфолипида и одной молекулы триацилглицерола при удалении фосфолипидов из растительных масел.
Фосфатсодержащая функциональная группа фосфолипида, обозначенная на фиг.1 как «X», обусловливает степень гидрофильности. Функциональная группа X на фиг.1 может быть группой любого из нескольких различных известных типов, малая часть которых приведена на фиг.3.
Фосфолипиды, содержащие в качестве функциональных групп холин и этаноламин, имеют наибольшее сродство к воде, тогда как кислоты, соли кислот (кальциевые, магниевые и соли железа) и инозитол имеют гораздо более низкое сродство к воде. Фосфатидная кислота и соли фосфатидной кислоты широко известны как «негидратируемые фосфолипиды», или NHP. Содержание фосфолипидов в масле обычно определяется как «содержание фосфора» в миллионных долях. Таблица 1 описывает обычные количества фосфолипидов, присутствующие в большинстве культур для производства растительного масла, и распределение различных функциональных групп, в процентных долях, фосфолипидов в маслах. Таблица 2 описывает обычное распределение фосфолипидов, присутствующих в лецитине (соевые камеди). В таблице 2 «как таковая» обозначает обычный фосфолипидный состав, отделяемый от растительного масла с увлеченным маслом (2 молекулы фосфолипида и 1 молекула масла), дающий нерастворимое в ацетоне содержимое в 67%. «Нормализованный» обозначает фосфолипидный состав без примеси масла, дающий нерастворимое в ацетоне содержимое в 100%. Таблица 3 описывает молекулярные веса основных типов фосфолипидов, лизо-фосфолипидов и соответствующих нелипидных соединений фосфора. Термин «лизо-фосфолипид», при использовании в таблице 3 и повсеместно в настоящей заявке обозначает фосфолипид, от которого одна из групп жирных кислот была отщеплена липазой. Молекулярный вес олеиновой кислоты составляет 282,48, а молекулярный вес диацилглицерола, в котором жирные кислоты являются олеиновой кислотой (C18:1), составляет 620,99.
| Таблица 1 | |||
| Распределение и количества фосфолипидов в маслах из распространенных масличных культур | |||
| Соевое масло | Масло канолы | Подсолнечное масло | |
| P (м.д.) | 400-1200 | 200-900 | 300-700 |
| PC (-холин) | 12-46% | 25-40% | 29-52% |
| PE (-этаноламин) | 8-34% | 15-25% | 17-26% |
| PA (-кислота) | 2-21% | 10-20% | 15-30% |
| PI (-инозитол) | 2-15% | 2-25% | 11-22% |
| Таблица 2 | ||
| Обычное распределение и количество фосфолипидов в соевых камедях | ||
| Процентная доля «как есть» | Процентная доля «нормализованная» | |
| Фосфатидилхолин | 33,9 | 47,2 |
| Фосфатидилэтаноламин | 14,3 | 19,9 |
| Фосфатидилсерин | 0,4 | 0,6 |
| Фосфатидиловая кислота | 6,4 | 8,9 |
| Фосфатидилинозитол | 16,8 | 23,4 |
| Всего | 71,8 | 100,0 |
| Таблица 3 | |||
| Молекулярный вес распространенных фосфолипидов и соединений | |||
| Фосфолипид Молекулярный вес | Лизо-фосфолипид Молекулярный вес | Соединения фосфора Молекулярный вес | |
| Холин-C18:1 | 786,15 | 521,67 | 183 |
| Этаноламин-C18:1 | 744,00 | 479,52 | 141 |
| Серин-C18:1 | 787,03 | 522,55 | 184 |
| Кислота-C18:1 | 721,90 | 457,42 | 98 |
| Инозитол-C18:1 | 863,98 | 599,50 | 260 |
Фосфолипиды могут быть частично или полностью удалены из растительных масел с помощью нескольких различных технологий; наиболее распространенными являются водное дегуммирование, кислотное дегуммирование, щелочная рафинация и ферментативное дегуммирование. Настоящее изобретение, описывающее получение масел из камедей, может применяться в отношении камедей, полученных в результате любого из этих процессов; с целью иллюстрации подробно будет объяснено ферментативное дегуммирование.
Ферментативное дегуммирование, также известное как «ферментативная рафинация», используется, когда целью является полное удаление фосфолипидов из масла. В основном, согласно предшествующему уровню техники ферментативное дегуммирование применяется в отношении масел, которые предварительно были дегуммированы каким-то другим способом, обычно водным дегуммированием. Для применения в качестве пищевой добавки дегуммированное ферментативным способом масло может затем подвергаться осветлению и дезодорации, технологии, известной в производстве как «физическая рафинация». Ферментативное дегуммирование обеспечивает лучший выход масла, чем водное, кислотное или щелочное дегуммирование, с улучшенными экономическими показателями.
Ферментативная реакция изменяет природу фосфолипида, отщепляя различные функциональные группы молекулы. Функциональные группы и продукты распада в основном могут рассматриваться как «жировые вещества» и «фосфорсодержащие вещества». Ферментативная реакция уменьшает эмульгирующие свойства полученных фосфолипидов таким образом, что при отделении камеди от масла сокращаются потери и сохраняется масло. Ферменты, проявляющие активность в отношении фосфолипидов, обычно называют «фосфолипазами». Классификация фосфолипаз основана на положении в молекуле фосфолипида, с которым реагирует фермент, и известны типы фосфолипаз PLA1, PLA2, PLC и PLD. Положения в молекуле фосфолипида, с которыми взаимодействуют различные типы фосфолипаз, показаны на фиг.4. Фосфолипаза B представляет собой дополнительный фермент, известный в данной области техники. Этот фермент отщепляет последнюю жирную кислоту в положении Sn-1 или Sn-2 (фиг.2) лизо-фосфолипида. Краткие сведения о различных фосфолипазах и продуктах осуществляемых ими реакций изложены в таблице 4.
| Таблица 4 | ||
| Жировые вещества | Фосфорсодержащие вещества | |
| Фосфолипаза A1 | Жирная кислота | Лизо-фосфолипид |
| Фосфолипаза A2 | Жирная кислота | 2-лизо-фосфолипид |
| Фосфолипаза B | Жирная кислота | Глицерофосфолипид |
| Фосфолипаза C | Диацилглицерол | Фосфатсодержащая концевая группа |
| Фосфолипаза D | Спирт | Фосфатидная кислота |
Фосфолипаза каждого типа имеет собственную скорость реакции и требует собственных оптимальных условий реакции по параметрам pH, содержания воды и температуры. PLA, применяемая сама по себе, требует времени реакции не менее 4 час, в то время как PLC, применяемая сама по себе, требует времени реакции около одного часа. Известно, что ферментативная обработка должна происходить при pH меньше или равном 8 для уменьшения нежелательного омыления масла, но PLA имеет оптимальный для реакции pH 4,5, тогда как PLC имеет оптимальный для реакции pH 7,0. Также каждый из ферментов имеет различную термоустойчивость. Ферменты PLA денатурируют примерно при 50°C, а ферменты PLC денатурируют примерно при 65°C.
Аминокислотные последовательности с активностью фосфолипаз широко освещены в литературе и описаны в патентах, и некоторые из них известны как обладающие активностью в отношении фосфолипидов, присутствующих в растительных маслах. Все это известно в данной области техники.
Одним из коммерческих продуктов PLA1 с ферментативной активностью фосфолипазы является фосфолипаза A1 фирмы Novozymes (Lecitase® Ultra). Как описано в инструкции по применению Novozymes «Oils & Fats» № 2002-185255-01 и 2002-05894-03, этот продукт может смешиваться с дегуммированым маслом в 1-1,5% водном цитрат-NaOH буфере при 4,5<pH<7,0 и 40°C<T<55°C. При указанных условиях PLA1 избирательно гидролизует жирную кислоту в положении напротив фосфатной функциональной группы на остове глицерина и дает на выходе полярные лизо-фосфолипиды и полярные жирные кислоты. Как показано на фиг.4, молекула фосфолипида теряет одну гидрофобную функциональную группу, т.е. жирную кислоту, оставляя лизо-фосфолипид, который теперь несет гидрофильную фосфатную группу и гидрофильную спиртовую группу. Имея два гидрофильных сайта, молекула лизо-фосфолипида становится водорастворимой и теряет эмульгаторные свойства. Таким образом, при отделении водной фазы от масляной фазы лизо-фосфолипид удаляется с водной фазой и не увлекает за собой масло, тогда как отщепленная от фосфолипида молекула жирной кислоты остается в масле. В технологиях известного уровня техники эта молекула жирной кислоты должна быть удалена при следующей процедуре дезодорации. Таким образом, методика дегуммирования с помощью PLA1 уменьшает потери при рафинации, так как вместе с лизо-фосфолипидами в водной фазе не происходит удаления каких-либо нейтральных масел, так что единственным удаляемым компонентом является нежелательный лизо-фосфолипид, полученный из исходной молекулы фосфолипида.
Теоретическое количество жирных кислот, которые могут быть получены при взаимодействии камедей с ферментом типа PLA, может быть подсчитано путем определения общего количества фосфолипидов в камедях, количества каждого типа фосфолипида и, наконец, изменения молекулярного веса, которое имеет место при преобразовании фосфолипида в лизо-фосфолипид, для каждого типа присутствующих фосфолипидов. Процентное содержание фосфолипида может быть подсчитано путем умножения количества элементарного фосфора, измеренного в миллионных долях, на 31 (молекулярный вес фосфора составляет 30,97) и деления на 10000. Количества фосфолипидов каждого типа могут быть подсчитаны путем умножения общего количества камедей на нормальное распределение фосфолипида каждого типа, известное для конкретного вида масла. И, наконец, количество высвободившейся жирной кислоты может быть определено исходя из каждого типа фосфолипида.
Например, для нерафинированного соевого масла, содержащего 800 м.д. фосфора с «нормализованным» распределением фосфолипида (таблица 2), принимая, что жирными кислотами, присоединенными к фосфолипидам, является олеиновая кислота (C18:1), ожидаемое количество высвободившихся жирных кислот может быть вычислено следующим образом.
Сначала подсчитывается общее содержание присутствующего фосфолипида.
Общее количество фосфолипидов = (800 м.д./1000000)×31×100=2,48%.
Затем подсчитывается количество фосфолипида каждого типа.
Фосфатидилхолин = (2,48×47,21)/100=1,17%
Фосфатидилэтаноламин = (2,48×19,92)/100=0,49%
Фосфатидилсерин = (2,48×0,56)/100=0,01%
Фосфатидилинозитол = (2,48×23,40)/100=0,58%
Фосфатидная кислота = (2,48×8,91)/100=0,22%
Наконец, количество жирных кислот, высвободившихся при реакции каждого типа фосфолипидов в камедях с PLA, определяется умножением количества фосфолипида каждого типа на процентное содержание свободной жирной кислоты (FFA), процентное содержание жирной кислоты вычисляется как остаток после удаления количества лизо-фосфолипида (см. таблицу 3), следующим образом:
FFA из PC = 1,17×(1-(521,67/786,15))=0,39%
FFA из PE = 0,49×(1-(479,52/744,00))=0,18%
FFA из PS = 0,01×(1-(522,56/787,03))=0,00%
FFA из PI = 0,58×(1-(599,50/863,98))=0,18%
FFA из PA = (0,22×(1-(457,22/721,90)=0,08%
Ожидаемое общее количество образующихся свободных жирных кислот = 0,83%
Несмотря на то что ферментативное дегуммирование предлагает значительные преимущества для маслоперерабатывающих предприятий, оно также имеет определенные недостатки. Одним недостатком является то, что реакция фермента с фосфолипидами может оказаться медленной и занимать много времени. В частности, реакция ферментов фосфолипазы A с фосфолипидами может проходить несколько часов в зависимости от таких параметров реакции, как pH, температура, относительные концентрации и условия перемешивания. Настолько продолжительное время реакции может оказать существенное негативное влияние на суммарную экономическую выгоду технологии ферментативного дегуммирования. Из-за медлительности реакции PLA ферментативное дегуммирование обычно проводится в отношении композиций масел, которые предварительно подверглись водному дегуммированию. Таким образом, для получения продукта с достаточно низким для предусмотренного назначения содержанием фосфора масло может подвергаться дегуммированию дважды.
В данной области техники известно, что ферменты PLC взаимодействуют с фосфолипидом путем избирательного гидролиза фосфатной функциональной группы, как показано на фиг.6. На выходе реакции получаются диацилглицерол («DAG») и фосфатидная группа. Молекула диациглицерола уже не несет фосфатной функциональной группы и не нуждается в удалении из масла. Например, реакция Фосфатидилхолина (PC), фиг.7, с PLC приводит к образованию DAG и фосфатной функциональной группы, показанной на фиг.8, более широко известной как фосфохолин или «C». Методика дегуммирования с участием PLC уменьшает потери масла в процессе рафинации путем удержания растворимого в масле DAG и одновременного удаления водорастворимой фосфатной функциональной группы. В процессе удаления водной фазы не теряются нейтральные масла, так как фосфолипид был разрушен. Однако фермент PLC не взаимодействует ни с одним из липидов, присутствующих в масле. Обычно PLC не взаимодействует с фосфатидной кислотой (PA) или фосфатидилинозитолом (PI), изображенными на фиг.3, хотя PI-специфичные PLC, именуемые PI-PLC, известны. Кроме того, и PA, и PI являются негидратируемыми фосфолипидами, которые остаются в масле после водного дегуммирования. Следовательно, масло, обработанное только ферментом PLC, должно подвергаться дополнительной обработке щелочью или другими ферментами для удаления оставшихся камедей.
Теоретическое количество диацилглицеролов, полученных в результате реакции камедей с ферментом типа PLC, может быть подсчитано путем определения процентного содержания фосфолипидов в масле, количества фосфолипидов каждого типа в масле конкретного вида и, наконец, изменения молекулярного веса, которое имеет место при преобразовании фосфолипида в DAG для фосфолипидов каждого типа, присутствующих в неочищенном масле. Процентное содержание фосфолипида в масле может быть подсчитано умножением количества элементарного фосфора, измеренного в миллионных долях, на 31 (молекулярный вес фосфора составляет 30,97) и делением на 10000. Количество индивидуальных фосфолипидов может быть подсчитано умножением общего количества камеди на нормальное распределение фосфолипида каждого типа. Наконец, количество диацилглицерола может быть определено как количество продукта реакции фосфолипида каждого типа.
Например, для нерафинированного соевого масла, содержащего 800 м.д. фосфора с «нормализованным» распределением фосфолипида (таблица 2), принимая, что жирными кислотами, присоединенными к фосфолипидам, является олеиновая кислота (C18:1), ожидаемое количество высвободившихся диацилглицеролов может быть вычислено следующим образом.
Сначала подсчитывается процентное содержание фосфолипида каждого типа, как описано выше.
Затем процентное содержание диацилглицеролов (DAG) каждого типа, высвобождаемых при реакции PLC с камедями, может быть определено умножением количества фосфолипида каждого типа на процентное содержание диацилглицеролов (таблица 3), количество DAG вычисляется как остаток после удаления количества фосфатных групп, следующим образом:
DAG из PC = 1,17×(1-(165,10/786,15))=0,93%
DAG из PE = (0,49×(1-(123,10/744,00)=0,41%
DAG из PS = (0,01×(1-(166,08/787,03)=0,01%
DAG из PI = (0,58×(1-(243,00/863,98)=0,42%
DAG из PA = (0,22×(1-(100,92/721,90)=0,19%
Общее количество полученных диацилглицеролов = 1,96%
Настоящее изобретение относится к ферментативной обработке фосфолипидов и фосфорсодержащих масляных композиций с целью получения новых молекул триацилглицерола. Авторы изобретения неожиданно обнаружили, что применение комбинации фосфолипаз с активностями PLA и PLC не только приводит к отщеплению специфических «групп», но также рекомбинирует отщепленную в реакции с PLA жирную кислоту (FA) и диацилглицерол (DAG), полученный в результате реакции с PLC, с выходом триглицерида, или масла. В частности, фосфолипаза A (PLA) взаимодействует с молекулой фосфолипида с образованием FA и лизо-лецитина, тогда как Фосфолипаза C (PLC) взаимодействует с другой молекулой фосфолипида с образованием DAG и фосфолецитина. Полученная в реакции с PLA жирная кислота и DAG, полученный в результате реакции с PLC, затем воссоединяются этерификацией в присутствии одного или более ферментов для получения новой молекулы триацилглицерола (TAG).
Настоящее изобретение особенно полезно для применения в дальнейшей обработке камедей, которые были отделены из неочищенного масла такими способами, как водная рафинация, кислотная рафинация или щелочная рафинация или ферментативная рафинация, за исключением рафинации с совместным использованием ферментов PLA и PLC. Считается, что будет предпочтительно довести pH камедей, отделенных щелочной рафинацией, до 8 или менее перед тем, как приступить к этапам получения масла согласно настоящему изобретению.
Масла, которые могут обрабатываться в соответствии с настоящим изобретением, могут включать, но не ограничиваются, следующие масла: масло канолы, касторовое масло, кокосовое масло, кориандровое масло, кукурузное масло, хлопковое масло, масло лесного ореха, конопляное масло, льняное масло, масло из косточек манго, масло пенника лугового, копытное масло, оливковое масло, пальмовое масло, пальмоядровое масло, пальмовый олеин, арахисовое масло, рапсовое масло, масло из рисовых отрубей, сафлоровое масло, масло камелии (Camelia sasanqua), соевое масло, подсолнечное масло, таловое масло, масло камелии (Camelia tzubaki) и растительное масло, и любая комбинация вышеперечисленных масел.
Фермент фосфолипаза A, применяемый согласно способу настоящего изобретения, может представлять собой и фермент фосфолипазу A1, и фермент фосфолипазу A2. Фермент фосфолипаза C, используемый в настоящем изобретении, может представлять собой фермент фосфолипазу C и/или инозитол-специфичную фосфолипазу C. Множество ферментов семейств фосфолипаз A и фосфолипаз C доступны коммерчески; и предполагается, что такие ферменты и их эквиваленты окажутся подходящими для применения согласно настоящему изобретению.
Согласно способу изобретения различные фосфолипазы, используемые совместно в способе ферментативного дегуммирования настоящего изобретения, могут смешиваться друг с другом перед добавлением к обрабатываемому маслу. Альтернативно, они могут добавляться к маслу по отдельности как последовательно, так и одновременно.
Способ дегуммирования настоящего изобретения осуществляется при pH ниже примерно 8, предпочтительно примерно между 3 и 7 и наиболее предпочтительно примерно между 4 и 5. Значение pH реакции ферментативного дегуммирования может быть достигнуто путем добавления известных буферов. Хорошо известно, что для этой цели подходят лимонная кислота и гидроксид натрия. По мере необходимости могут применяться другие буферные вещества для доведения pH при специфических условиях реакции.
Согласно настоящему изобретению температура процесса ферментативного дегуммирования может быть в интервале примерно 40-80°C, предпочтительно в интервале примерно 40-60°C и более предпочтительно в интервале примерно 45-55°C. Неожиданно было обнаружено, что при способе дегуммирования настоящего изобретения PLA может работать при температуре, превышающей собственный оптимум фермента в 45°C, и близкой к оптимальной рабочей температуре PLC, без чрезмерной денатурации.
По окончании процесса образования масла в камедях и отделения вновь образованного масла от камедей вновь образованное масло может подвергаться таким дальнейшим этапам обработки, известным в данной области техники, как осветление или дезодорация, что может быть необходимо или желательно в зависимости от конечного применения, для которого вновь образованное масло предназначено.
Различные предпочтительные варианты осуществления изобретения ниже изложены в примерах наряду с контрольными примерами, использующими условия известного уровня техники. В каждом из нижеперечисленных примеров верхнеприводной мешалкой являлась мешалка Heidolph, модель Elector KG с плоскими лопастями; использовалась при 90 об/мин для нормального перемешивания и 350 об/мин для интенсивного перемешивания. Для непрерывного разделения использовалась осадительная центрифуга De Laval Gyro - Tester с «ротором». Ротор центрифуги закрывался установленной резьбовой пробкой. Сдвиговое перемешивание выполнялось с помощью гомогенизатора Ultra-Turrax SD-45 с ротором-статором G450 при 10000 об/мин. Использовался фермент PLA1 Lecitase® Ultra (номер партии LYN05007), поставляемый фирмой Novozymes A/S (Дания). Использовался фермент PLC Purifine™ (PLC номер партии 90BU002A1 или 90BU004A1), поставляемый фирмой Verenium Corporation (San Diego, California). Количество фосфолипидов, остающихся в обработанном масле, измерялось в м.д. P в соответствии со способом, одобренным Американским обществом нефтехимиков, Ca 20-99, «Анализ содержания фосфора в масле с помощью оптической эмиссионной спектроскопии с индуктивно-сопряженной плазмой». Свободная жирная кислота (FFA) измерялась способом Ca 5a-40, одобренным Американским обществом нефтехимиков. Содержание влаги измерялось способом Ca 2c-25, одобренным Американским обществом нефтехимиков. Нейтральное масло определялось способом, изложенным в нижеследующем приложении. Нерастворимый в ацетоне материал, включающий фосфолипид, определялся способом Ja 4-46, одобренным Американским обществом нефтехимиков. Кислотность определялась способом Ja 6-55, одобренным Американским обществом нефтехимиков. Методики измерений P-31 (фосфора-31) ЯМР и диацилглицерола (DAG) высокоэффективной жидкостной хроматографией с испарительным детектором светорассеяния (HPLC-ELSD) осуществлялись, следуя протоколам, доложенным корпорацией Verenium (далее известной как корпорация Diversa), «Аналитическое профилирование лабораторных испытаний дегуммирования растительных масел, опосредованного фосфолипазой C», на конференции Американского общества нефтехимиков 2007 года.
Среди следующих примеров примеры 1-10 прямо соотносятся с примерами 13, 14, 18, 23, 24, 27, 29, 31, 33 и 36 вышеуказанной патентной заявки США № 11/853339, зарегистрированной 11 сентября 2007 года за исключением того, что значения свободных жирных кислот (FFA) и диацилглицеролов, присутствующих в ферментативно дегуммированном масле, были измерены способами, изложенными выше, и включены в данный документ.
Пример 1
1999,1 г необработанного соевого масла, содержащего 769,5 м.д. соединений фосфора, нагревали до 75-80°C при нормальном перемешивании с применением верхнеприводной мешалки. Добавляли 2,0 г 50% вес./вес. раствора лимонной кислоты и размешивали (сдвиговой деформацией) 1 мин. Масло подвергали нормальному перемешиванию в течение 1 час с помощью верхнеприводной мешалки. Масло остужали при перемешивании с нормальной скоростью до температуры 40°C, затем добавляли 2,4 мл 4-молярного раствора гидроксида натрия и смесь перемешивали 10 с. Лимонная кислота и щелочь формировали слабый буфер с pH 5,0. При поддерживающейся температуре 40°C добавляли 1,5008 г Verenium Purifine™ (PLC липаза, номер партии 90BU002A1) с последующим добавлением 30 г деионизованной воды и всю смесь размешивали 120 с. Смесь масла перемешивали с нормальной скоростью в течение 60 мин. При поддерживающейся температуре 40°C добавляли 0,2132 г Lecitase® Ultra фирмы Novozymes (PLA1 липаза, номер партии LYN05007) и всю смесь размешивали в течение 120 с. Масляную смесь перемешивали с нормальной скоростью 60 мин при температуре 40°C. Затем обработанное ферментами масло центрифугировали и отдельно собирали фракции отделенного масла и сырых камедей. Доля остаточных фосфорсодержащих веществ в масле, последовательно дегуммированном PLC, а затем PLA1, составила 6,5 м.д., доля FFA составила 0,56% и DAG 0,69%.
Пример 2
2010,5 г необработанного соевого масла, содержащего 785,1 м.д. соединений фосфора, охлаждали до 60°C при нормальном перемешивании с применением верхнеприводной мешалки. При поддерживающейся температуре 60°C добавляли 1,5316 г Purifine™ фирмы Verenium (PLC липаза, номер партии 90BU002A1) и 0,2073 г Lecitase® Ultra фирмы Novozymes (PLA1 липаза, номер партии LYN05007) с последующим добавлением 30 г деионизованной воды и всю смесь размешивали в течение 45 с. Масляную смесь перемешивали с нормальной скоростью в течение 60 мин при температуре 60°C. Затем обработанное ферментами масло центрифугировали и отдельно собирали фракции отделенного масла и сырых камедей. Доля остаточных фосфорсодержащих веществ в дегуммированном масле, совместно обработанном смесью ферментов PLC и PLA1 при нейтральном pH, составила 109,6 м.д. Доля FFA составила 0,61% и DAG 0,74%.
Пример 3
2005,3 г необработанного соевого масла, содержащего 742,9 м.д. соединений фосфора, нагревали до 75-80°C при нормальном перемешивании с применением верхнеприводной мешалки. Добавляли 2,0 г 50% вес./вес. раствора лимонной кислоты и размешивали 1 мин. Масло подвергали нормальному перемешиванию в течение 1 час с помощью верхнеприводной мешалки. Масло остужали при перемешивании с нормальной скоростью до температуры 60°C, затем добавляли 2,4 мл 4-молярного раствора гидроксида натрия и смесь размешивали в течение 10 с. Лимонная кислота и щелочь формировали слабый буфер с pH 5,0. При поддерживающейся температуре 60°C добавляли 0,7491 г Purifine™ фирмы Verenium (PLC липаза, номер партии 90BU002A1) с последующим добавлением 60 г деионизованной воды и всю смесь размешивали в течение 45 с. Масляную смесь перемешивали с нормальной скоростью в течение 60 мин. При поддерживающейся температуре 60°C добавляли 0,1220 г Lecitase® Ultra фирмы Novozymes (PLA1 липаза, номер партии LYN05007) и всю смесь размешивали в течение 45 с. Масляную смесь перемешивали с нормальной скоростью в течение 60 мин при температуре 60°C. Затем обработанное ферментами масло центрифугировали и отдельно собирали фракции отделенного масла и сырых камедей. Доля остаточных фосфорсодержащих веществ в масле, последовательно обработанном PLC, затем PLA1, составила 2,2 м.д. Доля FFA оказалась равной 0,58% и DAG 0,42%.
Пример 4
2002,0 г необработанного соевого масла, содержащего 747,3 м.д. соединений фосфора, нагревали до 75-80°C при нормальном перемешивании с применением верхнеприводной мешалки. Добавляли 2,0 г 50% вес./вес. раствора лимонной кислоты и размешивали 1 мин. Масло подвергали нормальному перемешиванию в течение 1 час с помощью верхнеприводной мешалки. Масло остужали при перемешивании с нормальной скоростью до температуры 60°C, затем добавляли 1,8 мл 4-молярного раствора гидроксида натрия и смесь размешивали в течение 10 с. Лимонная кислота и щелочь формировали слабый буфер с pH 4,5. При поддерживающейся температуре 60°C добавляли 2,2194 г Purifine™ фирмы Verenium (PLC липаза, номер партии 90BU002A1) с последующим добавлением 60 г деионизованной воды и всю смесь размешивали в течение 120 с. Масляную смесь перемешивали с нормальной скоростью в течение 15 мин. При поддерживающейся температуре 60°C добавляли 0,2198 г Lecitase® Ultra фирмы Novozymes(PLA1 липаза, номер партии LYN05007) и всю смесь размешивали в течение 120 с. Масляную смесь перемешивали с нормальной скоростью в течение 15 мин при температуре 60°C. Затем обработанное ферментами масло центрифугировали и отдельно собирали фракции отделенного масла и сырых камедей. Доля остаточных фосфорсодержащих веществ в масле, последовательно дегуммированном PLC и PLA1, составила 4,6 м.д. Доля FFA составила 0,37% и DAG 0,42%.
Пример 5
2000,8 г необработанного соевого масла, содержащего 747,3 м.д. соединений фосфора, нагревали до 75-80°C при нормальном перемешивании с применением верхнеприводной мешалки. Добавляли 2,0 г 50% вес./вес. раствора лимонной кислоты и размешивали 1 мин. Масло подвергали нормальному перемешиванию в течение 1 час с помощью верхнеприводной мешалки. Масло остужали при перемешивании с нормальной скоростью до температуры 50°C, затем добавляли 1,8 мл 4-молярного раст