Днк-плазмиды, обладающие повышенной экспрессией и стабильностью
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и вирусологии. Раскрыта ДНК-плазмида для доставки и экспрессии представляющих интерес антигена, эпитопа, иммуногена, пептида или полипептида. ДНК-плазмида содержит кассету гена устойчивости к канамицину (KanaR), в которой модифицирован промотор KanaR. ДНК-плазмида обладает повышенной экспрессией и стабильностью. Также описаны композиция, содержащая такую ДНК-плазмиду, и способы стимуляции иммунного ответа у животного и индуцирования иммунного ответа у животного с использованием композиции, содержащей ДНК-плазмиду. Изобретение может быть использовано для получения эффективных ДНК-вакцин. 4 н. и 14 з.п. ф-лы, 21 ил., 3 табл., 2 пр.
Реферат
Включение в описание изобретения сведений путем ссылки
Данная заявка включает в качестве ссылки предварительную заявку США №60/795324, поданную 27 апреля 2006. Все документы, цитируемые или упомянутые здесь ("цитируемые здесь документы"), и все документы, цитируемые или упомянутые в цитируемых здесь документах, вместе с инструкциями производителей, описаниями, спецификациями на продукт и технологическими картами для любых продуктов, упомянутых здесь или в любом документе, включенном здесь посредством ссылки, включены в данную заявку посредством ссылки и могут быть использованы для осуществления изобретения.
Область техники, к которой относится изобретение
Настоящее изобретение, в целом, относится к ДНК-вакцинам и способам их применения. В особенности, настоящее изобретение относится к ДНК-плазмидам с повышенной экспрессией и стабильностью, пригодных для ДНК-вакцин.
Предшествующий уровень техники
ДНК-вакцины, иначе называемые генетическими, плазмидными или полинуклеотидными вакцинами, представляют относительно простую и экономичную возможность переноса генов для иммунизации против антигенов. Низкая токсичность ДНК-вакцин стимулирует их дальнейшую разработку и дополнительные стратегии по улучшению эффективности этого подхода в клинической практике (рассмотрено в Shaw & Strong, Front Biosci. 2006 Jan 1; 11:1189-98). ДНК-вакцинация может обойти главные недостатки традиционных вакцин и имеет потенциал вакцин будущего. Однако коммерческий продукт все еще не вышел на рынок. Одним возможным объяснением этому может быть техническая неудача в индуцировании эффективной иммунной реакции у людей, при этом безопасность также может быть основной проблемой (опубликовано в Glenting & Wessels, Microb Cell Fact. 2005 Sep 6; 4:26).
Плазмида pVR1020 или 1012 (VICAL Inc.; Luke C. et al., Journal of Infectious Diseases, 1997, 175, 91-97; Hartikka J. et al., Human Gene Therapy, 1996, 7, 1205-1217, см, напр., Патенты США №5846946; 6451769; 6586409 и 6875748) представляет собой ДНК-плазмидный вектор, применяемый для вставки полинуклеотидной последовательности. Плазмиду pVR1020 получают из pVR1012 и она содержит сигнальную последовательность tPA человека. Найдены дополнительные ДНК-плазмиды, описанные, например, в Патентах США №6852705; 6818628; 6586412; 6576243; 6558674; 6464984; 6451770; 6376473 и 6221362. Однако для ДНК-вакцинации у плазмид, основанных на pVR1012, имеются недостатки, такие как нестабильность плазмид и гетерогенность в числе копий.
Соответственно, существует потребность в эффективной ДНК-вакцине, в особенности, обеспечивающей экспрессию представляющего интерес антигена-мишени, эпитопа, иммуногена, пептида или полипептида в количестве, достаточном для установления защитной реакции.
Цитирование или идентификация любого документа в данной заявке не является признанием, что такой документ является прототипом настоящего изобретения.
Сущность изобретения
Изобретение основано, частично, на экспериментальном наблюдении, что вставка транспозона между промотором гена устойчивости к канамицину и сайтом инициации трансляции аннулирует устойчивость к канамицину и при этом неожиданно способствует повышающей репликации плазмидной ДНК. Другими словами, выход мутантной плазмиды (содержащей транспозон) был в три раза выше по сравнению с немутантной плазмидой. На основании чего предположили, что эффективность экспрессии гена устойчивости к канамицину ("KanaR") оказывает влияние на репликацию плазмидной ДНК в бактериях, т.е. сниженная экспрессия гена устойчивости к канамицину способствует повышению скорости репликации плазмидной ДНК. В особенности, высокая скорость экспрессии KanaR может представлять сильную метаболическую нагрузку, которая нарушает оптимальную скорость репликации плазмидной ДНК и/или транскрипция гена KanaR нарушает сайт инициации репликации (ориджин репликации, ORI).
Настоящее изобретение относится к ДНК-плазмиде, которая может содержать ген устойчивости к канамицину ("KanaR"), в которой ген устойчивости к канамицину имеет наименее эффективный промотор для экспрессии KanaR и/или менее эффективный стартовый кодон. В преимущественном воплощении промотор KanaR является промотором Р1. Получаемая ДНК-плазмида обеспечивает более высокие выходы плазмидной ДНК и более высокую стабильность плазмиды, предположительно благодаря пониженной экспрессии KanaR. Предпочтительно, ДНК-плазмида может быть pLL10 или pLL14.
Настоящее изобретение также относится к ДНК-плазмиде, которая может содержать ген устойчивости к канамицину, в котором транспозон вставлен между промотором KanaR и сайтом инициации трансляции, что приводит к пониженной экспрессии KanaR. Получаемая ДНК-плазмида обеспечивает более высокие выходы плазмидной ДНК и более высокую стабильность плазмиды, предположительно благодаря пониженной экспрессии KanaR.
Настоящее изобретение охватывает составы для доставки и экспрессии антигена, эпитопа, иммуногена, пептида или полипептида, представляющего интерес, при этом состав может включать любые ДНК-плазмиды, описываемые здесь, и фармацевтически или ветеринарно подходящий носитель, наполнитель или эксципиент. В преимущественном воплощении носитель, наполнитель или эксципиент могут способствовать трансфекции и/или повышать стабильность вектора или белка. Предпочтительно, антиген, эпитоп, иммуноген, пептид или полипептид, представляющий интерес, может быть получен из птичьего, бычьего, собачьего, лошадиного, кошачьего или свиного вируса или патогена.
Изобретение дополнительно обеспечивает способы стимуляции иммунного ответа у животных, которые могут включать введение эффективного количества составов, здесь описываемых, в клетки животного и экспрессирование антигена, эпитопа, иммуногена, пептида или полипептида, представляющего интерес, в клетках. Изобретение также обеспечивает способы стимуляции и поддержания иммунного ответа у животного, которые могут включать введение эффективного количества составов, здесь описываемых, в клетки животного и экспрессирование антигена, эпитопа, иммуногена, пептида или полипептида, представляющего интерес, в клетках. Предпочтительно, животным может быть птица, бык, собака, лошадь, кошка или свинья.
Изобретение также охватывает наборы для осуществления любого из вышеописанных способов, которые могут включать ДНК-плазмиду или здесь описываемые составы вместе с инструкциями для осуществления способов стимуляции или установления иммунного ответа у животного.
Следует отметить, что в данном описании, в частности в формуле изобретения и/или параграфах, такие термины как «включает», «включенный», «включающий» и им подобные, могут иметь значение, придаваемое таким терминам в патентном законодательстве США, например, они могут означать «включает в себя», «заключает в себе» и т.п.; а такие термины, как «состоящий в основном из» и «состоит в основном из», имеют значение, приписываемое им в патентном законодательстве США, например, они разрешают элементы, не указанные явным образом, но исключают элементы, входящие в предшествующий уровень техники или затрагивающие фундаментальную или новую особенность изобретения
Эти и другие воплощения изобретения раскрыты в или вытекают из и охвачены нижеследующим подробным описанием.
Краткое описание чертежей
Следующее подробное описание, представленное в виде примера, но не предназначенное для ограничения изобретения только описываемыми специфичными воплощениями, может быть лучше понято в сочетании с прилагаемыми чертежами, в которых:
Фиг.1 иллюстрирует три потенциальных промотора KanaR экспрессионной кассеты, как показано в Примере 1: P1 (SEQ ID NO:1), Р2 (SEQ ID NO:2) и Р3 (SEQ ID NO:3). Р2 и Р3 частично совпадают;
Фиг.2 иллюстрирует схему pVR1012, демонстрируя направление транскрипции KanaR и положение ориджин репликации, ORI;
Фиг.3 илюстрирует, как кассету KanaR плазмиды pVR1012 в Примере 1 клонируют в мутагенный вектор pALTER-1;
Фиг.4 иллюстрирует, как сайт рестрикции PacI в Примере 1 был введен в прямом направлении ORF KanaR, получая пазмиду pLL2, как сайт рестрикции SwaI был введен в обратном направлении, как сайт рестрикции RsrII был введен в прямом направлении, получая pLL4, и, в конечном итоге, стартовый кодон трансляции ATG был мутирован с TTG, получая pLL6;
Фиг.5 иллюстрирует, как мутированная кассета KanaR pLL4 в Примере 1 была клонирована в плазмиду pVR1012, получая pLL7;
Фиг.6 иллюстрирует, как терминаторная последовательность rrnB, идентифицированная в Примере 1, была клонирована в плазмиду pLL7 с использованием PCR из pSB062 и последующим расщеплением PacI RsrII с формированием pLL9;
Фиг.7 иллюстрирует клонирование терминаторной последовательности speA, идентифицированной в Примере 1, в плазмиду pLL7 путем отжига синтетических олигонуклеотидов и расщепления Pad RsrII с формированием pLL11;
Фиг.8 иллюстрирует, как мутированная последовательность инициации трансляции плазмиды pLL6 была клонирована в pLL9 посредством расщепления Msd Pad с формированием pLL10;
Фиг.9 иллюстрирует, как промоторные последовательности Р2/Р3 (SEQ ID NOS: 2-3) вместе с P1 (SEQ ID NO:1), P1 (SEQ ID NO:1) и P2/P3 (SEQ ID NOS: 2-3), которые были идентифицированы в Примере 1, были клонированы с использованием URS11-URS12 PCR, URS13-URS12 PCR и URS11-URS14 PCR соответственно;
Фиг.10 иллюстрирует, как промоторная последовательность Р2/Р3 (SEQ ID NOS: 2-3) вместе с P1 (SEQ ID NO:1) была клонирована в плазмиду pLL9 с формированием pLL13;
Фиг.11 иллюстрирует, как промоторная последовательность P1 (SEQ ID NO:1) была клонирована в плазмиду pLL9 с формированием pLL14;
Фиг.12 иллюстрирует, как промоторная последовательность Р2/Р3 (SEQ ID NOS: 2-3) была клонирована в плазмиду pLL9 с формированием pLL15;
Фиг.13 иллюстрирует, как промоторная последовательность P1 (SEQ ID NO:1) была клонирована в плазмиду pLL7 с формированием pLL16;
Фиг.14 иллюстрирует некоторые производные pVR1012, полученные с различными пригодными промоторами и терминаторами, идентифицированные в Примере 1. Конструкции pLL13, pLL14, pLL15 и pLL16 имеют делеции в 192 пар оснований между промотором CMV и промотором Капа P1 (SEQ ID NO:1);
Фиг.15 иллюстрирует схематическое изображение производных pVR1012, демонстрируя участок в 192 п.о., удаленный в конструкциях pLL13-pLL16 Примера 1;
Фиг.16 иллюстрирует два графика способности бактериальных колоний к устойчивости в отношении увеличенных концентраций канамицина (Капа), в соответствии с Примером 1, при 50 мкл и 100 мкл разведениях бактериальных суспензий, соответственно;
Фиг.17 иллюстрирует графики плазмидных выходов, полученных при выращивании в лабораторных условиях. Бактериальные колонии Примера 1 были выращены в жидкой среде LB с Kana 100 мкг/мл;
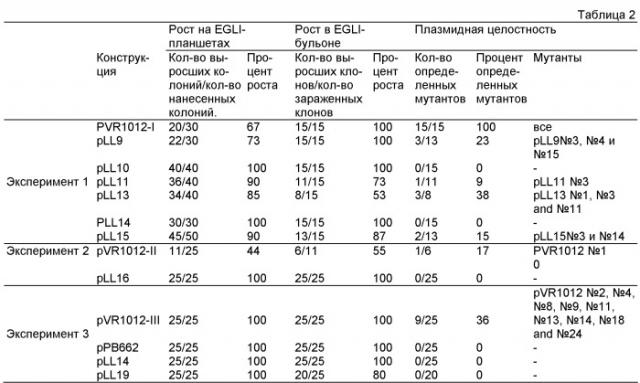
Фиг.18 иллюстрирует плазмидные выходы, выраженные как отношение к плазмидному выходу pLL14 (базисная линия = 100). Эксперимент 1 иллюстрирует 8-15 клонов на конструкцию, Эксперимент 2 иллюстрирует 6 клонов для pVR1012, 2 для pLL14 и 25 для pLL16 и Эксперимент 3 (25 клонов для pVR1012, рРВ662 и pLL14, и 20 для pLL9);
Фиг.19 иллюстрирует графики плазмидных выходов, полученные при выращивании в лабораторных условиях. Бактериальные колонии были выращены в среде EGLI. Плазмидные выходы выражали как отношение к парентеральному плазмидному выходу pVR1012 (базисная линия = 100) и
Фиг.20, 21 иллюстрирует индивидуальный плазмидный выход (указывающий на среднюю конструкцию pVR1012), показывающий гетерогенность клонов. (*: мутированная плазмида) и иллюстрирует графики плазмидных выходов трех разных клонов конструкции, адаптированных EGLI, согласно Примеру 1. Вариабельность выражается как индекс, где первый клон считается 100% эталоном.
Подробное описание изобретния
Изобретение основано, частично, на экспериментальном наблюдении, что вставка транспозона между промотором гена устойчивости к канамицину и сайтом инициации трансляции аннулирует устойчивость к канамицину и при этом неожиданно способствует ускорению репликации плазмидной ДНК. Другими словами, выход мутантной плазмиды (содержащей транспозон) был в три раза выше по сравнению с немутантной плазмидой. На основании чего предположили, что эффективность экспрессии гена устойчивости к канамицину ("KanaR") оказывает влияние на репликацию плазмидной ДНК в бактериях, т.е. сниженная экспрессия гена устойчивости к канамицину способствует повышению скорости репликации плазмидной ДНК. В особенности, относительно лимитирования питательными веществами высокая скорость экспрессии KanaR может представлять сильную метаболическую нагрузку, которая нарушает оптимальную скорость репликации плазмидной ДНК и/или транскрипция гена KanaR нарушает ориджин репликации (ORI).
Изобретение охватывает любую предполагаемую ДНК-плазмиду, в которой снижена экспрессия KanaR, что приводит к увеличению плазмидных выходов и более высокой стабильности плазмиды по сравнению, например, с плазмидой pVR1012 или ее производным, без сниженной экспрессии KanaR.
Настоящее изобретение относится к ДНК-плазмиде, которая может включать KanaR, в которой ген устойчивости к канамицину включает менее эффективный промотор для экспрессии KanaR и/или менее эффективный стартовый кодон. В преимущественном воплощении, промотор KanaR представляет собой промотор Р1 и стартовым кодоном является ATG. Получаемая ДНК-плазмида обеспечивает более высокие плазмидные выходы и более высокую стабильность плазмиды, предположительно благодаря сниженной экспрессии KanaR. Предпочтительно, ДНК-плазмидой может быть pLL10 или pLL14.
Настоящее изобретение также относится к ДНК-плазмиде, которая может включать ген устойчивости к канамицину, в котором транспозон вставлен между промотором KanaR и участком инициации трансляции, что обеспечивает сниженную экспрессию KanaR. Получаемая ДНК-плазмида обеспечивает более высокие плазмидные выходы и более высокую стабильность плазмиды, предположительно благодаря сниженной экспрессии KanaR.
Экспрессионным вектором является плазмидный вектор или вектор ДНК-плазмиды, в частности, экспрессионный вектор in vivo. В специфичном, не ограничивающем примере, ДНК-плазмидный вектор содержит элементы плазмид pVR1020 или 1012 (VICAL Inc.; Luke C. et al., Journal of Infectious Diseases, 1997, 175, 91-97; Hartikka J. et al., Human Gene Therapy, 1996, 7, 1205-1217, см, напр., Патенты США №5846946; 6451769; 6586409 и 6875748). Плазмиду pVR1020 получают из pVR1012 и она содержит сигнальную последовательность tPA человека. В одном воплощении человеческая сигнальная последовательность tPA включает от М(1) аминокислоты до S(23) аминокислоты в Genbank под номером HUMTPA14. В другом не ограничивающем примере плазмида, применяемая в качестве вектора для вставки полинуклеотидной последовательности, может содержать сигнальную пептидную последовательность лошадиного IGF1 от М(24) аминокислоты до А(48) аминокислоты в Genbank под номером U28070. Дополнительную информацию о ДНК-плазмидах, которые могут приниматься во внимание или использоваться в практике, можно найти, например, в Патентах США №6852705; 6818628; 6586412; 6576243; 6558674; 6464984; 6451770; 6376473 и 6221362.
В другом воплощении плазмидой может быть любая плазмида с геном устойчивости к канамицину, включая, но не ограничиваясь, векторы Clontech: Living Colors pAcGFP1, Living Colors pAcGFP1-C1, Living Colors pAcGFP1-N1, pAmCyan1-C1, pAmCyan1-N1, pAsRed2-C1, pAsRed2-N1, pCMV-DsRed-Express, pDsRed2-1, pDsRed2-C1, pDsRed2-N1, pDsRed-Express-1, pDsRed-Express-C1, pDsRed-Express-N1, pDsRed-Monomer-C1, pDsRed-Monomer-N1, pHcRed1-1, pHcRed1-C1, pHcRed1-N1/1, pIRES2-DsRed2, pIRES2-DsRed-Express, pLPS-AcGFP1-N Acceptor, Proteasome Sensor, pTimer, pZsGreen1-1, pZsGreen1-C1, pZsGreen1-N1, pZsYellow1-C1 и pZsYellow1-N1; векторы Invitrogen: pCR3, pCR3.1-Uni, pCR1000 и pZErO-2.1, и векторы Stratagene; pCMV-3Tag, pBK-CMV Phagemid, ZAP Express, pCMV-Script, pCMV-Tag, PCR-Script pMClneo и pMClneo Poly А. Можно сослаться на патенты США №6,942,975, 6,887,702, 6,849,442, 6,846,970, 6,825,012, 6,806,399, 6,803,230, 6,790,607, 6,696,278, 6,667,150, 6,624,344, 6,620,990, 6,610,909, 6,585,976, 6,573,437, 6,570,067, 6,562,584, 6,528,703, 6,503,748, 6,475,731, 6,410,317, 6,410,314, 6,387,654, 6,376,744, 6,350,934, 6,303,383, 6,297,054, 6,284,541, 6,258,999, 6,255,560, 6,248,937, 6,235,518, 6,174,708, 6,127,171, 6,121,511, 6,117,651, 6,054,635, 6,037,524, 6,018,103, 5,994,625, 5,981,191, 5,981,182, 5,977,439, 5,925,544, 5,910,488, 5,866,404, 5,851,808, 5,851,804, 5,830,727, 5,824,877, 5,792,935, 5,783,394, 5,750,871, 5,733,753, 5,733,744, 5,731,179, 5,723,746, 5,716,803, 5,712,112, 5,705,361, 5,654,180, 5,599,670, 5,591,577, 5,589,623, 5,569,834, 5,567,599, 5,565,347, 5,504,005, 5,463,174, 5,460,952, 5,436,138, 5,416,250, 5,416,011, 5,378,618, 5,256,568, 5,169,755, 5,137,829, 5,053,335, 5,004,863, 4,935,340, 4,920,054, 4,795,855, 4,782,022, 4,771,002, 4,626,510 и 4,567,146.
Настоящее изобретение также охватывает плазмиды с генами устойчивости к другим антибиотикам в дополнении к устойчивости к канамицину, таким как, но не ограничиваясь, ампициллин, хлорамфеникол, неомицин и тетрациклин.
В одном воплощении плазмидой может быть любая плазмида с геном устойчивости к ампициллину, включая, но не ограничиваясь, векторы Clontech: Living Colors pAcGFP1, pAmCyan, pAsRed2, pbetaga1-Basic, pbetagal-Control, pBI Tet, pBI-G Tet, pBI-L Tet, pCMVbeta, pCMV-Myc & pCMV-HA, pDsRed2, pDsRed-Express, pDsRed-Monomer Vector, pGFP, pGFPuv, pHcRed1, pIRES, pIRESbleo3, pIRESneo3, pIRESpuro3, pLP-IRESneo Acceptor, pLP-LNCX Acceptor, pLP-TRE2 Acceptor, pPUR, pRevTet-Off, pRevTet-Off-IN, pRevTet-On, pSEAP2-Basic, pSEAP2-Control, pTet-Off, pTet-On, pTet-tTS, pTimer, pTimer-1, pTK-Hyg, pTRE2, pTRE2hyg, pTRE2hyg2-6xHN, pTRE2hyg2-HA, pTRE2hyg2-Myc, pTRE2pur, pTRE2pur-6xHN, pTRE2pur-HA, pTRE2pur-Myc, pTRE-6xHN, pTRE-HA, pTRE-Myc, pTRE-Tight, pTRE-Tight-DsRed2, pZsGreen и pZsYellow; векторы Invitrogen: p2Bac, p2Bac/CAT/CAT, pAc5.1/V5-His, pAc5.1/V5-His/LacZ, pBAD-TOPO, pBlueBac, pBlueBac/His, pBlueBac/His/CAT, pBlueBac2, pBlueBac3, pBlueBac4, pBlueBac4/CAT, pcDNA1/Amp, pcDNA3/CAT, pcDNAII, pCMVSport1, pCMVSport2, pCMVSport2.2, pCMVSport4, pCR3, pCR3.1-Uni, pCRBac, pCRT7/CT-LacZ, pCRT7/CT-TOPO, pCRT7/NT-E3, pCRT7/NT-TOPO, pDW232, pFastBac1, pMEP4, pMT/LacZ, pMT/V5-His-TOPO, pPIC3, pPIC3K, pRBK, pSL301, pSPORT1-CAT, pYesTrp2-RalGDS и pYesTrp2-RalGDS, и векторы Stratagene: PCR-Script, pBC Phagemid, pMClneo и pMClneo Poly A, pBlueScript II Phagemid и SuperCos I. Ссылка может быть дана также на Патенты США №6,987,006, 6,972,322, 6,916,611, 6,887,702, 6,803,230, 6,790,607, 6,706,524, 6,696,278, 6,667,150, 6,569,678, 6,562,584, 6,544,782, 6,521,449, 6,503,748, 6,486,134, 6,410,317, 6,410,314, 6,387,654, 6,376,192, 6,291,238, 6,255,071, 6,221,630, 6,140,087, 6,127,171, 6,025,193, 6,025,192, 6,010,875, 5,981,279, 5,981,182, 5,955,363, 5,925,544, 5,919,676, 5,912,153, 5,894,060, 5,877,400, 5,866,404, 5,851,808, 5,834,191, 5,830,727, 5,830,690, 5,786,162, 5,776,773, 5,773,697, 5,766,940, 5,733,753, 5,731,193, 5,716,803, 5,705,361, 5,691,155, 5,602,300, 5,527,691, 5,504,005, 5,470,729, 5,436,138, 5,434,065, 5,432,082, 5,378,618, 5,290,691, 5,264,354, 5,256,568, 5,256,546, 5,160,489, 5,151,364, 5,147,789, 5,143,836, 5,126,252, 5,093,251, 5,081,022, 4,997,767, 4,988,622, 4,935,364, 4,920,054, 4,889,806, 4,879,230, 4,876,202, 4,845,031, 4,808,519, 4,766,072, 4,752,574, 4,703,012, 4,634,678,487,835, 4,349,629 и 4,340,674.
В другом воплощении плазмидой может быть любая плазмида с геном устойчивости к хлорамфениколу, включая, но не ограничиваясь, векторы Clontech: pDNR-LacZ Donor Reporter, pDNR-SEAP Donor Reporter, pLP-AcGFP1-C Acceptor, pLP-BacPAK9 Acceptor, pLP-BacPAK9-6xHN Acceptor, pLP-CMV-HA Acceptor, pLP-CMV-Myc Acceptor, pLP-CMVneo Acceptor, pLP-GADT7 AD Acceptor, pLP-GBKT7 DNA-Acceptor, pLP-IRESneo Acceptor, pLP-LNCX Acceptor, pLP-PROTet-6xHN Acceptor, pLP-RevTRE Acceptor, pLPS-AcGFPl-N Acceptor и pLP-TRE2 Acceptor; векторы Invitrogen: pLysS и pSPORT1-CAT, и векторы Stratagene: pBC Phagemid и PCR-Script. Ссылку можно дать на патенты США №6,916,611, 6,900,010, 6,887,702, 6,884,576, 6,846,671, 6,803,230, 6,696,278, 6,673,537, 6,667,150, 6,562,584, 6,548,246, 6,503,748, 6,436,694, 6,420,110, 6,410,317, 6,410,314, 6,391,640, 6,387,654, 6,376,192, 6,331,527, 6,309,883, 6,309,830, 6,291,211, 6,255,071, 6,252,140, 6,221,630, 6,146,871, 6,127,171, 6,107,093, 6,083,750, 6,031,151, 6,025,192, 6,001,564, 5,994,132, 5,994,066, 5,981,182, 5,955,363, 5,932,479, 5,928,891, 5,925,544, 5,925,523, 5,908,747, 5,866,404, 5,851,808, 5,821,093, 5,766,940, 5,733,753, 5,728,571, 5,716,803, 5,707,830, 5,639,644, 5,591,577, 5,470,729, 5,437,988, 5,434,065, 5,256,568, 5,256,546, 5,053,335, 5,004,863, 4,868,111, 4,839,284, 4,752,574 и 4,711,849.
В другом воплощении плазмидой может быть любая плазмида с геном устойчивости к неомоцину, включая, но не ограничиваясь, векторы Clontech: pRevTet-Off Vector, pRevTet-Off-IN Vector, pIRES Vector, pIRESbleo3 Vector, pIREShyg3 Vector, pIRESneo3 Vector, pIRESpuro3 Vector, pLP-IRESneo Acceptor Vector, pTet-Off Vector, pTet-On Vector, pIRES2-DsRed-Express Vector, pLXIN Retroviral Vector, pIRES2-DsRed2 Vector, Proteasome Sensor Vector, pLXSN Retroviral Vector, pCMV-DsRed-Express Vector, Living Colors pAcGFP1-C1 Vector, pAmCyan1-C1 Vector, pAsRed2-C1 Vector, pDsRed2-C1 Vector, pDsRed-Express-C1 Vector, pDsRed-Monomer-C1 Vector, pHcRed1-C1 Vector, pZsGreen1-C1 Vector, pZsYellow1-C1 Vector, Living Colors pAcGFP1 Vector, pDsRed2-1 Vector, pDsRed-Express-1 Vector, pHcRed1-1 Vector, pTimer Vector, pZsGreen1-1 Vector, pQCXIX Retroviral Vector, LRCX Retroviral Vector Set, pLNCX2 Retroviral Vector, pLP-LNCX Acceptor Vector, pQCXIN Retroviral Vector, Living Colors pAcGFP1-N1 Vector, pAmCyan1-N1 Vector, pAsRed2-N1 Vector, pDsRed2-N1 Vector, pDsRed-Express-N1 Vector, pDsRed-Monomer-N1 Vector, pHcRed1-N1/1 Vector, pLPS-AcGFP1-N Acceptor Vector, pZsGreen1-N1 Vector, pZsYellow1-N1 Vector и VP16 Minimal Domain Vector Set; векторы Invitrogen: pcDNA1/Neo, pcDNA3/CAT (замещенные на pcDNA3.1/CAT), pCR3 (замещенные на pCR3.1), pCR3.1-Uni и pRc/CMV, и векторы Stratagene: pCMV-3Tag Vectors, pCMV-Script Vector, SuperCos I Vector, ZAP Express Vector, pCMV-Tag Vectors, pMClneo и pMClneo Poly A Vectors, PCR-Script Cloning Kits, Vitality hrGFP Mammalian Expression Vector, pBK-CMV Phagemid Vector и Lambda ZAP-CMV Vector. Ссылку можно также дать на патенты США №7,026,525, 6,942,995, 6,905,818, 6,815,185, 6,806,399, 6,787,687, 6,747,189, 6,673,602, 6,673,537, 6,667,150, 6,624,344, 6,620,990, 6,440,444, 6,429,357, 6,391,633, 6,376,192, 6,316,253, 6,294,187, 6,291,211, 6,255,560, 6,252,140, 6,248,937, 6,232,526, 6,221,630, 6,210,930, 6,207,879, 6,194,636, 6,114,146, 6,096,717, 6,071,512, 5,998,144, 5,985,560, 5,969,211, 5,955,363, 5,955,319, 5,939,288, 5,902,577, 5,894,060, 5,891,634, 5,830,698, 5,807,742, 5,750,871, 5,733,779, 5,665,565, 5,639,663, 5,614,381, 5,583,278, 5,470,726, 5,463,174, 5,416,011, 5,352,605, 5,278,056, 5,256,568, 5,149,636, 5,017,478, 4,957,865, 4,935,340, 4,839,284, 4,792,520, 4,766,066, 4,752,574, 4,740,463, 4,663,285, 4,536,475, 4,513,086, 4,513,085, 4,503,155, 4,468,462, 4,460,688, 4,430,434 и 4,416,994.
В другом воплощении плазмидой может быть любая плазмида с геном устойчивости к тетрациклину, включая, но не ограничиваясь, векторы Clontech: pRevTet-Off Vector, pRevTet-On Vector, pRevTet-Off-IN Vector, Creator-Compatible PROTet 6xHN Bacterial Expression System, PROTet 6xHN Bacterial Expression System, pTRE-Tight Vector, pTet-Off Vector, pTet-On Vector, Tet-Off Gene Expression System, Tet-On Gene Expression System, Adeno-X Tet-Off Expression System 1, Adeno-X Tet-On Expression System 1, Adeno-X Viral DNA (расщепленный PI-Sce I/I-Ceu I), Creator-Compatible RevTet-Off Retroviral Gene Expression System, Creator-Compatible RevTet-On Retroviral Gene Expression System, pLP-RevTRE Acceptor Vector, pRevTRE Vector, RevTet-Off System, RevTet-On System, pBI Tet Vector, pBI-G Tet Vector, pBI-L Tet Vector, pTet-tTS Vector, pLP-TRE2 Acceptor Vector, pTRE2 Vector, pTRE2hyg Vector, pTRE2pur Vector, Tet System Approved FBS, US-Sourced (гамма-облученные), pTRE-Tight-DsRed2 Vector и VP 16 Minimal Domain Vector Set, и векторы Invitrogen: pTet-tTak и pTet-Splice. Сослаться можно также на патенты США №6,924,101, 6,905,836, 6,777,229, 6,759,236, 6,699,702, 6,699,692, 6,696,278, 6,680,301, 6,673,537, 6,667,150, 6,642,052, 6,620,618, 6,613,528, 6,544,782, 6,541,003, 6,503,748, 6,482,636, 6,440,741, 6,436,694, 6,410,317, 6,392,121, 6,376,192, 6,309,883, 6,303,383, 6,265,562, 6,261,807, 6,221,630, 6,218,181, 6,136,536, 6,127,171, 6,080,575, 6,033,856, 6,022,731, 6,010,875, 5,958,680, 5,955,363, 5,891,718, 5,869,035, 5,866,410, 5,858,762, 5,851,796, 5,849,576, 5,840,521, 5,830,727, 5,830,690, 5,786,162, 5,766,940, 5,637,503, 5,593,860, 5,585,254, 5,527,691, 5,516,669, 5,508,176, 5,384,259, 5,378,618, 5,348,886, 5,290,691, 5,256,568, 5,256,546, 5,166,070, 5,158,891, 5,151,364, 5,147,789, 5,053,335, 4,983,522, 4,879,230, 4,876,202, 4,874,703, 4,778,761, 4,752,574, 4,703,012, 4,680,260, 4,663,285, 4,634,677, 4,631,259, 4,581,335, 4,374,200 и 4,349,629.
Термин «плазмида» охватывает любую единицу транскрипции ДНК (транскриптон), содержащую полинуклеотид изобретения и элементы, необходимые для его экспрессии in vivo в клетке или клетках желаемого хозяина или мишени; и в этой связи примечательно, что сверхскрученная или несверхскрученная кольцевая плазмида, а также плазмида линейной формы входят в объем изобретения.
Каждая плазмида включает или состоит преимущественно из, в дополнение к полинуклеотиду, кодирующему антиген, эпитоп или иммуноген, функционально слитой с гетерологичной пептидной последовательностью, вариант, аналог или фрагмент, функционально связанный с промотором, или находится под контролем промотора или зависим от промотора. В общем, преимущественным является применение сильного промотора, функционального в эукариотических клетках. Предпочтительным сильным промотором является ранний промотор цитомегаловируса (CMV-IE), взятый от человека или от мыши, или, при необходимости, от других животных, таких как крыса или морская свинка. Промотор CMV-IE может включать конкретную промоторную часть, которая может или не может быть связана с энхансерной частью. Ссылку можно дать на ЕР-А-260 148, ЕР-А-323 597, патенты США №5,168,062, 5,385,839 и 4,968,615, а также на заявку РСТ WO 87/03905. Промотором CMV-IE является предпочтительно CMV-IE человека (Boshart М. et al, Cell., 1985, 41, 521-530) или CMV-IE крысы.
В более общих понятиях, промотор имеет как вирусное, так и клеточное происхождение. Сильным вирусным промотором, кроме CMV-IE, который может быть пригодным для применения в рамках изобретения, является ранний или поздний промотор вируса SV40 или промотор LTR вируса саркомы Рауса. Сильным клеточным промотором, который может быть пригодным для применения в рамках изобретения, является промотор гена цитоскелета, такой как, напр., промотор десмина (Kwissa М. et al., Vaccine, 2000, 18, 2337-2344) или промотор актина (Miyazaki J. et al., Gene, 1989, 79, 269-277).
Функциональные субфрагменты этих промоторов, т.е. части этих промоторов, которые сохраняют адекватную промоторную активность, включены в настоящее изобретение, напр., усеченные промоторы CMV-IE, описанные в заявке РСТ WO 98/00166 или патенте США №6,156,567, могут практически использоваться в изобретении. Промотор в практическом использовании изобретения, следовательно, включает производные и субфрагменты полноразмерного промотора, которые сохраняют достаточную промоторную активность и вследствие чего функционируют как промотор, при этом, предпочтительно, промоторная активность практически аналогична активности истинного или полноразмерного промотора, из которого производное или субфрагмент получен, напр., активность усеченных промоторов, описанных в патенте США №6,156,567, сходна с активностью полноразмерных промоторов CMV-IE. Таким образом, CMV-IE промотор, в практическом применении изобретения, может включать или состоять преимущественно из или состоять из промоторной части полноразмерного промотора и/или энхансерной части полноразмерного промотора, а также из производных и субфрагментов.
Предпочтительно, плазмиды включают или состоят преимущественно из других элементов, контролирующих экспрессию. В особенности предпочтительным является включение стабилизирующей последовательности(ей), напр., интронной последовательности(ей), предпочтительно первого интрона hCMV-IE (заявка РСТ WO 89/01036), интрона II гена β-глобина кролика (van Ooyen et al., Science, 1979, 206, 337-344).
Относительно сигнала полиаденилирования (polyA) для плазмид и вирусных векторов, кроме поксвирусов, применение может в большей степени затрагивать сигнал poly(A) гена бычьего гормона роста (bGH) (см. Патент США №5,122,458), или сигнал poly(A) гена кроличьего β-глобина или сигнал poly(A) вируса SV40.
Изобретение обеспечивает экспрессию любого пептида-мишени или полипетида, предпочтительно антигена, эпитопа, иммуногена, пептида или полипептида, представляющего интерес, посредством ДНК-плазмиды настоящего изобретения. Изобретение предполагает экспрессию любого антигена, эпитопа, иммуногена, пептида или полипептида, представляющего интерес, в ДНК-плазмидах, описываемых здесь. ДНК-плазмиды могут экспрессировать один или более антигенов, эпитопов или иммуногенов, представляющих интерес.
В преимущественном воплощении, антиген, эпитоп, иммуноген, пептид или полипептид получают из птичьего, бычьего, собачьего, лошадиного, кошачьего или свиного вируса или патогена. В другом воплощении, антиген, эпитоп, иммуноген, пептид или полипептид может быть получен из вируса Западного Нила. В другом воплощении антиген, эпитоп, иммуноген, пептид или полипептид может быть получен из вируса или патогена человека.
Птичьи антигены, эпитопы или иммуногены изобретения могут быть получены из вируса болезни Марека (MDV) (напр., серотипов 1 и 2, предпочтительно 1), вируса псевдочумы птиц (NDV), вируса болезни Гамборо или вируса инфекционного бурсита птиц (IBDV), вируса инфекционного бронхита (IBV), вируса инфекционной анемии или вируса анемии цыплят (CAV), вируса инфекционного ларинготрахеита (ILTV), вируса энцефаломиелита или вируса энцефаломиелита птиц (AEV или вируса лейкоза птиц ALV), вируса геморрагического энтерита индюшек (HEV), пневмовируса (TRTV), вируса птичьего гриппа, вируса птичьего гидроперикардита, птичьих реовирусов, Escherichia coli, Mycoplasma gallinarum, Mycoplasma gallisepticum, Haemophilus avium, Pasteurella gallinarum, Pasteurella multocida gallicida и их смесей. Предпочтительно, для MDV иммуногеном предпочтительно является gB и/или gD, напр., gB и gD, для NDV иммуногеном является предпочтительно HN и/или F, напр., HN и F; для IBDV иммуногеном предпочтительно является VP2; для IBV иммуногеном является предпочтительно S (более предпочтительно S1) и/или М и/или N, напр., S (или S1) и М и/или N; для CAV иммуногеном является предпочтительно VP1 и/или VP2; для ILTV иммуногеном является предпочтительно gB и/или gD; для AEV иммуногеном предпочтительно является env и/или gag/pro, напр., env и gag/pro или gag/pro; для HEV иммуногеном является предпочтительно белок 100 К и/или гексон; для TRTV иммуногеном является предпочтительно F и/или G, и для птичьей чумы иммуногеном является предпочтительно НА и/или N и/или NP, напр., НА и N и/или NP.
Бычьи антигены, эпитопы или иммуногены согласно изобретению могут быть получены из вируса BHV-1, BRV, bPI-3 и/или BCV или бычьего патогена, выбранного из группы, включающей, но не ограничиваясь, бычий респираторно-синцитиальный вирус и вирус диареи крупного рогатого скота. Иммуногенами BRSV могут быть BRSV F или G или N, такие как BRSV F и/или G или N и/или G. BHV-1-иммуногенами могут быть gB и/или gC и/или gD. BVDV-иммуногенами могут быть белок ЕО (gp48) и/или белок Е2 (gp53). BVDV может быть типом 1 и/или типом 2. bPI-3-иммуногенами могут быть bPI-3 F и/или HN. См. также патенты США №6,451,770, 6,376,473, 6,224,878 относительно иммуногенов бычьих патогенов и молекул нуклеиновых кислот, кодирующих их, и конструкций, которые их экспрессируют.
Собачьи антигены, эпитопы или иммуногены согласно изобретению могут быть получены из вируса цистицеркоза, вируса собачьей чумы (CDV), вируса собачьего парагриппа 2 типа (CPI-2), собачьего герпесвируса 1 типа (CHV-1), вируса бешенства (рабдовирус), собачьего парвовируса (CPV), собачьего коронавируса (CCV), собачьего аденовируса, Borrelia burgdorferi, Leptospira и их смесей. Предпочтительно, для CDV иммуногеном является предпочтительно F и/или НА (см. также патенты США №6,309,647, 5,756,102 относительно иммуногенов CDV и конструкций); для CPV иммуногеном является предпочтительно VP2; для CCV иммуногеном является предпочтительно S и/или М; для CHV-1 иммуногеном является предпочтительно gB и/или gC и/или gD (см. также патенты США №5,688,920, 5,529,780, regarding иммуногенов CHV и конструкций); для вируса бешенства иммуногеном является предпочтительно G (см. также патент США №5,843,456 относительно комбинированных композиций против бешенства); для Borrelia burgdorferi иммуногеном является предпочтительно OspA (см. также патент США №6,368,603 относительно комбинированных композиций OspA).
Лошадиные антигены, эпитопы или иммуногены согласно изобретению могут быть получены из вируса EHV-1 и/или EHV-4 или другого лошадиного патогена, выбранного из группы, включающей, но не ограничиваясь, вирус конского гриппа (EIV), вирус восточного энцефалита (EEV), вирус западного энцефалита (WEV), вирус венесуэльского энцефалита (VEV), агент болезни Лайма, Borrelia burgdorferi, Clostridium tetani, вирус лошадиного артрита (EAV) и вирус бешенства. Антигенами, эпитопами или иммуногенами могут быть гликопротеины EHV, такие как gB, gD, gB+gD, gC и gE, для EIV иммуногеном является предпочтительно НА, NP и/или N; для вирусов энцефалита иммуногеном является предпочтительно С и/или Е1 и/или Е2; и для Clostridium tetani иммуногеном являются все части субъединицы С тетанического токсина. Ссылки можно дать на Патенты США №6,395,283, 6,248,333, 5,338,683, 6,183,750 или иммуногены лошадиных патогенов и молекулы нуклеиновых кислот, кодирующие их, и конструкции, экспрессирующие их.
Кошачьи антигены, эпитопы или иммуногены согласно изобретение могут быть получены из кошачьего герпесвируса 1 типа (FHV-1), кошачьего кальцивируса (FCV), вируса бешенства (рабдовирус), кошачьего парвовируса (FPV), вируса кошачьего инфекционного перитонита (FIPV), вируса кошачьей лейкемии (FeLV), вируса кошачьего иммунодефицита (FIV), Chlamydia и их смесей. Предпочтительно, для FeLV иммуногеном является предпочтительно env и/или gag и/или pol, напр., gag/pol; для FPV иммуногеном является предпочтительно VP2; для FIPV иммуногеном является предпочтительно S и/или М и/или N, напр., S и М и/или N (см. также патенты США №6,348,196 и 5,858,373 и их иммуногены и конструкции); для FHV иммуногеном является предпочтительно gB и/или gC и/или gD, напр., gB и gC и/или gD (см. также патенты США №5,338,683, 6,183,750; для герпесвирусных иммуногенов и конструкций, экспрессирующих их); для FCV иммуногеном является предпочтительно С; для FIV иммуногеном является предпочтительно env и/или gag и/или pro, напр., gag/pro, env или env и gag/pro (см. также иммуногены и конструкции, рассматриваемые в Tartaglia et al., патентной заявке США №08/746,668, поданной 14 ноября 1996); для вируса бешенства иммуногеном является предпочтительно G.
Свиные антигены, эпитопы или иммуногены согласно изобретению могут быть получены из вирусу PRRS и/или свиного патогенна, выбранного из группы, включающей, но не ограничиваясь, вирус псевдобешенства, вируса гриппа свиней, свиного парвовируса, вируса инфекционного гастроэнтерита (коронавирус), свиного цирковируса, такого как свиной цирковирус 2 типа, ротавируса, свиного аденовируса 3 типа, Escherichia coli, Erysipelothrix rhusiopathiae, Bordetella bronchiseptica, Clostridium spp., Salmonella spp., Haemophilus parasuis, Pasteurella multocida, Streptococcus suis, Mycoplasma hyopneumoniae и Actinobacillus pleuropneumoniae. Антигены, эпитопы или иммуногены свиных патогенов могут включать gB псевдовируса бешенства, gC псевдовируса бешенства, gD псевдовируса бешенства, НА свиного гриппа, NA свиного гриппа, NP свиного гриппа, ORF4 вируса репродуктивно-респираторный синдром свиней, ORF7 вируса репродуктивно-респираторный синдром свиней, ORF5 PRRSV, ORF3 PRRSV, ORF6 PRRSV, открытые рамки считывания 5 (ORF5) и 6 (ORF6) PRRSV, открытые рамки считывания 5 (ORF5) и 3 (ORP3) и 6 (ORF6) PRRSV, El вируса холеры свиней, ген Е2 вируса холеры свиней, VP2 парвовируса, ORF1 свиного цирковируса 2 типа или ORF2 свиного цирковируса 2 типа. Ссылки приводятся на патенты США №6,517,843, 6,497,883, 6,391,314, 6,379,676, 6,217,883, 6,207,165 и публикацию патента США №2003003112 и WO 99/53047, WO 99/08706, WO 01/83737 и WO 00/47756 или иммуногены свиных патогенов, молекулы нуклеиновых кислот, кодирующие их, и конструкции, экспрессирующие их.
ДНК-плазмиды настоящего изобретения могут экспрессировать один или более полинуклеотидов вируса Западного Нила ("WNV"), кодирующих Е, prM, М или комбинации или их полипротеины (напр., Е или Е и prM или Е и М или Е и prM и М или полипртеин Е-prM-М или полипротеин prM-Е или полипротеин М-Е или, по меньшей мере, их эпитоп). Согласно воплощению изобретения другой вектор или векторы в препарате включает, состоит преимущественно из или состоит из полинуклеотида, который кодирует, и при соответствующих условиях вектор экспрессирует один или более других протеинов вируса WN, напр. prM, М, prM-М или его эпитоп.
В настоящем изобретении термин «антиген» или «иммуноген» означает вещество, вызывающее специфический иммунный ответ у животного-хозяина. Антиген может включать целый организм, убитый, ослабленный или живой; субъединицу или часть организма; рекомбинантный вектор, содержащий вставку с иммуногенными свойствами; часть или фрагмент ДНК, способный вызывать иммунный ответ после презентации животному-хозяину; белок, полипептид, пептид, эпитоп, гаптен или любую их комбинацию. Альтернативно, иммуноген или антиген может включать токсин или антитоксин.
Термин "иммуногенный белок или пептид" в используемом здесь значении также включает пептиды и полипептиды, которые иммунологически активны в том смысле, что однажды введенные в хозяина они способны индуцировать иммунный ответ гуморального и/или клеточного типа, направленного против белка. Предпочтительно белковый фрагмент представляет собой фрагмент, который обладает практически такой же иммунологической активностью, что и общий белок. Таким образом, белковый фрагмент согласно изобретению включает или состоит преимущественно из или состоит из, по меньшей мере, одного эпитопа или антигенной детерминанты. Термин эпитоп относится к участку белка, способному индуцировать иммунную реакцию гуморального типа (В-клетки) и/или клеточного типа (Т-клетки).
Термин "иммуногенный белок или пептид" дополнительно предполагает делеции, присоединения и замены в последовательности, поскольку функции полипептида заключаются в продуцировании иммунологической реакции, как здесь определено. В этой связи особенно предпочтительные замены, в целом, будут консервативными по природе, т.е. такими заменами, которые происходят в семействе аминокислот. Например, аминокислоты обычно подразделяют на четыре семейства: (1) кислотные - аспартат и глутамат; (2) основные - лизин, аргинин, гистидн; (3) неполярные - аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) незаряженные полярные - глицин, аспарагин, глутамин, цистин, серии, треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируют как ароматические аминокислоты. Было корректно предсказано, что изолированная замена лейцина на изолейцин или валин или наоборот; аспартата на глутамат или наоборот; треонина на серии или наоборот; или аналогичная консервативная замена аминокислоты на структурно родственную аминокислоту не оказывает основной эффект на биологическую активность. Белки, имеющие практически такую же аминокислотную последовательность, что и исходная молекула, но обладающие минорными заменами в аминокислотной последовательности, которые практически не влияют на иммуногенность белка, находятся тем самым в рамках определения исходного полипептида.
Термин "эпитоп" относится к участку на антигене или гаптене, на который отвечают специфичные В-клетки и/или Т-клетки. Термин также используется взаимозаменяюще с "антигенной детерминантой" или "сайтом антигенной детерминанты". Антитела, которые распознают такой эпитоп, могут быть идентифицированы с помощью иммунологического анализа, показывая способность одного антитела блокировать связывание другого антитела с антигеном-мишенью.
"Иммунологический ответ" на композицию или вакцину представляет развитие в хозяине клеточного и/или антителоопосредованного иммунного ответа на композицию или вакцину, представяющую интерес. Обычно "иммунологический ответ" включает, но не ограничивается, один или более следующих эффектов: продукцию антител, В-клеток, Т-хелперов и/или цитотоксических Т-клеток, направленных специфично на антиген, или антигены, включенные в композицию или вакцину, представляющую интерес. Предпочтительно, хозяин будет проявлять как терапевтиче