Способ и устройство для определения минорных клеточных популяций в гетерогенных клеточных популяциях
Иллюстрации
Показать всеИзобретение относится к области медицины. Применение устройства для определения фетоматеринской геморрагии или химер, для определения аналита, присутствующего на клетках в малых концентрациях, для определения значения гематокрита и/или для параллельного определения связанных с клетками аналитов в реакциях смешанного типа в жидкой пробе осуществляют с использованием устройства. Устройство состоит, по меньшей мере, из одной загрузочной зоны (5), предназначенной для нанесения жидкой пробы; пористой мембраны (2), через которую могут проникать клеточные компоненты, причем на этой мембране имеется по меньшей мере одна индикаторная зона, способная взаимодействовать со связанными с клетками аналитами и содержащая по меньшей мере один связывающий элемент, связывающий связанные с клетками аналиты; и по меньшей мере одной абсорбирующей области (3) на мембране, которая поглощает жидкость после прохождения ею индикаторных зон, причем по меньшей мере одна индикаторная зона расположена между загрузочной зоной (5) и абсорбирующей областью (3). Использование устройства позволяет быстро и с высокой степенью чувствительности провести определение. 23 з.п. ф-лы, 5 пр., 5 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способам определения минорных клеточных популяций в гетерогенных клеточных популяциях. Способы применимы для концентрирования и количественной оценки минорных клеточных популяций в гетерогенных клеточных популяциях, например - в случае фетоматеринской геморрагии; для параллельного определения связанных с клетками аналитов, и за счет этого - для определения обеих клеточных популяций в реакциях смешанного типа после трансфузии, при фетоматеринской геморрагии или в случае так называемых химер; для выявления аналитов, присутствующих на поверхности клеток в малых концентрациях; и/или для определения гематокрита. Кроме того, изобретение предусматривает устройство, подходящее для данного способа.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
ФМГ (фетоматеринская геморрагия)
Во время беременности регулярно происходит попадание крови из кровотока плода в кровоток матери (фетоматеринская геморрагия, ФМГ). В литературе указаны величины от 0,1 мл до примерно 30 мл; примерно в 96-98% случаев беременности ФМГ<2 мл, но примерно в 0,3% случаев беременности бывают и количества, превышающие 30 мл. Если принять, что объем крови матери равен 5000 мл, то это означает, что в кровоток матери попадает от 0,002% до 0,6% эритроцитов другого сорта с антигенным профилем, отличающимся от антигенного профиля матери, что может иметь клиническое значение, если приводит к иммунизации. Наиболее ярким примером является D- мать, которая беременна D+ плодом. Если у матери образуются анти-D-антитела, то при следующей беременности D+ плодом это может иметь фатальные последствия (Morbus hamolyticus neonatorum = желтушный синдром новорожденных, ЖСН). Поэтому в таких ситуациях матери проводят так называемую анти-D-профилактику. Тем не менее, очень важно иметь возможность оценивать объем ФМГ, так как при ФМГ>30 мл стандартная анти-D-терапия не обеспечивает достаточной защиты. Так, стандартная иммунизация в США осуществляется введением 250-300 мкг анти-D-иммуноглобулина G (IgG), за счет чего обеспечивается достаточная профилактика у беременной, в кровоток которой попало 15 мл эритроцитов плода, то есть 25-30 мл крови плода. В Европе назначаемая стандартная доза часто бывает ниже, а именно - от 100 до 150 мкг анти-D-иммуноглобулина G, что обеспечивает защиту при ФМГ, равной 8-10 мл. Каждое учреждение, которое проводит анти-D-профилактику, должно иметь в своем распоряжении способ, который позволял бы легко обнаруживать большие уровни ФМГ (Issitt P.D. and Anstee D.J. In: Applied Blood Group Serology [4th edition], Montgomery Scientific Publications. Chapter 41: Hemolytic disease of the newborn, p.1045-1050).
С помощью стандартных серологических анализов на группу крови, например - анализов, выявляющих D-антиген, такие малые количества эритроцитов второй популяции, которые указаны выше, определить невозможно.
Поэтому существует ряд анализов, которые были разработаны специально для выявления ФМГ. Эти анализы выявляют фетальные эритроциты, D-антиген группы крови или гемоглобин F.
| Анализы для выявления ФМГ | Предел обнаружения ФМГ |
| Розеточный тест: | Примерно 10 мл |
| Данный тест основан на обнаружении агрегатов эритроцитов и их оценке под микроскопом. Выявление фетального D-антигена. | |
| (Jones A.R., Silvers S. Blood, 1958; 13:763. | |
| Sebring E.S., Polesky H.F. Transfusion 1982; 22:468. | |
| Sebring E.S. In: Hemolytic disease of the newborn. Arlington VA; Am. Assoc. Blood Banks 1984:87). | |
| Тест Клейхауера-Бетке: | Примерно 5 мл |
| Данный тест основан на высокой резистентности фетальных эритроцитов к кислотной элюции и их микроскопической оценке. Определяют фетальные клетки. | |
| (Kleihauer E., Braun Н., Betke К. Klein Wschr. 1957; 35:637) | |
| Проточная цитометрия: | Примерно 1 мл |
| D-антиген или гемоглобин F маркируют соответствующими антителами и обнаруживают с помощью флуоресцирующего второго антитела. Выявляют фетальный D-антиген/гемоглобин. | |
| Garratty G., Arndt P. Transfusion 1995; 35:157. | |
| Davis B.H. Clin. Lab. Med. 2001; 21:829. | |
| Тест с потреблением антител: | Примерно 15 мл |
| Тест является первым тестом, используемым для выявления ФМГ, который основан на рутинном способе определения группы крови (гелевая технология). Он основан на потреблении анти-D-реагента фетальными эритроцитами. Жидкая реакционная фракция инкубируется с D-позитивными тестовыми клетками и центрифугируется в гелевом тесте. Выявление фетального D-антигена. | |
| Lapierre Y., Rigal D., Adam J., Josef D., Meyer Аюб Greber S., Drot C. Transfusion 1990; 30:109. | |
| David M., Stelzer A., Wittmann G., Dudenhausen J.W., Salama A.Z. Geburtshilfe Neonatal. 1999; 203:241. |
С помощью этих тестов выявляют эритроцитарные антигены, фетальные эритроциты или характерный для фетальных эритроцитов гемоглобин F. Общим для всех этих способов является то, что для их выполнения необходимы многочисленные реагенты, а проведение тестов является одновременно длительным и трудоемким. Кроме того, все эти способы отличаются тем, что для их проведения, в частности, необходимы очень дорогие приборы (микроскоп, центрифуга, проточный цитометр). Кроме того, общим для этих способов является то, что для их выполнения требуется специально обученный персонал. Тест Клейхауера-Бетке обладает дополнительным недостатком, состоящим в том, что оценка результатов является очень субъективной.
Слабые проявления D-признаков (Dweak), в частности - DEL
Следующей проблемой в серологии доноров и реципиентов являются слабые или частичные проявления D-антигена. Благодаря использованию моноклональных антител и подтверждению в непрямом тесте Кумбса, типирование и таких слабых групп крови казалось гарантированным до тех пор, пока не был описан фенотип DEL, который представляет собой особенно слабое проявление D-антигена («нормальный» D-антиген: 10-30000 антигенов на один эритроцит (RBC); слабый D-антиген: 400-1000; DEL: <30).
Серологически можно обнаружить DEL только косвенно, с помощью крайне дорогостоящих, содержащих до 10 стадий промывки адсорбционно-элюционных тестов. DEL имеет значение для трансфузионной медицины, так как D-реципиенты консервированной крови DEL-человека могут образовывать анти-D-антитела. Эта проблематика вызывает такие опасения, что в настоящее время среди специалистов обсуждается, не следует ли подтверждать D-статус всех (серологических) D-доноров молекулярными методами (Wagner Т., Kormoczi G.F., Buchta С, Vadon М., Lanzer G., Mayr W.R., Legler T. J. Transfusion 2005; 45:520).
Реакции смешанного типа, гомологичная трансфузия, кровяной допинг
Переливания крови следует производить только в случае одинаковой или совместимой группы по системе АВ0 и совместимости по D-антигену. В определенных случаях, например - у пациентов, которым ранее переливали кровь, клинически показано переливать кровь той же группы и по другим антигенам. Тем не менее, невозможно переливать кровь, абсолютно одинаковую по всем группам крови (исключение: аутологичная трансфузия). Поэтому после переливаний крови регулярно возникает ситуация, состоящая в том, что один и тот же пациент по определенным признакам группы крови одновременно является диагностически позитивным и негативным. В ходе диагностики обнаруживаются так называемые реакции смешанного типа, которые можно надежно обнаружить с использованием чувствительных способов - особенно таких, которые в ходе обнаружения могут пространственно разделить отдельные эритроциты и гемагглютинаты. Пусть, например, К-негативному человеку (группа крови kk), в системе кровообращения которого циркулирует 5000 мл крови (гематокрит 45%), переливают концентрат эритроцитов объемом 300 мл (67%), который является К+ (группа крови Kk или КК), тогда, по расчетам, примерно 8% эритроцитов этого человека являются К+, а 92% эритроцитов - К-.
Такая ситуация еще может быть обнаружена, например, с помощью широко распространенных в настоящее время гелевых систем компаний DiaMed и Bio-Rad. В этой технологии разбавленную суспензию эритроцитов исследуемого человека центрифугируют в закрытой снизу гель-хроматографической колонке, которая может содержать антитела-реагенты с различной специфичностью. Свободные, не агглютинированные клетки способны проходить через гель и образовывать осадок на дне реакционного резервуара, тогда как гемагглютинаты задерживаются на геле или внутри геля (Lapierre Y., Rigal D., Adam J., Josef D., Meyer A., Greber S., Drot C. Transfusion 1990; 30:109). Если эритроциты из нашего примера центрифугируются через такую колонку, содержащую анти-К-антитела, то большая часть клеток осаждается на дне, так как они являются К-, а небольшая часть задерживается на поверхности геля или внутри геля (К+), что соответствует обнаружению вышеописанной реакции смешанного типа. Если нанести эритроциты, описанные выше на MDmulticard (Medion Diagnostics), то также можно обнаружить слабую полосу на уровне анти-К-антител. В отличие от гелевой технологии, способ, описанный в WO 2005/005991, не способен одновременно выявить негативно реагирующую клеточную популяцию. Все остальные способы предшествующего уровня техники не обладают способностью к обнаружению реакций смешанного типа, сопоставимой с гелевыми системами и MDmulticard.
Гомологичная трансфузия и кровяной допинг:
Nelson М., Рорр Н., Sharpe К., Ashenden М. Haematologica 2003; 88:1284.
Реакции смешанного типа после трансфузии:
Issitt P.D. and Anstee D.J. In: Applied Blood Group Serology (4th edition), Montgomery Scientific Publications. Chapter 3: Hemolytic disease of the newborn. P.1045-1050.
Гематокрит
Гематокрит (или суммарный объем эритроцитов) выражает объемную долю эритроцитов в общем объеме цельной крови в процентах. На объемную долю эритроцитов в цельной крови влияют объем и количество эритроцитов.
Гематокрит обычно определяют посредством центрифугирования капилляров, заполненных кровью (Strumia М.М., Samble А.В., Hart E.D., 1954; Am. Ою Clin. Path.; 24:1016); после центрифугирования определяют долю осажденных клеточных компонентов в общем объеме. Гематокрит можно также определить посредством измерения электрического импеданса. При этом на ток, протекающий в растворе электролита между анодом и катодом, влияют частицы, имеющие другую электропроводность, встречающиеся на пути тока. Изменения тока регистрируются в виде импульсов. По амплитуде импульсов можно сделать вывод об определенной величине частиц, а в гематологии - и о виде частиц, например - о том, что это эритроциты. Суммируя импульсы, возникшие в измеренном объеме, можно определить число клеток и гематокрит (Руководство для оператора Sysmex KX-21N, 1999).
Поэтому в основе настоящего изобретения лежит задача создания простых, дешевых, обеспечивающих быстрые результаты, автоматизированных способов определения минорных клеточных популяций в гетерогенных клеточных популяциях, например - при фетоматеринской геморрагии и в случае так называемых химер. Кроме того, необходимы простые, быстрые и чувствительные способы обнаружения аналитов, присутствующих на поверхности клеток в малых концентрациях, способы определения гематокрита и/или параллельного определения связанных с клетками аналитов в реакциях смешанного типа. Предпочтительно эти способы должны иметь более высокую чувствительность, чем уже известные способы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Вышеуказанные задачи были решены за счет разработки способа определения одного или более связанных с клетками аналитов в жидкой пробе, причем этот способ осуществляется с использованием устройства, состоящего из:
- по меньшей мере одной загрузочной зоны (5), предназначенной для нанесения жидкой пробы;
- пористой мембраны (2), через которую могут проникать клеточные компоненты, причем на этой мембране имеется по меньшей мере одна индикаторная зона, способная взаимодействовать со связанными с клетками аналитами и содержащая по меньшей мере один связывающий элемент, связывающий связанные с клетками аналиты; и
- по меньшей мере одной абсорбирующей области (3) на мембране, которая поглощает жидкость после прохождения ею индикаторных зон,
причем по меньшей мере одна индикаторная зона расположена между загрузочной зоной (5) и абсорбирующей областью (3), а данный способ используется для концентрирования и количественной оценки минорных клеточных популяций в гетерогенных клеточных популяциях, например - в случае фетоматеринской геморрагии или в случае так называемых химер, для выявления аналитов, присутствующих на поверхности клеток в малых концентрациях, для определения гематокрита и/или для параллельного определения связанных с клетками аналитов в случае реакций смешанного типа.
В предпочтительной форме осуществления настоящего изобретения данный способ включает в себя этапы:
а) нанесения пробы, содержащей клетки, на загрузочную зону;
б) нанесения разбавителя;
в) проведения анализа; и
г) оценки результатов анализа посредством определения того, имеются ли клетки, связанные с индикаторной зоной.
Способ согласно этой предпочтительной форме осуществления настоящего изобретения предпочтительно используется для концентрирования и количественной оценки минорных клеточных популяций в гетерогенных клеточных популяциях, например - в случае фетоматеринской геморрагии, или для выявления аналитов, присутствующих на поверхности клеток в малых концентрациях.
Эта форма осуществления настоящего изобретения далее в тексте будет обозначена как «инкубационный способ».
Из патентных публикаций DE 10330982 A1 и WO 2005/005986 известно устройство с латеральным потоком жидкости. Оно используется для одновременного определения эритроцитарных антигенов и компонентов сыворотки, таких как антитела. Известное из этих печатных работ устройство с латеральным потоком жидкости пригодно для осуществления способа согласно настоящему изобретению. Поэтому содержание патентных публикаций DE 10330982 A1 и WO 2005/005986 полностью включено в данную работу посредством ссылки.
Согласно настоящему изобретению устройство с латеральным потоком жидкости используется в качестве проточного цитометра для того, чтобы максимально сконцентрировать вторую клеточную популяцию, присутствующую в гетерогенной смеси клеток в малом количестве. Концентрирование предпочтительно производится количественно за счет использования максимального количества цельной крови и качественно за счет обусловленного увеличением объема инкубационного эффекта. Поле для считывания результатов в устройстве с латеральным потоком аналогично проточной ячейке в проточном цитометре. Подложка имеет небольшие размеры, причем сорт клеток, присутствующий в большей концентрации, вымывается, а сорт клеток, присутствующий в меньшей концентрации, иммобилизируется в поле для считывания результатов анализа.
За счет этого достаточно большое число клеток из малочисленной популяции достигает полосы, содержащей антитело, и эта полоса становится видимой. Возможность этого обеспечивается за счет вымывания присутствующей в непропорционально большом количестве более многочисленной популяции.
Настоящий способ при использовании его для выявления ФМГ является высокочувствительным и обеспечивает выявление от примерно 0,1% до 0,2% фетальных D+-клеток в крови матери.
Согласно следующей предпочтительной форме осуществления изобретения устройство, используемое в данном способе, содержит по меньшей мере две индикаторные зоны, которые расположены друг за другом по направлению потока, так что жидкая проба по проточной дорожке проходит через более чем одну индикаторную зону, причем индикаторные зоны содержат элементы, связывающие связанные с клетками аналиты, а способ включает в себя:
а) нанесение пробы, содержащей эритроциты, на загрузочную зону;
б) нанесение разбавителя на загрузочную зону;
в) проведение анализа; и
г) оценку результатов анализа посредством определения того, связаны ли эритроциты с индикаторной зоной (или индикаторными зонами),
причем способ используется для определения аналитов, связанных с клетками, при фетоматеринской геморрагии (ФМГ), для выявления реакций смешанного типа, для выявления гомологичной трансфузии или для определения показателей гематокрита.
Эта форма осуществления далее в тексте будет также встречаться под названием «Способ с двумя индикаторными зонами».
Согласно следующему аспекту настоящего изобретения предусмотрено устройство для прямого (непосредственного) определения связанных с клетками аналитов в жидкой пробе, которое содержит:
- загрузочную зону (5) для нанесения на нее жидкой пробы;
- пористую мембрану, пригодную для проникновения клеточных компонентов, с по меньшей мере двумя индикаторными зонами на мембране, которые могут вступать во взаимодействие со связанными с клетками аналитами, причем индикаторные зоны содержат связывающие элементы, связывающие связанные с клетками аналиты, и
- по меньшей мере одну абсорбционную зону (3), которая принимает жидкость после прохождения индикаторных зон,
причем индикаторные зоны расположены между загрузочной зоной (5) и абсорбционной зоной (3), и в направлении потока жидкости друг за другом расположены по меньшей мере две индикаторные зоны, так что жидкая проба по проточной дорожке проходит через более чем одну индикаторную зону.
Предложенное согласно настоящему изобретению устройство с латеральным потоком жидкости отличается от устройств, описанных в публикации WO 2005/005991, тем, что в представленной в данной работе предпочтительной форме осуществления оно согласно настоящему изобретению содержит две расположенные друг за другом индикаторные зоны, чтобы в реакции смешанного типа можно было одновременно обнаружить обе популяции клеток. Чувствительность при выявлении реакции смешанного типа выше, чем чувствительность единственного имевшегося до сих пор рутинного способа, с помощью которого можно было выявить реакции смешанного типа, а именно - гелевой технологии (компания DiaMed). Чувствительность способа согласно настоящему изобретению обеспечивает выявление минорной клеточной популяции, если ее доля составляет примерно 1-2% от всей популяции.
Способ и устройство обеспечивают высокочувствительное обнаружение агглютинатов смешанного типа. Эта возможность применения также неожиданна, так как специалист в данной области техники должен понимать, что после связывания клеток, связанных с аналитом, первая индикаторная зона должна служить диффузионным барьером для связывания со второй индикаторной зоной.
Устройство с латеральным потоком жидкости можно использовать для определения гематокрита в качестве проточного цитометра, который содержит по меньшей мере две расположенные друг за другом индикаторные зоны для определения концентрации эритроцитов в пробе крови. Чем выше концентрация, тем больше точек одной линии дают положительный сигнал. Способ может быть развит до двумерной матрицы (2D-матрицы), в которой друг за другом расположено несколько проточных дорожек, каждая из которых содержит, например, 5 последовательно расположенных точек, содержащих антитела к эритроцитам, причем отдельные проточные дорожки содержат снижающиеся или повышающиеся концентрации антител к эритроцитам.
Применение устройства с латеральным потоком обеспечивает также возможность параллельного проведения определения группы крови и определения гематокрита.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
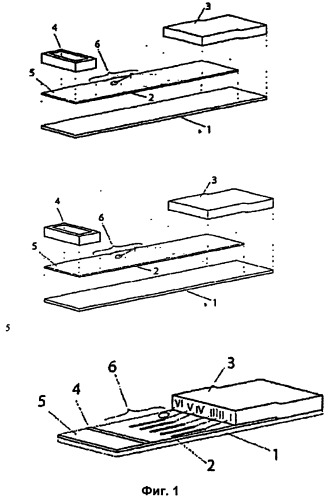
Фигура 1 демонстрирует схематическое изображение устройства, пригодного для осуществления описанного выше инкубационного способа. Цифровые обозначения имеют следующие значения: (1) опорный слой; (2) пористая мембрана; (3) абсорбционная зона; (4) уплотнительный элемент; (5) загрузочная зона; и (6) область индикаторных зон.
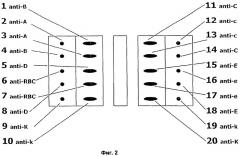
Фигура 2 демонстрирует схематическое изображение возможной модели нанесения для выявления реакций смешанного типа.
Фигура 3 демонстрирует возможные размеры изображенной на Фигуре 2 модели нанесения на мембрану, пригодную для обнаружения реакций смешанного типа.
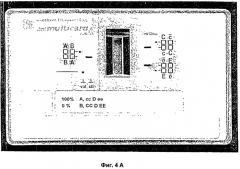
Фигуры 4A и 4B разъясняют обнаружение реакции смешанного типа с помощью способа с двумя индикаторными зонами согласно настоящему изобретению. На Фигуре 4A изображен результат исследования пробы крови со 100% А сс D. ее и 0% В СС D. ЕЕ. На Фигуре 4D изображен результат исследования пробы крови с 98% А сс D. ее и 2% В СС D. ЕЕ.
Фигура 5 иллюстрирует определение уровня гематокрита с помощью способа согласно настоящему изобретению.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Определения
В контексте настоящего изобретения следует понимать термины, перечисленные ниже, так, как разъяснено ниже.
Термин «минорная клеточная популяция в гетерогенной клеточной популяции» означает, что клеточная популяция присутствует в меньшем количестве или в меньшей концентрации, нежели одна или несколько других клеточных популяций, которые присутствуют в гетерогенных клеточных популяциях. Концентрация минорной клеточной популяции в данном случае составляет менее 50%, предпочтительно - менее 10%, особо предпочтительно - менее 1%, в частности - менее 0,1%, от всей гетерогенной клеточной популяции.
Термин «гомологичная трансфузия» означает трансфузии, которые совместимы по существенным признакам; чем больше признаков удается проверить после такой трансфузии, тем вероятнее обнаружить с помощью реакций смешанного типа, какая кровь была перелита. Эту вероятность можно довести до максимума за счет выбора признаков, которые необходимо определить. Такие определения служат для выявления запрещенного кровяного допинга, введенного посредством гомологичной трансфузии.
Термин «аутологичная трансфузия» означает порцию собственной крови; при этом донор и реципиент идентичны по всем признакам.
Термин «реакция смешанного типа» (англ. «mixed field»). Так как переливания крови, кроме аутологичной трансфузии, не могут быть одинаковыми по всем антигенам, то в серологии возникают реакции смешанного типа, связанные с различными антигенами в консервированной крови и у реципиента.
Термин «DEL». В данном случае речь идет об особенно слабо выраженном D-признаке при менее чем 30 антигенах на клетке. Этот признак невозможно выявить с использованием коммерчески доступных серологических методов.
Термин «гематокрит» означает долю эритроцитов [%] в общем объеме крови. Обнаружены следующие средние значения: у мужчин: 44-52%; у женщин: 37-47%.
Термин «химера» используется для организма, клетки которого происходят от двух или более зигот.
Изготовление устройства с латеральным потоком
Принципиально пригодны все устройства с латеральным потоком жидкости, описанные в DE 10330982 A1 и в WO 2005/005986.
Мембрана устройства согласно настоящему изобретению представляет собой пористую мембрану. Предпочтительными материалами для изготовления мембраны являются, например, нитроцеллюлоза (например - UniSart производства компании Sartorius, HiFlow производства компании Millipore, Whatman, АЕ99 или FF85/100 производства компании Whatman Schleicher & Schuell), полиэтилен (Lateral Flo производства корпорации Роrех) или нейлон (Novylon производства компании CUNO). Предпочтительно, мембрана должна иметь поры как можно большего размера, так как высокая пористость мембран способствует проникновению в пористую структуру клеточных компонентов пробы, подлежащей анализу, например - эритроцитов. Особо предпочтительным является использование абсорбирующих мембран. Тем не менее, устройство согласно настоящему изобретению не ограничивается этими свойствами. Предпочтительными являются все мембраны с высокой скоростью движения жидкости по капиллярам (капиллярной скоростью), при этом скорость движения жидкости по капиллярам - это время, которое требуется для того, чтобы раствор красителя прошел 40 мм по данной мембране. Особо предпочтительными являются мембраны со скоростью движения жидкости по капиллярам <100.
В предпочтительной форме осуществления изобретения за загрузочной зоной устройства согласно настоящему изобретению в направлении течения жидкости размещают уплотнительный элемент. Можно использовать двух- или трехмерные уплотнительные элементы, которые помещают на пористую мембрану, и за счет которых образуется загрузочная зона для нанесения пробы, изолированная от остальной поверхности пористой мембраны. Уплотнительный элемент согласно настоящему изобретению играет роль барьера для жидкости и обеспечивает направленное распределение жидкости пробы и используемых для анализа реактивов в пористой мембране. Кроме того, уплотнительный элемент согласно настоящему изобретению изолирует загрузочную зону для предотвращения нежелательного перехода жидкости в другие области устройства с латеральным потоком жидкости.
Предпочтительными формами осуществления уплотнительных элементов являются форма перегородки, форма ванночки или форма воронки. Формирование уплотнительного элемента осуществляют путем вырезания его из материала, используемого для изготовления уплотнительного элемента. В случае формы воронки или формы ванночки уплотнительный элемент имеет внутреннее отверстие, предпочтительными формами которого являются круглая, квадратная или прямоугольная, в случае формы воронки по направлению к нижней стороне воронки (стороне контакта с мембраной) уплотнительный элемент суживается.
Предпочтительными материалами для изготовления уплотнительного элемента являются такие материалы, которые не поглощают воду (гидрофобные материалы). В особой форме осуществления материалы с одной стороны покрыты слоем клеящего вещества, например - чувствительного к изменениям давления или самоклеящегося акрилатного клея. Благодаря этому слою, уплотнительный элемент может быть приклеен непосредственно к поверхности пористой мембраны. Альтернативно уплотнительный элемент может быть соединен с корпусом устройства для проведения анализа с латеральным потоком, например - приклеен, так что в этой форме осуществления корпус устройства для проведения анализа с латеральным потоком прижимает уплотнительный элемент к поверхности пористой мембраны, и за счет этого обеспечиваются функции уплотнительного элемента.
Предпочтительными материалами для изготовления двухмерных уплотнительных элементов являются любые формы клейких лент или клейких пленок (например - Tesa 4124 производства компании Beiersdorf AG, ARcare 7815 производства компании Adhesives Research).
Предпочтительными материалами для изготовления трехмерных уплотнительных элементов являются гибкие закрытопористые эластомерные материалы или гибкие силиконовые материалы с различными значениями толщины материалов, предпочтительно - в диапазоне 3-5 мм (например, ячеистый каучук EPDM140 производства компании Pitzner, силиконовый каучук или натуральный каучук с твердостью 40° или менее производства компании Castan).
В следующей предпочтительной форме осуществления настоящего изобретения к мембране прикреплено несколько состоящих из одного куска уплотнительных элементов, имеющих, например, 20 отдельных полостей (в форме ванночки).
Благодаря такой конструкции согласно настоящему изобретению устройство согласно настоящему изобретению способно воспринимать жидкие пробы, содержащие клетки, например - цельную кровь, без необходимости отфильтровывать клетки. Далее, уплотнительный элемент обеспечивает возможность нанесения на пористую мембрану (в загрузочную зону) пробы большого объема без переполнения загрузочной зоны. При этом уплотнительный элемент способствует использованию абсорбционных свойств пористой мембраны. Кроме того, уплотнительный элемент гарантирует направленное течение пробы. Однако устройство согласно настоящему изобретению может хорошо функционировать как с уплотнительным элементом, так и без него.
Для абсорбционной зоны (абсорбционной подушечки) устройства согласно настоящему изобретению предпочтительны механически стабильные материалы, предпочтительно - с абсорбцией воды в диапазоне 20-30 г/100 см2 (например, бумага Wicking, тип 300, производства компании Schleicher & Schull). Контакт между абсорбционной подушечкой и мембраной, обеспечивающей латеральный поток, в устройстве согласно настоящему изобретению обеспечивается за счет ее прижимания и перекрытия с пористой мембраной. Точное позиционирование абсорбционной подушечки на мембране осуществляется за счет приклеивания абсорбционной подушечки к опорному слою (подложке), к которому прикреплена мембрана, обеспечивающая латеральный поток.
В следующей форме осуществления настоящего изобретения компоненты устройства согласно настоящему изобретению с целью механического укрепления укладывают на подложку или опорный слой. Тем не менее, устройство согласно настоящему изобретению может функционировать и без опорного слоя. Предпочтительными являются механически стабильные и не поглощающие воду материалы, предпочтительно - с толщиной, равной 100 мкм или больше, которые с одной или с двух сторон покрыты слоем клеящего вещества, например - чувствительного к давлению или самоклеящегося акрилатного клея (например - 0,005" слой Polyester W/GL-187, G&L). На опорном слое фиксируют пористую мембрану и абсорбционную подушечку. В случае опорного слоя, покрытого клеем с двух сторон, вторую клеящую сторону используют для фиксации устройства на других поверхностях, например - внутри корпуса устройства для проведения анализа с латеральным потоком жидкости.
В следующей форме осуществления изобретения устройство согласно настоящему изобретению либо с опорным слоем, на котором размещены компоненты устройства согласно настоящему изобретению, либо без него, вставлено в корпус, за счет чего мембранные компоненты прижимаются друг к другу, и корпус способствует выполнению своей функции уплотнительным элементом. Однако устройство согласно настоящему изобретению может одинаково хорошо функционировать как с корпусом, так и без корпуса.
Инкубационный способ
Согласно предпочтительной форме осуществления способ используется для определения фетоматеринской геморрагии (ФМГ), при этом проба содержит эритроциты, а индикаторная зона предпочтительно содержит антитело или смесь антител.
Пробой, содержащей клетки, может быть любая проба. Клетками предпочтительно являются клетки, присутствующие в крови, такие как эритроциты, лейкоциты или тромбоциты. Предпочтительно клетками являются эритроциты. При этом проба, содержащая эритроциты, может быть выбрана как проба цельной крови или как проба концентрата клеток крови. Концентратом клеток крови при этом может быть ресуспендированный эритроцитарный осадок.
Предпочтительно используют более 200 мкл цельной крови. Такое количество содержит существенно большее число клеток, чем обычно наносится на устройства с латеральным потоком. За счет большого количества клеток, имеющегося в системе, увеличивается и общее число клеток минорной клеточной популяции, проходящее через проточный цитометр, что приводит к лучшей выявляемости.
В принципе, разбавителем может быть любой разбавитель, известный на современном уровне техники. Разбавитель предпочтительно выбирают из физиологического раствора поваренной соли, Разбавителя 1, разбавителя 2 (производства компании DiaMed), Разбавителя F (производства компании Medion Diagnostics). Предпочтительно разбавитель используют для разбавления клеток в количестве от 100 мкл до 200 мкл. В отличие от ранее опубликованных способов доля разбавителя в итоговой суспензии предпочтительно меньше доли использованной цельной крови или эритроцитарного осадка, чтобы обеспечить относительно более высокую концентрацию клеток и медленный поток эритроцитов.
Проведение анализа включает в себя инкубирование в течение времени, достаточного для того, чтобы нанесенная проба прошла от загрузочной зоны до абсорбционной зоны через индикаторную зону (или индикаторные зоны).
Оценку результатов анализа можно выполнить невооруженным глазом или автоматизировано.
Индикаторные зоны устройства согласно настоящему изобретению расположены на мембране и содержат связывающие элементы, которые захватывают или присоединяют к себе содержащиеся в пробе аналиты, подлежащие определению. В индикаторных зонах обнаруживаются реакции связывания между аналитом и связывающим элементом. В качестве особо предпочтительных связывающих элементов на пористую мембрану наносят антитела или фрагменты антител или лектины. Каждая индикаторная зона предпочтительно содержит один элемент, связывающий один из исследуемых аналитов. Индикаторные зоны могут быть выполнены как точечные, штриховидные и/или клиновидные. Предпочтительно штриховидное исполнение в направлении потока. Минорные клеточные популяции преимущественно выявляются при клиновидной форме индикаторной зоны, которая обеспечивает лучшую выявляемость.
Согласно следующей предпочтительной форме осуществления настоящего изобретения способ используется для определения аналита, присутствующего на поверхности клеток в низкой концентрации, предпочтительно - DEL-признака группы крови, а индикаторная зона предпочтительно содержит антитело или смесь антител.
Способ согласно настоящему изобретению может на этапе а) включать в себя получение эритроцитарного осадка путем центрифугирования пробы крови; инкубирование осадка с раствором бромелаина, папаина или фицина и ресуспендирование осадка, обработанного ферментом (как описано, например, в Техническом руководстве ААВВ, 14-е издание, 2003, 693 с.). Инкубация проводится в течение промежутка времени, составляющего от 5 до 60 минут. Используемые ферменты легкодоступны на коммерческом рынке.
Преимуществом предварительной обработки ферментами является более выраженная экспозиция D-антигена на поверхности эритроцитов, а вследствие этого - большая чувствительность определения.
В способе согласно настоящему изобретению (вариант «Инкубационный способ») на этапе а) на загрузочную зону предпочтительно наносят пробу крови или ресуспендированный эритроцитарный осадок в объеме от примерно 100 мкл до 500 мкл. Этот объем заметно больше обычно наносимого на устройства с латеральным потоком количества частиц или объема пробы.
В способе согласно настоящему изобретению на этапе б) предпочтительно наносят примерно 100-200 мкл разбавителя. Увеличение общего объема жидкости приводит к замедлению потока, что приводит к квазиинкубации аналита в индикаторной зоне.
Если индикаторная зона содержит анти-D-антитело, то это антитело предпочтительно выбрано из антител RUM-1, LDM-3, ESD1M, ТН-28, MS-201, MS-26 и LDM-1, которые можно приобрести в компаниях Miilipore или Alba Bioscence. Однако можно использовать и смеси антител или очищенные в соответствии с афинностью поликлональные антисыворотки.
Способ и устройство с двумя индикаторными зонами
Приведенные выше пояснения, касающиеся инкубационного способа, относятся и к способу с двумя индикаторными зонами, если ниже не приведено иных определений.
В предпочтительной форме осуществления способ используется для определения значения гематокрита, индикаторная зона предпочтительно содержит антитело или смесь антител, и на этапе г) определяется общая картина связывания эритроцитов с индикаторными зонами.
В следующей предпочтительной форме осуществления способа устройство содержит по меньшей мере две индикаторные зоны, которые размещены в одной проточной дорожке, причем индикаторные зоны содержат идентичные связывающие элементы, взаимодействующие с одними и теми же связанными с клетками аналитами.
В этой форме осуществления изобретения предусмотрено более одного ряда индикаторных зон. Индикаторные зоны могут быть выполнены как точечные, штриховидные и/или клиновидные. Предпочтительно штриховидное исполнение в направлении потока. Минорные клеточные популяции преимущественно выявляются при клиновидной форме индикаторной зоны, которая обеспечивает лучшую выявляемость. Способ с двумя индикаторными зонами обеспечивает выявление минорной клеточной популяции рядом с основной клеточной популяцией за счет расположения индикаторной зоны, ориентированной на минорную клеточную популяцию, проксимально относительно загрузочной зоны. Особо предпочтительным является такое расположение, при котором из двух индикаторных зон, расположенных в проточной дорожке, проксимальная зона является штриховидной и ориентирована в направлении потока, а дистальная зона является точечной.
В предпочтительной форме осуществления настоящего изобретения на мембране имеются по меньшей мере две проточные дорожки,