Дистанционный мониторинг и регулировка устройства ограничения потребления пищи
Иллюстрации
Показать всеГруппа изобретений относится к медицинской технике и медицине, а именно к системам для дистанционного мониторинга и регулировки устройства ограничения отверстия, имплантированного в пациента, и способам для передачи данных между этим устройством и блоком, находящимся на расстоянии. Система двунаправленной связи для применения с устройством ограничения отверстия, имплантированным в пациента, включает имплантированное в пациента средство для гидравлического и/или средство для механического регулирования устройства ограничения отверстия и измерительное средство для измерения параметра в устройстве ограничения отверстия. Средство для гидравлического регулирования выполнено в виде инъекционного порта или двунаправленного инфузера. Измерительное средство размещено в имплантированном инъекционном порту или двунаправленном инфузере и/или средстве для механического регулирования. Система также включает средство связи для передачи измеренных данных параметра от измерительного средства на локальный блок, находящийся вне пациента; и основной блок, находящийся на расстоянии от пациента. Основной блок включает средства пользовательского интерфейса для оценки измеренных данных параметра. При этом средства пользовательского интерфейса дополнительно включают средства для ввода команды регулировки устройства ограничения отверстия. Между локальным и основным блоками имеется канал связи для передачи данных между блоками, переданные данные включают измеренные данные параметра. Также группа изобретений включает систему для дистанционного мониторинга и регулировки устройства ограничения отверстия, имплантированного в пациента, в которой в качестве измеряемого параметра выступает давление текучей среды в устройстве ограничения отверстия. Способ передачи данных между устройством ограничения отверстия и основным блоком, находящимся на расстоянии от пациента, заключается в измерении давления текучей среды в устройстве ограничения отверстия измерительным средством. Далее полученные результаты считывают в устройстве ограничения отверстия и передают на основной блок. Оценивают в основном блоке для определения размера стомы, формируемой устройством ограничения отверстия. 3 н.и 17 з. п. ф-лы, 15 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение касается имплантированного устройства ограничения отверстия и конкретнее системы двусторонней связи для дистанционного мониторинга физиологических параметров, относящихся к имплантированному устройству ограничения потребления пищи и назначению регулировок устройства, находясь на расстоянии.
Уровень техники изобретения
Поскольку продолжает увеличиваться число людей, страдающих ожирением, и все больше узнается об отрицательном воздействии ожирения на здоровье, беспокойство относительно ожирения возрастает, особенно в Соединенных Штатах. Патологическое ожирение, при котором масса тела человека составляет 100 фунтов или больше, по сравнению с идеальной массой тела, представляет, в особенности, значительный риск возникновения тяжелых проблем со здоровьем. Соответственно, большое внимание сосредотачивается на лечении пациентов, страдающих ожирением. Один способ лечения патологического ожирения представляет собой помещение устройства ограничения отверстия, такого как удлиненный бандаж, в верхней части желудка. Бандаж помещается таким образом, чтобы сформировать маленький желудочный мешок выше бандажа и уменьшенной стомы, открывающейся в желудок. Бандаж должен оказывать эффект уменьшения доступного объема желудка и, таким образом, количества пищи, которое может потребляться до наполнения желудка. Суживающие желудочные бандажи обычно включают заполненный текучей средой резиновый баллон с фиксированными концами, который окружает желудок непосредственно ниже пищеводно-желудочного соединения. Когда текучая среда вливается в баллон, бандаж увеличивается в объеме, сдавливая желудок и вызывая его сужение. Для уменьшения сужения желудка текучая среда удаляется из бандажа.
К устройствам ограничения отверстия также относятся механически регулируемые бандажи, которые также окружают верхнюю часть желудка. Эти бандажи включают любые эластичные материалы или передаточные устройства, а также приводные элементы для регулировки бандажей. Также разработаны регулируемые бандажи, которые включают как гидравлические, так и механические элементы привода. Пример подобного регулируемого бандажа раскрыт в патенте США №6067991, озаглавленном "Механическое устройство ограничения потребления пищи", выданном 30 мая 2000 г. и приведенном здесь в качестве ссылки. Также известно ограничение доступного для пищи объема полости желудка с помощью имплантации надувного резинового баллона непосредственно в полость желудка. Баллон заполняется жидкостью для расширения к стенкам желудка, таким образом уменьшая доступный для пищи объем внутри желудка.
Для безопасного эффективного лечения с применением каждого из вышеописанных типов устройств ограничения отверстия необходимым является их регулярный мониторинг и регулировка для изменения степени сужения желудка. Желудочный мешок выше наложения бандажа существенно увеличивается в размере после начальной имплантации бандажного устройства. Соответственно, стома, открывающаяся в желудок, должна первоначально быть достаточно большой, чтобы пациент имел возможность принимать достаточное количество пищи, в то время как желудок приспосабливается к устройству бандажирования. При увеличении желудочного мешка в размерах бандаж регулируется для изменения размера стомы. Кроме того, часто бывает желательно изменить размер стомы для приспособления к изменениям в теле пациента или к режиму лечения, или в более срочном случае, для уменьшения обструкции или тяжелой дилатации желудка.
Для регулировки устройств ограничения отверстия ранее были необходимы плановые посещения врача. Во время этих посещений врач применял шприц с иглой для подкожных инъекций для проникновения в кожу пациента и добавления или удаления солевого раствора из баллона. Позже были разработаны имплантируемые насосы, которые позволили производить регулировки бандажа неинвазивным способом. Эти насосы контролируются извне с помощью программирующего устройства, которое осуществляет связь с насосом с помощью телеметрических командных сигналов. Во время планового посещения врач помещает переносную часть программирующего устройства рядом с имплантированным устройством ограничения потребления пищи и передает приводящие в действие и командные сигналы на имплантированный насос. В ответ на команды насос регулирует уровень текучей среды в бандаже и передает диагностические данные на программное устройство.
В дополнение к регулировкам желательно регулярно проводить мониторинг физиологических параметров, относящихся к устройству ограничения отверстия для оценки эффективности лечения. Особенно важным является мониторинг давления текучей среды в бандаже для определения степени сужения желудка пациента. Показатели давления, превышающие нормальный уровень, могут указывать на блокировку или развитие инфекции, тогда как показатели давления ниже нормального уровня могут указывать на утечку текучей среды из баллона. Одновременно рассматриваемая заявка на патент США №11/065410 этого же заявителя, озаглавленная "Неинвазивное измерение давления текучей среды в устройстве для лечения ожирения", которая приведена здесь в качестве ссылки, описывает способы измерения давления текучей среды в устройстве ограничения потребления пищи для определения величины отверстия стомы. Результат измерения давления текучей среды передается на внешнее программирующее устройство, размещенное над кожей пациента вблизи имплантата. Результат измерения давления в устройстве может применяться для определения потребности в регулировке.
Несмотря на то, что применение имплантированных насосов и систем измерения давления значительно улучшило лечение ожирения, плановое посещение кабинета врача и индивидуальные взаимоотношения между пациентом и врачом все еще было необходимо для контроля и регулировки устройства. Часто врача и пациента разделяет значительное расстояние, что вызывает необходимость обширных передвижений для выполнения регулировки. Таким образом, потребность планировать посещение кабинета врача увеличивает сложность лечения и обычно приводит к меньшей, чем могло бы быть желательно регулярности мониторинга и регулировок. Соответственно желательно предоставить способ дистанционного мониторинга физиологических параметров имплантированного устройства ограничения отверстия. Кроме того, желательно обеспечить двустороннее взаимодействие врача с пациентом, что позволит врачу осуществлять дистанционный мониторинг и регулировку устройства ограничения отверстия. Посредством взаимодействия врач может оценивать эффективность лечения и назначать регулировки, которые будут выполнены врачом-клиницистом, или самостоятельно пациентом, находящимся в другом месте. Взаимодействие позволяет осуществлять более быструю диагностику или решать проблемы лечения, а также регулярно выполнять плановые регулировки, например, с целью предотвращения дилатации желудка или с целью возможности оттока слизи ночью из желудочного мешка.
Сущность изобретения
Настоящее изобретение обеспечивает двустороннюю систему связи для применения с устройством ограничения отверстия, имплантированным пациенту. Система включает датчик для измерения рабочего параметра устройства ограничения отверстия. Кроме того, система включает средства для передачи данных измеряемого параметра от датчика к локальному блоку, находящемуся вне пациента. Кроме того, система включает основной блок, находящийся на расстоянии от пациента, основной блок включает пользовательский интерфейс, предназначенный для оценки данных измеряемого параметра, и канал связи между локальным и основным блоками для передачи данных между блоками, причем переданные данные включают данные измеряемого параметра.
Краткое описание чертежей
Несмотря на то, что описание, включая формулу изобретения, детально указывает и ясно определяет объем притязаний настоящего изобретения, полагается, что оно будет более понятным, ссылаясь на следующее описание, предоставленное в сочетании с сопроводительными чертежами,
где на фиг.1 представлено упрощенное схематическое изображение имплантированного устройства ограничения отверстия и системы двусторонней связи между имплантированным устройством и блоком дистанционного мониторинга;
на фиг.2 представлен более детальный вид в перспективе имплантируемой части устройства ограничения потребления пищи, показанного на фиг.1;
на фиг.3 представлен вид сбоку, частично в разрезе инъекционного порта, показанного на фиг.2;
на фиг.4 представлен вид сбоку, в разрезе, по линии А-А с фиг.3, иллюстрирующий пример датчика давления для измерения давления текучей среды в устройстве ограничения потребления пищи с фиг.2;
на фиг.5 упрощенно схематически представлена цепь с переменным сопротивлением для датчика давления, показанного на фиг.4;
на фиг.6 представлено поперечное сечение альтернативного двустороннего инфузера для устройства ограничения потребления пищи с фиг.2;
на фиг.7A представлено схематическое изображение механически управляемого ограничительного устройства, включающего датчик давления;
на фиг.7B представлено поперечное сечение по линии В-В механически управляемого устройства с фиг.7A;
на фиг.8 представлена блок-схема главного внутреннего и внешнего компонентов устройства ограничения потребления пищи, показанного на фиг.1;
на фиг.9 представлено схематическое изображение, иллюстрирующее множество различных каналов связи между локальным и дистанционным блоком с фиг.1;
на фиг.10 представлена блок-схема примера протокола связи между локальным и дистанционным блоком для ограничительного устройства с ручным управлением;
на фиг.11 представлена блок-схема примера протокола связи между локальным и дистанционным блоком для ограничительного устройства с дистанционным управлением;
на фиг.12 представлена блок-схема примера протокола связи, в котором связь запускается пациентом;
на фиг.13 представлено упрощенное схематическое изображение регистрирующего устройства для записи измерений давления в имплантированном ограничительном устройстве;
на фиг.14 представлена блок-схема, иллюстрирующая главные компоненты регистрирующего устройства, показанного на фиг.13; и
на фиг.15 графически представлен результат измерения давления текучей среды от датчика, показанного на фиг 4, который связан посредством системы настоящего изобретения.
Подробное описание изобретения
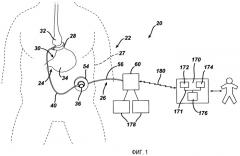
Теперь при детальном рассмотрении чертежей, на которых цифры обозначают одни и те же элементы на всех изображениях, на фиг.1 представлено упрощенное, схематическое изображение системы двусторонней связи 20 для передачи данных между имплантированным устройством ограничения отверстия и дистанционно расположенным устройством мониторинга. Для мониторинга и воздействия на лечение пациента сигналы данных и командные сигналы могут передаваться между имплантированным устройством и врачом, находящимся на расстоянии, по системе связи 20. Система связи изобретения позволяет врачу управлять устройством ограничения отверстия и осуществлять мониторинг лечения, не встречаясь лицом к лицу с пациентом. В целях раскрытия термины "дистанционный" и "дистанционно расположенный" определяют здесь расположение на расстоянии более шести футов. На фиг.1 и в следующем раскрытии устройство ограничения отверстия показано и описано как устройство ограничения потребления пищи 22 для применения в лечении ожирения. Однако применение устройства ограничения потребления пищи приведено только в качестве примера, и настоящее изобретение может применяться с другими видами имплантированных устройств ограничения отверстия, не отступая от объема применения изобретения.
Как показано на фиг.1, первая часть 24 устройства ограничения потребления 22 имплантирована под кожу пациента 27, тогда как вторая часть 26 расположена у наружной поверхности кожи пациента. Имплантированная часть 24 включает управляемый ограничительный бандаж 28, который имплантирован вокруг желудочно-кишечного тракта для лечения патологического ожирения. В этом применении регулируемый бандаж 28 образует петлю на внешней поверхности желудка 30 для создания стомы между верхним мешком 32 и нижним мешком 34 желудка. Регулируемый бандаж 28 может иметь полость, выполненную из силиконового каучука или другого вида биологически совместимого материала, которая при наполнении текучей средой расширяется внутрь к желудку 30. В ином случае бандаж 28 может включать механически регулируемое устройство, имеющее полость с текучей средой, которая подвергается воздействию давления, изменяющегося при настройках бандажа, или комбинацию гидравлически/механически регулируемого бандажа.
Инъекционный порт 36, который будет описан подробнее ниже, имплантирован в область тела, доступную для инъекций с помощью иглы и для телеметрических сигналов связи. В показанном варианте осуществления инъекционный порт 36 сообщается посредством текучей среды с регулируемым бандажом 28 через катетер 40. Хирург может регулировать положение и имплантировать инъекционный порт 36 внутрь тела пациента для выполнения настроек ограничения потребления пищи или стомы. Инъекционный порт 36 обычно имплантируется в боковую, подреберную область живота пациента под кожу и слои жировой клетчатки. В ином варианте хирург может имплантировать инъекционный порт 36 на груди пациента.
На фиг.2 подробнее проиллюстрирован управляемый бандаж 28. В этом варианте осуществления бандаж 28 включает полость переменного объема 42, которая расширяется или сокращается, сужая наружную стенку желудка, для формирования регулируемой стомы для контролируемого ограничения попадания пищи в желудок. Врач может уменьшать размер отверстия стомы, добавляя текучую среду в полость с переменным объемом 42 или, в ином варианте, может увеличивать размер стомы посредством удаления текучей среды из полости. Текучая среда может быть добавлена или удалена посредством введения иглы в инъекционный порт 36. Жидкость может являться, но не ограничиваясь им, 0,9%-ным солевым раствором.
Возвращаясь теперь к фиг.1, внешняя часть 26 устройства ограничения потребления 22 включает ручную антенну 54, электрически связанную (в этом варианте осуществления посредством соединения электрических кабелей 56) с локальным блоком 60. Блок электрических кабелей 56 может быть связан с локальным блоком 60 или антенной 54 разъемно для облегчения очистки, обслуживания, применения и хранения внешней части 26. Локальный блок 60 является устройством с микропроцессорным управлением, которое сообщается с имплантированным устройством 22 и дистанционным блоком 170, как будет описано далее ниже. С имплантированным инъекционным портом 36 локальный блок 60 сообщается посредством антенны 54. Антенна 54 может удерживаться на коже пациента рядом с местоположением инъекционного порта 36 для передачи сигналов приведения в действие и телеметрических сигналов на инъекционный порт 36.
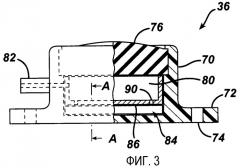
Обратимся теперь к фиг.3, на которой изображен пример инъекционного порта 36 в боковой проекции, частично в разрезе. Как показано на фиг.3, инъекционный порт 36 включает жесткий корпус 70, имеющий кольцевидный выступ 72, имеющий множество крепежных отверстий 74 для закрепления инъекционного порта в тканях пациента. Хирург может укрепить инъекционный порт 36 к ткани, такой как фасция, покрывающая мышцы живота, применяя любой из множества хирургических средств фиксации, включая шовные нити, скобки и клипсы. Кроме того, инъекционный порт 36 имеет перегородку 76, обычно изготовленную из силиконового каучука и удерживаемую сдавлением в корпусе 70. Перегородка 76 проницаема для иглы Хубера или приспособления для инъекций подобного типа, для добавления или удаления текучей среды из порта. Перегородка 76 самостоятельно закрывается после удаления иглы шприца для поддержания объема текучей среды в инъекционном порте 36. Кроме того, инъекционный порт 36 включает резервуар 80 для удержания текучей среды и соединитель для катетера 82. Соединитель 82 присоединяется к катетеру 40, как показано на фиг.2, формируя закрытую гидравлическую цепь между резервуаром 80 и полостью 42. Корпус 70 и соединитель 82 могут быть целиком литыми из биологически совместимого полимера или созданы из металла, такого как титан или нержавеющая сталь.
Инъекционный порт 36 также имеет датчик давления 84 для измерения давления текучей среды внутри устройства. Давление, измеренное датчиком 84, соответствует величине сдавления, которое бандаж 28 оказывает на желудок пациента или другую полость. Результат измерения давления передается от датчика 84 на локальный блок 60 посредством телеметрических сигналов, применяя антенну 54. Локальный блок 60 может показывать на дисплее, распечатывать и/или передавать результаты измерения давления на блок дистанционного мониторинга для анализа, что будет более подробно описано ниже. В варианте осуществления, показанном на фиг.3, датчик давления 84 размещен внизу резервуара для текучей среды 80 внутри корпуса 70. Удерживающее покрытие 86 расположено над датчиком давления 84 для большего отделения поверхности датчика от резервуара 80 и защиты датчика от проникновения иглы. Удерживающее покрытие 86 может быть выполнено из керамического материала, такого как, например, оксид алюминия, который устойчив к проникновению иглы и в то же время не препятствует электронной связи между датчиком давления 84 и антенной 54. Удерживающее покрытие 86 имеет отверстие 90, которое позволяет текучей среде из резервуара 80 попадать к датчику давления 84 и воздействовать на его поверхность.
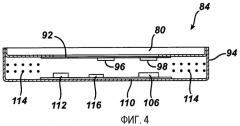
На фиг.4 представлен датчик давления 84 в боковой проекции в разрезе по линии А-А фиг.3, проиллюстрирован примерный вариант осуществления измерения давления текучей среды. Датчик давления 84 герметично закрыт в корпусе 94 для предотвращения проникновения текучей среды и нарушения работы датчика. Наружная поверхность датчика давления 84 включает диафрагму 92, имеющую поверхность, способную к деформации. Диафрагма 92 образована с помощью утоньшения участка основания титанового резервуара 80 до толщины от 0,001'' и 0,002''. При прохождении текучей среды через отверстие 90 в резервуаре 80 текучая среда воздействует на поверхность диафрагмы 92, вызывая механические смещения поверхности. Механическое смещение диафрагмы 92 преобразуется в электрический сигнал с помощью пары кремниевых тензодатчиков 96, 98 с переменным сопротивлением. Тензодатчики 96, 98 присоединены к диафрагме 92 на стороне, противоположной рабочей текучей среде в резервуаре 80. Тензодатчик 96 присоединен к центральной части диафрагмы 92 для измерения смещения диафрагмы. Второй согласованный тензодатчик 98 прикреплен около внешнего края диафрагмы 92. Тензодатчики 96, 98 могут быть присоединены к диафрагме 92 с помощью клея или могут распространяться в структуру диафрагмы. При колебании давления текучей среды внутри бандажа 28 поверхность диафрагмы 92 деформируется вверх или вниз с нижней стороны резервуара 80. Деформация диафрагмы 92 вызывает изменение сопротивления в центральном тензодатчике 96.
Как показано на фиг.5, тензодатчики 96, 98 составляют два главных элемента сопротивления полукомпенсированной мостовой цепи Wheatstone 100. При реагировании тензодатчика 96 на механические смещения диафрагмы 92 изменяющееся сопротивление датчика изменяет потенциал в главной части мостовой цепи. Тензодатчик 98 противодействует тензодатчику 96 и термализует мостовую цепь Wheatstone. Дифференциальные усилители 102, 104 связаны с мостовой цепью 100 для измерения изменения потенциала в мостовой схеме вследствие переменного сопротивления тензодатчиков. В частности, дифференциальный усилитель 102 измеряет напряжение во всей мостовой цепи, тогда как дифференциальный усилитель 104 измеряет дифференциальное напряжение в тензодатчике половины мостовой схемы 100. Больший дифференциал между напряжениями тензодатчиков, при фиксированном напряжении в мосте, соответствует большей разнице давления. Если желательно, для повышения чувствительности и точности датчика давления 84 может также применяться полностью компенсированная мостовая схема Wheatstone. В полностью компенсированной мостовой схеме к поверхности диафрагмы присоединены четыре тензодатчика 92 вместо двух тензодатчиков, как показано на фиг.4.
Возвращаясь к фиг.4, выходные сигналы от дифференциальных усилителей 102, 104 используются в микроконтроллере 106. Микроконтроллер 106 интегрирован в схемную плату 110 внутри корпуса 94. Температурный датчик 112 измеряет температуру внутри инъекционного порта 36 и посылает сигнал о температуре на микроконтроллер 106. Микроконтроллер 106 использует температурный сигнал от датчика 112 для коррекции изменений температуры тела и остаточных температурных погрешностей, не учитываемых тензодатчиком 98. Коррекция сигнала давления на изменения температуры тела повышает точность датчика давления 84. Дополнительно, внутри корпуса 94 расположена TET/телеметрическая катушка 114. Катушка 114 связана с конденсатором 116 для формирования колебательного контура с настройкой для приема энергии от локального блока 60 и передачи на него данных физиологических параметров, включая измеряемое давление текучей среды. На фиг.3-5 проиллюстрирован один примерный вариант осуществления измерения давления текучей среды внутри устройства ограничения потребления. Дополнительные варианты осуществления измерения давления жидкости описаны в заявке на патент США №11/065410, озаглавленной "Неинвазивное измерение давления текучей среды в устройстве для лечения ожирения", которая приведена здесь в качестве ссылки.
Как альтернатива инъекционному порту 36, имплантированная часть 24 может включать двунаправленный инфузер для изменения уровня текучей среды в регулируемом ограничительном бандаже 28. С помощью инфузера текучая среда может быть добавлена или удалена из бандажа 28 посредством командных телеметрических сигналов, без необходимости введения шприца через кожу пациента и в перегородку порта. На фиг.6 представлен пример инфузера 115 в поперечном сечении. Как показано на фиг.6, в инфузере 115 имеется насос, обозначенный в общем 118, для неинвазивного перемещения текучей среды в бандаж или из него, в ответ на командные телеметрические сигналы. Насос 118 находится внутри внешнего цилиндрического корпуса 120, имеющего кольцевую крышку 121, проходящую по всей верхней части. К крышке 121 прочно прикреплен верхним периферическим краем сжимаемый сильфон 122. Сильфон 122 состоит из подходящего материала, например титана, который способен повторно сгибаться в сгибах сильфона, но является достаточно жестким, чтобы не подвергаться деформациям при изменениях давления. Нижний периферический край сильфона 122 прикреплен к кольцевому колпачку 123 сильфона, который перемещается вертикально внутри насоса 118. Комбинация крышки 121, сильфона 122 и колпачка сильфона 123 образует объем резервуара 124 для текучей среды. Соединитель 119 катетера присоединяется к катетеру 40 (как показано на фиг.2), формируя закрытую гидравлическую цепь между бандажом и резервуаром 124 для текучей среды. Объем в резервуаре 124 может быть увеличен с помощью перемещения колпачка 123 сильфона в нисходящем направлении, от крышки 121. При опускании колпачка 123 сильфона сгибы сильфона 122 растягиваются, создавая вакуум для перемещения текучей среды из бандажа по катетеру 40 и соединителю 119 в резервуар 124. Подобным образом объем резервуара 124 может быть уменьшен с помощью перемещения колпачка 123 сильфона в восходящем направлении к крышке 121, тем самым сжимая сгибы сильфона 122 и вызывая нагнетание текучей среды из резервуара по катетеру 40 и соединителю 119 в бандаж 28.
Колпачок 123 сильфона включает целиком сформированную часть ходового винта 125, который при движении ввинчивается в соответствующую резьбу в цилиндрической гайке 126. Внешняя окружность гайки 126 прочно присоединена к осевому отверстию поворотной приводной пластины 127. В свою очередь, цилиндрическое приводное кольцо 128 установлено на внешнем кольцевом крае поворотной приводной пластины 127. Гайка 126, приводная пластина 127 и приводное кольцо 128 прочно прикреплены друг к другу с помощью любых подходящих средств, формируя сборный узел, который вращается единым блоком вокруг оси, сформированной винтовой частью 125. Каркас втулки 129 включает TET и телеметрические катушки (не показаны) для передачи сигналов приведения в действие и сигналов данных между антенной 54 и насосом 118.
Приводное кольцо 128 является приводимым во вращение с помощью одного или большего числа пьезоэлектрических гармонических двигателей. В варианте осуществления, показанном на фиг.6, два гармонических двигателя 131 размещены таким образом, чтобы наконечник 113 каждого двигателя находился во фрикционном контакте с внутренней окружностью приводного кольца 128. Когда двигатели 131 активизируются, наконечники 113 осуществляют вибрацию приводного кольца 128, производя "шаговое" движение в направлении внутренней окружности кольца, которое вызывает вращение кольца. Микроконтроллер (не показан) в насосе 118 электрически связан с TET и телеметрическими катушками для приема энергии для приводных двигателей 131, а также приема и передачи сигналов данных для насоса. Для изменения уровня текучей среды в полости бандажа 42 посредством телеметрии от антенны 54 передаются назначения регулировок. Телеметрическая катушка в инфузере 115 выявляет и передает регулировочный сигнал на микроконтроллер. Микроконтроллер, в свою очередь, приводит в движение двигатели 131 в необходимом количестве для сжатия или расширения сильфона 122 и нагнетания желательного количества текучей среды в бандаж 28.
Для измерения колебаний давления в инфузере 115 и, следовательно, величины отверстия стомы датчик давления, обозначенный как элемент 84', включен в сильфон 122. Датчик давления 84' подобен датчику давления 84, описанному выше. Поскольку давление на бандаж 28 колеблется вследствие например, перистальтического давления при глотании, текучая среда в бандаже 28 претерпевает изменения давления. Эти изменения давления передаются назад через текучую среду в катетере 40 на сильфон 122. Диафрагма в датчике давления 84' отклоняется в ответ на изменения давления текучей среды внутри сильфона 122. Отклонения диафрагмы преобразуются в электрический сигнал, характеризующий приложенное давление таким образом, как описано выше применительно к фиг.4 и 5. Сигнал давления попадает в микроконтроллер инфузера, который передает давление на блок мониторинга, находящийся вне пациента, посредством телеметрической катушки. Дополнительные детали относительно работы двунаправленного инфузера 115 могут быть найдены в одновременно рассматриваемой заявке на патент США №11/065410 этого же заявителя, озаглавленный "Неинвазивное измерение давления текучей среды в устройстве для лечения ожирения", которая приведена здесь в качестве ссылки.
На фиг.7A и 7B изображен механически регулируемый бандаж 153 для создания в животе пациента условий по ограничению потребления пищи. Как альтернатива гидравлически регулируемому бандажу 28, для создания стомы может применяться механический бандаж 153. Механически регулируемый бандаж 153 включает в основном круговой эластичный сердечник 133, имеющий перекрывающиеся концевые части 135, 137. Сердечник 133 большей частью заключен в заполненный текучей средой соответствующий корпус 139. Разъемное и блокируемое соединение 149 сердечника 133 выступает из концов корпуса 139 для возможности помещения сердечника и корпуса вокруг пищевода или желудка пациента, для формирования стомы. Имплантированный двигатель 141 расположен на расстоянии от сердечника 133 для механической регулировки перекрытия концевых частей 135, 137 сердечника и, соответственно, величины стомы, сформированной сердечником. Двигатель 141 регулирует размер сердечника 133 с помощью приводного вала 143, который связан с приводным колесом (не показано) внутри корпуса 139. Двигатель 141 залит воедино с блоком источника питания с дистанционным управлением 145 в корпусе 147, состоящем из силиконового каучука или другого подобного материала.
При изменении двигателем 141 размера сердечника 133 изменяется давление текучей среды внутри корпуса 139. Для измерения колебаний давления в сообщение с текучей средой в корпусе 139 помещен датчик давления, подобный описанному выше. Датчик давления может быть помещен внутрь корпуса 139, как обозначено элементом 84'', таким образом, чтобы колебания давления в пределах отверстия стомы передавались посредством текучей среды в корпусе 139 к диафрагме датчика. Датчик 84'' преобразует отклонения диафрагмы в сигнал давления, который передается на внешний блок посредством телеметрии таким образом, как описано выше. В альтернативной последовательности действий, датчик давления может быть помещен внутрь корпуса имплантированного двигателя 147, как обозначено элементом 84'', и сообщен с корпусом 139 посредством текучей среды через трубку 151, находящуюся рядом с приводным валом 143. При изменении давления текучей среды в корпусе 139, вследствие изменения давления в отверстии стомы, дифференциалы давления передаются посредством текучей среды в трубке 151 на датчик 84'''. Датчик 84''' генерирует электрический сигнал, характеризующий давление текучей среды. Этот сигнал передается от пациента на внешний блок таким образом, как описано выше.
На фиг.8 представлена блок-схема, иллюстрирующая главные компоненты имплантированной и внешней частей 24, 26 устройства ограничения потребления 22. Как показано на фиг.8, внешняя часть 26 включает первичную катушку TET 130 для передачи сигнала 132 приведения в действие на имплантированную часть 24. Также имеется телеметрическая катушка 144 для передачи сигналов данных на имплантированную часть 24. Первичная TET катушка 130 и телеметрическая катушка 144 объединены, как показано, формируя антенну 54. Локальный блок 60 внешней части 26 включает цепь управления TET 134 для контроля передачи энергии на первичную TET катушку 130. Цепь управления TET 134 контролируется микропроцессором 136. Графический пользовательский интерфейс 140 связан с микропроцессором 136 для ввода информации о пациенте и изображения на дисплее и/или распечатывания данных и инструкций врача. С помощью пользовательского интерфейса 140, пациент или врач-клиницист могут передать запрос о регулировке врачу и также ввести причины запроса. Кроме того, пользовательский интерфейс 140 позволяет пациенту читать и отвечать на инструкции врача.
Локальный блок 60 также включает первичный телеметрический трансивер 142 для передачи команд запроса на имплантированный микроконтроллер 106 и приема от него ответных данных, включая измеренное давление текучей среды. Первичный трансивер 142 электрически связан с микропроцессором 136 для ввода и приема командных сигналов и сигналов данных. Первичный трансивер 142 управляет телеметрической катушкой 144 для резонирования на выбранной для связи радиочастоте. Резонирующая цепь генерирует входную линию связи в переменном магнитном поле 146, которая передает командные данные на имплантированный микроконтроллер 106. В ином варианте трансивер 142 может принимать телеметрические сигналы, переданные от вторичной катушки 114. Полученные данные могут быть сохранены в памяти 138, связанной с микропроцессором 136. Источник питания 150 подает энергию на локальный блок 60 для приведения в действие устройства 22 ограничения потребления. Датчик внешнего давления 152 связан с микропроцессором 136. Микропроцессор 136 использует сигнал от датчика внешнего давления 152 для приспособления полученного результата измерения давления текучей среды к колебаниям атмосферного давления вследствие, например, колебаний барометрических условий или высоты.
На фиг.8 также проиллюстрированы главные компоненты имплантированной части 24 устройства 22. Как показано на фиг.8, вторичная TET/телеметрическая катушка 114 принимает сигналы приведения в действие и связи от внешней антенны 54. Катушка 114 формирует настраиваемый колебательный контур, который индуктивно связан как с первичной TET катушкой 130 для приведения имплантата в действие, так и с первичной телеметрической катушкой 144 для приема и передачи данных. Телеметрический трансивер 158 контролирует обмен данными с катушкой 114. Кроме того, имплантированная часть 24 включает выпрямитель/регулятор энергии 160, вышеописанный микроконтроллер 106, память 162, связанную с микроконтроллером, температурный датчик 112, датчик давления 84 и цепь согласования сигнала 164 для усиления сигнала от датчика давления. Имплантированные компоненты передают отрегулированный под температуру результат измерения давления от датчика 84 на локальный блок 60 посредством антенны 54. Результат измерения давления может быть сохранен в памяти 138 в локальном блоке 60, показан на дисплее локального блока 60 или передан в режиме реального времени на станцию дистанционного мониторинга.
Как упомянуто выше, желательно обеспечить систему связи для дистанционного мониторинга и контроля устройства ограничения потребления. Посредством системы связи врач может считывать хронологию измерений давления текучей среды в устройстве ограничения для оценки эффективности лечения ожирения. Кроме того, врач может передать по линии связи инструкции для регулировки устройства. Находясь на расстоянии, врач-клиницист может получить доступ к инструкциям по регулировке с помощью локального блока 60. Применяя инструкции, врач-клиницист может ввести шприц в инъекционный порт 36 и добавить или удалить солевой раствор из резервуара 80 для текучей среды для выполнения регулировок устройства. В ином варианте доступ к инструкциям с помощью локального блока 60 может получить пациент и неинвазивно выполнить инструкции относительно инфузера 115 или механически регулируемого бандажа 153, применяя антенну 54. Измерения давления в реальном времени могут быть переданы по исходящей линии связи врачу во время регулировок для немедленного отзыва об эффектах регулировки. В ином варианте пациент или врач-клиницист могут передать по исходящей линии связи результаты измерения давления врачу после регулировки для подтверждения и оценки регулировки.
Как показано на фиг.1, система связи 20 включает локальный блок 60 и блок дистанционного мониторинга 170, также упомянутый здесь, как основной блок. Дистанционный блок 170 может быть расположен в офисе врача, больнице или другом месте, удобном для врача. Дистанционный блок 170 является устройством типа персонального компьютера, включающего микропроцессор 172, который может быть, например, микропроцессором Intel Pentium® или подобным. Системная шина 171 соединяет микропроцессор 172 с памятью 174 для хранения данных, таких как, например, физиологические параметры и инструкции для пациента. Графический пользовательский интерфейс 176 также связан с микропроцессором 172 для отображения данных на дисплее и ввода инструкций и корреспонденции для пациента. Пользовательский интерфейс 176 может включать видеомонитор, сенсорный дисплей или другое устройство отображения, а также клавиатуру или стилус для ввода информации в дистанционный блок 170.
Для ввода физиологических данных, относящихся к состоянию пациента с локальным блоком 60, может связываться непосредственно множество периферийных устройств 178. Эти физиологические данные могут быть сохранены в локальном блоке 60 и переданы на дистанционный блок 170 во время запроса или другого обмена данными. Примеры периферических устройств, которые могут применяться с настоящим изобретением, включают весы, прибор для контроля за кровяным давлением, термометр, прибор для контроля уровня содержания сахара в крови или любой другой тип устройства, которое может применяться вне офиса врача, для обеспечения ввода рассматриваемого текущего физиологического состояния пациента. Например, весы могут электрически сообщаться с локальным блоком 60 или непосредственно, или через беспроводную связь посредством антенны 54, для создания отчета о потере в весе пациента. Отчет о потере в весе может быть сохранен в памяти 138 локального блока 60. Во время последующего запроса дис