Способ, соединение и фармацевтическая композиция и лекарственное средство для восстановления утраченной памяти в норме и патологии
Иллюстрации
Показать всеИзобретение относится к способу восстановления памяти, утраченной в результате патологии, неблагоприятных воздействий или времени, включающему введение эффективного количества (азагетероциклил)алкильных производных амидов (гет)арилглицинов общей формулы I:
в которой: m и n могут принимать значения 0, 1, 2 и 3; знак (#) здесь и далее обозначает возможность наличия хирального центра; R представляет необязательно замещенный С5-С10арил или 5-6-членный гетарил, содержащий 1-2 гетероатома, выбранных из азота и серы, возможно, конденсированный с бензольным кольцом, причем заместители выбираются из С1-С8алкила, C1-С8алкокси, галогена, ОН, CF3, CN, NO2, CF3O, незамещенной амино-группы или моно-С1-C6алкил- или ди(С1-C6алкил)замещенной амино-группы, С1-C8алкилсульфанила, С1-C6алкоксикарбонил, C1-С6ацила; А1 и А2 независимо представляют необязательно замещенный 5-6-членный насыщенный или ароматический азагетероцикл, содержащий от 1 до 2 атомов азота в цикле и, возможно, конденсированный с бензольным кольцом; причем заместители в замещенных группах R, А1 и А2 независимо выбираются из С1-С8алкила, С1-С8алкокси, С1-С-алкилсульфанила, галогена, ОН, CF3, нитро, CN, CF3O, незамещенной аминогруппы, моно-С1-4алкил- или ди(С1-4алкил) амино-группы, С1-8алкоксикарбонила, C1-С6ацила, или их фармацевтически приемлемых солей, или сложных алкиловых эфиров, в виде отдельных оптических изомеров или их смесей. Изобретение также относится к соединениям общей формулы I, фармацевтической композиции и лекарственному средству на их основе. 4 н. и 12 з.п. ф-лы, 24 пр., 1 табл., 20 ил.
Реферат
Изобретение относится к медицине, а именно к способу восстановления утраченной памяти в норме и патологии в результате неблагоприятных воздействий или времени, с использованием новых соединений не пептидной природы, фармацевтической композиции и лекарственному средству на их основе.
В настоящее время серьезной медицинской проблемой является деменция, особенно у людей пожилого возраста, которая проявляется у 4% населения в возрасте 65 лет и, по крайней мере, у 35% населения в возрасте 85 лет. В 2005 году в мире насчитывалось более 24 миллионов больных, страдающих от деменции, связанной с увеличением продолжительности жизни. Предполагается, что число больных, страдающих от деменции, достигнет 80 миллионов в 2040 году. Наиболее распространенной формой деменции является болезнь Альцгеймера (БА, около 60% всех случаев), представляющая собой прогрессирующее необратимое нейродегенеративное заболевание с недостаточно изученным патогенезом и практически не имеющая эффективных средств лечения. На протяжении многих лет ведется разработка средств для борьбы с заболеванием.
Формирование памяти представляет собой многостадийный процесс. Его первым этапом является процесс обучения, связанный с приобретением новой информации. Решающую роль на этом этапе играет активация АМРА рецепторов, и поэтому вещества, потенцирующие работу АМРА рецепторов, как правило, улучшают процесс запоминания (J.C.Quirk, E.S.Nisenbaum. A novel positive allosteric modulator of АМРА receptors. CNS Drug reviews. 2002, 8, 3:255-282). Однако, после того как процесс обучения закончился, данные вещества теряют свою эффективность. При этом сама память подвергается дальнейшей консолидации, при которой она переходит из кратковременной в долговременную форму. Этот процесс поддерживается за счет иных внутриклеточных механизмов, включающих в себя экспрессию генов и синтез новых белков и не вовлекающих активность АМРА рецепторов.
Обучение может быть сильным или слабым в зависимости от интенсивности и силы обучающего события. При слабом обучении необходимы дополнительные средства, чтобы сформировалась долговременная память. При слабом обучении формируется кратковременная память, которая проявляется при тестировании через 4-6, но не через 24 часа после обучения. Эта память может быть усилена введением некоторых соединений, например агонистов оксида азота, стероидных гормонов, определенных пептидов (Rickard N.S., Ng K.T., Gibbs M.E. A nitric oxide agonist stimulates consolidation of long-term memory in the 1-day-old chick. Behav Neurosci. 1994, 108:640-4; Sandi C., Rose S.P., Mileusnic R., Lancashire C. Corticosterone facilitates long-term memory formation via enhanced glycoprotein synthesis. Neuroscience 1995, 69:1087-93; Mileusnic R., Lancashire C.L., Rose S.P. The peptide sequence Arg-Glu-Arg, present in the amyloid precursor protein, protects against memory loss caused by A beta and acts as a cognitive enhancer. Eur J Neurosci. 2004, 19:1933-8).
Формирование долговременной памяти начинается с сильного обучения и обеспечивается синтезом новых белков в мозге, который начинается сразу после обучения (Davis H.P., Squire L.R. Protein synthesis and memory: a review. Psychol. Bull. 1984, 96:518-559). Введение в мозг блокаторов синтеза белка препятствует формированию долговременной памяти, в результате чего при тестировании через 24 часа после обучения доля животных, демонстрирующих выученное поведение, снижена (Goelet, P., Castelluci, V.F., Schacher, S., Kandel, E.R. The long and short of long-term memory - a molecular framework. Nature 1986, 322:419-423; Gibbs M.E., Ng, K.T. Psychobiology of memory: Towards a model of memory formation. Biobehav. Rev. 1977, 1:113-136; Mark, R.F., Watts, M.E. Drug inhibition of memory formation in chickens. II. Long-term memory. Proc. R. Soc. Lond. B. Biol. Sci. 1971, 178:439-454).
Забывание проявляется в невозможности или затруднении извлечения памяти. Природа забывания остается малоизученной, и рассматриваются сценарии как утраты следов памяти со временем, так и затруднений извлечения информации, продолжающей оставаться в памяти. Одним из способов извлечения памяти, в том числе и ослабленной, является напоминание. Напоминание представляет собой предъявление субъекту одного из компонентов ситуации обучения, приводящее к реактивации ранее сформированного следа памяти.
Способы и вещества, способные восстанавливать утраченную память, крайне немногочисленны и неудобны для применения с практической точки зрения. Они включают в себя сочетание напоминания с определенными воздействиями: электростимуляция ретикулярной формации мозга или голубого пятна, введение моносахаридов или стрихнина (DeVietti.T.L., Hopfer T.M.. Complete amnesia induced by ECS and complete recovery of memory following reinstatement treatment. Physiol. Behav. 1974, 12:599-603; Rodriguez, W.A., Horne C.A., Padilla J.L. Effects of glucose and fructose on recently reactivated and recently acquired memories. Prog. Neuropsychopharmacol. Biol. Psychiatry 1999, 23:1285-1317; Sara, S.J., Deweer В., Hars В. Reticular stimulation facilitates retrieval of a "forgotten" maze habit. 1980, Neurosci. Lett. 18:211-217; Gordon W.C. Susceptibility of a reactivated memory to the effects of strychnine: a time-dependent phenomenon. Physiol. Behav. 1977, 18:95-99).
Очевидно, что в реальной жизни невозможно восстанавливать память людей с использованием стимуляции ретикулярной формации или голубого пятна головного мозга при помощи вживленных в мозг электродов. Также практически неприменимо использование «крысиного яда» - стрихнина. Съедание кусочков сахара полезно для работы мозга, но вряд ли оно может рассматриваться как существенная помощь для извлечения памяти, особенно в случае патологических нарушений этого процесса. Таким образом, в фармакопее практически отсутствуют лекарства, способные восстанавливать утраченную память.
Известны соединения, которые можно отнести к производным амидов, арил(гетарил)глицинов например, описанные в RU 2270198, WO 03/082819, RU 2167866, US 6630451 могут быть использованы как средства, усиливающие секрецию гормона роста, как анальгетики либо в качестве антагонистов нейрокинина или как антагонисты рецептора тромбина, соответственно. При этом в двух последних случаях предполагается использование известных соединений для лечения нейродегенеративных заболеваний. Указанные соединения являются наиболее близкими по структуре к соединениям, используемым в настоящем изобретении.
Задачей, на решение которой направлено настоящее изобретение, является разработка способа восстановления утраченной памяти в норме и патологии, у пациентов всех возрастных групп, с использованием нового класса соединений с ранее неизвестными свойствами, обладающих направленным действием и не влияющих на другие функции организма, а также фармацевтических композиций и лекарственных средств на основе этих соединений.
Поставленная задача решается способом восстановления памяти, утраченной в результате патологии, неблагоприятных воздействий или времени, включающим введение эффективного количества производных амидов (гет)арилглицинов общей формулы I:
в которой n и m могут принимать значения 0, 1, 2 и 3;
знак (#) здесь и далее обозначает возможность наличия хирального центра;
R представляет необязательно замещенный C5-C10арил или 5-7-членный гетарил, содержащий 1-4 гетероатома, выбранных из азота, кислорода и серы, возможно, конденсированный с бензольным кольцом;
A1 и A2 независимо представляют необязательно замещенный 3-7-членный насыщенный, частично насыщеный или ароматический азагетероцикл, содержащий от 1 до 3 атомов азота в цикле и, возможно, конденсированный с бензольным кольцом;
или их фармацевтически приемлемых солей или сложных алкиловых эфиров, в виде отдельных оптических изомеров или их смесей.
Предпочтительными для использования являются соединения, представляющие собой (азагетероциклил)алкильные производные амидов арилглицинов общей формулы I.1
в которой k и I могут принимать значения 0 и 1;
X представляет H, необязательно замещенный алкил, необязательно замещенный C1-C8алкокси, галоген, OH, CF3, CN, CF3O, необязательно замещенную амино-группу, C1-C6ацильную группу, необязательно замещенный C6арил или 5-6-членный гетарил, содержащий 1-3 гетероатома, C2-C4алкенил, C2-C4алкинил, C6арC1-C6алкил, C1-C8алкоксикарбонил, 5-6-членный гетарил, содержащий 1-2 гетероатома выбранных из азота, кислорода и серы, C6арилсульфонил или C1-C8алкилсульфонил, необязательно N-замещенный аминосульфонил; либо группа Х означает бензольное кольцо, аннелированное с фенилом или 5-7-членным гетероциклилом, содержащим 1-3 гетероатома, выбранных из атомов азота, кислорода, серы;
R1 и R2 независимо представляют необязательно замещенный азагетероцикл, такой как пиридин, пиперидин, пиримидин, триазин, хинолин, изохинолин, хиназолин, хиноксалин.
При этом особенно предпочтительны соединения I.1 в виде отдельных изомеров или в виде смеси R-(-)- и S-(+)-изомеров, соответственно представленных общими формулами I.1.1 и I.1.2:
в которых k и I могут принимать значения 0 и 1;
X представляет H, необязательно замещенный C1-C8алкил, необязательно замещенный C1-C4алкокси, галоген, OH, CF3, CN, CF3O, необязательно замещенную амино-группу, C1-C6ацильную группу, необязательно замещенный C6арил или 5-6-членный гетарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода или серы, C2-C4алкенил, C2-C4алкинил, C6арC1-C6алкил, C1-C8алкоксикарбонил, карбоксигруппу, C6арилсульфонил или C1-C8алкилсульфонил, необязательно N-замещенный аминосульфонил; либо группа X означает бензольное кольцо, аннелированное с фенилом или 5-7-членным гетероциклилом, содержащим 1-3 гетероатома, выбранных из атомов азота, кислорода, серы;
R1 и R2 независимо представляют необязательно замещенный азагетероцикл, такой как пиридин, пиперидин, пиримидин, триазин, хинолин, изохинолин, хиназолин, хиноксалин.
В соединения настоящего изобретения общей формулы I в группах A1, A2, R C1-C8алкил представляет собой линейный или разветвленный алкил, возможно, циклический алкил, в котором одна или несколько CH2 групп могут быть заменены атомами кислорода, азота или серы. Примерами таких групп могут быть метил, этил, н.пропил, изопропил, н.бутил, трет бутил, пентил, гексил, н.гептил, изогептил, циклопропил, циклобутил, циклолпентил, циклогексил, циклогептил, циклооктил и др. Заместители алкила могут быть выбраны из атомов галогена, C1-C8, предпочтительно C1-C4алкокси, галогенированного C1-C4алкокси, гидрокси, арилокси, амино, моно- или C1-C4алкиламина, циано, нитро и др. Примерами таких групп являются прежде всего метокси, метоксиэтокси, этоксиметокси, пропоксиэтоксиэтил, изопропоксиэтокси, трифторметил, перфторэтил, дифторметил, фторметил, дифторметокси, трифторметокси, гидроксиметил, дигидроксиэтил, гидроксиэтил, фенилокси, дифенилокси, нафтилокси, аминометил, аминоэтил, диаминопропил и др.
Заместители амино-группы выбираются прежде всего из C1-C8алкила, преимущественно C1-C4алкила, который может быть разветвленным, или C1-C8алкила, замещенного гидрокси, C1-C4алкокси или амино, моно- или C1-C4алкиламингруппами. Примерами таких групп являются прежде всего моно- или диметиламино, моно- или диэтиламино, моно- или дигидроксиC1-C4алкиламино, гидроксиметиламино, этоксиметиламино, дигидроксиэтиламино, метоксиэтиламино, трифторметилэтиламино, фторметилэтиламино, дифторметоксиметиламино и др.
Заместители арила или гетарила, выбираются из H, необязательно замещенного алкила, где заместители указаны выше, необязательно замещенного C1-C4алкокси, например галогенированного алкокси, такого как CF3O, галогена, OH, CN, необязательно замещенной, как указано выше, амино-группы, C1-C6ацильной группы, необязательно замещенного C6арила или 5-6-членного гетарила, содержащего 1-3 гетероатома, где в каждом ариле и гетариле заместители могут быть выбраны из галогена, C1-C4алкила, C2-C4алкенила, C2-C4алкенила, C2-C4алкинила, C6арC1-C6алкила, C1-C8алкоксикарбонила, карбоксигруппы, 5-6-членного гетарила, содержащего 1-2 гетероатома, выбранных из азота, кислорода и серы, C6арилсульфонила или C1-С8алкилсульфонила, необязательно N-замещенного, как указано выше, аминосульфонила. Аннелированные группы также могут быть замещены, например, атомами галогена, C1-C4алкилом, C1-C4алкокси.
Примерами таких заместителей могут быть метил, этил, изопропил, н-пропил, изобутил, s-бутил, трет бутил, гексил, нонил циклопропил, циклогексил, циклобутил, циклопентил, циклооктил и др.
Заместители алкила могут быть выбраны из атомов галогена, таких как атомы хлора, брома, йода, C1-C8, предпочтительно C1-C4алкокси, например метокси, этокси, изопропокси, пропокси, бутокси изобутокси, циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси, галогенированного C1-C4алкокси, например трифторметилокси, дифторметилокси, фторметилокси, гидрокси, арилокси, например, фенилокси, нафтилокси, возможно, замещенного амино, циано, нитро, алкилтио, например, метилтио, этилтио, пропилтио, изопропилтио, бутилтио, трет.бутилтио, циклоалкилтио, например циклопропилтио, циклобутилтио или циклогексилтио и др.
Заместители амино-группы выбираются прежде всего из C1-C8алкила, преимущественно C1-C4алкила, который может быть разветвленным, или C1-C8алкила и могут представлять собой моно- или C1-С8алкиламин, например монометил- или моноэтиламин, диметил- или диэтиламин, который в свою очередь может быть замещен гидрокси, C1-C4алкокси или амино, моно- или C1-C4алкиламино, атомами галогена, например дихлорметил, дифторметил, трифторметил, бромметил, трифторметокси, аминометил, монометиламинометил, диметиламинометил, диметиламиноэтил и т.д.
Заместители арила или гетарила, выбираются из H, необязательно замещенного алкила, где заместители указаны выше, необязательно замещенного C1-C4алкокси, например галогенированного алкокси, такого как CF3O, галогена, OH, CN, необязательно замещенной, как указано выше, амино-группы, C1-C6ацильной группы, необязательно замещенного C6арила или 5-6-членного гетарила, содержащего 1-3 гетероатома, где в каждом ариле и гетариле заместители могут быть выбраны из галогена, C1-C4алкила, C2-C4алкенила, C2-C4алкенила, C2-C4алкинила, C6арC1-C6алкила, C1-C8алкоксикарбонила, карбоксигруппы, 5-6-членного гетарила, содержащего 1-2 гетероатома, выбранных из азота, кислорода и серы, C6арилсульфонила или C1-C8алкилсульфонила, необязательно N-замещенного, как указано выше, аминосульфонила. Бензольное кольцо, аннелированное с фенилом или 5-7-членным гетероциклилом, содержащим 1-3 гетероатома, выбранных из атомов азота, кислорода, серы, как правило, представляет собой бициклическую или трициклическую группу, выбранную, например, из нафталина, хинолила, индолила,бензопиразолила, бензотиофенила, бензофуранила, бензоизофуранила, бензодиоксалила, бензодиоксина, бензазепина, бензодиазепина, бензимидазола, бензизоксазолила, бензоксазолила, бензтиазолила, бензоизотиазолила, пиридопиримидина, пиридоимидазолила, пиридотриазолила и др. Аннелированные группы также могут быть замещены, например, атомами галогена, C1-C4алкилом, C1-C4алкокси.
В качестве фармацевтически приемлемых солей могут быть использованы соли галоидводородных солей, особенно хлоргидраты, бромгидраты, соли серной и сульфоновой кислоты, такие как мезилат, тозилат, соли фосфорной, малеиновой, фумаровой, молочной, лимонной, винной, янтарной, малоновой, уксусной кислоты, карбоновой кислоты, например бикарбонаты, соли металлов, особенно соли щелочных или щелочноземельных металлов.
Предпочтительные соединения могут быть выбраны, в частности, из соединений, указанных в таблице, или их фармацевтически активных солей, если они не указаны специально.
Соединения формулы 1 потенцируют токи АМРА рецепторов и тем самым могут быть полезны для улучшения когнитивных функций, таких как обучение, формирование, консолидация и извлечение памяти.
При этом неожиданно было обнаружено, что соединения формулы 1, кроме того, обладают также способностью влиять и на другие звенья памяти, а именно улучшать процессы извлечения памяти, что делает их уникальными и особо ценными среди всех известных препаратов, которые влияют на память.
Способность восстанавливать память с помощью соединений формулы 1, благодаря обнаружению у них новых неожиданных свойств, не является очевидной и не вытекает из химической структуры этих соединений. Указанные свойства позволяют использовать соединения в качестве средства для восстановления утраченной памяти в норме и патологии у пациентов всех возрастных групп. Соединения могут быть использованы для восстановления памяти, утраченной, например, в результате нейродегенеративного заболевания или других заболеваний ЦНС. Такими заболеваниями могут быть болезнь Альцгеймера, болезнь Паркинсона; болезни (хореи) Хантингтона; рассеянный склероз; мозжечкововая дегенерация; амиотрофический латеральный склероз; деменция с тельцами Леви; спинальная мускульная атрофия; периферическая нейропатия; губчатый энцефалит; СПИД-ассоциированная деменция; мультиинфарктная деменция; лобно-височная деменция; лейкоэнцефалопатия; хронические нейродегенеративные заболевания; инсульт; ишемическое, реперфузионное и гипоксическое повреждение мозга; эпилепсия; церебральная ишемия; глаукома; синдром Дауна; энцефаломиелит; менингит; энцефалит; нейробластома; шизофрения; депрессия и нейродегенеративные процессы.
Изобретение также относится к использованию соединений формулы I, или их фармацевтически приемлемых солей, или сложных алкиловых эфиров, в виде отдельных оптических изомеров или их смесей, в том числе предпочтительных соединений, соответствующих соединениям формулы I, I.1, I.1.1 и I.1.2, в качестве активного ингредиента для фармацевтических композиций и лекарственных средств для восстановления утраченной памяти в норме или патологии у пациентов всех возрастных групп, а также к фармацевтическим композициям и лекарственным средствам с использованием указанных активных ингредиентов.
Фармацевтическая композиция, обладающая способностью восстанавливать утраченную память в результате патологий, неблагоприятных воздействий или времени, согласно настоящему изобретению содержит одно или несколько соединений активного ингредиента, соответствующего соединениям формулы I, I.1, I.1.1 и I.1.2, или их фармацевтически приемлемых солей или сложных алкиловых эфиров, в виде отдельных оптических изомеров или их смесей в эффективном количестве и, по крайней мере, один фармакологически совместимый наполнитель, и/или растворитель, и/или разбавитель. При необходимости фармацевтическая композиция может содержать вспомогательные, распределяющие и воспринимающие средства, средства доставки, такие как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки. Выбор и соотношение указанных компонентов зависит от природы и способа назначения и дозировки.
Понятие «эффективное количество», используемое в данной заявке, подразумевает использование того количества соединения формулы 1, которое вместе с его показателями активности и токсичности, а также на основании знаний специалиста должно быть эффективным в данной фармацевтической композиции или лекарственной форме.
Содержание активного ингредиента составляет обычно от 1 до 20 вес.%, в сочетании с одной или более фармацевтически приемлемыми вспомогательными добавками, такими как разбавители, связующие, разрыхляющие агенты, адсорбенты, ароматизирующие вещества, вкусовые агенты.
Изобретение относится также к лекарственному средству для восстановления утраченной памяти в результате патологии, неблагоприятных воздействий или времени в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, включающему в свой состав один или более активных ингредиентов I, I.1, I.1.1 и I.1.2, или их фармацевтически приемлемых солей, или сложных алкиловых эфиров, в виде отдельных оптических изомеров или их смесей или фармацевтическую композицию на их основе.
Указанные фармацевтическая композиция и лекарственное средство могут быть получены известными в фармацевтике способами.
Для получения фармацевтической композиции активный ингредиент (соединение формулы 1) смешивается с фармацевтически приемлемым носителем, разбавителем или растворителем и при необходимости соответствующими добавками.
При этом лекарственное средство может быть в виде жидкой или твердой формы.
Примерами твердых лекарственных форм являются, например, таблетки, пилюли, желатиновые капсулы и др. Примерами жидких лекарственных форм для инъекций и парентерального введения являются растворы, эмульсии, суспензии и др. Получение указанных лекарственных форм осуществляется традиционными для фармацевтики методами - смешением компонентов, таблетированием, капсулированием и т.д.
Изобретение также относится к способам восстановления памяти, утраченной в результате нейродегенеративных заболеваний или в результате злоупотребления веществами, вызывающими зависимость, при воздействии нейротоксинов или других амнестических агентов, в результате черепно-мозговой травмы или других физических воздействий на ЦНС или в результате старения организма. Указанные способы осуществляются путем введения активного ингредиента, представляющего собой соединения формул I, I.1, I.1.1 и I.1.2, или его фармацевтически приемлемых солей, или сложных алкиловых эфиров, в виде отдельных оптических изомеров или их смесей. При этом во всех указанных случаях лекарственная доза лекарственного средства для введения активного компонента (млекопитающему, такому как животное или человек) составляет 0,005-1,5 мг/кг массы по крайней мере один раз в день в течение периода, необходимого для достижения терапевтического эффекта.
Еще одним аспектом изобретения является способ восстановления утраченной памяти в норме и патологии у пациентов всех возрастных групп, заключающийся во введении пациенту фармакологического средства, содержащего эффективное количество лекарственного средства в дозе 0,005-1,5 мг/кг, предпочтительно 0,005-1 мг/кг, массы тела, по крайней мере один раз в день в течение периода, необходимого для достижения терапевтического эффекта.
Соединение формулы 1 может вводиться в виде общепринятых оральных композиций, таких как таблетки, таблетки с покрытием, желатиновые капсулы с твердым и мягким покрытием, эмульсии или суспензии.
Назначаемая для приема доза активного компонента (соединения формулы 1) варьируется в зависимости от многих факторов, таких как возраст, пол, вес пациента, симптомов и тяжести заболевания, конкретно назначаемого соединения, способа приема, формы препарата, в виде которой назначается активное соединение.
Обычно общая назначаемая доза составляет от 0.5 до 80 мг в день. Общая доза может быть разделена на несколько доз, например, для приема от 1 до 4 раз в день. При оральном назначении интервал общих доз активного вещества составляет от 1 до 80 мг в день. При парентеральном приеме интервал назначаемых доз составляет от 0.5 до 40 мг в день, предпочтительно, а при внутривенных инъекциях - от 0.1 до 5 мг в день, предпочтительно. Точная доза может быть выбрана лечащим врачом.
Техническим результатом, который может быть получен при осуществлении изобретения, является восстановление утраченной памяти в норме и патологии у пациентов всех возрастных групп.
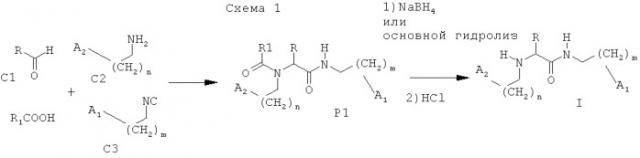
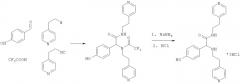
Используемые в предлагаемом изобретении соединения являются новыми и могут быть получены мультикомпонентной реакцией альдегида, амина, изонитрила и карбоновой кислоты, с последующим удалением N-ацильной группы в соответствии со схемой 1:
В мультикомпонентную реакцию в соответствии со схемой I вводят эквивалентные количества альдегида C1, амина С2, изонитрила С3 и карбоновой кислоты и процесс проводят при температуре 10-25°С в инертном протонном растворителе (метанол, этанол, трифторэтанол и подобных) или апротонном растворителе (гексан, циклогексан, этиленкарбонат, нитрометан и подобных) без катализатора или в его присутствии. При этом соединения формулы I получают, удаляя карбоксильную группу из полупродукта Р1 действием восстановительного агента, например, такого как борогидрид щелочного металла (NaBH4, LiBH4, KВН4), или действием основания, такого как гидроксиды или карбонаты щелочных металлов, или подобного.
Возможность осуществления изобретения с реализацией заявляемого назначения подтверждается, но не исчерпывается следующими сведениями. Приведенные ниже примеры иллюстрируют получение представителей предлагаемых соединений согласно изобретению, но не ограничивают последнее.
Все соединения, указанные ниже, как и соединения, перечисленные выше, но не упоминаемые в примерах, получены в соответствии со схемой 1.
Для синтеза были использованы следующие исходные реагенты и физико-химические методы доказательства строения синтезированных веществ и их чистоты.
Все растворители и реагенты были получены из коммерческих источников, таких как Sigma-Aldrich (США), Fluka (Германия), Acros (Бельгия) и Lancaster (Англия). Точки плавления (т.пл.) были получены на приборе фирмы Buchi модель В-520. 1Н и 13С ЯМР спектры были получены на спектрометрах фирмы Varian (300 MHz) в CDCl3, D2O и DMSO-d6, химические сдвиги приведены в шкале δ (м.д.). Внутренний стандарт тетраметилсилан.
Содержание основного вещества контролировали с помощью LC-MS на приборе Applied Biosystems (Shimadzu 10-AV LC, Gilson-215 автоматическая подача образца, масс-спектрометр API 150ЕХ, детекторы UV (215 и 254 нм) и ELS, колонка Luna-C18, Phenomenex, 5 см×2 мм). В соответствии с данными LC/MS все синтезированные соединения в спектрах MS имели молекулярный пик М+1, при этом содержание основного вещества во всех случаях было выше 95%.
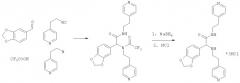
Пример 1. 2-(1,3-бензодиоксол-5-ил)-N-(2-пиридин-4-илэтил)-2-[(2-пиридин-4-илэтил)-амино]ацетамид (вещество 271)
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СН2Сl2:МеОН 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СН2Сl2:МеОН 20:1. Чистый продукт растворяют в метаноле, насыщают НСl (газ) и упаривают в вакууме. Выход 48%, 250 мг. Здесь и далее, если не указано иначе, приведены спектры оснований заявляемых соединений. Спектр 1Н-ЯМР: 2.64-2.75 (м, 5Н), 2.85-2.93 (м, 1H), 3.27-3.39 (м, 1H), 3.43-3.54 (м, 1H), 3.99 (с, 1H), 5.87 (с, 2Н), 6.52-6.55 (м, 4Н), 6.97 (д, J=5.8 Гц, 2Н), 7.10 (д, J=5.8 Гц, 2Н), 8.43-8.50 (м, 4Н).
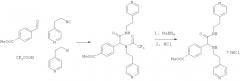
Пример 2. Метил 4-{2-оксо-1,2-бис[(2-пиридин-4-илэтил)амино]этил}бензоат (вещество 661)
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СН2Сl2:МеОН 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СН2Сl2:МеОН 20:1. Чистый продукт растворяют в метаноле, насыщают НС1 (газ) и упаривают в вакууме. Выход 19% (100 мг). Спектр 1Н-ЯМР: 2.65-2.75 (м, 5Н), 2.85-2.93 (м, 1Н), 3.28-3.40 (м, 1H), 3.44-3.54 (м, 1Н), 3.88 (с, 3Н), 4.15 (с, 1Н), 6.85 (t, J=6.1 Гц, 1Н), 6.95 (д, J=5.8 Гц, 2Н), 7.06 (д, J=5.8 Гц, 2Н), 7.27 (д, J=8.1 Гц, 2Н), 7.95 (д, J=8.1 Гц, 2Н), 8.41 (д, J=6.41 Гц, 2Н), 8.46 (д, J=8.46 Гц, 2Н).
Пример 3. 2-(4-гидроксифенил)-N-(2-пиридин-4-илэтил)-2-[(2-пиридин-4-илэтил)амино]ацетамид(вещество 581)
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СН2Сl2:МеОН 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СН2Cl2МеОН 20:1. Чистый продукт растворяют в метаноле, насыщают НСl (газ) и упаривают в вакууме. Выход 25% (120 мг). Спектр 1Н-ЯМР: 2.60-2.93 (м, 6Н), 3.27-3.37 (м, 1Н), 3.45-3.57 (м, 1Н), 4.01 (с, 1Н), 6.67 (д, J=8.6 Гц, 2Н), 6.92 (t, J=6.1 Гц, 1Н), 6.90-6.97 (м, 4Н), 7.07 (д, J=5.6 Гц, 2Н), 8.37 (д, J 5.8 Гц, 2Н), 9.45 (д, J=5.8 Гц, 2Н).
Пример 4. 2-(1,3-бензодиоксол-5-ил)-N-(пиридин-4-илметил)-2-[(пиридин-4-илметил)-амино]ацетамид (вещество 272)
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СН2Сl2:МеОН 20:1. Чистый продукт растворяют в метаноле, насыщают НСl (газ) и упаривают в вакууме. Выход 29% (140 мг). Спектр 1Н-ЯМР: 3.11 (д, J=14.2 Гц, 2Н), 3.16 (д, J=6.8 Гц), 3.38 (д, J=6.8 Гц, 2Н), 3.77 (д, J=14.2 Гц, 2Н), 5.98 (с, 2Н), 6.69 (АВ-система, J=7.8 Гц, 2Н), 6.98 (с, 1Н), 7.13 (д, J=4.8 Гц), 7.23 (д, J -4.8 Гц), 8.49 (д, J=4.1 Гц, 2Н), 8.51 (д, J=4.1 Гц, 2Н).
Пример 5. 2-(1,3-бензодиоксол-5-ил)-2-[(2-пиперидин-4-илэтил)амино]-Н-(2-пиридин-4-илэтил)ацетамид (вещество 273)
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СН2Сl2:МеОН 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СН2Сl2:МеОН 20:1. Чистый продукт растворяют в метаноле, насыщают НСl (газ) и упаривают в вакууме. Выход 29% (150 мг). Спектр 1Н-ЯМР: 1.25-1.40 (м, 2Н), 1.55-1.70 (м, 1Н), 1.78-1.86 (м, 2Н), 2.75-2.95 (м, 4Н), 2.95-3.13 (м, 2Н), 3.25-3.33 (м, 2Н), 3.44-3.52 (м, 1H), 3.69-3.80 (м, 1Н), 5.98 (д, J=21.5 Гц, 2Н), 6.76-6.85 (м, 2Н), 6.91-6.97 (м, 1H), 7.78 (д, J=6.3 Гц, 2Н), 8.58 (д, J=6.3 Гц, 2Н).
Пример 6. 2-(1,3-бензодиоксол-5-ил)-2-[(2-пиперидин-4-илэтил)амино]-N-(пиридин-4-ил-метил)ацетамид (вещество 274)
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СH2Сl2:МеОН 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СH2Сl2:МеОН 20:1. Чистый продукт растворяют в метаноле, насыщают НСl (газ) и упаривают в вакууме. Выход 20% (100 мг). Спектр 1Н-ЯМР: 1.07-1.24 (м, 2Н), 1.50-1.70 (м, 5Н), 2.57-2.76 (м, 3Н), 2.80-2.90 (м, 1Н), 3.00-3.17 (м, 3Н), 5.14 (д, J=8.6 Гц, 1Н), 5.52 (д, J=8.6 Гц, 1Н), 5.68 (с, 2Н), 6.50 (д, J 7.6 Гц, 1Н), 6.75-6.79 (м, 1Н), 6.93 (с, 1Н), 8.04 (д, J=5.6 Гц, 2Н), 8.63 (д, J=5.6 Гц, 2Н).
Пример 7. 2-(4-гидроксифенил)-2-[(2-пиперидин-4-илэтил)амино]-N-(2-пиридин-4-ил-этил)ацетамид (вещество 583)
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СH2Сl2:МеОН 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СH2Сl2:МеОН 20:1. Чистый продукт растворяют в метаноле, насыщают НСl (газ) и упаривают в вакууме. Выход 21% (100 мг). Спектр 1Н-ЯМР: 1.29-1.60 (м, 6Н), 1.75-2.00 (м, 2Н), 2.85-3.10 (м, 4Н), 3.33-3.40 (м, 2Н), 3.45-3.60 (м, 1Н), 3.90-4.10 (м, 2Н), 5.47 (с, 2Н), 6.84 (д, J=8.1 Гц, 2Н), 7.01 (д, J=8.1 Гц, 2Н), 8.04 (д, J=6.1 Гц, 2Н), 8.74 (д, J=6.1 Гц, 2Н).
Пример 8. Метил 4-{2-оксо-1-[(2-пиридин-3-илэтил)амино]-2-[(2-пиридин-4-илэтил)амино]этил}бензоат (вещество 669)
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СH2Сl2:МеОН 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии СH2Сl2:МеОН 20:1. Чистый продукт растворяют в метаноле, насыщают НСl (газ) и упаривают в вакууме. Выход 38% (200 мг). Спектр 1Н-ЯМР: 2.65-2.75 (м, 5Н), 2.81-2.90 (м, 1Н), 3.31-3.40 (м, 1Н), 3.44-3.55 (м, 1Н), 3.87 (с, 3Н), 4.15 (с, 1Н), 6.85-7.05 (м, 3Н), 7.2 (уш.с, 1Н), 7.26 (д, J=8.1 Гц, 2Н), 7.43 (д, J=7.6 Гц, 1Н), 7.93 (д, J=8.1 Гц, 2Н), 8.4 (уш.с, 4Н).
Пример 9. Метил 4-{2-оксо-1,2-бис[(2-пиридин-3-илэтил)амино]этил}бензоат (вещество 668)
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Чистый продукт растворяют в метаноле, насыщают HCl (газ) и упаривают в вакууме. Выход 38% (200 мг). Спектр 1H-ЯМР: 2.65-2.75 (м, 5H), 2.80-2.90 (м, 1H), 3.30-3.40 (м, 1H), 3.44-3.50 (м, 1H), 3.87 (с, 3H), 4.15 (с, 1H), 6.03 (t, J=5.8 Гц), 7.13 (дд, J=4.8, 2.8 Гц, 1H), 7.18 (дд, J=4.8, 2.8 Гц, 1H), 7.27 (д, J=8.3 Гц, 2H), 7.35 (д, J=7.8 Гц, 1H), 7.44 (д, J=7.8 Гц, 1H), 7.93 (д, J=8.3 Гц, 2H), 8.34 (с, 1H), 8.39-8.47 (м, 3H).
Пример 10. Метил 4-{2-оксо-2-[(2-пиридин-3-илэтил)амино]-1-[(2-пиридин-4-илэтил)амино]этил}бензоат (вещество 670)
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 ммоль изонитрила. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Полученный трифторацетамид растворяют в метаноле (10 мл), охлаждают до 0°С и добавляют 0.2 г NaBH4. Смесь перемешивают 12 часов при комнатной температуре, растворитель упаривают в вакууме, а остаток очищают методом колоночной хроматографии CH2Cl2:MeOH 20:1. Чистый продукт растворяют в метаноле, насыщают HCl (газ) и упаривают в вакууме. Выход 38% (200 мг). Спектр 1H-ЯМР: 2.65-2.75 (м, 5H), 2.80-2.90 (м, 1H), 3.30-3.40 (м, 1H), 3.44-3.50 (м, 1H), 3.88 (с, 3H), 4.15 (с, 1H), 6.03 (t, J=5.8 Гц), 7.06 (д, J=5.6 Гц, 2H), 7.10-7.20 (м, 1H), 7.27 (д, J=8.3 Гц, 2H), 7.35 (д, J=7.8 Гц, 1H), 7.94 (д, J=8.3 Гц, 2H), 8.34 (с, 1H), 8.42 (д, J=3.8 Гц, 1H), 8.47 (д, J=5.6 Гц, 2H).
Пример 11. Метил 3-{2-оксо-1,2-бис[(2-пиридин-4-илэтил)амино]этил}бензоат (вещество 651)
К раствору 1 ммоль альдегида и 1 ммоль амина в 10 мл метанола добавляют CF3COOH (1 ммоль) и 1 мм