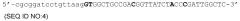Aav векторы с усовершенствованными rep-кодирующими последовательностями, используемыми в системах продукции на основе клеток насекомых
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, генной инженерии и вирусологии. Изобретение относится к конструкциям нуклеиновой кислоты, используемым для получения рекомбинантных парвовирусных векторов в клетках насекомых, к клеткам насекомых, включающим такие конструкции, и к способам, в которых клетки используют для получения рекомбинантных парвовирусных вирионов. Клетки насекомых предпочтительно содержат первую нуклеотидную последовательность, кодирующую парвовирусные белки Rep, где инициирующий кодон трансляции парвовирусного белка Rep78 представляет собой субоптимальный инициирующий кодон, который влияет на частичный скиппинг экзона при экспрессии в клетках насекомых. Клетка насекомого дополнительно содержит вторую нуклеотидную последовательность, содержащую нуклеотидную последовательность, по меньшей мере с одним парвовирусным (AAV) инвертируемым концевым повтором (ITR), и третью нуклеотидную последовательность, содержащую последовательности, кодирующие капсидные белки парвовируса. 7 н. и 23 з.п. ф-лы, 6 ил., 2 табл., 3 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к продукции аденоассоциированного вируса в клетках насекомых и к аденоассоциированному вирусу, который обладает улучшенными характеристиками экспрессии и стабильностью вирусных белков rep, что повышает продуктивность векторов на основе аденоассоциированных вирусов в клетках насекомых.
Предпосылки создания изобретения
Аденоассоциированный вирус (AAV) может рассматриваться как один из наиболее многообещающих вирусных векторов для использования в генной терапии человека. AAV обладает способностью эффективно инфицировать как делящиеся, так и неделящиеся клетки человека, при этом геном AAV интегрирует в единичный сайт хромосомы в геном клетки-хозяина, и что наиболее важно, наличие AAV в организме большого числа людей никогда не связывали с каким-либо заболеванием. Ввиду этих преимуществ, рекомбинантный аденоассоциированный вирус (rAAV) анализировали в рамках клинических испытаний для применения в генной терапии гемофилии B, злокачественной меланомы, муковисцидоза и других заболеваний.
Клетки-хозяева, которые поддерживают репликацию AAV in vitro, все получены из клеток различных типов, принадлежащих млекопитающим. Таким образом, rAAV, используемый в генной терапии, в основном получают на основе клеточных линий млекопитающих, таких как, например, клетки 293, COS клетки, HeLa клетки, KB клетки и другие клеточные линии млекопитающих (см., например, US 6156303, US 5387484, US 5741683, US 5691176, US 5688676, US 20020081721, WO 00/47757, WO 00/24916 и WO 96/17947). Как правило, векторы rAAV получают в этих культурах клеток млекопитающих путем введения ДНК-плазмид, содержащих терапевтический ген, фланкированный точкой начала репликации AAV (инвертированные концевые повторы или ITR), гены для репликации белков AAV Rep78, Rep68, Rep52 и Rep40, а также гены для образования вирионов или структурных белков VP1, VP2 и VP3. Кроме того, вводят плазмиду, содержащую ранние гены аденовируса (E2A, E40RF6, VARNA), для усиления экспрессии генов AAV и повышения выхода вектора (см., например, Grimm et al., 1998, Hum. Gene Ther. 9: 2745-2760). Однако в большинстве таких культур клеток млекопитающих число частиц AAV в расчете на клетку составляет порядка 104 частиц (см. обзор Clark, 2002, Kidney Int. 61 (Suppl. 1): 9-15). Для клинического испытания может потребоваться более 1015 частиц rAAV. Для получения такого количества частиц rAAV требуется трансфицировать и культивировать примерно 1011 клеток 293 человека, что эквивалентно 5000 колб с массой клеток, соответствующей площади 175 см2, что, в свою очередь, означает проведение трансфекции 1011 клеток 293. Соответственно, как это уже было доказано, крупномасштабное получение rAAV на основе культуры клеток млекопитающих для получения материала для клинических испытаний является проблематичным, а коммерческий масштаб получения невозможен. Кроме того, имеется также риск того, что вектор для клинического использования, который образуется в культуре клеток млекопитающих, будет загрязнен нежелательным, возможно, патогенным материалом, присутствующим в клетках млекопитающего-хозяина.
Для преодоления такого рода трудностей, связанных с использованием систем клеток млекопитающих, в последнее время была разработана система продукции AAV с использованием клеток насекомых (Urabe et al., 2002, Hum. Gene Ther. 13: 1935-1943; US 20030148506 и US 20040197895). Для получения AAV в клетках насекомых необходимо сделать некоторые модификации для достижения корректной стехиометрии всех трех капсидных белков AAV (VP1, VP2 и VP3), которые основаны на сочетании чередующегося использования двух акцепторных сайтов сплайсинга и субоптимальном использовании ACG-инициирующего кодона для VP2, который не совсем точно репродуцируется клетками насекомых. Для сохранения корректной стехиометрии капсидных белков в клетках насекомых Urabe et al. (2002, supra) использовали конструкцию, которая транскрибируется в общий полицистронный мессенджер, способный экспрессировать все три белка VP, без необходимости сплайсинга и где большая часть инициирующего кодона против направления считывания информации замещена субоптимальным инициирующим кодоном ACG. В совместно рассматриваемой заявке (PCT/NL2005/050018) авторы настоящего изобретения также улучшили инфективность бакуловирусных векторов rAAV на основе продукции с последующей оптимизацией стехиометрии капсидных белков AAV в клетках насекомых.
Для экспрессии Rep белков AAV в системе клеток насекомых с экспрессией AAV, первоначально разработанной Urabe et al. (2002, supra), используют рекомбинантную бакуловирусную конструкцию, которая несет две независимые единицы экспрессии Rep (одну - для Rep78, а другую - для Rep52), где каждая находится под контролем независимого промотора клетки насекомого, промоторов ΔIЕ1 и PolH, соответственно. В этой системе для осуществления экспрессии Rep78 был выбран промотор ΔIE1, который значительно слабее промотора PolH, поскольку известно, что в клетках млекопитающих экспрессия Rep78 менее активна, по сравнению с Rep52, и приводит к высокому выходу вектора (Li et al., 1997, J Virol. 71: 5236-43; Grimm et al., 1998, supra).
Однако несколько позже Kohlbrenner et al. (2005, Mol. Ther. 12: 1217-25) сообщили, что бакуловирусная конструкция для экспрессии двух белков Rep, использованная Urabe et al., отличается присущей ей нестабильностью. При расщеплении палиндромной структуры двух генов Rep в исходном векторе, использованном Urabe, и при конструировании двух отдельных бакуловирусных векторов экспрессии Rep52 и Rep78, Kohlbrenner et al. (2005, supra) удалось повысить стабильность вектора при проведении пассажей. Однако, несмотря на устойчивую экспрессию Rep78 и Rep52 из двух независимых бакуловирусных конструкций на основе Rep в клетках насекомых в течение по меньшей мере 5 пассажей, выход вектора rAAV был в 5-10 раз ниже, по сравнению с исходной конструкцией бакуловируса на основе Rep, созданной Urabe et al. (2002, supra).
В этой связи существует потребность в преодолении вышеуказанных серьезных ограничений, свойственных крупномасштабной (коммерческой) продукции векторов AAV в клетках насекомых. Таким образом, задачей настоящего изобретения является создание средств и способов, при которых возможно получение стабильного и высокого крупномасштабного выхода векторов AAV в клетках насекомых.
Описание изобретения
Определения
В контексте настоящего описания термин «функционально связанный» относится к связи полинуклеотидных (или полипептидных) элементов в функциональную связь. Нуклеиновая кислота является «функционально связанной», если она находится в условиях функциональной связи с другой последовательностью нуклеиновой кислоты. Например, регуляторная последовательность транскрипции функционально связана с кодирующей последовательностью, если она влияет на транскрипцию указанной кодирующей последовательности. Термин «функционально связанный» означает, что связанные последовательности ДНК являются, как правило, непрерывными, и при необходимости соединения двух участков, кодирующих белок, являются также непрерывными и находятся в рамке считывания.
Фраза «контрольная последовательность экспрессии» относится к последовательности нуклеиновой кислоты, которая регулирует экспрессию нуклеотидной последовательности, с которой она функционально связана. Контрольная последовательность экспрессии является «функционально связанной» с нуклеотидной последовательностью, если такая контрольная последовательность экспрессии контролирует и регулирует транскрипцию и/или трансляцию нуклеотидной последовательности. Таким образом, контрольная последовательность экспрессии может включать промоторы, энхансеры, внутренние сайты входа в рибосому (IRES), терминаторы транскрипции, старт-кодон перед геном, кодирующим белок, сигнал сплайсинга для интронов и стоп-кодоны. Под термином «контрольная последовательность экспрессии» понимают последовательность, которая включает, как минимум, последовательность, присутствие которой необходимо для воздействия на экспрессию и которая может также включать дополнительные полезные компоненты. Так, например, лидерные последовательности и слитые последовательности представляют собой пример контрольных последовательностей экспрессии. Этот термин также может включать конструкцию последовательности нуклеиновой кислоты, в которой удалены нежелательные возможные кодоны инициации транскрипции как внутри, так и за пределами рамки считывания. Этот термин может также включать конструкцию последовательности нуклеиновой кислоты, в которой удалены нежелательные возможные сайты сплайсинга. Контрольная последовательность экспрессии также включает последовательности или последовательности полиаденилирования (pA), которые регулируют добавление полиА хвоста, то есть удлинение цепи адениновыми остатками на 3'-конце мРНК, последовательности, которые называют полиА последовательностями. Указанные контрольные последовательности могут быть сконструированы с тем, чтобы усиливать стабильность мРНК. Контрольные последовательности экспрессии, которые влияют на стабильность транскрипции и трансляции, например промоторы, а также последовательности, которые влияют на трансляцию, например последовательности Козака, известны для клеток насекомых. Природа контрольных последовательностей экспрессии может определять их способность модулировать нуклеотидную последовательность, с которой они функционально связаны, для снижения уровней экспрессии или повышения уровней экспрессии.
В контексте настоящего описания термин «промотор» или «регуляторная последовательность транскрипции» относится к фрагменту нуклеиновой кислоты, который контролирует транскрипцию одной или нескольких кодирующих последовательностей, и который расположен против направления считывания информации относительно направления транскрипции от сайта инициации транскрипции кодирующей последовательности, а также который структурно идентифицируется по наличию сайта связывания для ДНК-зависимой РНК-полимеразы, сайтов инициации транскрипции и других последовательностей ДНК, включающих, без ограничения, сайты связывания фактора транскрипции, сайты связывания репрессора и активатора белка, а также любые другие последовательности нуклеотидов, известные специалистам в данной области, которые непосредственно или опосредованно регулируют уровень транскрипции с данным промотором. «Конститутивный» промотор представляет собой такой промотор, который активен в большинстве тканей в обычных физиологических условиях и условиях развития. «Индуцибельный» промотор представляет собой промотор, который подвергается физиологической регуляции или регуляции в ходе развития, например, при воздействии химического индуктора. «Тканеспецифичный» промотор активен только в конкретных типах тканей или клеток.
Термины «по существу идентичные» или «по существу сходные» в контексте настоящего описания используют для обозначения того, что две пептидных или две нуклеотидных последовательности, при их оптимальном выравнивании, например, с помощью программ GAP или BESTFIT с использованием параметров по умолчанию, обладают по меньшей мере некоторым процентом идентичности по последовательности. В программе GAP используется алгоритм глобального выравнивания Needleman и Wunsch для выравнивания двух последовательностей по всей их длине, максимизации числа совпадений и минимизации числа пропусков. В основном, в программе GAP используются параметры по умолчанию, в соответствии с которыми штраф за пропуск составляет 50 (нуклеотидов)/8 (белков) и штраф за удлинение пропуска составляет 3 (нуклеотидов)/2 (белков). В случае нуклеотидов используют заданную балльную матрицу nwsgapdna, а для белков заданной по умолчанию балльной матрицей является Blosum62 (Henikoff & Henikoff, 1992, PNAS 89, 915-919). Очевидно, что в том случае, когда речь идет о том, что последовательности РНК по существу сходны или обладают определенной степенью идентичности последовательности с последовательностью ДНК, то в этом случае тимин (T) в последовательности ДНК рассматривается как урацил (U) в последовательности РНК. Выравнивание последовательностей и определение баллов процента идентичности последовательностей может быть проведено с использованием таких компьютерных программ, как программа GCG Wisconsin Package, версия 10.3, доступная от компании Accelrys Inc., 9685 Scranton Road, San Diego, CA 92121-3752 USA, или доступного из открытого источника пакета программ Emboss для Windows (современная версия 2.7.1-07). В альтернативном варианте, процент сходства или идентичности может быть определен путем поиска в соответствующих базах данных, таких как FASTA, BLAST и т.п.
Нуклеотидные последовательности, кодирующие парвовирусные белки Rep по настоящему изобретению, могут быть также определены по их способности гибридизоваться с нуклеотидной последовательностью SEQ ID NO:10, соответственно, в умеренных или, предпочтительно, в жестких условиях гибридизации. Жесткие условия гибридизации по настоящему изобретению представляют собой условия, которые позволяют гибридизоваться последовательностям нуклеиновой кислоты из по меньшей мере примерно 25, предпочтительно, примерно 50 нуклеотидов, 75 или 100 и, наиболее предпочтительно, примерно 200 или более нуклеотидов, при температуре около 65°C в растворе, содержащем примерно 1М соли, предпочтительно, в растворе 6 × SSC или в любом другом растворе, обладающем сравнимой ионной силой, и при промывке при температуре 65°C в растворе, содержащем примерно 0,1M соли или менее, предпочтительно, в растворе 0,2 × SSC или любом другом растворе, обладающем сравнимой ионной силой. Предпочтительно, гибридизацию проводят в течение ночи, то есть в течение по меньшей мере 10 часов, а промывку, предпочтительно, проводят в течение по меньшей мере одного часа с по меньшей мере двумя заменами промывочного раствора. Эти условия обычно позволяют достичь специфической гибридизации последовательностей с идентичностью последовательностей примерно 90% или больше.
Умеренные условия в соответствии с настоящим описанием определяются как условия, которые позволяют гибридизоваться последовательностям нуклеиновой кислоты по меньшей мере из 50 нуклеотидов, предпочтительно, примерно из 200 или более нуклеотидов, при температуре примерно 45°C в растворе, содержащем примерно 1М соли, предпочтительно, в растворе 6 × SSC или в любом другом растворе, обладающем сравнимой ионной силой, и при промывке при комнатной температуре в растворе, содержащем примерно 1М соли, предпочтительно, в растворе 6 × SSC или любом другом растворе, обладающем сравнимой ионной силой. Предпочтительно, гибридизацию проводят в течение ночи, то есть в течение по меньшей мере 10 часов, а промывку, предпочтительно, проводят в течение по меньшей мере одного часа с по меньшей мере двумя заменами промывочного раствора. Эти условия обычно позволяют достичь специфической гибридизации последовательностей, обладающих идентичностью последовательностей до 50%. Любой специалист в данной области может модифицировать описанные условия гибридизации для достижения специфической идентификации последовательностей, уровень идентичности которых изменяется от 50% до 90%.
Подробное описание изобретения
Настоящее изобретение относится к применению парвовирусов животных, в частности депендовирусов, таких как инфекционный AAV человека или обезьяны, и их компонентов (например, генома парвовируса животных) для применения в качестве векторов для введения и/или экспрессии нуклеиновых кислот в клетках млекопитающих. В частности, настоящее изобретение относится к повышению продуктивности таких парвовирусных векторов при образовании в клетках насекомых.
Вирусы семейства Parvoviridae представляют собой небольшие ДНК-содержащие вирусы животных. Семейство Parvoviridae может быть разделено на два подсемейства: Parvovirinae, представители которого инфицируют позвоночных животных, и Densovirinae, представители которого инфицируют насекомых. Представители подсемейства Parvovirinae в данном случае рассматриваются как парвовирусы и включают род Dependovirus. Как можно понять из названия этого рода, представители Dependovirus являются уникальными в том смысле, что для достижения продуктивной инфекции в клеточной культуре им обычно требуется одновременное инфицирование хелперным вирусом, таким как аденовирус или герпесвирус. Род Dependovirus включает AAV, который в норме инфицирует людей (например, серотипы 1, 2, 3А, 3B, 4, 5 и 6) или приматов (например, серотипы 1 и 4), а также родственные вирусы, которые инфицируют других теплокровных животных (например, коровий, собачий, лошадиный и овечий аденоассоциированные вирусы). Дополнительная информация по парвовирусам и другим представителям Parvoviridae описана в литературе (Kenneth I. Berns, "Parvoviridae: The Viruses and Their Replication", Chapter 69 in Fields Virology (3d Ed. 1996)). Для простоты настоящее изобретение далее описано только применительно к AAV. Однако следует понимать, что настоящее изобретение не ограничивается только AAV и может быть равным образом применимо к другим парвовирусам.
Геномная организация всех известных серотипов AAV очень сходна. Геном AAV представляет собой линейную одноцепочечную молекулу ДНК, которая содержит менее чем примерно 5000 нуклеотидов (нт) в длину. Инвертированные концевые повторы (ITR) фланкируют уникальные кодирующие нуклеотидные последовательности репликации неструктурных белков (Rep) и структурных белков (VP). Белки VP (VP1, -2 и -3) образуют капсид. Концевые 145 нуклеотидов являются самокомплементарными и организованы таким образом, что может быть сформирован энергетически стабильный внутримолекулярный дуплекс, образующий Т-образную шпилечную структуру. Такие шпилечные структуры функционируют как точки начала репликации ДНК вируса, являясь праймерами для клеточного ДНК-полимеразного комплекса. После инфекции клеток млекопитающих AAV дикого типа (wtAAV) гены Rep (например, Rep78 и Rep52) экспрессируются с помощью P5 промотора и P19 промотора, соответственно, и оба белка Rep выполняют определенную функцию в репликации генома вируса. Сплайсинг в открытой рамке считывания Rep (Rep ORF) приводит к экспрессии фактически четырех белков Rep (например, Rep78, Rep68, Rep52 и Rep40). Однако было показано, что несплайсированная мРНК, кодирующая белки Rep78 и Rep52, является достаточной для продукции вектора AAV в клетках млекопитающих. Аналогично, в клетках насекомых белки Rep78 и Rep52 являются достаточными для продукции вектора AAV.
Фраза «рекомбинантный парвовирусный или вектор AAV» (или «вектор rAAV») в контексте настоящего описания относится к вектору, содержащему одну или несколько интересующих полинуклеотидных последовательностей, интересующих генов или «трансгенов», которые фланкированы парвовирусными или инвертированными концевыми повторяющимися последовательностями (ITR) AAV. Такие векторы rAAV могут быть реплицированы и упакованы в инфекционные вирусные частицы, которые присутствуют в клетке-хозяине насекомого, экспрессирующей генные продукты rep и cap AAV (например, белки Rep и Cap). В том случае, если вектор rAAV встроен в более крупную конструкцию нуклеиновой кислоты (например, в хромосому или другой вектор, такой как плазмида или бакуловирус, используемый для клонирования или трансфекции), указанный вектор rAAV обычно рассматривается как «про-вектор», который может быть «незатронут» при репликации или инкапсидировании при наличии упаковочных функций и необходимых хелперных функций AAV.
В первом аспекте настоящее изобретение относится к нуклеотидной последовательности, содержащей открытую рамку считывания, которая содержит нуклеотидные последовательности, кодирующие белки Rep парвовирусов животных, где инициирующий кодон трансляции парвовирусного белка Rep78 представляет собой субоптимальный инициирующий кодон. Предпочтительно, субоптимальный инициирующий кодон представляет собой кодон инициации, который осуществляет частичный скиппинг экзонов. Частичный скиппинг экзонов в контексте настоящего описания означает, что по меньшей мере часть рибосом не начинает трансляцию при субоптимальном инициирующем кодоне белка Rep78, но при инициирующем кодоне, следующем по пути считывания информации, трансляция начинается, и в этой связи, предпочтительно, инициирующий кодон, следующий по пути считывания информации, представляет собой инициирующий кодон белка Rep52. Предпочтительно, субоптимальный инициирующий кодон влияет на частичный скиппинг экзона при экспрессии нуклеотидной последовательности в клетке насекомого. Предпочтительно, субоптимальный инициирующий кодон влияет на частичный скиппинг экзона в клетке насекомого, так что достигается продукция в клетке насекомого Rep78 и Rep52 в молярном соотношении в диапазоне от 1:10 до 10:1, от 1:5 до 5:1 или от 1:3 до 3:1, предпочтительно, примерно через 20-40 часов после инфекции, более предпочтительно, примерно через 30-40 часов после инфекции, используя систему экспрессии бакуловируса. Молярное соотношение Rep78 и Rep52 может быть определено вестерн-блоттингом, как описано в примере 1.1.3, предпочтительно, с использованием моноклональных антител, которые распознают общий эпитоп для Rep78 и Rep52, или с использованием антител, описанных в примере 1.1.3.
Термин «субоптимальный инициирующий кодон» в контексте настоящего описания относится не только к самому тринуклеотидному инициирующему кодону, но также к его соответствующему смысловому аналогу. Таким образом, субоптимальный инициирующий кодон может состоять из «оптимального» ATG кодона в субоптимальном контексте, то есть в контексте не-Козака. Однако более предпочтительными являются субоптимальные инициирующие кодоны, в случае которых тринуклеотидный инициирующий кодон сам является субоптимальным, то есть не является ATG. Термин «субоптимальный» в контексте настоящего описания означает, что такой кодон менее эффективен для инициации трансляции, тогда как в другом смысле он идентичен нормальному ATG кодону. Предпочтительно, эффективность субоптимального кодона составляет менее чем 90, 80, 60, 40 или 20% относительно эффективности нормального ATG кодона, тогда как в другом контексте они идентичны. Способы сравнения относительной эффективности инициации трансляции известны специалистам в данной области. Предпочтительные субоптимальные кодоны инициации могут быть выбраны из ACG, TTG, CTG и GTG. Более предпочтительным является ACG.
Под нуклеотидной последовательностью, которая кодирует белки Rep парвовирусов животных, в контексте настоящего изобретения следует понимать нуклеотидную последовательность, кодирующую неструктурные белки Rep, которые являются необходимыми и достаточными для продукции парвовирусного вектора в клетках насекомых, таких как белки Rep78 и Rep52. Нуклеотидную последовательность парвовирусов животных получают из депендовируса, более предпочтительно, из аденоассоциированного вируса человека или обезьяны (AAV) и, наиболее предпочтительно, из AAV, который обычно инфицирует людей (например, серотипы 1, 2, 3A, 3B, 4, 5 и 6) или приматов (например, серотипы 1 и 4). Пример нуклеотидной последовательности, кодирующей белки Rep парвовирусов животных, приведен в виде последовательности SEQ ID NO:10, которая представляет собой часть геномной последовательности AAV серотипа 2, кодирующей белки Rep. Кодирующая последовательность Rep78 включает нуклеотиды 11-1876, а кодирующая последовательность Rep52 включает нуклеотиды 683-1876. Следует понимать, что точный молекулярный вес белков Rep78 и Rep52, а также точное расположение инициирующих кодонов трансляции могут отличаться у разных парвовирусов. Однако специалистам в данной области известно, каким образом можно идентифицировать соответствующее положение в нуклеотидной последовательности из парвовирусов, отличных от AAV-2. Таким образом, нуклеотидная последовательность, кодирующая белки Rep парвовирусов животных, может быть определена как нуклеотидная последовательность:
a) которая кодирует полипептид, содержащий аминокислотную последовательность, которая идентична по меньшей мере на 50, 60, 70, 80, 88, 89, 90, 95, 97, 98 или 99% аминокислотной последовательности SEQ ID NO:11;
b) которая идентична по меньшей мере на 50, 60, 70, 80, 81, 82, 85, 90, 95, 97, 98 или 99% нуклеотидной последовательности на участке 11-1876 в SEQ ID NO:10;
c) комплементарная цепь которой гибридизуется с молекулой нуклеиновой кислоты, имеющей последовательность согласно пунктам (a) или (b);
d) нуклеотидные последовательности которой отличаются от последовательности молекулы нуклеиновой кислоты согласно пункту (c) благодаря вырожденности генетического кода.
Предпочтительно, нуклеотидная последовательность кодирует белки Rep парвовирусов животных, которые необходимы и достаточны для продукции парвовирусного вектора в клетках насекомых.
Другая предпочтительная нуклеотидная последовательность по настоящему изобретению содержит контрольную последовательность экспрессии, которая содержит девятинуклеотидную последовательность SEQ ID NO:7 или нуклеотидную последовательность, которая по существу гомологична SEQ ID NO:7, расположенную против направления считывания информации от инициирующего кодона в нуклеотидной последовательности, кодирующей парвовирусный белок Rep78. Последовательность, по существу идентичная нуклеотидной последовательности SEQ ID NO:7, которая будет способствовать повышению экспрессии парвовирусного белка Rep78, представляет собой, например, последовательность, которая по меньшей мере на 60%, 70%, 80% или 90% идентична девятинуклеотидной последовательности SEQ ID NO:7.
Потребность в удалении возможных ложных сайтов инициации трансляции в кодирующих последовательностях белка Rep, отличных от сайтов инициации трансляции Rep78 и Rep52, в других парвовирусах очевидна для специалистов в данной области, поскольку это будет устранение возможных сайтов сплайсинга, которые могут распознаваться в клетках насекомых. Различные модификации последовательностей парвовирусов дикого типа для соответствующей экспрессии в клетках насекомых получают при использовании известных методик генетического конструирования, таких как, например, описанные в работе Sambrook и Russell (2001) "Molecular Cloning: A Laboratory Manual (3rd edition), Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, New York. Специалистам в данной области хорошо известны другие модификации кодирующих участков белков Rep, с помощью которых можно повысить выход белка Rep. Такие модификации входят в объем настоящего изобретения.
В другом аспекте настоящее изобретение относится к конструкции нуклеиновой кислоты, содержащей нуклеотидную последовательность, которая кодирует белок Rep парвовируса, определенный выше. Предпочтительно, в указанной конструкции нуклеотидная последовательность, кодирующая белки Rep парвовируса, функционально связана с контрольными последовательностями экспрессии для экспрессии в клетке насекомого. Эти контрольные последовательности экспрессии включают по меньшей мере промотор, который активен к клетках насекомого. В практике осуществления настоящего изобретения могут быть использованы известные в данной области методики, которые применяются для экспрессии чужеродных генов в клетках-хозяевах насекомых. Стратегии молекулярного конструирования и экспрессии полипептидов в клетках насекомых описаны в литературе (см., например, Summers and Smith. 1986. A Manual of Methods for Baculovirus Vectors and Insect Culture Procedures, Texas Agricultural Experimental Station Bull. No. 7555, College Station, Tex.; Luckow. 1991. In Prokop et al., Cloning and Expression of Heterologous Genes in Insect Cells with Baculovirus Vectors' Recombinant DNA Technology and Applications, 97-152; King, L. A. and R. D. Possee, 1992, The baculovirus expression system, Chapman and Hall, United Kingdom; O'Reilly, D. R., L. K. Miller, V. A. Luckow, 1992, Baculovirus Expression Vectors: A Laboratory Manual, New York; W. H. Freeman and Richardson, С. D., 1995, Baculovirus Expression Protocols, Methods in Molecular Biology, volume 39; US 4,745,051; US2003148506 и WO 03/074714). Особенно подходящим промотором для транскрипции нуклеотидной последовательности по настоящему изобретению, которая кодирует белки Rep парвовируса, является, например, полиэдронный промотор. Однако в данной области известны также другие промоторы, которые активны в клетках насекомых, например промоторы p10, p35, IE-1 или ΔIE-1, а также другие промоторы, описанные в цитированных выше работах.
Предпочтительно, конструкция нуклеиновой кислоты для экспрессии белков Rep парвовируса в клетках насекомых представляет собой вектор, совместимый с клеткой насекомого. Под таким «вектором, совместимым с клеткой насекомого», или просто «вектором», следует понимать молекулу нуклеиновой кислоты, которая способна к трансформации или трансфекции насекомого или клетки насекомого. Примеры биологических векторов включают плазмиды, линейные молекулы нуклеиновой кислоты и рекомбинантные вирусы. При этом можно использовать любой вектор, если он совместим с клеткой насекомого. Такой вектор может быть интегрирован в геном клеток насекомого, но присутствие вектора в клетке насекомого необязательно должно быть постоянным, настоящее изобретение также включает временные эписомальные векторы. Указанные векторы могут быть введены любыми способами, например, путем химической обработки клеток, путем электропорации или инфекции. В предпочтительном варианте указанный вектор представляет собой бакуловирус, вирусный вектор или плазмиду. В более предпочтительном варианте указанный вектор представляет собой бакуловирус, например, указанная конструкция представляет собой бакуловирусный вектор. Бакуловирусные векторы и способы их использования описаны в цитированных выше работах по молекулярному конструированию клеток насекомых.
В другом аспекте настоящее изобретение относится к клетке насекомого, которая включает нуклеотидную последовательность не более одного типа, содержащую единственную открытую рамку считывания, которая кодирует белок Rep парвовируса. Предпочтительно, указанная единственная открытая рамка считывания кодирует один или несколько белков Rep парвовируса, более предпочтительно, указанная открытая рамка считывания кодирует все белки Rep парвовируса, наиболее предпочтительно, указанная открытая рамка считывания кодирует полноразмерный белок Rep 78, из которого в клетке насекомого предпочтительно экспрессируются по меньшей мере как белок Rep52, так и белок Rep78. Следует отметить, что клетка насекомого в контексте настоящего описания может включать более чем одну копию нуклеотидной последовательности одного типа, например, в составе мультикопийного эписомального вектора, и такие векторы представляют собой множественные копии по существу одной и той же молекулы нуклеиновой кислоты или по меньшей мере молекулы нуклеиновой кислоты, которая кодирует одну аминокислотную последовательность белка Rep, то есть молекулы нуклеиновой кислоты, которые незначительно отличаются друг от друга благодаря вырожденности генетического кода. Наличие только одного типа молекул нуклеиновой кислоты, кодирующих белки Rep парвовируса, препятствует рекомбинации гомологичных последовательностей, которая могла бы происходить в случае различных типов векторов, содержащих последовательности Rep, а это, в свою очередь, могло бы привести к образованию дефектных конструкций при экспрессии белка Rep и влиянию (в плане стабильности) на уровни продукции парвовирусов в клетках насекомых. Предпочтительно, нуклеотидная последовательность, которая находится в клетке насекомого и содержит единственную открытую рамку считывания, кодирующую один или несколько белков Rep парвовируса, представляет собой часть конструкции нуклеиновой кислоты, где указанная нуклеотидная последовательность функционально связана с контрольными последовательностями экспрессии для экспрессии в клетке насекомого. Другая предпочтительная клетка насекомого содержит, в качестве «первой» нуклеотидной последовательности, определенную выше нуклеотидную последовательность, которая кодирует белки Rep парвовируса, предпочтительно, кодирующую последовательность с субоптимальным инициирующим кодоном, определенную выше, или определенную выше конструкцию нуклеиновой кислоты, или клетка насекомого содержит, в качестве «первой» конструкции нуклеиновой кислоты, определенную выше конструкцию нуклеиновой кислоты, которая содержит такие нуклеотидные последовательности.
Любая клетка насекомого, в которой может реплицироваться рекомбинантный парвовирусный вектор (rAAV), и которая может поддерживаться в культуре, может быть использована по настоящему изобретению. Так, например, используемые клеточные линии могут быть получены из Spodoptera frugiperda, клеточных линий дрозофиллы, или клеточных линий комара, например клеточных линий, полученных из Aedes albopictus. Предпочтительные клетки насекомых или клеточные линии насекомых представляют собой клетки, полученные у вида насекомого, который является чувствительным к инфекции бакуловирусов, включая, например, Se301, SeIZD2109, SeUCR1, Sf9, Sf900+, Sf21, BTI-TN-5B1-4, MG-1, Tn368, HzAm1, Ha2302, Hz2E5, High Five (Invitrogen, CA, USA) и expresSF+® (US 6103526; Protein Sciences Corp., CT, USA).
Предпочтительная клетка насекомого по настоящему изобретению, кроме указанной выше «первой» нуклеотидной последовательности или конструкции нуклеиновой кислоты, содержит также:
a) вторую нуклеотидную последовательность, содержащую по меньшей мере одну нуклеотидную последовательность инвертированного концевого повтора (ITR) парвовируса; и
b) третью нуклеотидную последовательность, содержащую кодирующую последовательность белка Cap парвовируса, функционально связанную с контрольными последовательностями экспрессии для экспрессии в клетке насекомого.
В контексте настоящего описания под фразой «по меньшей мере одна нуклеотидная последовательность ITR парвовируса» следует понимать палиндромную последовательность, которая преимущественно содержит комплементарные, симметрично организованные последовательности, обозначаемые как участки "A", "B" и "C". ITR функционирует в качестве точки начала репликации, сайта, выполняющего «цис»-функцию в процессе репликации, то есть сайта распознавания трансактивных белков репликации, таких как, например, Rep78 (или Rep68), которые распознают палиндромные и специфические последовательности внутри палиндрома. Одним исключением в симметрии последовательности ITR является участок "D" в ITR. Он характеризуется уникальной структурой (не имеет комплемента внутри одной из последовательностей ITR). Точечный разрыв в одноцепочечной ДНК происходит в месте соединения участков A и D. Это тот участок, в котором происходит инициация синтеза ДНК. Участок D в норме находится на одной стороне палиндрома и определяет направленность нуклеиновой кислоты на стадии репликации. Парвовирус, реплицирующийся в клетке млекопитающего, как правило, содержит две последовательности ITR. Однако возможно сконструировать ITR таким образом, чтобы сайты связывания находились на обеих цепях участков A и D и располагались симметрично, то есть по одному на каждой стороне палиндрома. В случае двухцепочечной кольцевой ДНК-матрицы (например, в плазмиде), репликация нуклеиновой кислоты Rеp78 или Rеp68 происходит в двух направлениях и достаточно одной последовательности ITR для репликации кольцевого вектора парвовируса. Таким образом, в рамках настоящего изобретения можно использовать одну нуклеотидную последовательность ITR. Однако, предпочтительно, используют две или более упорядоченных ITR. Более предпочтительно, используют две последовательности ITR. Предпочтительной парвовирусной последовательностью ITR является ITR AAV. По соображениям безопасности может быть желательно сконструировать рекомбинантный парвовирусный вектор (rAAV), который не способен делиться после его введения в клетку. Такой механизм безопасности, направленный на ограничение нежелательного деления вектора в организме реципиента, может быть обеспечен за счет использования rAAV с химерной ITR, как описано в US2003148506.
Количество конструкций нуклеиновой кислоты, используемых в клетке насекомого для продукции рекомбинантного парвовирусного вектора (rAAV), в настоящем изобретении не ограничено. Например, можно использовать одну, две, три, четыре, пять или больше отдельных конструкций для продукции rAAV в клетках насекомых, в соответствии со способами по настоящему изобретению. Если используют пять конструкций, то одна конструкция кодирует VP1 AAV, другая конструкция кодирует VP2 AAV, еще одна конструкция кодирует VP3 AAV, дополнительная конструкция кодирует белок Rep, определенный выше, и последняя конструкция содержит по меньшей мере одну ITR AAV. Если используют меньше пяти конструкций, то указанные конструкции могут содержать различные сочетания по меньшей мере одной ITR AAV и VP1, VP2, VP3, а также кодирующие посл