Способ оценки эффективности антимикробного воздействия антибиотиков и ультразвукового излучения на патогенные бактерии, существующие в форме биопленки
Иллюстрации
Показать всеСпособ оценки эффективности лечения проводится на имитационной модели и предусматривает создание модели бактериальной биопленки, выращенной из биолюминесцентных бактерий Vibrio fischeri. На биопленку воздействуют антибиотиками и ультразвуковым излучением и затем оценивают антимикробный эффект. Изменение жизнеспособности бактерий можно контролировать по изменению интенсивности свечения биолюминесцентных бактерий с помощью приборов, например люменометров. Антимикробный эффект оценивают по степени подавления интенсивности свечения по сравнению с контролем. Способ может быть использован в доклинических экспериментах для определения эффективных методов лечения хронических бактериальных инфекций, осложненных образованием бактериальных биопленок, при этом существенно снижаются затраты и трудоемкость экспериментов. 25 ил., 6 пр.
Реферат
Изобретение относится к экспериментальной медицине и биотехнологии и может быть использовано при определении эффективных мер лечения хронических инфекционных заболеваний человека в условиях моделирования в доклинических экспериментах.
Микробные биопленки ответственны за этиологию и патогенез многих острых и, особенно, хронических бактериальных инфекций человека. К этим инфекциям относятся хронический риносинусит, пародонтит, кариес, воспаление среднего уха, муковисцидоз, бактериальный простатит, инфекционный эндокардит, инфекции мочевыводящих путей, минингококковая болезнь. Подобные инфекционные заболевания могут быть вызваны не одним видом бактерий, а целым их сообществом. Биопленки представляют собой трехмерные упорядоченные структуры, которые проявляют высокую устойчивость к физическим и химическим воздействиям, в том числе к антибиотикам, сульфаниламидным препаратам, нитрофуранам и другим современным лекарствам. Очень часто бактериальные биопленки развиваются на медицинских имплантатах. По мнению многих исследователей, свыше 60% всех внутрибольничных инфекций происходит в результате деятельности микроорганизмов, находящихся в биопленках. Например, инфекции, связанные с катетеризацией сосудов, чаще всего вызываются Staphylococcus aureus и другими грамположительными микроорганизмами.
Эксперименты и клинические исследования показали, что достаточно эффективным средством сенсибилизации биопленок к антимикробным агентам может быть обработка ультразвуком.
Известен способ воздействия низкочастотным ультразвуком, который применяется в сочетании с различными антимикробными препаратами для лечения бактериальных инфекций, связанных с образованием биопленок. (Bartley, J. Ultrasound as a treatment for chronic rhinosinusitis. [Текст] / J.Bartley, D.Young // Med. Hypotheses. - 2009. - V.73. №1. - P.15-17.) [1]. Биоакустический эффект проявляется в уменьшении жизнеспособности бактерий в биопленках в результате одновременного воздействия низкочастотного ультразвука и антимикробных препаратов.
Серьезной проблемой в хирургии являются инфекции, связанные с протезированием. Для борьбы с ними используются костные цемента, обработанные антибиотиками.
Известен способ воздействия комбинации низкочастотного ультразвука и антибиотиков для снижения жизнеспособности планктонных форм бактерий и бактериальных биопленок в костном цементе, применяемом для постоянной фиксации суставов. (Ensing, G.T. The combination of ultrasound with antibiotics released from bone cement decreases the viability of planktonic and biofilm bacteria: an in vitro study with clinical strains [Текст] / G.T. Ensing, D. Neut, J.R. van Horn, H.C. van der Met, H.J. Busscher // J. Antimicrob. Chemother. - 2006. - V.58. - №6. P.1287-1290.) [2]. В результате обработки бактерий Escherichia coli ATCC 10798, Staphylococcus aureus 7323, стафилококков (CoNS 7368 и CoNS 7391), Pseudomonas aeruginosa 5148 (планктонных форм и в виде биопленок) пульсирующим ультразвуком в комбинации с антибиотиками в костном цементе (время обработки пульсирующим ультразвуком составило 40 часов) был сделан вывод о том, что сам по себе низкочастотный ультразвук не затрагивает жизнеспособность бактерий. Однако в комбинации с антибиотиками он существенно снижает жизнеспособность как планктонных форм бактерий, так и бактериальных биопленок.
Известен способ эндопротезирования крупных суставов (RU 2218886, МПК7 A61B 17/56, A61N 7/00; опубл. 2003.12.20) [3], заключающийся в том, что на этапе рассечения тканей, резекции частей сустава и обработки вертлужной впадины осуществляют контактный гемостаз с помощью ультразвука. После обработки вертлужной впадины в ней формируют отверстия ультразвуком. Затем вертлужную впадину заполняют раствором антисептика или антибиотика, погружают рабочий торец инструмента в раствор и осуществляют очистку поверхности и кавитационный гемостаз. После удаления жидкости осуществляют ультразвуковую фрагментарную сушку поверхности костного ложа для цементирования и установки тазового компонента эндопротеза. Перед установкой бедренной части эндопротеза и ее цементированием костномозговой канал заполняют антисептиком или антибиотиком. Погружают рабочий торец инструмента в раствор и осуществляют очистку канала и кавитационный гемостаз.
В известном способе установлена перспективность использования комбинации антибиотиков и пульсирующего ультразвука в клинической практике для предотвращения или лечения инфекций, связанных с протезированием.
Известен способ исследования влияния низкочастотного ультразвука на повышение эффективности антибиотического воздействия гентамицина на грамотрицательные бактерии. (Pitt, W.G. Ultrasonic enhancement of antibiotic action on gram-negative bacteria [Текст] / W.G.Pitt, M.O.McBride, J.K.Lunceford, R.J.Roper, R.D.Sagers // Antimicrob. Agents Chemother. - 1994. - V.38. - №11. - P.2577-2582.) [4]. Результаты исследований были рекомендованы для использования в клинической практике при лечении инфекций, устойчивых к антибиотикам на медицинских имплантатах.
Известен способ лечения острого панкреатита (RU 2119769, МПК6 A61B 17/00, A61N 7/00, A61K 31/505, A61K 38/55; опубл. 1998.10.10) [5], заключающийся в том, что после вскрытия брюшной полости из сальниковой сумки формируют изолированную полость. Заполняют полость раствором ингибиторов протеаз. Через раствор обрабатывают поджелудочную железу и забрюшинную клетчатку низкочастотным ультразвуком. Обработанную жидкость заменяют раствором 5-фторурацила с антибиотиками. Повторно воздействуют ультразвуком. Процедуру повторяют 1 раз в сутки в течение 3-5 дней. Способ позволяет сократить сроки лечения острого панкреатита за счет интенсификации лекарственного и физического воздействия.
Известен способ лечения аденоидита у детей (RU 2087166, МПК A61N 7/00; опубл. 1997.08.20) [6] путем нанесения на область верхнего шейного бокового лимфатического узла I порядка для носоглоточной миндалины, расположенного позади наружного слухового прохода, 3-5% мази, содержащей антибиотик, и воздействия на эту область ультразвуком поочередно с обеих сторон.
Ученые отмечают, что воздействие ультразвуком усиливает эффективность антибиотического воздействия, однако механизмы этого процесса все еще не выяснены окончательно. Предполагается, что воздействие ультразвуком увеличивает норму антибиотического транспорта к бактериальным клеткам, улучшает проницаемость бактериальных мембран. Пульсирующий ультразвук столь же эффективен, как и непрерывный. Слабая изученность действия ультразвука на бактериальную клетку не позволяет более точно указать механизмы наблюдаемых явлений. Очевидно, что их исследование является одной из актуальных задач современной микробиологии.
Наиболее близким к заявляемому изобретению является способ изучения на кролике комплексного воздействия аминогликозидных антибиотиков и низкочастотного ультразвука (Rediske. A.M. Ultrasonic enhancement of antibiotic action on Escherichia coli biofilms: an in vivo model [Текст] / A.M.Rediske, B.L.Roeder, M.K.Brown, J.L.Nelson, R.L.Robison, D.O.Draper, G.B.Schaalje, R.A.Robison, W.G. Pitt // Antimicrob Agents Chemother. - 1999. - V.43. - №5. - P.1211-1214) [7], принимаемый за прототип. В известном способе биопленку из патогенных микроорганизмов помещают на полиэтиленовый диск и хирургическим путем внедряют в организм белого кролика. Совместное воздействие на кролика низкочастотного ультразвука и антибиотика (гентамицина) по показателям его самочувствия позволило определить некоторые закономерности. Было показано, что воздействие ультразвука вызывает снижение жизнеспособности бактериальных биопленок (Escherichia coli ATCC 10798) только в случае наличия антибиотика. Способ подтвердил возможности совместного действия ультразвука и гентамицина в клинической практике. Недостатками способа являются манипуляции с животным, хирургическое вмешательство в его организм с использованием хирургических инструментов и нанесением ему операционных травм. Это сложно, дорого, трудоемко, а также может вызвать побочные эффекты (например, образование гнойных абсцессов), ослабление организма животного и даже его гибель.
Задачей заявляемого изобретения является замена экспериментов на животных для определения эффективных мер лечения хронических инфекционных заболеваний, экспериментами на модели бактериальной биопленки, выращенной из биолюминесцентных бактерий, патогенные свойства которых идентичны для микроорганизмов, вызывающих инфекционные заболевания.
Техническим результатом заявляемого изобретения является снижение затрат, трудоемкости, повышение безопасности за счет проведения оценки эффективности мер лечения хронических инфекционных заболеваний не над животными, а на модели бактериальной биопленки, выращенной из биолюминесцентных бактерий, патогенные свойства которых идентичны для микроорганизмов, вызывающих инфекционные заболевания. В этом случае снижение жизнеспособности бактерий под воздействием физических и химических факторов, например, ультразвука и антибиотиков, можно контролировать по снижению интенсивности их свечения с помощью приборов, например, люминометров.
Поставленный результат достигается тем, что в известном способе оценки эффективности антимикробного воздействия антибиотиков и ультразвукового излучения на патогенные бактерии, существующие в форме биопленки, заключающемся в создании модели бактериальной биопленки, подборе доз воздействия антибиотиков и ультразвукового излучения на бактериальную биопленку, регистрации и оценке антимикробного эффекта, согласно изобретению в качестве модели бактериальной биопленки используют биопленку биолюминесцентных бактерий, которую выращивают из биолюминесцентных бактерий Vibrio fischeri, имитирующих морфологические, физиологические и биохимические свойства, аналогичные патогенным бактериям, при этом регистрацию воздействия антибиотиков и ультразвука на биопленку проводят путем измерения интенсивности свечения биолюминесцентных бактерий Vibrio fischeri, а антимикробный эффект оценивают по степени подавления интенсивности свечения по сравнению с контролем.
Образование биопленок характерно для многих микроорганизмов. В ходе исследований было установлено, что основные механизмы формирования биопленок, а также системы регуляции этого процесса, существующие у патогенных микроорганизмов, сходны с таковыми у морской люминесцентной бактерии Vibrio fischeri. Бактерии рода Vibrio способны образовывать биопленки, имеющие типичные морфологические, физиологические и биохимические параметры, аналогичные патогенным микроорганизмам, что объединяет Vibrio fischeri с патогенными вибрионами. Это позволяет использовать выращенную из клеток микроорганизма Vibrio fischeri биопленку в качестве имитационной модели для изучения воздействия физических и химических факторов на патогенные виды бактерий. Существенное преимущество Vibrio fisheri состоит в том, что образование биопленки сопровождается у него резким усилением свечения, а воздействие физических и химических факторов, например ультразвукового излучения и антибиотиков, фиксируется изменением свечения, что позволяет регистрировать соответствующие процессы в режиме реального времени. Таким образом, на модели биопленки, выращенной из бактерии Vibrio fischeri, можно регистрировать и оценивать антибактериальное действие физических и химических факторов, например ультразвукового излучения и антибиотиков на патогенные виды бактерий, что значительно упростит и ускорит процесс выбора оптимального лечения.
Способ оценки эффективности антимикробного воздействия антибиотиков и ультразвукового излучения на патогенные бактерии, существующие в форме биопленки, иллюстрируется чертежами.
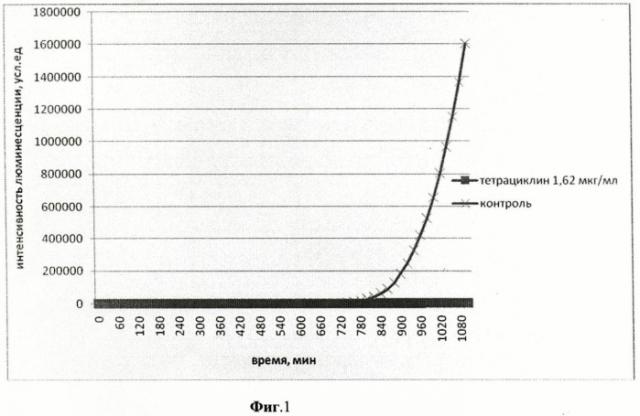
На фиг.1 приведен график биолюминесцентного ответа Vibrio fischeri (начальное количество клеток в 1 мл среды составляет 105) на добавление тетрациклина (конечная концентрация в среде 1,62 мкг/мл).
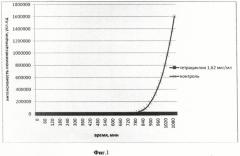
На фиг.2 приведен график биолюминесцентного ответа Vibrio fischeri (начальное количество клеток в 1 мл среды составляет 105) на добавление тетрациклина (конечная концентрация в среде 0,44 мкг/мл).
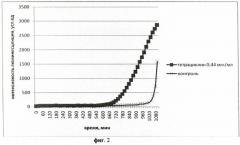
На фиг.3 приведен график биолюминесцентного ответа Vibrio fischeri (начальное количество клеток в 1 мл среды составляет 105) на добавление тетрациклина (конечная концентрация в среде 0,032 мкг/мл).
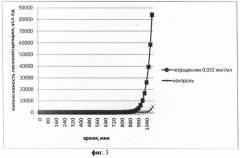
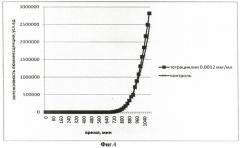
На фиг.4 приведен график биолюминесцентного ответа Vibrio fischeri (начальное количество клеток в 1 мл среды составляет 105) на добавление тетрациклина (конечная концентрация в среде 0,0012 мкг/мл).
На фиг.5 приведен график биолюминесцентного ответа Vibrio fischeri (начальное количество клеток в 1 мл среды составляет 105) на добавление хлорамфеникола (конечная концентрация в среде 1,62 мкг/мл).
На фиг.6 приведен график биолюминесцентного ответа Vibrio fischeri (начальное количество клеток в 1 мл среды составляет 105) на добавление хлорамфеникола (конечная концентрация в среде 0,44 мкг/мл).
На фиг.7 приведен график биолюминесцентного ответа Vibrio fischeri (начальное количество клеток в 1 мл среды составляет 105) на добавление хлорамфеникола (конечная концентрация в среде 0,032 мкг/мл).
На фиг.8 приведен график биолюминесцентного ответа Vibrio fischeri (начальное количество клеток в 1 мл среды составляет 105) на добавление хлорамфеникола (конечная концентрация в среде 0,0012 мкг/мл).
На фиг.9 приведен график биолюминесцентного ответа Vibrio fischeri (начальное количество клеток в 1 мл среды составляет 105) на добавление хлорамфеникола (конечная концентрация в среде 1,0 мкг/мл) и обработку ультразвуком через 5,5 часов после начала культивирования.
На фиг.10 приведен график биолюминесцентного ответа Vibrio fischeri (начальное количество клеток в 1 мл среды составляет 105) на добавление хлорамфеникола (конечная концентрация в среде 0,5 мкг/мл) и обработку ультразвуком через 5,5 часов после начала культивирования.
На фиг.11 приведен график биолюминесцентного ответа Vibrio fischeri (начальное количество клеток в 1 мл среды составляет 105) на добавление хлорамфеникола (конечная концентрация в среде 0,25 мкг/мл) и обработку ультразвуком через 5,5 часов после начала культивирования.
На фиг.12 приведен график биолюминесцентного ответа Vibrio fischeri (начальное количество клеток в 1 мл среды составляет 105) на добавление хлорамфеникола (конечная концентрация в среде 0,1 мкг/мл) и обработку ультразвуком через 5,5 часов после начала культивирования.
На фиг.13 приведен график биолюминесцентного ответа Vibrio fischeri(начальное количество клеток в 1 мл среды составляет 105) на добавление хлорамфеникола (конечная концентрация в среде 0,05 мкг/мл) и обработку ультразвуком через 5,5 часов после начала культивирования.
На фиг.14 приведен график биолюминесцентного ответа Vibrio fischeri (начальное количество клеток в 1 мл среды составляет 105) на добавление хлорамфеникола (конечная концентрация в среде 0,025 мкг/мл) и обработку ультразвуком через 5,5 часов после начала культивирования.
На фиг.15 приведен график биолюминесцентного ответа Vibrio fischeri (начальное количество клеток в 1 мл среды составляет 105) без добавление хлорамфеникола без- и с обработкой ультразвуком через 5,5 часов после начала культивирования.
На фиг.16 приведен кадр люминесценции образцов культуры светящихся бактерий, полученных на начальном (15 час после посева) этапе формирования биопленки.
Негативное изображение.
На фиг.17 приведен кадр люминесценции образцов культуры светящихся бактерий, наблюдаемая на 19 ч культивации. Негативное изображение.
На фиг.18 приведен кадр люминесценции образцов культуры светящихся бактерий, наблюдаемая к 22 ч культивации. Негативное изображение.
На фиг.19 приведен кадр люминесценции образцов культуры светящихся бактерий, наблюдаемая к 26 ч культивации. Негативное изображение.
На фиг.20 приведен график кинетической кривой люминесценции бактериальных культур, подвергшихся 60-минутной обработке ультразвуком непосредственно в установке видеорегистрации. Проба 1 - суспензионная культура бактерий в жидкой среде (в фазе спада люминесценции), проба 2 - влажная бактериальная биопленка на поверхности стекла (фаза роста люминесценции).
↑УЗ, ↓УЗ - включение и выключение генератора ультразвука.
На фиг.21 приведен график кинетической кривой люминесценции бактериальных культур, подвергшихся 60-минутной обработке ультразвуком пониженной мощности непосредственно в установке видеорегистрации. Проба 1 - суспензионная культура бактерий в жидкой среде, проба 2 - влажная бактериальная биопленка на поверхности стекла.
↑УЗ, ↓УЗ - включение и выключение генератора ультразвука.
На фиг.22 приведен график динамики люминесценции проб, подвергшихся комбинированному воздействию ультразвука (длительное воздействие) и подпороговых доз антибиотика. Полная временная шкала. Проба a - без антибиотика, проба b - 0,25 мкг/мл хлорамфеникола.
На фиг.23 приведен график динамики люминесценции проб, подвергшихся комбинированному воздействию ультразвука (длительное воздействие) и подпороговых доз антибиотика. Проба a - без антибиотика, проба b - 0,25 мкг/мл хлорамфеникола. Период индукции свечения. Кинетику люминесценции в полной временной шкале см. фиг.11.
На фиг.24 приведен график влияния 60-минутной обработки ультразвуком на кинетику люминесценции бактерий, обработанных и необработанных подпороговыми дозами антибиотика. 1 - влажная бактериальная биопленка на стекле, обработанная антибиотиком (0,25 мкг/мл хлорамфеникол); 2 - проба в жидкой питательной среде без антибиотика; 3 - проба в жидкой питательной среде с антибиотиком. Показана полная временная шкала эксперимента.
На фиг.25 приведен график влияния 60-минутной обработки ультразвуком на кинетику люминесценции бактерий, обработанных и необработанных подпороговыми дозами антибиотика. 1 - влажная бактериальная биопленка на стекле, обработанная антибиотиком (0,25 мкг/мл хлорамфеникола); 2 - проба в жидкой питательной среде без антибиотика; 3 - проба в жидкой питательной среде с антибиотиком. Показана ограниченная временная шкала на участке воздействия ультразвуком.
Способ реализуется следующим образом.
В качестве имитационной модели для изучения воздействия антибиотиков и ультразвука на патогенные микроорганизмы, существующие в форме биопленки, можно использовать биопленки любых биолюминесцирующих бактерий рода Vibrio. В данном случае была использована биопленка, формируемая клетками люминесцирующей бактерии Vibrio fisheri, выделенной из воды Черного моря. Для исследования чувствительности биопленок к воздействиям антибиотиков были использованы тетрациклин и хлорамфеникол. Механизм действия этих препаратов на бактерии детально изучен. Они неспецифически подавляют синтез белка, взаимодействуя с рибосомами. Подобный механизм действия характерен для большинства антибиотиков, в том числе и для более современных. Микроорганизм Vibrio fischeri чувствителен к обоим препаратам, что позволяет использовать его в качестве экспериментальной имитационной модели. Для усиления воздействия антибиотиков использовался ультразвук. В качестве источника ультразвукового излучения был использован ультразвуковой генератор, дающий колебания с частотой 44,5 кГц. Такими частотными характеристиками обладает большинство современных устройств для разрушения биопленок. Для исследования люминесценции бактерий использовался микропланшетный люминометр LM-01T (Immunotech).
Штамм Vibrio fischeri выращивали на жидкой среде Луриа-Бертани (LB) (пептон - 10 г, дрожжевой экстракт - 5 г, хлористый натрий - 10 г на 1 л раствора; рН 7.0) в присутствии 3% NaCl. В случае использования агаризованной среды LB в ее состав добавлялся микробиологический агар в количестве 20 г/л. Выращивание бактерий проводили при температуре 25°C.
Для изучения биолюминесцентного ответа Vibrio fischeri при воздействии антибиотиков были приготовлены растворы хлорамфеникола и тетрациклина различных концентраций в этаноле.
Пример 1. Измерение биолюминесцентного «ответа» штамма Vibrio fischeri при различной концентрации антибиотиков
Выращивали ночную культуру Vibrio fischeri на жидкой питательной среде LB с 3% NaCl при температуре 25°C.
Готовили суспензию штамма Vibrio fischeri с использованием стандарта мутности в 10 единиц (концентрация микробных клеток в 1 млрд) и десятикратные серийные разведения (по 4 разведения включительно) в жидкой питательной среде LB с 3% NaCl. В дальнейшей работе использовали 4 разведение (105 КОЕ/мл). В лунки планшета для люминометра вносили по 195 мкл суспензии Vibrio fischeri и подращивали в течение 13-17 часов при температуре 25°C. В часть лунок, которая служила контролем, добавляли 5 мкл этанола, а в другие лунки (в трехкратной повторности) вносили по 1,62 мкг/мл, 0,44 мкг/мл, 0,032 мкг/мл, 0,0012 мкг/мл растворов антибиотиков в этаноле. Сразу же после внесения антибиотиков, пробы с клетками Vibrio fischeri помещали в люминометр и каждые 20 минут измеряли интенсивность биолюминесценции клеточной суспензии. Инкубацию проб проводили при комнатной температуре. После окончания внесения антибиотиков (26 ч) измерения продолжали еще 16 ч. Единицы измерения интенсивности биолюминесценции - условные единицы.
На фиг.1-4 представлены результаты интенсивности биолюминесценции клеток штамма Vibrio fischeri после его обработки штамма различными концентрациями антибиотика тетрациклина.
Концентрация тетрациклина 1,62 мкг/мл, максимальная из всех исследованных, вызвала полное подавление биолюминесценции клеток штамма Vibrio fischeri. Концентрация тетрациклина 0,44 мкг/мл привела к более ранней «вспышке» свечения клеток на 5 ч по сравнению с контролем. При концентрации тетрациклина 0,032 мкг/мл наблюдается аналогичный эффект, но разница между началом роста биолюминесценции в опыте и контроле составила меньшую величину времени - 1 ч 20 мин. Концентрация тетрациклина 0,0012 мкг/мл, минимальная из всех исследованных, не вызвала изменений в интенсивности биолюминесценции штамма Vibrio fischeri.
На фиг.5-8 представлены результаты интенсивности биолюминесценции клеток штамма Vibrio fischeri после его обработки штамма различными концентрациями антибиотика хлорамфеникола.
Как видно из полученных данных, концентрация хлорамфеникола 1,62 мкг/мл, максимальная из всех исследованных, вызвала, как и в случае с тетрациклином, полное подавление биолюминесценции клеток штамма Vibrio fischeri NB 15. Концентрация тетрациклина в среде 0,44 мкг/мл также вызвала подавление биолюминесценции клеток штамма Vibrio fischeri, но не 100%. При концентрации хлорамфеникола 0,032 мкг/мл была зафиксирована более поздняя «вспышка» свечения клеток - примерно на 2 ч 40 мин по сравнению с контролем. Концентрация хлорамфеникола 0,0012 мкг/мл минимальная из всех исследованных, напротив, вызвала более ранний рост интенсивности биолюминесценции штамма Vibrio fischeri в опыте (на 1 ч 20 мин) по сравнению с контролем.
Пример 2. Измерение биолюминесцентного «ответа» штамма Vibrio fischeri при различной концентрации антибиотиков после обработки ультразвуком
Выращивали ночную культуру Vibrio fischeri на жидкой питательной среде LB с 3% NaCl при температуре 25°C. Готовили суспензию штамма Vibrio fischeri с использованием стандарта мутности в 10 единиц (концентрация микробных клеток в 1 млрд) и десятикратные серийные разведения (по 4 разведения включительно) в жидкой питательной среде LB с 3% NaCl. В дальнейшей работе использовали 4 разведение (105 КОЕ/мл). В лунки планшета для люминометра вносили по 195 мкл суспензии Vibrio fischeri и подращивали в течение 5-6 часов при температуре 25°C. В часть лунок, которая служила контролем, добавляли 5 мкл этанола, а в другие лунки (в трехкратной повторности) вносили растворы антибиотиков в этаноле в концентрации 1,0 мкг/мл; 0,5 мкг/мл; 0,25 мкг/мл; 0,1 мкг/мл; 0,05 мкг/мл; 0,025 мкг/мл. Сразу же после внесения антибиотиков, пробы с клетками Vibrio fischeri обрабатывали ультразвуком (УЗ). Для этого планшет, содержащий объединенные в стрипы лунки с культурами, погружали в ванну (9×5,5×15,6 см) с водой (772 мл). Ультразвуковой (УЗ) генератор помещали на дно ванны. Частота генерируемого звука составляла 44,5 кГц, средняя акустическая мощность - 30 Вт. Время обработки во всех опытах с регистрацией свечения при помощи фотоэлектронного умножителя составляло 60 мин. Затем пробы с клетками Vibrio fischeri помещали в люминометр и каждые 20 минут измеряли интенсивность биолюминесценции клеточной суспензии. Инкубацию проб проводили при комнатной температуре. После внесения антибиотиков и обработки ультразвуком измерения продолжали еще 20-30 часов. Единицы измерения интенсивности биолюминесценции - условные единицы. Измерение люминесценции проводилось на микропланшетном люминометре LM-01T (Immunotech). На фиг.9-15 представлены результаты исследований интенсивности свечения клеток Vibrio fischeri при различной концентрации антибиотиков после обработки ультразвуком.
Как видно из фиг.15, обработка ультразвуком без дополнительного воздействия антибиотиков лишь в некоторой степени - примерно на 1,5 ч ускоряет возникновение «вспышки» биолюминесценции. При этом уровень свечения как в контроле, так и в опыте практически не различается. Результаты внесения хлорамфеникола в разных концентрациях с последующей обработкой ультразвука можно увидеть на фиг.9-14.
На фиг.9 видно, что совместное действие ультразвука и антибиотика в максимальной концентрации 1,0 мкг/мл привело к полному подавлению свечения штамма Vibrio fischeri, в то время как без обработки ультразвуком наблюдалась вспышка биолюминесценции клеток. Т.е. одновременное действие ультразвука и антибиотика препятствует образованию биопленок. При одновременном действии антибиотика в концентрации 0,5 мкг/мл и ультразвука наблюдается задержка «вспышки» биолюминесценции примерно на 6 ч по сравнению с действием одного антибиотика (Фиг.10). При концентрациях хлорамфеникола 0,25-0,1 мкг/мл наблюдается падение интенсивности биолюминесценции штамма примерно на 20-30% в сравнении с контролем (фиг.11, 12). При концентрациях хлорамфеникола 0,05-0,025 мкг/мл кроме снижения уровня свечения клеток на 30-50% штамма Vibrio fischeri (фиг.13, 14) фиксируется и задержка «вспышки» биолюминесценции на 1,5-3 ч.
Таким образом, самое значительное антимикробное воздействие ультразвука регистрируется при совместном использовании с антибиотиком хлорамфениколом при его максимальной исследованной концентрации 1,0 мкг/мл. При этом степень снижения интенсивности биолюминесценции штамма Vibrio fischeri при воздействии антибиотика хлорамфеникол зависит от его концентрации и времени внесения в процессе роста культуры. Максимальное уменьшение биолюминесценции регистрируется при внесении антибиотика в питательную среду через 21-26 ч ее роста.
Конструкция люминометров не дает возможность наблюдать за морфологией образования биопленок и не позволяет наблюдать за бактериями непосредственно при воздействии ультразвука. Современные CCD-видеокамеры позволяют обеспечивать наблюдение биохемилюминесценции с чувствительностью до 0,0004 люкс, сопоставимой с чувствительностью фотоумножителей. Разработаны также методы количественного анализа такого рода видеоданных, предусматривающие автоматическое покадровое измерение яркости свечения выделенных участков и вывод данных в виде текстовых файлов и графиков.
Пример 3. Регистрация биолюминесцентного «ответа» при помощи видеокамеры
Бактериальную суспензию объемом по 2 мл помещали в 20-мл пробирки, установленные наклонно в кассетах по 12 шт., закрепленных перед видеокамерой, или по 2 шт. с погружением в сосуд с 500 мл воды (ультразвуковая ванна), также установленный в поле зрения камеры.
Исследование действия ультразвука осуществлялось двумя способами:
1) наблюдали люминесценцию бактерий (пробирки в кассетах) на начальном этапе, извлекали интересующие пробирки с культурой, обрабатывали их ультразвуком в ультразвуковой ванне (500-мл сосуд) и вновь помещали в кассету для видеонаблюдения. Кадры, соответствующие извлечению и обратной установке пробирок, вырезали;
2) пробирки по 2 шт. помещали непосредственно в 500-мл ультразвуковую ванну установки, наблюдали люминесценцию на начальном этапе (источник ультразвука выключен), далее включали источник ультразвука на фиксированное время (без выключения камеры), после чего вновь наблюдали люминесценцию при выключенном источнике.
В качестве источника ультразвукового излучения был использован ультразвуковой генератор, дающий колебания с частотой 44,5 кГц.; средней акустической мощностью 30 Вт.
Для исследований люминесценции бактерий применяли черно-белую CCD-видеокамеру VNC-748-H3 ("ЭВС", Россия, Санкт-Петербург), имеющую чувствительность до 0,0004 лк на объекте и функции ручного управления. На камере устанавливали объектив Avenir (относительное отверстие 1,2, фокусное расстояние 6 мм). Видеосъемку длительностью до 4-х суток производили с частотой 1 кадр/сек. Видеозахват осуществлялся программой VDub 1.8.1. С помощью этой же программы *.avi-файл преобразовывали в последовательность изображений (серия файлов *.bmp). Последовательность открывали в программе ImageJ. На одном из кадров выделяли интересующие области изображения - поверхность жидкой среды с суспензией светящихся бактерий в отдельно взятых пробирках. Для каждого такого участка получали численный временной ряд - зависимость средней яркости от номера кадра инструментами Analyse→Tools→ROI manager→More→MultiMeasure, преобразуемый стандартными программными средствами Exel или Origin в кинетическую кривую. Видеокадр образцов культуры светящихся бактерий, полученных на начальном этапе (15 ч после посева) формирования биопленки (до обработки ультразвуком) показан на фиг.16. Из 12 проб, наблюдавшихся в эксперименте, ультразвуком (10 мин экспозиции) были обработаны две - №8 (на 16-м ч) и 11 (на 18-м ч).
Пробы 1, 3, 5 и 12 были подготовлены с использованием пониженной начальной концентрации бактерий в суспензии. Люминесценция этих проб к 15 ч инкубации не наблюдалась. Характер люминесценции проб, начавших свечение, - пристеночно-периферический (по краям менисков жидкости) с образованием светящихся кольцевых структур. Зонам люминесценции визуально соответствовали участки формирования биопленки. К 19 ч после посева (фиг.17-19) наблюдали рост люминесценции всех проб как необработанных, так и обработанных ультразвуком (проба №7-10 мин обработки на 16-м ч после посева). Характер люминесценции всех люминесцирующих проб менялся с пристеночно-периферического на сплошной по всей открытой поверхности жидкой среды, чему соответствовали также визуально наблюдаемые биопленки. В то же время пробы 1, 3, 5 на данный момент времени в фазу начала свечения и формирования биопленки не вступали. К 22 ч после посева наблюдается резкий рост свечения культур с задержкой формирования биопленки, начальная концентрация бактерий в которых была снижена (№1, 3, 5 и 12). Остальные культуры с нормальной скоростью развития снижали уровень свечения по сравнению с 19 ч инкубации, причем проба №11 снижала яркость свечения более быстро. На завершающем этапе эксперимента, к 26 ч после посева максимальная яркость сохранялась у проб №1, 3, 5 и 12. Культуры в пробах №2, 4, 6, 7, 9, 10, 11 проявляли небольшое свечение, проба 11 - свечение минимальной яркости. Наблюдался рост свечения пробы №8.
Таким образом, визуальная (по выбранным видеокадрам) качественная оценка уровня свечения в проведенном эксперименте свидетельствует о том, что проба, обработанная ультразвуком на начальной стадии формирования биопленки, при последующей длительной инкубации развивает более мощный максимум люминесценции, тогда как проба, обработанная на более поздней стадии формирования биопленки (на спаде люминесценции), имеет более низкий конечный уровень люминесценции по сравнению с необработанными ультразвуком образцами. Следовательно, в условиях эксперимента для достижения более эффективного подавления пленкообразования обработку бактериальных культур ультразвуком необходимо производить на стадии сформировавшейся биопленки.
Полученные данные подтверждают вывод, сделанный по результатам предыдущего эксперимента о том, что более предпочтительным периодом воздействия ультразвука на бактериальную биопленку является фаза спада люминесценции (зрелая биопленка).
Пример 4. Динамика люминесценции проб, подвергшихся 60-минутной обработке ультразвуком вне установки в условиях непрерывной регистрации люминесценции
Кинетическая кривая люминесценции бактериальных культур, подвергшихся 60-минутной обработке ультразвуком непосредственно в установке видеорегистрации, представлена на фиг.20. Проба 1 - суспензионная культура бактерий в жидкой среде (в фазе спада люминесценции), проба 2 - влажная бактериальная биопленка на поверхности стекла (фаза роста люминесценции). Включение генератора ультразвука приводило к быстрому (1-2 мин) снижению люминесценции в обеих пробах. Однако проба в жидкой среде (№1) снижала люминесценцию на 9%, тогда как проба №2 - на 92%. Для обеих проб за периодом быстрого спада люминесценции следовал период медленного ее роста с максимумом через 20 мин после включения ультразвука, причем проба 2 обнаруживала более выраженную стимуляцию. Преобладание стимулирующего эффекта над ингибирующим для пробы 2 определяется, по-видимому, с меньшей интенсивностью воздействия на нее ультразвука, связанной с тем, что эта проба погружена в жидкость, тогда как проба 1 иммобилизована на поверхности стекла. Аналогичные результаты получены для проб, обработанных при меньшей интенсивности ультразвука (фиг.20). С целью ее снижения при той же мощности ультразвукового генератора использовали ванну большего объема - 1 л. Проба 1 соответствует бактериальной суспензии в жидкости - биопленка формируется на поверхности жидкой среды. Проба 2 - влажная биопленка на поверхности стекла. Обработка ультразвуком меньшей мощности в проведенном эксперименте (по сравнению с предыдущим) показала практически полное отсутствие первоначального быстрого спада светимости и более мощный ее медленный рост с 20-минутным максимумом. В условиях эксперимента проба в жидкой среде и проба, иммобилизованная на поверхности стекла, обнаруживали сходную кинетику (фиг.21).
Пример 5. Динамика люминесценции проб, подвергшихся комбинированному воздействию ультразвука и подпороговых доз антибиотика
Доза антибиотика, использованная в эксперименте, предварительно подбиралась как подпороговая по воздействию на кинетику люминесценции таким образом, чтобы его воздействие не влияло на уровень люминесценции ни на одном из этапов контрольного опыта без ультразвука. Антибиотик (хлорамфеникол, 0,25 мкг/мл) добавляли за 1-2 ч до воздействия ультразвуком в пробирки с пробами бактериальной суспензии, свечение которых предварительно регистрировали видеокамерой. Пробирку с пробой извлекали из экспериментальной установки, добавляли раствор антибиотика, перемешивали и возвращали в установку для наблюдения кинетики люминесценции. Воздействие ультразвуком производилось при включенной камере. Эксперимент, результаты которого представлены на фиг.22 и 23, проводился при делительном включении ультразвука - с 18 ч после начала инкубации и до конца наблюдения - более 8 ч. Наблюдение начинали через 15 ч инкубации, после обнаружения начальной фазы формирования биопленки по слабому росту люминесценции. Проба а - без антибиотика, проба b - 0,25 мкг/мл хлорамфеникола. До включения ультразвука исследованные пробы обнаруживали резкий рост люминесценции, восстанавливающей свой уровень после перемешивания пробы в момент введения антибиотика. После включения ультразвука свечение исследуемых образцов усиливалось в течение 30 мин, причем в пробе с антибиотиком это увеличение было выражено более слабо. Дальнейшая кинетика люминесценции проб обнаруживала спад до фоновых значений без последующего восстановления. Таким образом, введение антибиотика в пробы позволяет снизить индуцируемую ультразвуком стимуляцию люминесценции.
Пример 6. Динамика люминесценции проб, подвергшихся комбинированному воздействию ультразвука (60-минутное воздействие) и подпороговых доз антибиотика
На фиг.24 и 25 представлены данные исследования влияния 60-минутной обработки ультразвуком на кинетику люминесценции трех проб:
1) влажная бактериальная пленка, иммобилизованная на поверхности стеклянной стенки пробирки и обработанная антибиотиком; 2) бактериальная суспензия в жидкой питательной среде без антибиотика, и 3) бактериальная суспензия в жидкой питательной среде с антибиотиком. Проба 1 наиболее быстро восстанавливается после падения интенсивности люминесценции, вызванного ультразвуком, до исходного уровня. Пробы бактериальных суспензий в жидкой питательной среде проявляют медленное и неполное восстановление уровня свечения, причем это восстановление проис