Способ моделирования аденокарциномы толстой кишки человека
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине и касается создания модели аденокарциномы толстой кишки человека. Для этого в качестве экспериментального животного используют крыс линии «Вистар», которым предварительно выполняют полную аспленизацию. Через 60 минут после этого проводят подкожную ксенотрансплантацию суточной культуры клеток аденокарциномы. В толщу подкожной жировой клетчатки в межлопаточной области, параллельно коже, вводят 1 мл взвеси, содержащей 4×108 клеток суточной культуры аденокарциномы толстой кишки человека, при этом вводимую взвесь клеток распределяют в 3 места введения. Способ обеспечивает 100% приживление трансплантированных клеток за счет создания условий преодоления барьера тканевой несовместимости, стандартизацию получаемых результатов при изучении иммунологических механизмов антибластических свойств организма и подбора новых лекарственных препаратов и тактики лечения аденокарциномы толстой кишки человека. 5 ил., 1 пр.
Реферат
Предлагаемое изобретение относится к области медицины, а именно к экспериментальной хирургии и патофизиологии, и может быть использовано для получения модели аденокарциномы толстой кишки человека у лабораторного животного.
Известен способ моделирования аденокарциномы кишки у крыс путем внутрибрюшинного введения химического канцерогена 1, 2 - диметилгидразина, который вводили из расчета 20 мг/кг веса животного, 1 раз в неделю, в течение четырех недель (Морфофункциональное состояние тимуса в условиях развития опухоли толстой кишки /Стручко Г.Ю., Л.М. Меркулова, Е.В. Москвичев и др. // Здравоохранение Чувашии. - №3, 2009. - С.47-52).
К недостаткам данного способа следует отнести то, что получаемая модель аденокарциномы кишки является видоспецифичной, что затрудняет интерпретацию полученных данных на клиническое течение аденокарциномы толстой кишки у человека. Кроме этого по данным авторов известного способа воспроизведение модели составляет 65%.
Необходимо также отметить и токсическое воздействие канцерогена на весь организм животного, длительные сроки эксперимента (150 суток). В совокупности указанные недостатки не позволяют «стандартизировать» модель, что необходимо для оценки новых способов лечения.
Наиболее близким по технической сущности к предлагаемому является способ моделирования аденокарциномы толстой кишки человека путем подкожного введения клеток ткани аденокарциномы экспериментальному животному (Лацерус Л.А., Пинигина Н.М., Смирнова З.С., Барышников А.Ю. Противоопухолевое действие препарата Абисил в комбинации с цисплатином на перевиваемых опухолях мыши / Российский биотерапевтический журнал, 2010. - № 1. - С.21-23).
Известный способ осуществляют следующим образом. Моделирование опухоли проводят на мышах линии BALB. Для этого от мыши-носителя выделяют опухоль аденокарциномы АКАТОЛ, помещают ее в чашку Петри, освобождают от тканевых пленок и некротических участков. Выбирают неповрежденные, жизнеспособные участки опухоли, обычно располагающиеся на периферии. Вырезанные опухолевые кусочки переносят в химический стаканчик с небольшим количеством физиологического раствора и ножницами измельчают их до получения однородной массы, для получения 25-50% взвеси ткани опухоли дополнительно добавляют физиологический раствор. После чего при помощи шприца с толстой иглой 0,5 мл полученной взвеси вводят под кожу правого бока мыши.
К недостаткам данного способа моделирования следует отнести:
- введение аденокарциномы Акатол, являющейся видоспецифической для мышей;
- использование мышей линии BALB, характеризующихся тяжелым комбинированным иммунодефицитом, не позволяет стандартизировать получаемые результаты и интерпретировать их на клиническое течение аденокарциномы толстой кишки человека;
- иммунодефицит мышей линии BALB не позволяет изучать иммунологические механизмы антибластических свойств организма;
- содержание мышей в стерильных условиях значительно усложняет способ.
Задачей заявляемого технического решения является разработка способа моделирования аденокарциномы толстой кишки человека на лабораторных животных - крысах линии «Вистар» с воспроизводимостью не менее 90%.
Техническим результатом предлагаемого способа является 100%-ное приживление трансплантированных клеток аденокарциномы толстой кишки человека в организме реципиента - крысы, получение роста аденокарциномы толстой кишки человека в подкожной жировой ткани, а также стандартизация получаемых результатов и упрощение условий содержания животных.
Технический результат достигается тем, что способ моделирования аденокарциномы толстой кишки человека проводят путем подкожного введения экспериментальному животному клеток ткани аденокарциномы.
Отличительные приемы заявляемого способа заключаются в том, что в качестве экспериментальных животных используют крыс линии «Вистар», которым предварительно выполняют полную аспленизацию. Через 60 минут после аспленизации в толщу подкожной жировой клетчатки в межлопаточной области, параллельно коже, вводят 1 мл взвеси, содержащей 4×108 клеток суточной культуры аденокарциномы толстой кишки человека. При этом вводимую взвесь культуры клеток аденокарциномы распределяют в 3 места введения.
Сопоставительный анализ заявляемого технического решения с прототипом позволяет сделать вывод о соответствии заявляемого технического решения критерию изобретения «новизна».
Использование в качестве экспериментальных животных крыс линии Вистар позволяет стандартизировать получаемые результаты, упростить моделирование опухолевого процесса, так как используются линейные животные и, в отличие от прототипа, не требуются стерильные условия для их содержания.
Предварительное выполнение полной аспленизации обеспечивает создание иммунодефицита в организме экспериментального животного, что создает условия развития опухоли человека в организме животного. Этим приемом авторы преодолели барьер тканевой несовместимости между опухолью и реципиентом, так как известно, что клетки опухоли человека не приживаются в организме крыс.
Экспериментальными исследованиями авторов заявляемого способа показано, что удаление селезенки обеспечивает 100%-ное приживление трансплантированных клеток аденокарциномы толстой кишки человека в организме реципиента. Высокий процент приживления трансплантированных клеток позволяет достоверно отследить и оценить рост опухоли.
Введение взвеси клеток через 60 минут после аспленизации дает возможность исключить из эксперимента животных с послеоперационными осложнениями, что способствует стандартизации способа.
Экспериментальные исследования авторов предлагаемого способа показали, что введение 1 мл взвеси, содержащей 4×108 клеток суточной культуры аденокарциномы толстой кишки человека, является необходимым и достаточным для приживления и начала активного роста клеток аденокарциномы толстой кишки человека уже к 6-м суткам после ксенотрансплантации.
Распределение вводимой взвеси культуры клеток аденокарциномы в 3 места введения в толще подкожной жировой клетчатки в межлопаточной области, параллельно коже, также способствует полному приживлению клеток опухоли. При этом рост клеток опухоли в подкожной жировой клетчатке легко контролируется визуально и при пальпации.
Исследованиями авторов заявляемого способа установлено, что морфологическая структура и характеристика развивающейся в подкожной клетчатке крысы опухоль соответствует аденокарциноме толстой кишки человека. Следовательно, заявляемый способ обеспечивает возможность получения модели аденокарциномы толстой кишки человека на животном, что позволит изучать коррекцию опухолевого процесса новыми способами. Изложенное позволяет сделать вывод о соответствии заявляемого технического решения критерию «изобретательский уровень».
Способ, составляющий заявляемое изобретение, предназначен для использования в экспериментальной хирургии и патофизиологии. Возможность его осуществления подтверждена описанными в заявке приемами и средствами. Заявляемый способ обеспечивает достижение усматриваемого заявителем технического результата, а именно 100%-ное приживление трансплантированных клеток аденокарциномы толстой кишки человека в организме реципиента - крысы, получение роста аденокарциномы толстой кишки человека в подкожной жировой ткани, а также стандартизацию получаемых результатов, что позволяет считать его соответствующим критерию изобретения «промышленная применимость».
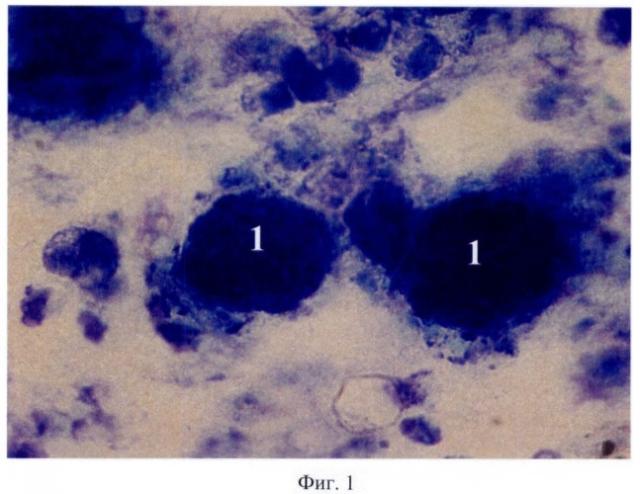
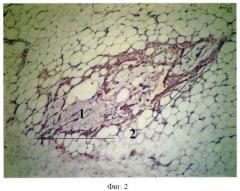
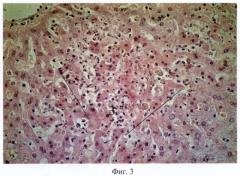
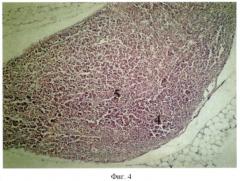
Сущность предложенного способа моделирования аденокарциномы толстой кишки человека поясняется пятью фигурами: на фиг.1 - образец суточной культуры изолированных клеток аденокарциномы человека 1 с сохранной структурой; на фиг.2 - разрастание опухоли аденокарциномы толстой кишки человека с ослизнением 2 в зоне ксенотрансплантации; на фиг.3 - участки некроза гепатоцитов 3; на фиг.4 - в лимфатических узлах отсутствие фолликулов 4, гиперплазия Т-зависимых зон 5; на фиг.5 - рост опухолевых клеток 1 с формированием аденокарциномы толстой кишки человека под кожей в капсуле 6 к 45-м суткам исследования.
Заявляемый способ осуществляют следующим образом. Животным под общим наркозом проводят аспленизацию, т.е. удаление селезенки и всех добавочных селезеночных тел. Через час после операции аспленизации однократно выполняют ксенотрансплантацию под кожу 1 мл суточной культуры клеток аденокарциномы толстой кишки человека, содержащей 4×108 клеток. Клетки распределяют в три места введения в толще подкожной жировой клетчатки в межлопаточной области параллельно коже.
Предлагаемый способ поясняется примером конкретного выполнения.
Исследования проведены на 30-ти крысах породы «Вистар» массой 280-350 гр. Возраст животных был не менее 8 месяцев. Животные содержались в условиях вивария при свободном доступе к воде и пище, соответственно нормативам ГОСТа «Содержание экспериментальных животных в питомниках НИИ» (виварий I категории, вет. удостоверение 238 №0015220 от 25 марта 2009 г, служба ветеринарии Иркутской области).
Эксперименты на животных выполнены в соответствии с правилами гуманного обращения с животными, которые регламентированы «Правилами проведения работ с использованием экспериментальных животных», утвержденными Приказом МЗ СССР №742 от 13.11.84 г. «Об утверждении правил проведения работ с использованием экспериментальных животных» и №48 от 23.01.85 г. «О контроле за проведением работ с использованием экспериментальных животных», а также основывались на положениях Хельсинской Декларации Всемирной Медицинской Ассоциации от 1964 г., дополненной в 1975, 1983 и 1989 гг.
Животным под общим обезболиванием выполняли аспленизацию. Для этого после выполнения срединной лапаротомии в операционную рану выводили селезенку, определяли число подходящих к ней сегментарных сосудов (ветви селезеночной артерии 2 порядка). Во всех наблюдениях для выявления добавочных селезенок проводили ревизию полости живота, результаты которой протоколировали. Спленэктомию выполняли после перевязки сегментарных и коротких желудочных сосудов. Для профилактики послеоперационного внутрибрюшинного спленоза при удалении селезенки особое внимание уделяли сохранности ее капсулы.
Методика выделения и культивирования клеток аденокарциономы человека разработана в лаборатории экспериментальной хирургии Научного центра реконструктивной и восстановительной хирургии СО РАМН. Забор биоматериала производили из операционного материала пациентов отделения колопроктологии Иркутской государственной Ордена «Знак Почета» областной клинической больницы, оперированных по поводу аденокарциномы толстой кишки.
Опухоль измельчали до получения фрагментов 0,05-0,1 мм, удаляли соединительнотканные элементы. Проводили очистку в фиколловом градиенте, добиваясь удаления клеточного детрита, элементов крови, слизи, соединительнотканных клеток, крупных фрагментов. Взвесь микрофрагментов отмывали. Подсчет клеток проводили с помощью теста на исключение красителя с использованием камеры Фукса-Розенталя.
Культивирование выделенных клеток проводили в матрацах Ру с использованием стандартных питательных сред и добавок (Фрешни Р. Культура животных клеток. Методы: пер. с англ. - М.: Мир, 1989. - с.38, 74, 116).
Жизнеспособность суточной культуры клеток составила 97,3% (фиг.1).
Для трансплантации брали образец суточной культуры клеток в среде культивирования при их содержании 4×108 в 1 мл.
Ксенотрансплантацию культуры клеток аденокарциномы толстой кишки человека выполняли через 60 минут после операции аспленизации. Кожные покровы трижды обрабатывали 2,4% раствором первомура и однократно 70%-ным спиртом. Затем выполняли ксенотрансплантацию под кожу в количестве 1 мл взвеси, содержащей 4×108 клеток. При трансплантации инъекционную иглу на всю длину вводили в толщу подкожной жировой клетчатки в межлопаточной области, параллельно коже. Во время инъекции постепенно извлекали иглу, достигая равномерного распределения материала в подкожной жировой клетчатке. Клетки делили на 3 места введения.
Результаты
При воспроизведении опухолевого роста клетками в условиях аспленизации отмечали высокий уровень летальности, который на 10-е сутки составил 70% (21/9).
У животных, погибших на 6-е сутки, при гистологическом исследовании выявлен рост трансплантированного образца суточной культуры изолированных клеток 1 с формированием опухоли аденокарциномы толстой кишки человека с ослизнением 2 в зоне ксенотрансплантации (фиг.2).
Гистологическое исследование печени животных, погибших на 6-е сутки, не выявило метастаз, отмечали обширные участки некроза гепатоцитов 3 (см. фиг.3). В подмышечных лимфатических узлах выявлено отсутствие фолликулов 4, гиперплазия Т-зависимых зон 5 (фиг.4).
К 45-м суткам исследования в зоне трансплантации выявлен рост опухолевых клеток 1 с формированием аденокарциномы толстой кишки человека под кожей в капсуле 6 (фиг.5).
К 45-м суткам исследования из трансплантированных 4×108 клеток выросла опухоль весом 0,85 (0,65-1,1) г, с 3-5 очагами роста.
Авторами предлагаемого способа экспериментальным путем установлено, что при ксенотрансплантации клеток аденокарциномы толстой кишки человека крысе с ослабленным иммунитетом, что обусловлено аспленизацией животного, летальность составила 70%. У животных, погибших на 6-е сутки, выявляли рост опухолевых клеток с ослизнением в месте введения в подкожной ткани, в печени обширные участки некроза гепатоцитов, в лимфатических узлах зарегистрировано отсутствие фолликулов, гиперплазия Т-зависимых зон. К 45-м суткам послеоперационного периода у выживших животных в зоне трансплантации выявляли рост опухолевых клеток с формированием аденокарциномы толстой кишки человека.
Выявлено 100%-ное приживление трансплантируемых клеток с ростом аденокарциномы человека на 6-е сутки. Воспроизведение модели аденокарциномы человека у крыс составило 100%. Выявленное 100%-ное приживление клеток обусловлено снижением антибластической резистентности животных в условиях послеоперационного гипоспленизма.
Таким образом, предложенный способ позволяет получить модель опухолевого роста аденокарциномы толстой кишки у крысы, по своим характеристикам соответствующую росту аденокарциномы человека. Использование предлагаемого способа обеспечивает возможность выбора тактики лечения и подбора новых лекарственных препаратов.
Способ моделирования аденокарциномы толстой кишки человека путем подкожного введения экспериментальному животному клеток ткани аденокарциномы, отличающийся тем, что лабораторным животным - крысам линии «Вистар» предварительно выполняют полную аспленизацию, после которой через 60 мин в толщу подкожной жировой клетчатки в межлопаточной области, параллельно коже, вводят 1 мл взвеси, содержащей 4×108 клеток суточной культуры аденокарциномы толстой кишки человека, при этом вводимую взвесь клеток распределяют в 3 места введения.