Способ клонального микроразмножения сирени in vitro
Иллюстрации
Показать всеИзобретение относится к области биотехнологии растений. Способ включает культивирование одноузловых сегментов на среде мультипликации, содержащей макро-, микроэлементы, хелат железа, витамины по прописи Murashige & Skoog (MS) или Quorin & Lepoivre, или Woody Plant Medium, или Driver & Kuniyuki, 30-40 г/л сахарозы, 8-9 г/л агар-агара, 0,2-2,0 мг/л 6-бензиламинопурина и/или 0,2-2,0 мг/л зеатина, или 0,5-1,5 мг/л кинетина и антибиотики (пенициллин (50-1000 мг/л) и/или ампициллин (50-1000 мг/л), и/или цефотаксим (50-1000 мг/л), и/или тикарциллин (10-500 мг/л), и/или стрептомицин (5-500 мг/л), и/или тетрациклин (10-1000 мг/л), и/или ванкомицин (1-100 мг/л)). Полученные пробирочные микрорастения повторно черенкуют на апикальную часть и серединные одноузловые сегменты. Одноузловые сегменты повторно выращивают на среде мультипликации, а апикальные высаживают на среду укоренения. Она содержит 1/2 макроэлементов, полные микроэлементы, хелат железа и витамины по прописи MS, 10-30 г/л сахарозы, 8-9 г/л агар-агара, перечисленные выше антибиотики, 0,1 мг/л индолилмасляной кислоты, а также 0,01 мг/л α-нафтилуксусной кислоты или 0,1 мг/л индолилуксусной кислоты. Культивирование проводят на светокультуральных стеллажах при освещении белыми люминесцентными лампами общей интенсивностью 2000-4000 люкс с 16-часовым фотопериодом и температурой 21-25°С. Изобретение позволяет повысить выход нормально сформированных корнесобственных микрорастений, улучшить рост и развитие эксплантов. 1 з.п. ф-лы, 3 ил., 3 табл.
Реферат
Изобретение относится к области биотехнологии растений, в частности цветоводству, и может быть использовано для оздоровления и микроразмножения растений сирени in vitro.
Известен способ микроразмножения сирени, включающий черенкование выращиваемых in vitro растений на одноузловые сегменты, посадку черенков на питательную среду для мультипликации, содержащую микроэлементы, хелат железа и витамины по прописи Мурасиге и Скуга (MS) [2], 1,5 концентрацию макроэлементов MS, 35 г/л сахарозы, 8 г/л Difco бакто-агара и 1 мг/л 2-изопентениладенина (2ip), получение пробирочных микрорастений, повторное их черенкование и высадку полученных регенерантов на среду укоренения с ауксинами (R.L.M.Pierik; H.H.M.Steegmans; A.A.Elias; O.T.J.Stiekema; A.J.van der Velde. Vegetative propagation of Syringa vulgaris L. in vitro. // Acta Hort., 226 (1988) 195-204.).
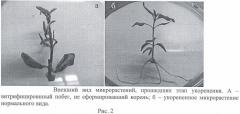
Недостатком данного способа размножения является то, что растения по окончанию этапа размножения получаются утолщенными и укороченными со скрученными листьями вдоль центральной жилки (витрифицированными) (Рисунок 1). Эти микропобеги плохо укореняются (Рисунок 2). Укорененные микрорастения такого качества неспособны адаптироваться к условиям ex vitro.
Технический результат изобретения заключается в повышении выхода нормально сформированных корнесобственных микрорастений, улучшении роста и развитии эксплантов при положительном влиянии оптимальных концентраций минеральных и органических компонентов питательной среды, регуляторов роста растений и антибиотиков.
Сущность изобретения заключается в том, что одноузловые сегменты выращиваемых in vitro растений помещают на среду для мультипликации, содержащую макро-, микроэлементы, хелат железа и витамины по прописи Мурасиге и Скуга (MS) (Murashige Т. & Skoog F., A revised medium for rapid growth and bioassays with tobacco tissue culture. // Physiol. Plant, 15 (1962) 473-497) или или Кворина-Лепорье (1977) (QL) (Quorin M. & Lepoivre P., Elude de milieux adaptes aux cultures in vitro de Prunus. // Acta Hort., 78 (1977) 437-442) или Вуди Плант Медиум (WPM) (Lloyd G. & McCown В., Commercially feasible micropropagation of mountain laurel, Kalmia latifolia, by shoot tip culture. // Comb. Proc. Int. Plant Prop.Soc, 30 (1980) 421-427) или Драйвер и Куниюки (DKW) (Driver J.A., Kuniyuki A.H., In vitro propagation of Paradox walnut rootstock. // Hort. Science, 19 (4), August (1984).), 30-40 г/л сахарозы, 8-9 г/л агар-агара, 0,2-2,0 мг/л 6-бензиламинопурина (БАП) и/или 0,2-2,0 мг/л зеатина (Z) и/или 0,5-1,5 мг/л кинетина (kin) и антибиотики (пенициллин (50-1000 мг/л) и/или ампициллин (50-1000 мг/л) и/или цефотаксим (50-1000 мг/л) и/или тикарциллин (10-500 мг/л) и/или стрептомицин (5-500 мг/л) и/или тетрациклин (10-1000 мг/л) и/или ванкомицин (1-100 мг/л)). Культивирование проводят на светокультуральных стеллажах при освещении белыми люминесцентными лампами общей интенсивностью 2000-4000 люкс при 16-часовом фотопериоде и температуре 21-25°C. Полученные пробирочные микрорастения повторно черенкуют на апикальную часть и серединные одноузловые сегменты. Одноузловые сегменты повторно выращиваются на среде мультипликации, а апикальные высаживают на среду укоренения. Она содержит ½ макроэлементов, полные микроэлементы, хелат железа и витамины по прописи MS, 10-30 г/л сахарозы, 8-9 г/л агар-агара, перечисленные выше антибиотики, 0,1 мг/л ИМК, а также 0,01 мг/л НУК или 0,1 мг/л ИУК.
Добавление сахарозы в питательные среды в концентрациях более 40 г/л снижает интенсивность роста растений и приводит к их витрификации. Добавление в питательные среды регуляторов роста и антибиотиков в предложенных концентрациях наиболее оптимально подходят для роста эксплантов и не оказывают токсического воздействия и эффекта угнетения культуры.
Предлагаемый способ клонального микроразмножения сирени реализуется следующим образом:
1. В нестерильных условиях готовится питательная среда. В нее добавляются необходимые количества макро-, микроэлементов, хелата железа, мио-инозита, объем доводится дистиллированной водой, pH 5,6-5,8. После этого растворяется навеска агара. Среда разливается по колбам, укупоривается фольгой и бумагой, завязывается банковской резинкой. Автоклавирование проводится при 1 ати (=1 изб. атм) в течение 25 минут. В остывшую до 55°C среду в ламинар-боксе добавляются стерильные растворы витаминов, регуляторов роста и антибиотиков. Полученный раствор разливается по стерильным культуральным сосудам.
Все манипуляции с растительным материалом производится в стерильных условиях ламинар-бокса. На всех этапах культивирования число эксплантов в сосудах составляет 15-25 штук.
2. Размножение растительного материала проводят на средах мультипликации, приготовленных по прописи MS или QL или WPM или DKW, дополненных сахарозой (30-40 г/л), агар-агаром (8-9 г/л), БАП и/или зеатином (0,2-2,0 мг/л) или кинетином (0,5-1,5 мг/л) и антибиотиками (пенициллин (50-1000 мг/л) и/или ампициллин (50-1000 мг/л) и/или цефотаксим (50-1000 мг/л) и/или тикарциллин (10-500 мг/л) и/или стрептомицин (5-500 мг/л) и/или тетрациклин (10-1000 мг/л) и/или ванкомицин (1-100 мг/л)). При этом наиболее оптимальными минеральными композициями являются MS и QL. Для цитокининов наиболее удачны концентрации 0,2-1,0 мг/л как для БАП, так и для зеатина, для кинетина - 0,9-1,1 мг/л, а для антибиотиков - пенициллин (50-100 мг/л) и/или ампициллин (50-100 мг/л) и/или цефотаксим (50-200 мг/л) и/или тикарциллин (10-50 мг/л) и/или стрептомицин (5-50 мг/л) и/или тетрациклин (10-100 мг/л) и/или ванкомицин (1-15 мг/л).
3. Полученные микропобеги черенкуются на апикальную часть и серединные одноузловые сегменты. Серединные сегменты повторно переносятся на среды мультипликации. Апикальные части высаживают на среду укоренения. В качестве среды для укоренения используется редуцированная до ½ по макросолям среда MS, дополненная сахарозой (10-30 г/л), агар-агаром (8-9 г/л), антибиотиками (перечень и концентрации указаны в п.2).
Эффективность укоренения оценивается долей укорененных хорошо сформированных микрорастений от числа всех эксплантов, выраженной в процентах.
В таблицах 1-3 представлены результаты исследований по влиянию на укореняемость микропобегов условий предшествующего этапа культивирования, а именно: концентрация цитокининов (БАЛ, зеатин и кинетин), минеральный состав питательной среды (MS, QL, WPM и DKW), наличие антибиотиков в среде. В качестве контрольного варианта использовались среда и концентрация цитокинина (2-изопентениладенин), описанные в прототипе.
| Таблица 1 | ||||||||||||
| Процент укорененных хорошо сформированных микрорастений на питательных средах с различным содержанием сахарозы в зависимости от концентраций фитогормонов, применяемых на этапе мультипликации (при использовании среды MS) | ||||||||||||
| Среда укоренения | Среда мультипликации | |||||||||||
| Прототип | Z0,5 мг/л | БАП0,2 мг/л | Z 0,2 мг/л; БАП0,5 мг/л | Z 0,5 мг/л;БАП 0,2 мг/л | БАП1,0 мг/л | БАП2,0 мг/л | Z 1,0 мг/л | Z 2,0 мг/л | kin 0,5 мг/л | kin 1 мг/л | kin 1,5 мг/л | |
| Примроуз | ||||||||||||
| R 10* | 45 | 60 | 43 | 63 | 50 | 60 | 37 | 95 | 79 | 53 | 57 | 39 |
| R20* | 51 | 43 | 40 | 72 | 30 | 63 | 42 | 95 | 77 | 50 | 63 | 43 |
| R30* | 47 | 45 | 39 | 57 | 35 | 60 | 40 | 90 | 81 | 46 | 53 | 30 |
| Богдан Хмельницкий | ||||||||||||
| R10 | 54 | 75 | 40 | 90 | 50 | 80 | 61 | 84 | 74 | 54 | 81 | 28 |
| R20 | 51 | 95 | 35 | 93 | 95 | 85 | 57 | 97 | 79 | 62 | 92 | 30 |
| R30 | 62 | 80 | 35 | 89 | 70 | 82 | 63 | 94 | 83 | 63 | 76 | 35 |
| Надежда | ||||||||||||
| R10 | 48 | 65 | 50 | 65 | 88 | 73 | 64 | 93 | 83 | 61 | 60 | 58 |
| R20 | 48 | 70 | 50 | 62 | 92 | 76 | 71 | 87 | 85 | 67 | 64 | 61 |
| R30 | 45 | 70 | 45 | 70 | 87 | 74 | 59 | 78 | 79 | 67 | 68 | 66 |
| * - где R - редуцированная по макросолям до ½ среда MS, цифровой индекс после R означает концентрацию сахарозы в среде в граммах на 1 литр (Здесь и далее) |
| Таблица 2 | ||||||||||||
| Процент укорененных хорошо сформированных микрорастений на различных питательных средах с различным содержанием сахарозы в зависимости от типа питательной среды | ||||||||||||
| Среда укоренения | Минеральный состав среды на этапе мультипликации | |||||||||||
| MS | QL | WPM | DKW | |||||||||
| Цитокинин (концентрация 1 мг/л) | ||||||||||||
| Z | БАП | Kin | Z | БАП | Kin | Z | БАП | Kin | Z | БАП | Kin | |
| R10 | 95 | 60 | 57 | 90 | 90 | 65 | 80 | 75 | 69 | 89 | 67 | 65 |
| R20 | 95 | 63 | 63 | 97 | 93 | 71 | 79 | 73 | 70 | 92 | 72 | 64 |
| R30 | 90 | 60 | 53 | 95 | 95 | 70 | 75 | 77 | 68 | 94 | 70 | 65 |
| Результаты представлены на примере сорта Примроуз. |
| Таблица 3 | ||||
| Процент укорененных хорошо сформированных микрорастений на питательных средах с различным содержанием сахарозы в зависимости от типа питательной среды и наличия антибиотика, применяемых на этапе мультипликации | ||||
| Среда укоренения | Среда мультипликации | |||
| MS; Z 1,0 мг/л | MS; Z 1,0 мг/л; CEF | QL; Z 1,0 мг/л; | QL; Z 1,0 мг/л; CEF | |
| R10 | 75 | 80 | 80 | 85 |
| R20 | 70 | 75 | 68 | 81 |
| R30 | 80 | 95 | 84 | 100 |
| Результаты представлены на примере сорта Президент Греви. Статистически достоверные различия отсутствуют в вариантах питательных сред, где цевотаксим содержится в концентрациях от 50 до 150 мг/л. |
При добавлении индивидуальных антибиотиков в среду культивирования в следующих концентрациях: ванкомицин 1-15 мг/л и/или цефотаксим 50-150 мг/л и/или тикарциллин 10-50 мг/л и/или пенициллин 50-100 мг/л и/или ампициллин 50-100 мг/л и/или стрептомицин 5-50 мг/л и/или тетрациклин 10-100 мг/л - статистически достоверных различий не выявлено (данные не представлены).
Добавление НУК или ИУК в заявленных концентрациях не вызывало статистически достоверных различий процента укоренения (данные не представлены).
Использование перечисленных концентраций фитогормонов позволяют увеличить эффективность укоренения микропобегов сирени в культуре in vitro относительно прототипа до 2 раз.
1. Способ клонального микроразмножения сирени in vitro, включающий микрочеренкование пробирочных растений на одноузловые сегменты, высадку их на питательную среду, содержащую макро- и микроэлементы, хелат железа, витамины, сахарозу, агар-агар и цитокинины, получение микропобегов, их черенкование и укоренение на среде, содержащей ауксины, отличающийся тем, что высадку одноузловых сегментов осуществляют на питательную среду Quorin & Lepoivre или Woody Plant Medium, или Driver & Kuniyuki с добавлением 0,2-2,0 мг/л 6-бензиламиноурина, и/или 0,2-2,0 мг/л зеатина, и/или 0,5-1,5 мг/л кинетина, 50-1000 мг/л антибиотика из группы β-лактамных антибиотиков, и/или 5-500 мг/л антибиотика из группы аминогликозидов, и/или 10-1000 мг/л антибиотика из группы тетрациклинов, и/или 1-100 мг/л антибиотика из группы циклических гликопептидов, а укоренение осуществляют на среде, содержащей 1/2 концентрации микросолей по прописи Murashige & Skoog с добавлением 50-1000 мг/л антибиотика из группы β-лактамных антибиотиков, и/или 5-500 мг/л антибиотика из группы аминогликозидов, и/или 10-1000 мг/л антибиотика из группы тетрациклинов, и/или 1-100 мг/л антибиотика из группы циклических гликопептидов, 0,1 мг/л индолилмасляной кислоты, 0,01 мг/л α-нафтилуксусной кислоты или 0,1 мг/л индолилуксусной кислоты.
2. Способ по п.1, отличающийся тем, что в питательную среду в качестве антибиотика группы β-лактамных антибиотиков добавляют пенициллин, или ампициллин, или цефотаксим, или тикарциллин, в качестве антибиотика из группы аминогликозидов - стрептомицин, в качестве антибиотика из группы тетрациклинов - тетрациклин, в качестве антибиотика из группы циклических гликопептидов - ванкомицин.