Способ иммунотерапии гнойного риносинусита
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к оториноларингологии, и касается иммунотерапии гнойного риносинусита. Способ основан на данных генотипирования по признакам аллельного полиморфизма гена цитокина, полученных при исследовании клеток крови и клеток, выделенных из смывов с пазух. При выявлении у пациента высокопродуцирующего аллеля гена IL-1β «2/2» и низкопродуцирующего аллеля гена IL-1RA «1/1» проводят иммунотерапию препаратом рекомбинантного IL-1RA, обусловленную регулировкой активации фагоцитарной активности нейтрофилов. Способ обеспечивает эффективное лечение пациентов с затяжным течением заболевания, которые не поддаются традиционным методам терапии, за счет индивидуального подбора иммунопрепарата с учетом иммуногенетических особенностей организма. 6 ил., 4 пр.
Реферат
Изобретение относится к медицине, а именно оториноларингологии, и может быть использовано для лечения гнойных риносинуситов.
Риносинусит - инфекционный воспалительный процесс бактериальной или вирусной этиологии, локализующийся в слизистой оболочке околоносовых пазух.
Гнойные формы риносинусита относятся к числу часто встречающейся патологии в оториноларингологии и составляют до 40-50% в структуре ЛОР-заболеваний.
Несмотря на существование множества консервативных и хирургических методов лечения гнойных риносинуситов, достигнуть полного излечения удается редко, рецидивы же заболевания приходится наблюдать достаточно часто.
Частота встречаемости риносинуситов, связанных с аллергическим процессом, колеблется от 25 до 70% случаев в зависимости от использованных критериев включения в группу обследования и применяемых методов лечения.
Аллергия может лежать в основе как острых, так и хронических синуситов. В результате аллергического воспаления развивается отек слизистой оболочки не только носа, но и околоносовых пазух, чаще всего этмоидальных и гайморовых пазух, клинически проявляющийся отечной формой синусита.
Воспаленная слизистая оболочка носа и сниженная функция цилиарного аппарата может нарушить естественный дренаж из околоносовых пазух и вызвать стаз назального секрета с последующим присоединением бактериального воспаления.
Известен способ лечения гнойных риносинуситов путем применения антибактериальных средств (см. Н.А.Арефьева и др. Риногенный синусит (диагностика и лечение), методические рекомендации. Уфа, 1997, стр.19).
Недостатками традиционного способа являются низкая эффективность лечения из-за высокой резистентности микроорганизмов к антибактериальным препаратам, отсутствие восстановления стерильности синуса и изменение реакций иммунной защиты слизистых оболочек носа и пазух.
Иммунотерапия как понятие объединяет различные способы воздействия на систему иммунитета с целью прекращения патологического процесса в организме.
Для специфического лечения используют препараты антигенов или антител, специфичные по отношению к возбудителю или антигену.
Неспецифические методы включают воздействия на систему иммунитета химических веществ, физических факторов и антигенов, неспецифичных по отношению к возникшему патологическому процессу. Заместительная неспецифическая иммунотерапия характеризуется тем, что готовые неспецифические факторы иммунитета и клетки вводятся больному, у которого имеется их недостаточность.
Цитокины могут быть выделены в новую самостоятельную систему регуляции основных функций организма, существующую наряду с нервной и эндокринной системами регуляции и связанную в первую очередь с поддержанием гомеостаза при внедрении патогенов и нарушении целостности тканей.
Цитокины представляют собой группу полипептидных медиаторов, участвующих в формировании и регуляции защитных реакций организма. За последние два десятилетия клонированы гены большинства цитокинов и получены рекомбинантные аналоги, полностью повторяющие биологические свойства природных молекул. Сейчас известно уже более 100 индивидуальных веществ, относящихся к семейству цитокинов.
В 40-е годы XX века были описаны первые эффекты кахектина - фактора, присутствовавшего в сыворотке крови и способного вызывать кахексию или снижение веса тела. В дальнейшем данный медиатор удалось выделить и показать его идентичность фактору некроза опухолей (TNF).
Изучение цитокинов проходило по принципу обнаружения какого-либо одного биологического эффекта, служившего отправной точкой для названия соответствующего медиатора. Так в 50-е годы назвали интерферон (IFN) из-за способности интерферировать, то есть мешать размножению вируса, и тем самым повышать сопротивляемость при повторной вирусной инфекции.
Интерлейкин 1 (IL-1) вначале назывался эндогенным пирогеном в противовес бактериальным липополисахаридам, считавшимся экзогенными пирогенами.
Следующий этап изучения цитокинов, относящийся к 60-70 годам, связан с очисткой природных молекул и всесторонней характеристикой их биологического действия. К этому времени относится открытие Т-клеточного ростового фактора, известного теперь как IL-2, и целого ряда других молекул, стимулирующих рост и функциональную активность Т-, В-лимфоцитов и других типов лейкоцитов.
В 1979 году для их обозначения и систематизации был предложен термин «интерлейкины», то есть медиаторы, осуществляющие связь между лейкоцитами. Однако очень скоро выяснилось, что биологические эффекты цитокинов распространяются далеко за пределы иммунной системы, и поэтому более приемлемым стал ранее предложенный термин «цитокины», сохранившийся и по сей день.
Революционный поворот в изучении цитокинов произошел в начале 80-х годов после клонирования генов интерферона мыши и человека и получения рекомбинантных молекул, полностью повторявших биологические свойства природных цитокинов. Вслед за этим удалось клонировать гены и других медиаторов из данного семейства. Важной вехой в истории цитокинов стало клиническое применение рекомбинантных интерферонов и особенно рекомбинантного IL-2 для лечения рака. 90-е годы ознаменовались открытием субъединичного строения рецепторов цитокинов и формированием понятия «цитокиновая сеть», а также открытием новых цитокинов путем генетического анализа.
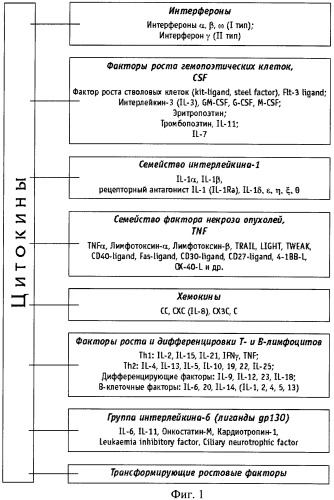
Классификация цитокинов в основном проводится по их биологическим свойствам. К цитокинам относятся интерфероны, представляющие собой большую группу противовирусных полипептидов; колониестимулирующие факторы (CSF), вызывающие размножение и дифференцировку клеток-предшественников различных ростков гемопоэза на разных этапах их созревания; хемокины или хемотактические цитокины, обеспечивающие активацию процессов миграции различных типов лейкоцитов и некоторых других клеток; трансформирующие ростовые факторы; группа фактора некроза опухолей; интерлейкины со сложившимися исторически порядковыми номерами и некоторые другие.
Интерлейкины, имеющие номера с 1 по 25, не относятся к одной подгруппе цитокинов, а могут быть разделены на провоспалительные цитокины, ростовые и дифференцировочные факторы лимфоцитов, отдельные регуляторные цитокины (см. схему на фиг.1).
Ниже представляем общие свойства цитокинов, объединяющие их в самостоятельную систему регуляции.
1. Цитокины являются полипептидами или белками, часто гликозилированными, с молекулярной массой (ММ) от 5 до 50 кДа. Для сравнения: MM IgG составляет 160 кДа.
2. Цитокины не имеют антигенной специфичности биологического действия. Они влияют на функциональную активность клеток, принимающих участие в реакциях врожденного и приобретенного иммунитета. Тем не менее, воздействуя на Т- и В-лимфоциты, цитокины способны стимулировать антиген-зависимые процессы в иммунной системе.
3. Синтез цитокинов является индуцибельным процессом. Большинство цитокинов не синтезируется клетками вне воспалительной реакции и иммунного ответа. Экспрессия генов цитокинов начинается в ответ на проникновение в организм патогенов, антигенное раздражение или повреждение тканей. Одними из наиболее сильных индукторов синтеза цитокинов служат компоненты клеточных стенок бактерий: липополисахариды, пептидогликаны и мурамилдипептиды.
4. Цитокины синтезируются в ответ на стимуляцию через короткий промежуток времени. Синтез прекращается за счет разнообразных механизмов ауторегуляции, включая повышенную нестабильность РНК, и существования отрицательных обратных связей, опосредуемых простагландинами, кортикостероидными гормонами и другими факторами.
5. Один и тот же цитокин может продуцироваться различными по гистогенетическому происхождению типами клеток организма в разных органах.
6. Цитокины обладают плейотропностью биологического действия. Один и тот же цитокин может действовать на многие типы клеток, вызывая различные эффекты в зависимости от вида клеток-мишеней.
7. Для цитокинов характерна взаимозаменяемость биологического действия. Несколько разных цитокинов могут вызывать один и тот же биологический эффект либо обладать похожей активностью.
8. Биологические эффекты цитокинов опосредуются через специфические клеточные рецепторные комплексы, связывающие цитокины с очень высокой аффинностью, причем отдельные цитокины могут использовать общие субъединицы рецепторов.
Каждый цитокин связывается со своим специфическим рецепторным комплексом, однако все рецепторы цитокинов, представляющие собой трансмембранные белки, могут быть разделены на 5 основных типов.
Наиболее распространен так называемый первый тип рецепторов, имеющих два экстраклеточных домена, один из которых содержит общую последовательность аминокислотных остатков WSXWS.
Второй тип рецепторов также имеет два внеклеточных домена с большим количеством консервативных цистеинов.
Третий тип представлен рецепторами цитокинов, относящихся к группе фактора некроза опухолей.
Четвертый тип рецепторов цитокинов принадлежит к суперсемейству иммуноглобулиновых рецепторов, имеющих внеклеточные домены, напоминающие строение доменов молекул иммуноглобулинов.
Пятый тип рецепторов, связывающих молекулы семейства хемокинов, представлен трансмембранными белками, пересекающими клеточную мембрану в 7 местах.
Рецепторы цитокинов могут существовать в растворимой форме, сохраняя способность связывать лиганды.
9. Цитокины индуцируют либо подавляют синтез самих себя, других цитокинов и их рецепторов, участвуя в формировании цитокиновой сети.
10. Цитокины могут быть ассоциированными с мембранами синтезирующих их клеток, обладая в виде мембранной формы полным спектром биологической активности.
11. Цитокины могут влиять на пролиферацию, дифференцировку и функциональную активность клеток-мишеней.
Существует несколько вариантов проявления биологической активности в зависимости от участия различных внутриклеточных систем в передаче сигнала от рецептора, что связано с особенностями конкретных клеток-мишеней.
Цитокины могут оказывать антиапоптотическое действие посредством проведения сигнала с участием bcl2 и связанных с ним белков. Митогенное действие с активацией синтеза ДНК осуществляется с участием с-Мус, mTOR, CdK. Оба описанных сигнала приводят к поддержанию жизнеспособности и длительному росту клеток. Напротив, сигнал к апоптозу проводится с участием специфического участка рецепторов группы TNF, так называемого домена «смерти» (death domain). Дифференцировочный сигнал, приводящий к выбору пути развития либо терминальной дифференцировки клеток, осуществляется с участием внутриклеточных белков STAT (сигнальные трансдукторы и активаторы транскрипции). G-белки участвуют в передаче сигнала от хемокинов, что приводит к усилению миграции и адгезии клеток.
12. Цитокины действуют на клетки различными путями: аутокринно - на клетку, синтезирующую и секретирующую данный цитокин; паракринно - на клетки, расположенные вблизи клетки-продуцента, например, в очаге воспаления или в лимфоидном органе; эндокринно - дистантно на клетки любых органов и тканей после попадания цитокина в циркуляцию. В последнем случае действие цитокинов напоминает действие гормонов.
Цитокины в первую очередь регулируют развитие местных защитных реакций в тканях с участием различных типов клеток крови, эндотелия, соединительной ткани и эпителиев. Защита на местном уровне развивается путем формирования типичной воспалительной реакции с ее классическими проявлениями: развитием отека, покраснением, появлением болевого синдрома и нарушением функции. Воспаление развивается в ответ на повреждение и проникновение в ткани патогенов при участии провоспалительных цитокинов, к которым относятся IL-1, TNF, IL-6, хемокины и некоторые другие цитокины.
Перечисленные цитокины синтезируются в очаге воспаления главным образом макрофагальными клетками, активированными компонентами клеточной стенки патогенов, а также в ответ на повреждение тканей.
Они вызывают активацию эндотелия, приводящую к увеличению проницаемости, повышению экспрессии адгезионных молекул и усилению прокоагулянтной активности. При этом происходит выброс низкомолекулярных медиаторов воспаления, таких как гистамин, простагландины и др., ответственных за развитие воспалительной реакции в полном объеме. Хемокины усиливают направленную миграцию лейкоцитов в очаг воспаления и вместе с другими цитокинами увеличивают их функциональную активность: фагоцитоз и продукцию кислородных радикалов, направленную на элиминацию патогена.
Одновременно провоспалительные цитокины активируют метаболизм соединительной ткани, стимулируют пролиферацию фибробластов и клеток эпителия, что чрезвычайно важно для заживления повреждения и восстановления целостности ткани.
Таким образом, на местном уровне цитокины ответственны за все последовательные этапы развития адекватного ответа на внедрение патогена, обеспечение его локализации и удаления, а затем восстановления поврежденной структуры тканей, где бы ни развивалась воспалительная реакция.
Последовательные этапы формирования воспалительной реакции изучены достаточно хорошо, однако до последнего времени были неизвестны клеточные рецепторы, передающие активационные сигналы после взаимодействия с различными бактериальными патогенами или компонентами их клеточных стенок.
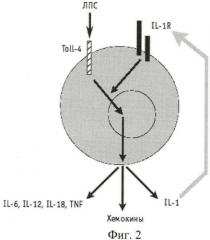
Лишь в последние годы выяснилось, что эта функция связана с Toll-белками, которые экспрессированы на поверхностных мембранах многих типов лейкоцитов, особенно макрофагов и дендритных клеток. Среди 12 известных Toll-белков существуют явные различия в узнавании бактериальных производных. Белок Toll-4 обеспечивает проведение сигнала при встрече лейкоцитов с грамотрицательными бактериями и основным компонентом их клеточных стенок - липополисахаридом (ЛПС), взаимодействующим также с CD14 и ЛПС-связывающим белком, которые сами не обладают функцией проведения сигнала в клетку.
Toll-белки ответственны за активацию синтеза провоспалительных цитокинов IL-1, TNF и др. Вслед за взаимодействием со специфическим лигандом, например ЛПС, запускается программа передачи внутриклеточного сигнала активации с участием адапторного белка MyD88, ассоциированной с рецептором IL-1-киназы и транслокацией ядерного транскрипционного фактора NFkB.
Важно, что этот путь полностью повторяется при передаче сигнала от рецептора IL-1, более того, внутриклеточные части трансмембранных Toll-белков имеют гомологию с рецептором IL-1. По сути, семейство молекул IL-1 использует тот же путь активации клеток, который используется и при первичном распознавании патогенов Toll-белками, и это нужно для усиления сигнала к развитию защитной воспалительной реакции (см. схему на фиг.2).
ЛПС, пептидогликаны, зимозан и другие компоненты клеточных стенок различных микроорганизмов запускают синтез IL-1 и ряда других провоспалительных цитокинов в макрофагах. В свою очередь, IL-1 способен вызвать продукцию тех же провоспалительных цитокинов и самого себя.
Анализ строения Toll-белков и рецепторного комплекса IL-1 подтверждает, что это не случайно. IL-1 практически повторяет все биологические эффекты ЛПС как на местном, так и на системном уровне. Однако Toll-4-рецепторы экспрессируются, главным образом, на клетках моноцитарно-макрофагального ряда, тогда как рецепторы IL-1 обнаружены на многих типах клеток, находящихся в различных органах.
Это подтверждается и спектром биологической активности IL-1, включающей активацию кроветворения, всех типов клеток иммунной системы, эндокринной системы и ЦНС.
Последние данные по изучению роли Toll-белков в развитии защитных реакций позволяют предположить, что IL-1 служит не просто медиатором действия ЛПС в организме, но является амплификатором развития защитных реакций, используя гомологичные рецепторы и полностью идентичные внутриклеточные сигнальные системы.
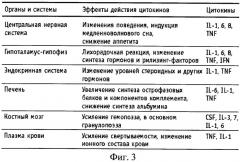
В случае несостоятельности местных защитных реакций воспалительная реакция развивается, возрастает синтез цитокинов, они попадают в циркуляцию, и их действие проявляется на системном уровне. Начинается следующий этап воспаления - системная воспалительная реакция или острофазовый ответ на уровне организма. В этом случае провоспалительные цитокины оказывают влияние практически на все органы и системы организма, участвующие в регуляции гомеостаза (см. таблицу 1 на фиг.3).
Действие провоспалительных цитокинов на ЦНС приводит к снижению аппетита и изменению всего комплекса поведенческих реакций. Временное прекращение поиска пищи и снижение сексуальной активности выгодно в плане экономии энергии для одной лишь задачи - борьбы с внедрившимся патогеном.
Этот сигнал обеспечивают цитокины, так как их попадание в циркуляцию, безусловно, означает, что местная защита не справилась с патогеном и требуется включение системной воспалительной реакции. Одно из первых проявлений системной воспалительной реакции, связанное с действием цитокинов на терморегуляторный центр гипоталамуса, заключается в подъеме температуры тела. Увеличение температуры является одной из эффективных защитных реакций, так как при повышенной температуре снижается способность ряда бактерий к размножению, и, напротив, возрастает пролиферация лимфоцитов.
В печени под влиянием цитокинов увеличивается синтез острофазовых белков и компонентов системы комплемента, нужных для борьбы с патогеном, но одновременно снижается синтез альбумина. То есть на уровне регуляции экспрессии отдельных генов цитокины направляют энергетические потоки, выбирая только то, что нужно для развития защитных реакций.
Такая система регуляции сформировалась эволюционно и несет безусловные выгоды для наиболее оптимального защитного ответа макроорганизма. Другим примером избирательного действия цитокинов служит изменение ионного состава плазмы крови при развитии системной воспалительной реакции. При этом происходит снижение уровня ионов железа, но повышение уровня ионов цинка, а ведь хорошо известно, что лишить бактериальную клетку ионов железа - значит снизить ее пролиферативный потенциал (на этом основано действие лактоферрина).
С другой стороны, увеличение уровня цинка нужно для нормальной работы иммунной системы, в частности, это необходимо для образования биологически активного сывороточного фактора тимуса - одного из основных тимических гормонов, обеспечивающих дифференцировку лимфоцитов.
Влияние цитокинов на кроветворную систему связано с существенной активизацией гемопоэза. Увеличение числа лейкоцитов, конечно, необходимо для наращивания количества клеток, непосредственно убивающих патогены, и для восполнения потерь нейтрофильных гранулоцитов в очаге гнойного воспаления. Действие на систему свертывания крови направлено на усиление свертываемости, которое необходимо для остановки кровотечения и для прямого блокирования патогена.
Наконец, в рамках иммунной системы цитокины осуществляют взаимосвязь между неспецифическими защитными реакциями и специфическим иммунитетом, действуя в обоих направлениях.
Таким образом, на уровне организма цитокины осуществляют связь между иммунной, нервной, эндокринной, кроветворной и другими системами и служат для их вовлечения в организацию и регуляцию единой защитной реакции. Цитокины как раз и служат той организующей системой, которая формирует и регулирует весь комплекс защитных реакций организма при внедрении патогенов. Приведенные данные ясно указывают, что нельзя ограничить понятие защитных реакций только участием неспецифических механизмов резистентности и специфического иммунного ответа. В единой защитной реакции участвует весь организм и все системы, на первый взгляд не относящиеся к поддержанию иммунитета.
Увеличение уровней цитокинов не может продолжаться бесконтрольно, так как гиперпродукция цитокинов служит причиной развития ряда патологических состояний, в частности септического шока. Появление цитокинов в кровотоке сразу приводит к увеличению синтеза стероидных гормонов, причем IL-1 и другие провоспалительные цитокины вызывают как усиление синтеза рилизинг-факторов, так и стимуляцию продукции гормонов клетками коры надпочечников. Стероидные гормоны, известные как одни из наиболее мощных иммуносупрессоров, блокируют синтез цитокинов и не позволяют их уровню превысить предельные значения.
Это является эффективным механизмом отрицательной обратной связи для контроля гиперпродукции цитокинов. Тем не менее, в ряде случаев уровни цитокинов превышают физиологические концентрации. На примере TNF очевидно, что характер действия цитокинов в организме зависит от их уровня (см. таблицу 2 на фиг.4).
Цитокины в низких концентрациях нужны для правильного формирования местного воспаления, более высокие дозы вызывают развитие системной воспалительной реакции, но патологически высокие концентрации приводят к состоянию септического шока и гибели организма.
Большинство цитокинов не играет никакой роли в нормальной физиологии организма, а синтезируются лишь при развитии защитных реакций. Тем не менее, некоторые цитокины в небольших количествах синтезируются постоянно, регулируя различные этапы нормального гемопоэза, либо только на определенных этапах развития организма. Так, в онтогенезе цитокины группы TNF и ряд хемокинов регулируют нормальное развитие клеток, миграцию лимфоидных предшественников и закладку органов иммунной системы.
Не менее важную роль цитокины играют и в регуляции дифференцировки и функциональной активности лимфоцитов, а значит, в регуляции специфического иммунитета. В настоящее время признано, что типы иммунного ответа связаны с одним из вариантов активации лимфоцитов с преимущественным участием клонов Т-лимфоцитов хелперов первого типа (Th1) или второго типа (Th2), которые различаются по паттернам продуцируемых цитокинов и ролью в стимулировании развития иммунного ответа по клеточному или гуморальному типу (см. фиг.5).
Активация Th1, секретирующих IL-2 и интерферон γ, ведет к стимуляции главным образом функций Т-лимфоцитов и макрофагов и к развитию клеточного типа ответа, тогда как синтез Т-хелперами 2 типа IL-4, IL-5, IL-10, IL-13 и IL-25 стимулирует преимущественно гуморальное звено иммунитета. У человека эта ситуация выглядит несколько сложнее за счет существования Т-хелперных клонов, секретирующих одновременно IL-2, IL-4 и IFNγ и некоторые другие сочетания цитокинов. Роль этих клонов в регуляции иммунитета окончательно не выяснена.
Продукты Th1 и Th2 негативно влияют на активацию противоположных клонов. IL-2 подавляет пролиферацию лимфоцитов, индуцированную IL-4, и наоборот. Цитокины Th2, в основном IL-4 и IL-10, прямо подавляют продукцию IL-2 Т-лимфоцитами, экспрессию α_цепи рецептора IL-2 на Т-лимфоцитах и β-цепи на В-лимфоцитах и NK-клетках и активность NK-клеток. Избыточная активация какого-то из типов Т-хелперных клонов может направить иммунный ответ по одному из вариантов развития. Хроническая несбалансированность активации Т-хелперных клонов приводит к развитию иммунопатологических состояний, связанных с проявлениями аллергии или аутоиммунитета.
Считается, что выраженность аллергических реакций обусловлена преимущественной активацией Th2, продуцирующих IL-4 и IL-5, которые стимулируют синтез антител класса IgG1 и особенно IgE, как известно, играющего решающую роль в развитии аллергических реакций.
В последние годы активно дискутируется роль цитокинов в патологии, в частности участие хемокинов в патогенезе СПИДа. Оказалось, что отдельные рецепторы хемокинов могут служить кофакторами для проникновения вируса иммунодефицита человека (ВИЧ) в клетки. Штаммы ВИЧ, тройные к моноцитам, используют рецепторы СС хемокинов, тогда как штаммы ВИЧ, тропные к Т-лимфоцитам и доминирующие на более поздних стадиях прогрессии СПИДа, используют рецепторы СХС хемокинов, в частности рецептор CXCR4. Такие СС хемокины, как RANTES, MIP-1α и MIP-1β, блокируют вход некоторых штаммов ВИЧ в клетки макрофагального ряда посредством рецептора CCR5, а СХС хемокин SDF-1, взаимодействующий с рецептором CXCR4, блокирует инфицирование лимфоцитов лимфотропными штаммами ВИЧ.
Лица, гомозиготные по делеции определенного участка из 32 пар оснований в аллелях гена рецептора хемокинов CCR5, оказались высокорезистентны к инфицированию ВИЧ, потому что дефектный рецептор не способен экспрессироваться на мембране клетки. Лица, гетерозиготные по данной делеции, подвержены инфицированию ВИЧ, но СПИД прогрессирует у них значительно медленнее.
ВИЧ использует клеточные рецепторы хемокинов для инфицирования клеток, и это лишь один из случаев приспособления микроорганизмов с целью обойти пагубное влияние иммунной системы или, более того, использовать молекулы иммунной системы для своего развития и размножения.
Сейчас накоплено достаточно фактов, указывающих на активное использование микроорганизмами рецепторов цитокинов в своих целях и модификацию биологического действия цитокинов, меняющую противоинфекционную направленность их биологической активности.
Ряд вирусов, в частности вирус герпеса и цитомегаловирус, экспрессируют белки, имеющие высокую степень гомологии с рецепторами хемокинов. Таким способом вирусы синтезируют белки, служащие ловушками для хемокинов, что ведет к снижению концентрации хемокинов и противодействию развития защитных реакций.
Другое предположение заключается в том, что кодируемый вирусным геномом хемокиновый рецептор может экспрессироваться на мембране инфицированной клетки. Активация клетки через данный рецептор может служить дополнительным сигналом для усиления вирусной репликации.
В таблице 3 (см. фиг.6) суммированы различные подходы к клиническому использованию отдельных цитокинов. Из приведенных данных очевидно, что в настоящее время цитокины находят все более широкое применение в клинической практике для лечения различных онкологических, инфекционных и иммунодефицитных заболеваний.
Этот новый класс регуляторных молекул создан природой в ходе миллионов лет эволюции и обладает неограниченными возможностями для употребления в качестве лекарственных препаратов.
В настоящее время наблюдается переход от терапии массовой к терапии индивидуальной, позволяющей вылечить конкретного больного. Однако без данных генотипирования пациента его лечение зачастую неэффективно, поскольку в зависимости от условий и доз воздействующего агента можно вызвать как стимуляцию, так и угнетение ряда показателей системы иммунитета.
На уровне организма цитокины осуществляют связь между иммунной, нервной, эндокринной, кроветворной и другими системами и служат для их вовлечения в организацию и регуляцию единой защитной реакции. Таким образом, цитокины служат той организующей системой, которая формирует и регулирует весь комплекс патофизиологических сдвигов при внедрении патогенов.
Однако опыт клинического применения рекомбинантных аналогов цитокинов показал, что действуют они выборочно. Многим пациентам такая терапия существенно помогает в ряде случаев, позволяя вылечить после первого применения, некоторым не помогает вообще, а в ряде случаев наблюдаются выраженные побочные реакции.
Известен способ лечения хронических гнойных риносинуситов путем иммунотерапии препаратом Беталейкин, включающий его системное и местное применение (см. патент RU №2161983, А61К 38/20, А61В 17/24, 2001).
Рекомбинантный IL-1β под коммерческим названием Беталейкин (далее БЛ) разрешен Минздравом РФ к клиническому применению (97/51/6). Биологические свойства этого цитокина, а именно стимуляция костномозгового кроветворения, перестройка иммунопоэза, активация метаболизма соединительной ткани, усиление пролиферации фибробластов и эпителиальных клеток (ранозаживляющее действие), в настоящее время с успехом используются в клинической практике для лечения ряда патологий (онкологических, инфекционных, хирургических, ЛОР и др.).
После терапии Беталейкином по данному способу у большинства больных (53%) резко сокращается количество гноя в промывной жидкости, который исчезает на третьи сутки лечения (отличный результат), у части больных (33%) небольшое количество гноя в промывной жидкости наблюдается до четвертого дня лечения (хороший результат), и у части пациентов (14%) на фоне уменьшения количества выделений из пазух сохраняются прожилки гноя и имеет место отек и гиперемия слизистой оболочки носа (удовлетворительный результат). Таким образом, эффект терапии отличается у разных больных.
Больные, являющиеся носителями высокопродуцирующих генов аллеля IL-1β, не могут получать терапию рекомбинантным IL-1β, так как увеличение концентрации приводит к усилению воспалительной реакции в организме и местно в околоносовых пазухах.
Недостатком данного способа является то, что больные гнойным риносинуситом на фоне гиперпродукции IL-1β, генетически обусловленной, не должны получать провоспалительную терапию, как местно, так и системно.
Известен также способ диагностического использования полиморфизма гена, кодирующего рецептор к TNF типа II для выявления пациентов, не отвечающих на анти-TNF терапию, в котором в качестве одного из факторов неэффективности терапии антителами к TNF выявляют полиморфизм гена рецептора для этого цитокина (см. патент ЕР 1172444, C12Q 1/68, 2002).
Данный способ позволяет выявить респондентов, не отвечающих на терапию антителами к TNF.
Наиболее близким по технической сущности к заявляемому решению является способ лечения интерлейкином-1 (см. патент RU №2301012, А61В 5/01, 2007).
Данный способ включает анализ данных генотипирования по признакам аллельного полиморфизма гена цитокина и позволяет достичь эффективности лечения препаратом рекомбинантным IL-1β на основании индивидуальной восприимчивости больного к лечению этим препаратом для исключения побочного эффекта предстоящей терапии.
Недостатком данного способа является то, что он недостаточно эффективен в отношении сокращения сроков лечения.
Технический результат изобретения заключается в повышении эффективности терапии пациентов с риносинуситами с затяжным течением болезни, которые не поддаются традиционным методам терапии, и сокращения сроков их лечения путем индивидуального подхода за счет данных генотипирования.
Для достижения указанного технического результата в способе иммунотерапии гнойного риносинусита, посредством рекомбинантного IL-1RA, основанном на данных генотипирования по признакам аллельного полиморфизма гена цитокина, полученных при исследовании клеток крови, согласно предложению, дополнительно исследуют клетки, выделенные из смывов, и определяют функциональную активность фагоцитирующих нейтрофилов, и при выявлении у пациента высокопродуцирующего аллеля гена IL-1β «2/2» и низкопродуцирующего аллеля гена IL-1RA«1/1» проводят иммунотерапию, обусловленную регулировкой активации фагоцитарной активности нейтрофилов.
Известно использование для решения таких задач рекомбинантных цитокинов, в частности цитокинов, регулирующих воспаление, таких как интерлейкин-1 (далее IL-1), фактор некроза опухолей (TNF), «пролиферативные» - IL-2, или «стимуляторы аллергии» - IL-4, IL-5 и др. Они могут возмещать недостающие регуляторные факторы и тем усиливать иммунные реакции.
Препарат Ралейкин (аэрозоль для местного применения) представляет собой лекарственную форму рецепторного антагониста интерлейкина-1 (IL-1RA).
IL-1RA представляет собой рекомбинантный белок, полученный по генно-инженерной технологии с использованием штамма-продуцента E.coli, трансформированного векторной плазмидой, содержащей ген рецепторного антагониста IL-1 человека.
IL-1RA ингибирует действие IL-1 путем конкурентного связывания мембранного рецептора первого типа к интерлейкину-1 и предотвращения взаимодействия рецептора с его акцессорным белком, что приводит к отсутствию проведения сигнала внутрь клетки. Сам IL-1RA после связывания рецептора не интернализуется в клетку, находясь в связанном с рецептором состоянии. IL-1RA продуцируется мононуклеарными фагоцитами вслед за IL-1, ограничивая действие этого провоспалительного белка, играющего ведущую роль в патогенезе таких аутоиммунных заболеваний, как ревматоидный артрит и васкулит. Развитие аутоиммунного процесса зависит от баланса уровней IL-1RA и IL-1.
Препарат разработан Федеральным государственным унитарным предприятием «Государственный научно-исследовательский институт особо чистых биопрепаратов» Федерального медико-биологического агентства (ФГУП «Гос. НИИ ОЧБ» ФМБА России, г.Санкт-Петербург).
В состав препарата Ралейкин входят следующие компоненты: действующее вещество - рекомбинантный рецепторный антагонист интерлейкина-1 - 10 мг; вспомогательные вещества: натрия гидрофосфат, натрия дигидрофосфата моногидрат, динатрия эдетат, альфа-токоферола ацетат (витамин Е), декстран, бензалкония хлорид, бензойная кислота, натрия хлорид, этиловый спирт 95%, а также вода в качестве растворителя и пропеллент азот.
Общий объем содержимого аэрозольного флакона составляет 10 мл. При пользовании аэрозольными флаконами снимают предохранительный колпачок, надевают насадку, свободный конец которой вводят поочередно в каждый носовой ход либо в ротовую полость, и кратковременно нажимают на основание насадки (в течение одной секунды). Ралейкин вводят 3 раза в сутки в течение 5 дней.
Спектр биологического действия препарата соответствует биологическим эффектам нативного цитокина IL-1RA, поэтому препарат будет применяться для лечения острых легочных воспалений, вызванных инфекционными агентами, аллергенами, физическими (механическая пыль, ожоги) или химическими (токсиканты) факторами, для профилактики и лечения аллергического ринита, бронхиальной астмы и других заболеваний дыхательного тракта, связанных с гиперпродукцией IL-1.
Работы по доклиническому изучению аэрозольного препарата на основе IL-1RA Ралейкин проводились институтом совместно с ФГУН «Институт токсикологии» ФМБА России и включали изучение специфической активности и фармакокинетики препарата, острой и субхронической токсичности, а также возможных аллергенных и иммунотоксических свойств.
Лечебную эффективность препарата Ралейкин, аэрозоль для местного применения, оценивали по купированию воспалительной реакции на разработанных моделях острого легочного воспаления у мышей, вызванного механической пылью или химическим воздействием блеомицина. Экспериментальное доклиническое изучение специфической активности аэрозольного препарата Ралейкин показало, что местное применение препарата (в полость рта, глотки, гортани) вызывает уменьшение воспалительной реакции у мышей.
В результате исследования фармакокинетики препарата были рассчитаны его основные фармакокинетические показатели: период полувыведения, среднее время удерживания, эффективная длительность, общий клиренс, стационарный объем распределения. Было показано, что концентрация IL-1RA начинает определяться в системном кровотоке уже через 15 минут после введения препарата Ралейкин. Наибольшая концентрация действующего вещества в плазме крови отмечается через 1,5 часа после введения препарата (34,60±2,02 мкг/мл).
Планирование и проведение работы по изучению безопасности препарата Ралейкин, аэрозоль для местного применения, осуществлялось в строгом соответствии с требованиями МЗСР РФ и международными стандартами в области доклинического изучения безопасности новых фармакологических средств - системы GLP (Good Laboratory Practice).
Результаты токсикометрии, данные наблюдений за экспериментальными животными на протяжении 14 дней после острого введения, а также данные некропсии позволяют отнести жидкий аэрозольный препарат на основе рецепторного антагониста интерлейкина-1 к V классу практически нетоксичных лекарственных веществ. Состояние животных после острого введения препарата свидетельствует о хорошей переносимости и безвредности препарата в дозах, превышающих максимальные терапевтические в сотни раз. Кроме того, показано, что препарат не оказывает раздражающего действия на слизистые оболочки в месте