Применение камфоленовых производных в качестве ароматических ингредиентов в парфюмерии и производстве вкусовых ароматизаторов
Иллюстрации
Показать всеИзобретение относится к камфоленовым производным общей формулы (I), душистой или ароматической вкусовой композиции и их применению в парфюмерии для получения ароматизированных основ и концентратов, в качестве ароматических средств для получения вкусовых композиций или изделий, в качестве средств, маскирующих запахи и/или вкус, в том числе в комбинации с другими парфюмерными или ароматическими ингредиентами, растворителями или добавками. В общей формуле (I)
R1, R2, R3, R4 и R5 представляют собой, каждый независимо от других элементов, атом водорода или линейную или разветвленную C1-C5 алкильную или С2-С5 алкенильную группу, - Y представляет собой CN, С(O)R6 или CR6(ORα)(ORβ) группу, где R6 представляет собой атом водорода или линейную или разветвленную C1-C5 алкильную или C2-C5 алкенильную группу, и Rα и Rβ одновременно представляют собой линейную или разветвленную C1, C2, С3, C4 или С5 алкильную или С2, С3, C4 или С5 алкенильную группу, - 5-членный цикл является насыщенным или содержит двойную связь между С3' и С4' в формуле (I), и - боковая цепь при необходимости содержит двойную связь между С1 и С2 и/или между С3 и С4, при условии, что данное производное не является 3-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналем. 6 н. и 4 з.п. ф-лы, 1 табл., 20 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области душистых веществ и вкусовых ароматических добавок. Более конкретно изобретение относится к новым камфоленовым производным и их применению в области парфюмерии и ароматизации.
Уровень техники
Некоторые камфоленовые производные, содержащие С1-С4 или С1-С5 алкильную или С2-С4 или С2-С5 алкенильную цепь, разветвленную в положении 1' камфоленового цикла, описаны в литературе в качестве пахучих веществ, как в ЕР 0203528, ЕР 0466019, ЕР 1008579, ЕР 0841318 или в патенте США 5,057,158. В частности, указанные документы касаются производных циклопентанбутанола, циклопентенбутенола и циклопентенпентенола, придающих типичный запах сандалового масла.
Раскрытие изобретения
Поставленная задача
Заявитель сосредоточил внимание на новой группе циклопентановых или циклопентеновых соединений, замещенных боковой цепью из, по меньшей мере, 6 атомов углерода. Заявитель обнаружил, что одно соединение из данной группы, 3-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналь, было известно, но органолептические свойства данного соединения ранее не были раскрыты.
Неожиданно, и, несмотря на тот факт, что камфоленовые производные обычно известны своим ароматом сандалового дерева, новые камфоленовые производные продемонстрировали неожиданные запахи, такие как цветочный, фруктовый или запах моря.
Потребность в новых соединениях очень важна для развития производства вкусовых ароматизаторов и парфюмерии, которому недавно пришлось столкнуться с ужесточенными международными нормативными требованиями относительно использования определенных веществ, а также с экологическими факторами и потребительским спросом на улучшенные свойства. Таким образом, производство новых душистых веществ представляет собой сложную задачу.
Другими словами, представленный новый подход направлен на решение технической проблемы, заключающейся в разработке новых ароматических или душистых соединений, предпочтительно характеризующихся простым и недорогим способом производства.
Определения
Термины “душистое вещество” и “ароматическое вещество”, при употреблении в данном тексте, используются взаимозаменяемо, когда имеется в виду соединение или смесь соединений, предназначенная для приятного воздействия на обоняние.
Термины “вкусовой ароматизатор” и “ароматизатор”, при употреблении в данном тексте, используются взаимозаменяемо, когда имеется в виду соединение или смесь соединений, предназначенная для приятного воздействия на вкус и обоняние. Также в контексте изобретения термин “ароматизация” относится к ароматизации любой жидкости или твердого вещества, человека или животного, особенно напитков, молочных продуктов, мороженого, супов, приправ, соусов, блюд, мясных продуктов, кулинарных добавок, соленых печений или сухих завтраков. Данный термин также означает ароматизацию пива, вин и табака.
Термин “органолептическое соединение”, такое как, например, душистые вещества и вкусовые ароматизаторы, при употреблении в данном тексте, относится к соединениям по изобретению, которые воздействуют на вкус или обоняние, и, таким образом, воспринимаются как имеющие характерный аромат и/или вкус.
Термин “ольфакторное эффективное количество”, при употреблении в данном тексте, означает уровень или количество душистого/ароматического соединения, присутствующего в веществе, при котором содержащееся соединение проявляет сенсорный эффект.
Термин “маскировка” означает уменьшение или устранение восприятия неприятного запаха или плохого вкуса, вызванного одной или более молекулами, входящими в состав продукта.
Термин “алкил” или “алкильная группа” в настоящем изобретении означает любую линейную или разветвленную насыщенную углеводородную цепь, содержащую предпочтительно 1, 2, 3, 4 или 5 атомов углерода и обозначаемую в данном тексте как C1-5алкильная группа, такая как, например, метил, этил, пропил, изопропил, бутил, трет-бутил, пентил.
Термин “алкенил” или “алкенильная группа” в настоящем изобретении означает любую линейную или разветвленную моно- или полиненасыщенную углеводородную цепь, содержащую предпочтительно 2, 3, 4 или 5 атомов углерода и обозначаемую в данном тексте как С2-5алкенильная группа, такая как, например, этенил, пропенил, бутенил или пентенил.
Термин “изомер” в настоящем изобретении означает молекулы, имеющие одинаковую химическую формулу, что означает одинаковое количество и типы атомов, но в которых атомы расположены по-разному. Термин “изомер” включает структурные изомеры, геометрические изомеры, оптические изомеры и стереоизомеры.
Таким образом, настоящее изобретение относится к камфоленовому производному общей формулы (I)
где
- R1, R2, R3, R4 и R5 представляют собой, каждый независимо от других элементов, атом водорода или линейную или разветвленную С1-С5 алкильную или С2-С5 алкенильную группу,
- Y представляет собой CN, C(O)R6 или CR6(ORα)(ORβ) группу, где R6 представляет собой атом водорода или линейную или разветвленную С1-С5 алкильную или С2-С5 алкенильную группу,
и Rα и Rβ одновременно представляют собой линейную или разветвленную С1-С5 алкильную или С2-С5 алкенильную группу или вместе образуют цикл, и предпочтительно Y представляет собой CN, СНО, С(O)СН3, С(O)С2Н5 или CR6(ORα)(ORβ), где R6 представляет собой атом водорода, метильную или этильную группу, и Rα и Rβ одновременно представляют собой линейную или разветвленную С1-С5 алкильную или С2-С5 алкенильную группу, или вместе образуют цикл
- 5-членный цикл является насыщенным или содержит двойную связь между C3' и С4' в формуле (I), и
- боковая цепь при необходимости содержит двойную связь между С1 и С2 и/или между С3 и С4;
- при условии, что данное производное не является 3-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналем.
Предпочтительно соединения по изобретению представляют собой соединения приведенной выше общей формулы (I), где
- R1, R2, R3, R4 и R5 представляют собой, каждый независимо от других элементов, атом водорода или метильную или этильную группу,
- Y представляет собой CN, C(O)R6 или CR6(ORα)(ORβ) группу, где R6 представляет собой атом водорода или линейную или разветвленную С1-С5 алкильную или С2-С5 алкенильную группу,
и Rα и Rβ одновременно представляют собой линейную или разветвленную С1-С5 алкильную или С2-С5 алкенильную группу или вместе образуют цикл, и предпочтительно Y представляет собой CN, СНО, С(O)СН3, С(O)С2Н5 или CR6(ORα)(ORβ), где R6 представляет собой атом водорода, метильную или этильную группу, и Rα и Rβ одновременно представляют собой линейную или разветвленную С1-С5 алкильную или С2-С5 алкенильную группу или вместе образуют цикл,
- 5-членный цикл является насыщенным или содержит двойную связь между C3' и С4' в формуле (I), и
- боковая цепь при необходимости содержит двойную связь между С1 и С2 и/или между C3 и С4;
- при условии, что данное производное не является 3-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналем.
Предпочтительно соединения по изобретению представляют собой соединения общей формулы (I) выше, где
- R1, R2, R3, R4 и R5 представляют собой, каждый независимо от других элементов, атом водорода или линейную или разветвленную С1-С5 алкильную или С2-С5 алкенильную группу,
Y представляет собой CN, СНО, С(O)СН3, С(O)С2Н5 или CR6(ORα)(ORβ), где R6 представляет собой атом водорода, метильную или этильную группу, и Rα и Rβ одновременно представляют собой линейную или разветвленную С1-С5 алкильную или С2-С5 алкенильную группу или вместе образуют цикл,
- 5-членный цикл является насыщенным или содержит двойную связь между C3' и С4' в формуле (I), и
- боковая цепь при необходимости содержит двойную связь между С1 и С2 и/или между C3 и С4;
- при условии, что данное производное не является 3-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналем.
Согласно другому предпочтительному варианту осуществления соединения по изобретению представляют собой соединения приведенной выше общей формулы (I), где
- R1, R2, R3, R4 и R5 представляют собой, каждый независимо от других элементов, атом водорода или метильную или этильную группу, и
- Y представляет собой CN, СНО, С(O)СН3, С(O)С2Н5 или CR6(ORα)(ORβ), где R6 представляет собой атом водорода, метильную или этильную группу, и Rα и Rβ одновременно представляют собой линейную или разветвленную С1-С5 алкильную или С2-С5 алкенильную группу или вместе образуют цикл,
- 5-членный цикл и боковая цепь являются ненасыщенными, предпочтительно боковая цепь является мононенасыщенной;
- при условии, что данное производное не является 3-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналем.
Согласно другому предпочтительному варианту осуществления соединения по изобретению представляют собой соединения общей формулы (I), приведенной выше, где
- R1, R2, R3, R4 и R5 представляют собой, каждый независимо от других элементов, атом водорода или линейную или разветвленную С1-С5 алкильную или С2-С5 алкенильную группу,
- Y представляет собой CN, СНО, С(O)СН3, С(O)С2Н5 или CR6(ORα)(ORβ), где R6 представляет собой атом водорода, метильную или этильную группу, и Rα и Rβ одновременно представляют собой линейную или разветвленную С1-С5 алкильную или С2-С5 алкенильную группу, или вместе образуют цикл,
- 5-членный цикл и боковая цепь являются ненасыщенными, предпочтительно боковая цепь является мононенасыщенной;
- при условии, что данное производное не является 3-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналем.
Согласно первому варианту осуществления настоящего изобретения камфоленовые производные по изобретению имеют общую формулу (Iа),
Где
- R1, R2, R3, R4 и R5 представляют собой, каждый независимо от других элементов, атом водорода или линейную или разветвленную С1-С5 алкильную или С2-С5 алкенильную группу, и предпочтительно R1, R2, R3, R4 и R5 представляют собой, каждый независимо от других элементов, атом водорода или метильную или этильную группу,
- 5-членный цикл является насыщенным или содержит двойную связь между С3' и С4', и
- боковая цепь при необходимости является ненасыщенной между С1 и С2 и/или между С3 и С4 в формуле (Iа).
Согласно второму варианту осуществления изобретения камфоленовые производные по изобретению имеют общую формулу (Ib),
где
- R1, R2, R3, R4 и R5 представляют собой, каждый независимо от других элементов, атом водорода или линейную или разветвленную С1-С5 алкильную или С2-С5 алкенильную группу, и предпочтительно R1, R2, R3, R4 и R5 представляют собой, каждый независимо от других элементов, атом водорода или метильную или этильную группу,
- 5-членный цикл является насыщенным или содержит двойную связь между C3' и С4', и
- боковая цепь при необходимости является ненасыщенной между С1 и С2 и/или между C3 и С4 в формуле (Ib), и
- R6 представляет собой атом водорода, линейную или разветвленную С1-5 алкильную или С2-5 алкенильную группу, предпочтительно R6 представляет собой атом водорода или метильную группу, более предпочтительно R6 представляет собой атом водорода;
- при условии, что данное производное не является 3-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналем.
Согласно третьему варианту осуществления изобретения камфоленовые производные по изобретению имеют общую формулу (Ic),
где
- R1, R2, R3, R4 и R5 представляют собой, каждый независимо от других элементов, атом водорода или линейную или разветвленную С1-С5 алкильную или С2-С5 алкенильную группу и предпочтительно R1, R2, R3, R4 и R5 представляют собой, каждый независимо от других элементов, атом водорода или метильную или этильную группу,
- 5-членный цикл является насыщенным или содержит двойную связь между С3' и С4' в формуле (Ic), и
- боковая цепь при необходимости является ненасыщенной между С1 и С2 и/или между C3 и С4 в формуле (Ic), и
- Rα и Rβ одновременно представляют собой линейную или разветвленную С1-С5 алкильную или С2-С5 алкенильную группу, предпочтительно Rα и Rβ одновременно представляют собой метильную или этильную группу или
- Rα и Rβ вместе образуют цикл, предпочтительно 5-членный цикл или 6-членный цикл.
Настоящее изобретение относится к соединениям формулы (I), как описано выше, но также к любому из их различных изомеров.
Согласно предпочтительному варианту осуществления изобретения камфоленовые производные по изобретению выбраны из группы, содержащей:
6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еннитрил,
(4E)-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еннитрил,
(4Z)-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еннитрил,
(+)-6-((1R)-2,2,3-триметил-циклопент-3-енил)-гекс-4-еннитрил, (-)-6-((1S)-2,2,3-триметил-циклопент-3-енил)-гекс-4-еннитрил, (4E)-6-((1R)-2,2,3-триметил-циклопент-3-енил)-гекс-4-еннитрил, (4Z)-6-((1R)-2,2,3-триметил-циклопент-3-енил)-гекс-4-еннитрил, (4E)-6-((1S)-2,2,3-триметил-циклопент-3-енил)-гекс-4-еннитрил, (4Z)-6-((1S)-2,2,3-триметил-циклопент-3-енил)-гекс-4-еннитрил, 6-(2,2,3-триметил-циклопентил)-гекс-4-еннитрил, (4E)-6-(2,2,3-триметил-циклопентил)-гекс-4-еннитрил, (4Z)-6-(2,2,3-триметил-циклопентил)-гекс-4-еннитрил, 4-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еннитрил, (4Z)-4-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еннитрил, (4Е)-4-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еннитрил, 4-метил-6-(2,2,3-триметил-циклопентил)-гексаннитрил, 4-этил-6-(2,2,3-триметил-циклопентил)-гексаннитрил, 4-метил-6-(2,2,3-триметил-циклопентил)-гекс-3-еннитрил, 6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналь, (4E)-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналь, (4Z)-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналь, (+)-6-((1R)-2,2,3-триметил-циклопент-3-енил)-гекс-4-еналь, (-)-6-((1S)-2,2,3-триметил-циклопент-3-енил)-гекс-4-еналь, (4Z)-6-((1R)-2,2,3-триметил-циклопент-3-енил)-гекс-4-еналь, (4Z)-6-((1S)-2,2,3-триметил-циклопент-3-енил)-гекс-4-еналь, (4Z)-6-((1S)-2,2,3-триметил-циклопент-3-енил)-гекс-4-еналь, (4Z)-6-((1R)-2,2,3-триметил-циклопент-3-енил)-гекс-4-еналь, 6-(2,2,3-триметил-циклопентил)-гекс-4-еналь, (4Z)-6-(2,2,3-триметил-циклопентил)-гекс-4-еналь, (4Е)-6-(2,2,3-триметил-циклопентил)-гекс-4-еналь, 4-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналь, (4E)-4-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналь, (4Z)-4-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналь, 4-метил-6-(2,2,3-триметил-циклопентил)-гексаналь, 4-этил-6-(2,2,3-триметил-циклопентил)-гексаналь, 3-метил-6-(2,2,3-триметил-циклопентил)-гексаналь, 2,4-диметил-6-(2,2,3-триметил-циклопентил)-гексаналь, 7-(2,2,3-триметил-циклопент-3-енил)-гепт-5-ен-2-он, (4E)-7-(2,2,3-триметил-циклопент-3-енил)-гепт-5-ен-2-он, (4Z)-7-(2,2,3-триметил-циклопент-3-енил)-гепт-5-ен-2-он, 2-(6,6-диэтокси-3-этил-гексил)-1,1,5-триметил-циклопентан, 4-(6,6-диэтокси-гекс-2-енил)-1,5,5-триметил-циклопентен, 4-((2E)-6,6-диэтокси-гекс-2-енил)-1,5,5-триметил-циклопентен, 4-((2Z)-6,6-диэтокси-гекс-2-енил)-1,5,5-триметил-циклопентен.
В другом аспекте настоящее изобретение относится к применению соединений формулы (I), как описано выше, и к применению одного или более изомеров 3-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналя в качестве душистых или вкусовых ароматических средств. Настоящее изобретение также относится к душистой или ароматической композиции, содержащей по меньшей мере одно камфоленовое производное по изобретению и/или 3-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналь, который никогда не был описан как органолептическое соединение.
Настоящее изобретение включает любую душистую или ароматическую композицию, содержащую один или более изомеров соединения формулы (I) и/или 3-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналя. Согласно предпочтительному варианту осуществления настоящее изобретение относится к композиции, содержащей по меньшей мере два или три изомера соединения формулы (I) и/или 3-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналя.
Соединения по изобретению можно использовать отдельно или в комбинации с другими обычно используемыми парфюмерными или ароматическими ингредиентами, растворителями, добавками или фиксативами, которые квалифицированный специалист в данной области техники может легко выбрать в соответствии с требуемым эффектом и характером продукта, которому необходимо придать аромат или вкус.
В первом варианте осуществления настоящее изобретение относится к использованию по меньшей мере одного камфоленового производного или содержащей их композиции, как описано выше, в области парфюмерии для получения ароматизированных основ и концентрированных составов, душистых веществ, парфюмерных изделий и аналогичной продукции; композиций для наружного применения; косметических композиций, таких как, например, кремы для лица и тела, очищающие средства, средства для ухода за кожей лица, тальковые пудры, масла для волос, шампуни, лосьоны для волос, масла и соли для ванн, гели для душа и ванн, мыла, антиперспиранты и дезодоранты для тела, кремы и лосьоны до бритья, для бритья и после бритья, кремы, зубные пасты, средства для полоскания рта, помады; очищающие продукты, такие как, например, умягчители, детергенты, освежители воздуха и бытовые чистящие средства. Таким образом, настоящее изобретение относится также к душистой композиции, включающей по меньшей мере одно соединение формулы (I) или один или более изомеров соединения формулы (I).
Во втором варианте осуществления настоящее изобретение относится к применению соединений или композиции, как описано выше, в качестве ароматических средств для получения ароматических композиций или изделий, таких как, например, напитки, молочные продукты, мороженое, супы, приправы, соусы, блюда, мясные продукты, кулинарные добавки, соленые печенья или закуски, а также пиво, вина и табак. Таким образом, настоящее изобретение относится также к ароматической композиции, включающей по меньшей мере одно соединение формулы (I) или один или более изомер соединения формулы (I).
В третьем варианте осуществления настоящее изобретение относится к применению соединений или композиции, как описано выше, в качестве средств, маскирующих запахи и/или вкусы, и к любой фармацевтической, косметической или пищевой композиции, содержащей по меньшей мере одно соединение формулы (I) или один или более изомер соединения формулы (I). Таким образом, настоящее изобретение относится также к любой композиции, содержащей по меньшей мере одно соединение формулы (I), как описано в данном тексте, в комбинации с любым подходящим наполнителем, особенно фармацевтическим или косметическим или диетическим наполнителем.
Соединения по настоящему изобретению можно использовать в концентрации в диапазоне от 0,001 до 99% по массе, предпочтительно от 0,1 до 50% по массе, более предпочтительно от 0,1 до 30% по массе. Квалифицированному специалисту в данной области техники известно, что указанные значения зависят от характера композиции/изделия, которому необходимо придать аромат и/или вкус, от требуемой интенсивности запаха и/или вкуса, и от природы других ингредиентов, присутствующих в указанной композиции или изделии. Согласно предпочтительному варианту осуществления изобретения соединения используют в ольфакторном эффективном количестве.
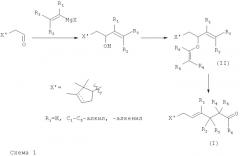
Новые производные по настоящему изобретению можно легко получать различными способами посредством реакций, известных специалисту в данной области техники. Например, производные общей формулы (I), как описано выше, где Y представляет собой группу C(O)R6 и где отсутствует двойная связь между С2-С3, можно получать перегруппировкой Кляйзена, как показано на Схеме 1, из соединений формулы (II), где R1-R6 такие, как описано выше в тексте. Молекулы формулы (II) можно получать конденсацией соответствующим образом замещенного реактива Гриньяра с камфоленовым альдегидом, насыщенным или ненасыщенным, с последующей переэтерефикацией соответствующим простым виниловым эфиром или взаимодействием с подходящими аллилгалогенидами согласно известным методикам.
Новые производные формулы (I), в которых R1-5 имеют значения, определенные в формуле (I), где Y представляет собой группу CN, можно получать конденсацией Кневенагеля-Дебнера соединения формулы (III) с цианоуксусной кислотой или этилцианоацетатом, с последующим восстановлением одной или более двойных связей, как показано на Схеме 2. Соединения (III) получают кротонизацией из камфоленового альдегида и подходящих оксосоединений согласно методикам, известным в данной области техники; и их можно использовать непосредственно или восстанавливать α,β-непредельный фрагмент до конденсации по Кневенагелю.
Когда получены производные формулы (I), в которых Y представляет собой цианогруппу, легко получить соединения формулы (I), в которых Y представляет собой группу C(O)R6, например, путем восстановления диизобутилгидридом алюминия или алкилирования фосфониевыми производными. Соединения формулы (I), в которых Y представляет собой группу CR6(ORα)(ORβ), затем легко получить из (I), в которых Y представляет собой C(O)R6 группу, путем образования ацеталя с подходящим спиртом или диолом.
Камфоленовый альдегид, исходное вещество либо покупают, либо получают из α-пинена через пиненоксид согласно известной методике. (S)-(-) Камфоленовый альдегид и его (R)-(+)-энантиомер можно получить из (1R)-(+) и (1S)-(-)-α-пинена, соответственно. Двойную связь можно прогидрировать для получения соединений формулы (I), как описано ранее, в которых отсутствует двойная связь в цикле.
Описанные далее примеры уточняют способы получения соединений по изобретению и их применение. Данные примеры представлены только с целью иллюстрации и не должны рассматриваться как ограничивающие объем изобретения.
Осуществление изобретения
Пример 1: Получение 6-(2,2,3-триметил-циклопент-3-енил)гекс-4-еннитрила
Суспензию хлорида (3-циано-пропил)-трифенилфосфония (легко получающегося известным взаимодействием трифенилфосфина с 4-хлор-бутиронитрилом) в толуоле, к которой были добавлены карбонат калия, коммерчески доступный камфоленовый альдегид и каталитическое количество бензойной кислоты, кипятили с обратным холодильником 24 ч. Затем смесь охлаждали и фильтровали. Фильтрат дважды промывали теплой водой, сушили сульфатом магния и упаривали растворители до получения сырого продукта в виде масла, которое растирали в трет-бутилметиловом эфире для осаждения большей части фосфиноксида. После фильтрования упаривали растворители и перегоняли маслообразный сырой продукт.
Полученное таким образом соединение представляет собой цис/транс (90:10) смесь.
Т.кип. = 98-100°С/0,76-0,79 торр
Цис-изомер:
1Н-ЯМР (200 МГц, CDCl3): δ 0,83 (с, 3H), 1,03 (с, 3H), 1,6-1,65 (м, 3H), 1,75-1,95 (м, 2Н), 1,95-2,4 (м, 3H), 2,4-2,55 (м, 4Н), 5,2-5,3 (м, 1H), 5,35-5,7 (м, 2Н).
13С-ЯМР (50 МГц, CDCl3): δ 13,02, 17,93, 20,13, 23,76, 26,28, 28,32, 35,93, 47,15, 50,66, 119,82, 212,99, 125,57, 133,51, 148,83.
Транс-изомер: некоторые данные
1Н-ЯМР (200 МГц, CDCl3): δ 0,80 (с, 3H), 1,01 (с, 3H).
13С-ЯМР (50 МГц, CDCl3): δ 18,14, 28,81, 33,69, 50,41, 122,08, 126,41, 134,25, 148,89.
ИК (пленка, см-1): 798 ср, 1013 сл, 1360 ср, 1444 ср, 1463 ср, 1653 сл, 2246 сл, 2835 ср, 2866 сильн, 2895 сильн, 2930 сильн, 2956 сильн, 3013 сл, 3035 сл.
МС (ЭУ, интенсивность (%)): 203 (М+, 10), 188 (100), 171 (38), 160 (19), 147 (35), 133 (19), 121 (31), 109 (83), 108 (91), 107 (26), 105 (24), 95 (26), 94 (31), 93 (44), 91 (44), 81 (19), 79 (40), 77 (33), 55 (36), 53 (27), 41 (72), 39 (26).
Пример 2: Получение (+)-(1'R-(6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еннитрила
Данный продукт получали из (R)-(+)-камфоленового альдегида аналогично примеру 1. αD (без растворителя) = +1.92°.
Пример 3: Получение 6-(2,2,3-триметил-циклопентил)-гекс-4-еннитрила
6-(2,2,3-Триметил-циклопентил)-гекс-4-еннитрил получали из 2H-дигидро-камфоленового альдегида и хлорида (3-циано-пропил)-трифенилфосфония аналогично примеру 1. Продукт был получен в виде цис/транс (90:10) смеси.
Т.кип. = 82°С/0,02 торр
Цис-изомер:
1Н-ЯМР (200 МГц, CDCl3): δ 0,53 (с, 3H), 0,82 (д, 3H, J=6,7 Гц), 0,88 (с, 3H), 1,05-1,25 (м, 2Н), 1,25-1,55 (м, 2Н), 1,55-1,90 (м, 3H), 2,05-2,25 (м, 1H), 2,27-2,47 (м, 4Н), 5,20-5,40 (м, 1Н), 5,45-5,65 (м, 1H).
13С-ЯМР (50 МГц, CDCl3): δ 13,82, 14,33, 17,47, 23,24, 25,60, 28,13, 28,27, 29,85, 44,97, 50,89, 119,34, 124,67, 133,30.
Транс-изомер:
1H-ЯМР (200 МГц, CDCl3, некоторые данные): δ 0,50 (с, 3H), 0,84 (с, 3H).
13С-ЯМР (50 МГц, CDCl3): δ 12,54, 17,67, 19,65, 25,80, 27,84, 28,01, 33,69, 35,45, 50,18, 50,52, 119,34, 125,05, 133,03.
ИК (пленка, см-1): 1367 ср, 1388 сл, 1428 ср, 1453 ср, 1465 ср, 1660 сл, 1710 сл, 1727 сл, 2247 ср, 2870 сильн, 2955 сильн, 3013 ср.
МС (ЭУ, интенсивность (%)): 205 (М+, 1), 190(7), 188(4), 162(8), 148(13), 134(8), 120(6), 111(72), 109(18), 95(24), 84(33), 70(22), 69(100), 67(25), 55(38), 41(41).
Пример 4: Получение 4-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еннитрила
К суспензии хлорида (3-циано-пропил)-трифенилфосфония (смотри Пример 1) в тетрагидрофуране порциями добавляли один моль-экв. трет-бутилата калия. После перемешивания при комнатной температуре в течение 30 мин смесь охлаждали (ледяная баня) перед медленным добавлением метилиодида. Смесь перемешивали еще 1 ч и добавляли порциями еще один эквивалент трет-бутилата калия. После перемешивания при комнатной температуре в течение еще одного часа добавляли камфоленовый альдегид и затем реакционную смесь перемешивали в течение ночи. Реакционную смесь выливали в смесь вода:трет-бутилметиловый эфир (50:50). Отделенную водную фазу подкисляли и три раза экстрагировали трет-бутилметиловым эфиром. Объединенные органические слои дважды промывали водой, затем насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. После сушки сульфатом магния растворители упаривали и сырой продукт очищали перегонкой.
Т.кип. = 104-106°С/0,7-0,8 торр
Соединение было получено в виде цис/транс (50:50) смеси.
1Н-ЯМР (200 МГц, CDCl3): δ 0,79 (с, 3H), 0,99 (с, 3H), 1,58-1,63 (м, 3H), 1,63-2,53 (м, 12Н), 2,41 (с, 3H), 5,2-5,25 (м, 1Н), 5,25-5,38 (м, 1H).
13С-ЯМР (50 МГц, CDCl3): δ 12,57, 15,64 и 15,84, 16,31 и 22,72, 19,68, 25,84 и 25,87, 27,56, 28,36 и 28,5, 35,07, 35,48 и 35,52, 46,68, 50,34 и 50,53, 119,47 и 119,52, 121,56 и 121,69, 127,3 и 128,48, 130,79 и 130,9,148,41 и 148,49.
ИК (пленка, см-1): 799 ср, 1013 сл, 13560 ср, 1382 сл, 1445 ср, 1462 ср, 1691 сл, 2246 сл, 2835 ср, 2866 ср, 2930 сильн, 2956 сильн, 3036 сл.
МС (ЭУ, интенсивность (%), цис-изомер): 217 (М+, 12), 202 (19), 185 (13), 146 (12), 122 (45), 121 (93), 109 (100), 108 (93), 107 (83), 95 (31), 93 (48), 91 (48), 81 (63), 79 (54), 77 (35), 67 (76), 55 (37), 53 (34), 41 (66), 39 (23).
МС (ЭУ, интенсивность (%), транс-изомер): 217 (М+, 15), 202 (27), 185 (5), 146 (10), 122 (54), 121 (100), 109 (99), 108 (100), 107 (90), 95 (33), 93 (48), 91 (50), 81 (64), 79 (53), 77 (35), 67 (75), 55 (35), 53 (33), 41 (61), 39 (22).
Пример 5: Получение 4-метил-6-(2,23-триметил-циклопентил)-гексаннитрила
2-Метил-4-(2,2,3-триметил-циклопент-3-енил)-бут-2-еналь (полученный по известной методике) конденсировали с цианоуксусной кислотой в присутствии 2,6-лутидина при комнатной температуре с получением 4-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекса-2,4-диеннитрила. После удаления тяжелых побочных продуктов сырой 4-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекса-2,4-диеннитрил гидрировали под давлением Н2 (pH2=20 бар; комнатная температура) с получением 4-метил-6-(2,2,3-триметил-циклопентил)-гексаннитрила.
Т.кип. = 95°С/0,07 торр
1H-ЯМР (200 МГц, CDCl3): δ 0,49 (с,3H), 0,82 (д, 3H, J=6,1 Гц), 0,85 (с, 3H), 0,91 (2 д, 3H, J=6,3 Гц), 1,0-1,8 (м, 13Н), 2,25-2,42 (м, 2Н).
13С-ЯМР (50 МГц, CDCl3): δ 13,91 и 14,43, 14,93 и 15,0, 18,77 и 19,06, 25,68 и 25,72, 27,5 и 27,69, 28,24 и 28,38, 30,13, 32,1 и 32,27, 32,55, 35,35 и 35,65, 42,32, 45,24, 50,85 и 51,17.
ИК (пленка, см-1): 1365 ср, 1385 сл, 1427 сл, 1465 ср, 2246 сл, 2869 сильн, 2955 сильн.
МС (ЭУ, интенсивность (%)): 221 (М+, 3), 206 (6), 204 (9), 178 (18), 84 (100), 83 (26), 70 (56), 69 (83), 55 (58), 41 (45).
Пример 6: Получение 4-этил-6-(2,2,3-триметил-циклопентил)-гексаннитрила
4-Этил-6-(2,2,3-триметил-циклопентил)-гексаннитрил получали из 2-этил-4-(2,2,3-триметил-циклопент-3-енил)-бут-2-еналя (получен из камфоленового альдегида и пропаналя по известной методике) и цианоуксусной кислоты аналогично Примеру 5.
Соединение было получено в виде смеси изомеров (70:30).
Т.кип. = 112°С/0,03 торр
1H-ЯМР (200 МГц, CDCl3, общие протоны): δ 0,46 (с, 3H), 0,7-0,9 (м, 9Н), 0,9-1,5 (м, 12Н), 1,5-1,85 (м, 3H).
Превалирующие изомеры: δ 2,27 (т, 2Н, J=7,4 Гц);
минорные изомеры: δ 2,54 (т, 2Н, J=7,2 Гц).
13С-ЯМР (50 МГц, CDCl3):
Превалирующие изомеры: δ 10,18 и 10,52, 13,73 и 13,76, 14,27, 14,52 и 14,66, 24,72 и 25,16, 25,54 и 25,58, 27,0 и 27,27, 28,19 и 28,23, 28,58 и 28,83, 29,97 и 30,04, 31,31 и 31,39, 38,05 и 38,25, 42,12 и 42,15, 45,08 и 45,11, 50,93 и 51,14, 119,89.
Минорные изомеры (некоторые данные): δ 10,55 и 10,88, 25,46 и 25,92, 26,97 и 27,05, 30,68 и 31,02, 39,12 и 39,23, 50,99.
ИК (пленка, см-1): 1118 сл, 1244 сл, 1367 ср, 1384 сл, 1461 ср, 1738 сл, 2247 сл, 2869 сильн, 2956 сильн.
МС (ЭУ, интенсивность (%)): 235 (М+, 1), 220 (3), 192 (10), 84 (162), 83 (26), 70 (67), 69 (89), 55 (49), 41 (43).
Пример 7: Получение 4-метил-6-(2,2,3-триметил-циклопентил)-гекс-3-еннитрила
2-Метил-4-(2,2,3-триметил-циклопентил)-бутиральдегид (легко получен из 2-метил-4-(2,2,3-триметил-циклопент-3-енил)-бут-2-еналя) конденсировали с цианоуксусной кислотой в присутствии 2,6-лутидина при комнатной температуре с получением 4-метил-6-(2,2,3-триметил-циклопентил)-гекс-3-еннитрила в виде (40:60) смеси изомеров.
Т.кип. = 95°С/0,03 торр
1Н-ЯМР (200 МГц, CDCl3): δ 0,49 (с, 3H), 0,75-0,9 (м, 6Н), 0,9-1,4 (м, 5Н), 1,4-1,6 (м, 2Н), 1,6-2,1 (м, 3H), 1,65 (с, 3H), 3,03 (д, 2Н, J=6,9 Гц), 5,1-5,2 (м, 1Н).
Минорный изомер (некоторые данные): δ 1,73 (д, 3H, 7=1,3 Гц).
13С-ЯМР (50 МГц, CDCl3):
Превалирующий изомер: δ 13,82, 14,37, 16,16, 16,39, 25,56, 28,04, 28,46, 30,05, 38,4, 42,25, 45,11, 50,29, 111,11, 118,63, 142,96.
Минорный изомер: δ 13,82, 14,37, 16,02, 16,39, 23,13, 28,15, 28,25, 28,46, 31,13, 38,4, 42,31, 45,19, 50,61, 111,72, 118,63, 143,09.
ИК (пленка, см-1): 920 сл, 1049 сл, 1366 ср, 1386 ср, 1418 сл, 1453 ср, 1466 ср, 1669 сл, 1754 сл, 2250 сл, 2869 сильн, 2954 сильн.
МС (ЭУ, интенсивность (%)): 219 (М+, 1), 204 (5), 179 (8), 124 (9), 109 (26), 95 (16), 84 (67), 83 (32), 81 (17), 70 (44), 69 (100), 67 (26), 55 (40), 41 (49).
219 (М+, 1), 204 (7), 124 (15), 109 (69), 95 (23), 84 (49), 83 (26), 82 (36), 81 (20), 70 (35), 69 (100), 67 (30), 55 (39), 41 (48).
Пример 8: Получение 6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналя
1М раствор диизобутилалюминий гидрида в толуоле добавляли по каплям к раствору 6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еннитрила с такой скоростью, чтобы температура оставалась ниже 40°С. После добавления раствор нагревали до 80°С в течение 2 ч. Осторожно проводили гидролиз, выливая реакционный раствор в смесь уксусной кислоты и льда. Водную фазу дважды экстрагировали трет-бутилметиловым эфиром и объединенные органические фазы дважды промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. После сушки сульфатом магния растворители упаривали с получением сырого продукта в виде масла. Очистка заключалась в короткоходном (bulb-to-bulb) упаривании перед перегонкой.
Т.кип. = 76-78°С/0,2 торр
1Н-ЯМР (200 МГц, CDCl3):
Цис-изомер: δ 0,8 (с, 3H), 1,1 (с, 3H), 1,55-1,65 (м, 3H), 1,65-2,6 (м, 9Н), 5,15-5,25 (м, 1H), 5,25-5,55 (м, 2Н), 9,78 (т, 1Н, J=1,5 Гц).
Транс-изомер: (некоторые данные) δ 0,76 (с, 3H), 0,97 (с, 3H), 9,66 (м, 1H).
13С-ЯМР (50 МГц, CDCl3): (цис-изомер) δ 12,58, 19,67, 20,11, 25,85, 27,77, 35,52, 43,76, 46,69, 50,31, 121,6, 127,2, 131,09, 148,49, 202,15.
ИК (пленка, см-1): 798 ср, 1013 сл, 1360 ср, 1384 сл, 1409 сл, 1444 ср, 1463 ср, 1727 сильн, 2719 сл, 2833 ср, 2866 ср, 2894 сильн, 2930 сильн, 2955 сильн, 3010 ср, 3035 сл.
МС (ЭУ, интенсивность (%)): 206 (М+, 8), 191 (19), 173 (12), 147 (28), 121 (30), 109 (48), 108 (100), 107 (45), 105 (20), 97 (21), 95 (36), 93 (52), 91 (36), 81 (27), 79 (65), 77 (30), 69 (36), 67 (76), 55 (46), 53 (21), 43 (24), 41 (80), 39 (26).
Пример 9: Получение (+)-(1'R)-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналя
Данное соединение было получено из нитрила из примера 2, аналогично примеру 8. αD (без растворителя) = +2°.
Пример 10: Получение 6-(2,2,3-триметил-циклопентил)-гекс-4-еналя
6-(2,2,3-Триметил-циклопентил)-гекс-4-еналь был получен из 6-(2,2,3-триметил-циклопентил)-гекс-4-еннитрила аналогично Примеру 8.
Продукт был получен в виде цис/транс смеси (90:10).
Цис-изомер:
1Н-ЯМР (200 МГц, CDCl3): δ 0,51 (с, 3H), 0,80 (д, 3H, J=6,7 Гц), 0,86 (с, 3H), 1,05-1,25 (м, 2Н), 1,25-1,90 (м, 5Н), 2,02-2.2,20 (м, 1H), 2,25-2,52 (м, 4Н), 5,12-5,50 (м, 2Н), 9,74 (т, 1H, J=1,5 Гц).
13С-ЯМР (50 МГц, CDCl3): δ 13,82, 14,24, 20,03, 25,60, 28,15, 29,87, 42,18, 43,74, 44,99, 50,97, 126,75, 131,28, 202,01.
Транс-изомер:
1H-ЯМР (200 МГц, CDCl3, некоторые данные): δ 0,47 (с, 3H), 0,97 (с, 3H), 9,72 (т, 1H, J=1,6 Гц).
13С-ЯМР (50 МГц, CDCl3): 12,52, 13,24, 25,13, 25,79, 27,72, 35,48, 42,09, 43,41, 45,10, 50,28, 127,16, 130,99, 201,92.
ИК (пленка, см-1): 1366 ср, 1388 ср, 1409 сл, 1453 ср, 1466 ср, 1728 сильн, 2719 ср, 2870 сильн, 2955 сильн, 3010 ср.
МС (ЭУ, интенсивность (%)): 208 (М+, 1), 193 (3), 124 (6), 111 (33), 109 (25), 95 (28), 80 (25), 79 (22), 69 (100), 67 (24), 55 (38), 41 (40).
Пример 11: Получение 4-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналя
4-Метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еналь был получен из 4-метил-6-(2,2,3-триметил-циклопент-3-енил)-гекс-4-еннитрила согласно примеру 8, в виде (60:40) цис/транс смеси.
1Н-ЯМР (200 МГц, CDCl3):
Цис-изомер: δ 0,77 (с, 3H), 0,97 (с, 3H), 1,55-1,65 (м, 3H), 1,65-1,70 (м, 3Р), 1,70-2,05 (м, 4Н), 2,05-2,25 (м, 2Н), 2,25-2,55 (м, 3H), 5,15-5,25 (м, 2Н), 9,77 (т, 1Н, J=1,7 Гц).
Транс-изомер: (некоторые данные) δ 1,57-1,60 (м, 3H), 9,74 (т, 1Н, J=1,9 Гц).
13С-ЯМР (50 МГц, CDCl3):
Цис-изомер: δ 12,57 и 19,67, 23,09, 24,28, 25,86, 28,31, 35,60, 42,25, 46,66, 50,66, 121,63, 126,41, 132,67, 148,50, 202,28.
Транс-изомер: δ 12,57 и 19,67, 16,13, 25,88, 28,45, 31,96, 35,53, 42,13, 46,66, 50,51, 121,68, 125,35, 132,74, 148,50, 202,61.
Пример 12: Получение 4-метил-6-(2,2,3-триметил-циклопентил)-гексаналя
4-Метил-6-(2,2,3-триметил-циклопентил)-гексаналь получали из 4-метил-6-(2,2,3-триметил-циклопентил)-гексаннитрила согласно примеру 8.
1Н-ЯМР (200 МГц, CDCl3): δ 0,49 (с, 3H), 0,74-0,91 (м, 6Н), 0,82 (д, 3H, J=6,7 Гц), 0,91-1,56 (м, 10Н), 1,56-1,85 (м, 4Н), 2,35-2,5 (3, 2Н), 9,78 (т, 1H, J=1,9 Гц).
13С-ЯМР (50 МГц, CDCl3): δ 13,92 и 14,42, 19,29 и 19,6, 25,71 и 25,74, 27,66 и 27,85, 28,28 и 28,42, 28,69 и 29,21, 30,17, 32,68 и 32,93, 35,8 и 36,08, 41,71 и 41,83, 42,31, 45,27, 50,95 и 51,26, 203,04.
ИК (пленка, см-1): 1365 сл, 1387 сл, 1465 ср, 1729 сильн, 2714 сл, 2869 сильн, 2931 сильн, 2955 сильн.
МС (ЭУ, интенсивность (%)): 224 (М+, 2), 207 (6), 163 (9), 110 (20), 109 (36), 95 (34), 85 (33), 84 (70), 83 (34), 81 (29), 70 (79), 69 (100), 67 (23), 57 (19), 55 (66), 43 (22), 41 (55).
Пример 13: Получение 4-этил-6-(2,2,3-триметил-циклопентил)-гексаналя
4-Этил-6-(2,2,3-триметил-циклопентил)-гексаналь получали из 4-этил-6-(2,2,3-триметил-циклопентил)-гексаннитрила согласно примеру 8. Соединение было очищено колоночной хроматографией и представляет собой (50:50) смесь изомеров.
1Н-ЯМР (200 МГц, CDCl3): δ 0,45 (с, 3H), 0,7-0,95 (м, 9Н), 0,78 (д, 3H, J=6,1 Гц), 0,95-1,35 (м, 12Н), 1,35-1,65 (м, 3H), 1,65-1,85 (м, 3H), 2,34 и 2,38 (2 тд, 2Н, J=1,7 и 1,5 Гц, J=7,8 и 7,6 Гц), 9,73 (т, 1Н, J=1,9 Гц).
13С-ЯМР (50 МГц, CDCl3): δ 10,45 и 10,77, 13,78, 14,30, 24,93 и 25,68, 25,24, 25,58, 27,19 и 27,21, 28,24, 30,03, 31,87 и 31,90, 38,55 и 38,68, 41,20 и 41,42, 42,18, 45,14, 51,07 и 51,11, 202,98.
ИК (пленка, см-1): 1051 ср, 1103 ср, 1367 ср, 1385 ср, 1461 сильн, 1728 сильн, 2715 сл, 2869 сильн, 2955 сильн.
МС (ЭУ, интенсивность (%)): 238 (М+, 1), 223(4), 209(4), 177(6), 123(8), 110(20), 109(27), 99(19), 95(27), 84(66), 83(37), 81(26), 70(79), 69(100), 67(23), 57(19), 55(81), 43(30), 41(65).
Пример 14: Получение 3-метил-6-(2,2,3-триметил-циклопентил)-гексаналя
3-Метил-6-(2,2,3-триметил-циклопентил)-гексаналь получали согласно методике примера 8 из нитрила, полученного согласно примеру 5 из 5-(2,2,3-триметил-циклопент-3-енил)-пент-3-ен-2-она (полученного из камфоленового альдегида и ацетона).
Сырой продукт очищали колоночной хроматографией.
1Н-ЯМР (200 МГц, CDCl3): δ 0,47 (с, 3H), 0,80 (д, 1H, J=6,7 Гц), 0,83 (с, 3H), 0,94 (2д, 1H, J=6,6 Гц), 1,0-1,55 (м, 10H), 1,55-1,85 (м, 2Н), 2,03 (о, 1H, J=6,5 Гц), 2,18 и 2,24 (тд, 2Н, J=2,2 Гц, J=1,1 Гц) и 2,34 и 2,42 (тд, 2Н, J=2 Гц, J=5,8 Гц), 9,74 (т, 1Н, J=2,2 Гц).
13С-ЯМР (50 МГц, CDCl3): δ 13,85, 14,31, 19,86 и 20,05, 25,63, 26,14 и 26,22, 28,12 и 28,25, 28,21, 30,12, 30,47 и 30,58, 37,28 и 37,39, 42,20, 45,19, 20,79 и 50,85, 50,99 и 51,17, 202,99 и 203,02.
ИК (пленка, см-1): 1127 сл, 1367 ср, 1384 ср, 1464 сильн, 1728 сильн, 2712 ср, 2869 сильн, 2954 сильн.
МС (ЭУ, интенсивность (%)): 224 (М+, 1), 109 (13), 95 (21), 84 (61), 83 (28), 81 (22), 70 (86), 69 (100), 67 (18), 55 (52), 43 (23), 41 (51).
Пример 15: Получение 2,4-диметил-6-(2,2,3-триметил-циклопентил)-гексаналя
Альдегид из примера 12 алкилировали метилиодидом согласно известной методике через его диизобутиленамин, полученный с диизобутиламином азеотропной отгонкой воды в толуоле в присутствии каталитического количества пара-толуолсульфокислоты.
Полученный продукт очищали колоночной хроматографией, он представляет собой смесь изомеров, 2 различимые группы в ЯМР, соотношение (60:40), каждая состоит из 2 диастереоизомеров.
Превалирующие изомеры:
1Н-ЯМР (200 МГц, CDCl3): δ 0,48 (с, 3H), 0,80 (д, 3H, J=6,7 Гц), 0,83 (с, 3H), 0,87 (д, 3H, J=6,5 Гц), 0,92-1,51 (м, 10H), 1,06 (д, 3H, J=6,9 Гц), 1,51-1,87 (м, 3H), 9,55 (д, 1H, J=1,6 Гц), 9,57 (д, 1Н, J=1,5 Гц).
13С-ЯМР (50 МГц, CDCl3): δ 13,85, 14,10 и 14,26, 14,35, 19,66 и 19,99, 25,64, 27,63, 28,20, 30,10, 30,51 и 30,95, 35,73 и 36,02, 38,17 и 38,51, 42,24, 44,13, 45,20, 50,83 и 51,17, 205,40.
Минорные изомеры:
1Н-ЯМР (200 МГц, CDCl3, некоторые данные): δ 0,88 (д, 3H, J=6,6 Гц), 1,05 (д, 3H, J=7,0 Гц), 9,59 (2 д, 1H, J=2,0 Гц).
13С-ЯМР (50 МГц, CDCl3): δ 13,24 и 13,38, 13,85, 14,35, 19,10 и 19,43, 25,68, 27,42, 28,34, 30,10, 30,41 и 30,60, 36,40 и 36,67, 37,33 и 37,92, 42,24, 44,23, 45,20, 50,88 и 51,14, 205,35.
ИК (пленка, см-1): 1367 сл, 1380 сл, 1464 ср, 1709 ср, 1729 сильн, 2704 сл, 2870 сильн, 2956 сильн.
МС (ЭУ, интенсивность (%)): 238 (М+)