Аналог альфа-конотоксина pnia, обладающий высоким сродством и селективностью к ацетилхолин-связывающему белку из aplysia californica
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии, а именно к новому аналогу альфа-конотоксина PnIA, обладающему высоким сродством и селективностью к ацетилхолин-связывающему белку (АХСБ) из Aplysia californica. Пептид имеет аминокислотную последовательность: GCCSHPPCAANNPDYC-NH2 (SEQ ID NO:1) и содержит две внутримолекулярные дисульфидные связи между Cys2 и Cys8, Cys3 и Cys16. Предложенное изобретение позволяет расширить ассортимент веществ, являющихся конкурентными антагонистами никотиновых ацетилхолиновых рецепторов (нАХР). 3 ил., 1 табл., 3 пр.
Реферат
Изобретение относится к биохимии, а именно к новому пептидному соединению, обладающему высоким сродством и селективностью к ацетилхолин-связывающему белку из Aplysia californica и имеющему следующую аминокислотную последовательность: GCCSHPPCAANNPDYC-NH2 (SEQ ID NO:1), а также его радиоактивному [125I]-меченному производному. Более конкретно данное изобретение относится к применению соединений SEQ ID NO:1 в биохимии и медицине.
В начале 80-х годов прошлого века из яда одного из морских моллюсков семейства Conus были выделены первые токсические пептидные соединения, названные впоследствии альфа-конотоксинами, которые блокировали нервно-мышечную передачу [Gray et al. (1981) J. Biol. Chem. 256: 4734-4740]. Они были быстро охарактеризованы как эффективные конкурентные антагонисты нАХР (никотиновый ацетилхолиновый рецептор) мышечного типа. К настоящему времени из более чем 500 видов Conus выделены сотни разнообразных биологически активных соединений пептидной природы. Среди них - многочисленные представители конотоксинов разных классов (альфа, мю, кара, омега, дельта и др.), которые действуют на самые разные рецепторы, ионные каналы, транспортеры [Terlau et al. (2004) Physiol. Rev. 84: 41-68; Armishaw et al. (2005) Curr. Protein Pept. Sci. 6: 221-240; Norton et al. (2006) Toxicon 48: 780-798; Davis et al. (2009) Peptides 30: 1222-1227]. Только альфа-конотоксинов (небольших пептидов из 12-22 аминокислотных остатков (а.о.) с характерным расположением остатков цистеина вдоль аминокислотной цепи, замкнутых в две дисульфидные связи), которые являются эффективными блокаторами разных подтипов нАХР, известно на сегодняшний день уже более трех десятков. Сегодня они - один из наиболее востребованных инструментов фармакологического и структурного исследования холинорецепторов [Kasheverov et al. (2009) Curr. Pharm. Des. 15: 2430-2452]. В качестве инструмента изучения нАХР альфа-конотоксины обладают (по сравнению с традиционно использовавшимися альфа-нейротоксинами из яда змей [Tsetlin (1999) Eur. J. Biochem. 264: 281-286; Tsetlin et al (2004) FEBS Lett. 557: 9-13]) двумя неоспоримьми преимуществами. Первое из них - это разнообразие в специфичности их разных представителей к разным типам нАХР. Второе преимущество - небольшие размеры (в 5-6 раз меньшие, чем альфа-нейротоксины), позволяющие достаточно просто синтезировать альфа-конотоксины и их разнообразные аналоги методом твердофазного пептидного синтеза.
Структурно-функциональные исследования нАХР насчитывают уже несколько десятилетий (см., например, обзор [Hucho et al (1996) Eur. J. Biochem. 239: 539-557]), в результате чего известна достаточно разрешенная пространственная структура рецептора из электрического органа ската Torpedo [Unwin (2005) J. Mol. Biol. 346: 967-989]. Вторая волна интереса к холинорецепторам была вызвана открытием того факта, что нарушение нормального функционирования определенных подтипов нАХР вызывает или является следствием ряда мышечных или психических заболеваний, таких как болезнь Альцгеймера или Паркинсона [Olivera et al. (2008) Channels 2: 143-152; Vincent et al. (2000) Eur. J. Biochem. 267: 6717-6728; Steinlein (2004) Prog. Brain Res. 145: 275-285; O'Neill et al. (2002) Curr. Drug Targets CNS Neurol. Disord. 1: 399-411]. Это диктует необходимость поиска или создания новых лигандов, эффективно и избирательно действующих на определенный подтип нАХР с целью создания новых лекарств или маркеров этих типов рецептора. Для создания таких лигандов нужно знать детальное устройство лигнд-связывающего участка. Общей пространственной структуры нАХР для этого недостаточно, однако на сегодня мы располагаем другими возможностями для характеристики лиганд-связывающих сайтов.
Толчком к дальнейшему развитию в этом направлении явилось открытие АХСБ (ацетилхолин-связывающий белок) из прудовика Lymnaea stagnalis, который представляет собой водорастворимый белок, образующий в активной форме пентамер и структурно гомологичный N-концевому лиганд-связывающему домену всех природных нАХР [Brejc et al. (2001) Nature 411: 269-276]. Кроме того, данный АХСБ проявлял также фармакологические свойства, сходные со свойствами некоторых подтипов нейрональных нАХР [Smit et al. (2001) Nature 411: 261-268]. Позднее были выделены и закристаллизованы АХСБ из двух других видов моллюсков - Aplysia californica [Hansen et al. (2004) J. Biol. Chem. 279: 24197-24202] и Bulinus truncatus [Celie et al. (2005) J. Biol. Chem. 280: 26457-26466]. К настоящему времени получены высоко разрешенные структуры комплексов этих белков с различными лигандами [Celie et al. (2004) Neuron 41: 907-914; Hansen et al. (2005) EMBO J. 24: 3635-3646; Bourne et al. (2005) EMBO J. 24: 1512-1522], в том числе и рядом альфа-конотоксинов [Celie et al. (2005) Nat. Struct. Mol. Biol. 12: 582-588; Ulens et al. (2006) Proc. Natl. Acad. Sci. USA 103: 3615-3620; Dutertre et al. (2007) EMBO J. 26: 3858-3867]. На основе этих структур в настоящее время получены многочисленные компьютерные модели нАХР различных типов [Sgrignani et al. (2009) J. Comp. Chem. 30: 2443-2454; Parthibanet al. (2009) J. Biomol. Struct. Dyn. 26: 535-547; Pérez et al. (2009) Bioorg. Med. Chem. Lett. 19: 251-254] и проводятся поиски и конструирование новых холинергических лигандов, высоко эффективных и селективных для определенных подтипов рецептора. Каждая новая кристаллическая структура АХСБ с тем или иным лигандом позволяет получить более достоверную картину организации лиганд-связывающих участков различных природных нАХР.
Однако успешным структурно-функциональным исследованиям и нАХР и АХСБ с помощью альфа-конотоксинов во многом мешает их недостаточная эффективность и особенно селективность по отношению к разным подтипам рецепторов и белкам из разных видов моллюсков. До сих пор сохраняется необходимость в селективном к гомомерным альфа7 холинорецепторам и при этом высокоактивном альфа-конотоксине; нет аффинных лигандов для альфа3бета4 нАХР и практически отсутствуют пептиды, которые мощно и специфически взаимодействовали бы с основным типом холинорецепторов, представленных в мозге - альфа4бета2; также отсутствуют пептиды надежно различающие АХСБ из Aplysia californica и Lymnaea stagnalis. Все это диктует необходимость не только в расширении поиска новых пептидных соединений в яде моллюсков Conus, но и в создании на основе уже известных альфа-конотоксинов аналогов с заданными свойствами.
Уже с момента выделения первых альфа-конотоксинов были начаты работы по созданию их различных аналогов и к настоящему времени в литературе описаны сотни подобных пептидных лигандов (структуры большей части представлены в обзорах [Kasheverov et al. (2009) Curr. Pharm. Des. 15: 2430-2452; Кашеверов и др. (2009) Успехи биол. химии 49: 275-318]), созданные с целью решения различных научных задач. Бóльшая часть информации о значимости того или иного а.о. в структуре альфа-конотоксина, определяющего его эффективность и специфичность, была получена из работ, в которых синтезировались и исследовались аналоги, содержащие единичные или множественные замены различных а.о. (так называемый «мутагенез» альфа-конотоксинов). Для альфа-конотоксинов MI, RgIA, Vc1.1, GID, ImI, PnIA, PnIB и MII в серии работ была проведена полная замена всех а.о. за исключением дисульфид формирующих а.о. цистеинов, в том числе и на аланины (часто используемый в белково-пептидных исследованиях так называемый «аланин-сканирующий мутагенез») [Jacobsen et al. (1999) Biochemistry 38: 13310-13315; Ellison et al. (2008) J. Mol. Biol. 377: 1216-1227; Halai et al. (2009) J. Biol. Chem. 284: 20275-20284; Millard et al. (2009) J. Biol. Chem. 284: 4944-4951; Servent et al. (1998) J. Physiol. Paris 92: 107-111; Hogg et al. (2003) J. Biol. Chem. 278: 26908-26914; Everhart et al. (2004) Biochemistry 43: 2732-2737]. Как результат, определенный прогресс был достигнут в последнее время в создании новых аналогов альфа-конотоксинов, которые обладают более высоким сродством или специфичностью к определенному подтипу нАХР по сравнению с природными соединениями. Наиболее успешными примерами создания таких «узкоспециализированных» лигандов для конкретных подтипов холинорецепторов на сегодня следует признать получение серии аналогов альфа-конотоксинов МП и ArIB. Введением в последовательность первого пептида одиночных, двойных и даже тройных замен нескольких а.о. на аланин удалось получить самый мощный на сегодня антагонист альфа6альфа3бета2бета3 нАХР - MII[А11] [McIntosh et al. (2004) Mol. Pharmacol. 65: 944-952; Bordia et al. (2007) Mol. Pharmacol. 72: 52-61], а также соединения (MII [А9, A15] и MII [А4, A11, A15]), более чем на три порядка, различающиеся по сродству к родственным подтипам рецептора, содержащим альфа6- и альфа3-субъединицы [McIntosh et al. (2004) Mol. Pharmacol. 65: 944-952; Azam et al. (2008) J. Biol. Chem. 283: 11625-11632]. Перспективность введения аминокислотных замен была наглядно продемонстрирована в случае с альфа-конотоксином ArIB, когда из «полиспецифичного» пептида были получены эффективные и высокоспецифичные к альфа7 нАХР лиганды - ArIB [L11, A16] и ArIB [L11, D16] [Whiteaker et al. (2007) Biochemistry 46: 6628-6638].
Значительно меньше в литературе представлено данных о получении и использовании радиоактивно меченных производных альфа-конотоксинов и их аналогов. Известно применение радиоактивных форм (третированных или [125I]иодированных) альфа-конотоксинов MI и GI, которые служат эффективной заменой широко применяемому коммерческому [125I]-альфа-бунгаротоксину при работе с нАХР мышечного типа [Kasheverov et al. (2006) FEBS J. 273: 4470-4481; Luo et al. (2004) Biochemistry 43: 6656-6662; Myers et al. (1991) Biochemistry 30: 9370-9377; Kasheverov et al. (2001) Eur. J. Biochem. 268: 3664-3673; Sugiyama et al. (1998) Mol. Pharmacol. 53: 787-794; Золотарев и др. (2000) Биоорган, химия 26: 587-592]. Известно получение радиоактивной формы альфа-конотоксина ArIB [L11, А16] - мощного антагониста альфа7 нАХР [Whiteaker et al. (2008) J. Pharmacol. Exp. Ther. 325: 910-919]. Широкое применение среди радиоактивно меченных альфа-конотоксинов нашел [125I]иодированный аналог альфа-конотоксина МП, который активно используется для детектирования подтипов нАХР, содержащих альфа6 и/или альфа3 субъединицы, на самых разных клеточных и тканевых препаратах и срезах (см., например, [Cut et al. (2003) J. Neurosci. 23: 11045-11053; Whiteaker et al. (2000) Mol. Pharmacol. 57: 913-925; Champtiaux et al. (2002) J. Neurosci. 22: 1208-1217; Salminen et al. (2005) Neuropharmacology 48: 696-705; Doura et al. (2008) Brain Res. 1215: 40-52]).
Известно, что введением мутаций в альфа-конотоксины можно добиться получения аналогов более эффективных по отношению не только к разным нАХР (см. выше), но и к разным АХСБ [Celie et al. (2005) Nat. Struct. Mol. Biol. 12: 582-588; Кашеверов и др. (2009). Успехи биол. химии 49: 275-318]. В то же время способность АХСБ эффективно связывать некоторые альфа-конотоксины дает основание к использованию этих белков для скринирования ядов Conus на предмет поиска новых пептидных лигандов нАХР. Первым удачным примером такого рода стало обнаружение с помощью АХСБ из L. stagnalis и выделение из яда С.textile нового альфа-конотоксина TxIA [Dutertre et al. (2007) EMBO J. 26: 3858-3867]. Он (а также его TxIA[L10] аналог) оказались первыми пептидами, для которого эффективность взаимодействия с АХСБ была выше, чем с нАХР, среди которых наибольшим было сродство к α3β2 типу [Dutertre et al. (2007) EMBO J. 26: 3858-3867]. Данный пример является убедительным доказательством необходимости дальнейших работ по характеристике АХСБ и поиску соединений, обладающих высоким сродством к АХСБ определенного вида моллюска.
Наиболее близкими к заявляемому пептиду являются аналоги альфа-конотоксина PnIA - PnIA [L10] и PnIA [L10, K14] [Celie et al. (2005) Nat. Struct. Mol. Biol. 12: 582-588; Кашеверов и др. (2009). Успехи биол. химии 49: 275-318]. Однако указанные аналоги обладают как минимум на порядок меньшей активностью при связывании с АХСБ из А. californica чем патентуемое соединение. Кроме того, ни один указанный аналог не проявляет специфичности по отношению к двум разным АХСБ в отличие от патентуемого соединения.
Задачей настоящего изобретения является расширение ассортимента лигандов высокоспецифичных для ацетилхолин-связывающих белков (АХСБ).
Поставленная задача решается за счет структуры аналога альфа-конотоксина PnIA - пептида PnIA [Н5], имеющего следующую аминокислотную последовательность: GCCSHPPCAANNPDYC-NH2, содержащего две внутримолекулярные дисульфидные связи между Cys2 и Cys8, Cys3 и Cys16 и амидированный С-концевой цистеин 16. Пептид PnIA[Н5] имеет соответствующую заявляемой структуре молекулярную массу 1646.74 Да Заявляемый пептид (SEQ ID NO:1) представляет собой новое соединение, ранее не описанное в научно-технической и патентной литературе.
Сущность изобретения заключается в проявлении пептидом PnIA[Н5] высокого сродства и исключительной селективности к АХСБ из морского моллюска Aplysia californica. В конкуренции с радиоактивно меченным альфа-бунгаротоксином ((125-I)-Bgt) за связывание с этим белком PnIA[Н5] показал сродство, равное IC50=3.1±0.4 нМ (концентрация препарата, вызывающая 50% ингибирование специфического связывания радиолиганда с рецепторами). Сродство к другому АХСБ из прудовика Lymnaea stagnalis было в 70 раз хуже: IC50=220±80 нМ. Наиболее близкий по структуре PnIA[L10] аналог показал в том же тесте почти в 20 раз меньшее сродство к АХСБ из A. californica (IC50=55±12 нМ) и примерно такое же к АХСБ из L. stagnalis (IC50=200±40 нМ).
Другим аспектом изобретения является возможность получения из заявленного пептида PnIA[Н5] его радиоактивного (125-1)-меченного производного - PnIA[H5, Y15(125-I)] (SEQ ID NO:1). Данное производное получают химической модификацией в присутствии хлорамина Т и выделяют в индивидуальном виде с помощью ВЭЖХ (высокоэффективная жидкостная хроматография). В качестве побочного продукта подобной реакции получают и выделяют в индивидуальном виде ди-(125-I)-меченное производное - PnIA[H5, Y15(125-I)2]. Молекулярные массы обоих соединений, полученных в одинаковых условиях с применением нерадиоактивного изотопа 127-I йода, подтверждены MALDI (матрично-активированная лазерная десорбция/ионизация) масс-спектрометрией и составили 1772.42 Да и 1898.45 Да для моно- и ди-(127-I)-меченных пептидов, соответственно.
Следующим аспектом изобретения является способность PnIA[H5, Y15(125-I)] (SEQ ID NO:1) с высоким сродством напрямую связываться с АХСБ из A. californica и таким образом использоваться в качестве его эффективного и специфического маркера. Константа диссоциации такого взаимодействия составила KD=0.48±0.20 нМ. Фармакологическая характеристика взаимодействия PnIA[H5, Y15(125-I)] с АХСБ из A. californica оказалась близка таковой для (125-I)-Bgt. Наиболее эффективно вытесняли PnIA[H5, Y15(125-I)] сам пептид PnIA[Н5] и его наиболее близкий аналог PnIA[L10] (IC50=4.2±0.3 нМ и 9.5±1.1 нМ, соответственно), значительно менее эффективно - альфа-бунгаротоксин (IC50=60±10 нМ) и практически не вытеснял альфа-конотоксин GI, действующий на нАХР мышечного типа (IC>>1000 нМ). В случае с (125-I)-Bgt соответствующие значения IC50 составили: 3.1±0.4, 55±12, 130±20 и 25500±6300 нМ.
Техническим результатом заявляемого изобретения является получение нового пептидного соединения (SEQ ID NO:1) и его радиоактивного производного (SEQ ID NO:1), высокая эффективность взаимодействия и исключительная селективность обоих пептидов для АХСБ из A. californica и возможность их использования в качестве маркеров как для АХСБ, так и некоторых подтипов нАХР.
Изобретение иллюстрируют рисунки:
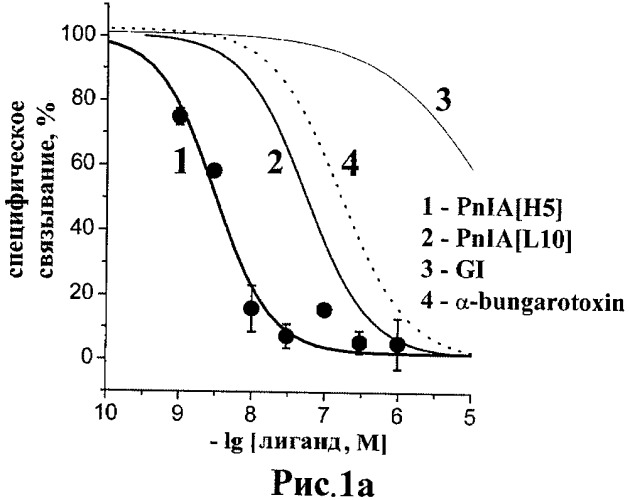
Рис.1а и 1б. Кривые ингибирования специфического связывания [125-I]-Bgt с АХСБ из A. californica (рис.1a) и с АХСБ из L. stagnalis (рис.1б) для пептида PnIA[H5] (SEQ ID NO:1) и веществ сравнения;
Рис.2. Кривая специфического связывания PnIA[H5, Y15(125-I)] с АХСБ из А. californica;
Рис.3. Кривые ингибирования специфического связывания PnIA[Н5, Y15(125-I)] с АХСБ из A. californica для пептида PnIA[H5] (SEQ ID NO:1) и веществ сравнения.
Примеры осуществления изобретения.
Пример 1. Синтез PnIA[H5] (SEQ ID NO:1).
Присоединение первой аминокислоты. Получение Fmoc-Cys(Trt)-P (Fmoc = 9-флуоренилметилоксикарбонил).
400 мг N-[(9Н-флуорен-9-илметокси)карбонил]-2,4-диметокси-4-(карбоксиметилокси)-бензгидриламин аминометил полимера (полимер Ринка), с содержанием гидроксильных групп 0,55 ммоль/г, промывают диметилформамидом, затем в течение 20 мин обрабатывают 20%-ным раствором пиперидина в диметилформамиде. Полимер промывают последовательно 5 мл следующих растворителей: диметилформамидом - 3 раза по 2 мин, смесью диоксан-вода (2:1) - 2 раза по 5 мин, диметилформамидом - 5 раз по 2 мин. В 5 мл диметилформамида растворяют 644 мг (1,1 ммоль) Fmoc-Cys(Trt)-OH, 150 мг (1,1 ммоль) 1-гидроксибензотриазола, и 172 мкл (1,1 ммоль) NN'-диизопропилкарбодиимида, раствор перемешивают 10 мин при 0°С и затем приливают к полимеру. Реакцию проводят 4 часа при периодическом перемешивании. По окончании реакции полимер отфильтровывают, промывают диметилформамидом и обрабатывают 5 мл смеси Ac2O-пиридин-CH2Cl2 (20:20:60) в течение 1 ч, после чего полимер промывают изопропанолом и диметилформамидом.
Пример одного синтетического цикла.
Получение Fmoc-Tyr(tBu)-Cys(Trt)-P(VII):
а) Полученный на предыдущем этапе пептидил-полимер в течение 20 мин обрабатывают 20%-ным раствором пиперидина в диметилформамиде. Полимер промывают последовательно 5 мл следующих растворителей: диметилформамидом - 3 раза по 2 мин, смесью диоксан-вода (2:1) - 2 раза по 5 мин, диметилформамидом - 5 раз по 2 мин.
б) В 5 мл диметилформамида растворяют 505 мг (1,1 ммоль) Fmoc-Tyr(tBu)-OH, 150 мг (1,1 ммоль) 1-гидроксибензотриазола, и 172 мкл (1,1 ммоль) NN'-диизопропилкарбодиимида, раствор перемешивают 10 мин при 0°С и затем приливают к суспендированному полимеру. Реакцию проводят 4 часа при периодическом перемешивании. По окончании реакции полимер отфильтровывают, промывают диметилформамидом и обрабатывают 5 мл смеси Ас2О-пиридин-диметилформамид (20:20:60) в течение 1 ч, после чего полимер последовательно промывают диметилформамидом, изопропанолом, диметилформамидом.
Синтез полипептидной цепи проводят вручную в стеклянном проточном реакторе (2×20 см) по следующему протоколу для каждого синтетического цикла (из расчета 8-10 мл растворителя на 400 мг исходного полимера), при проведении реакции конденсации (операция 6) используют объем реакционной смеси 5-7 мл:
1. ДМФА (диметилформамид) (5×2 мин);
2. 20% пиперидин в ДМФА (20 мин);
3. ДМФА (3×2 мин);
4. Диоксан-вода, 2:1, (2×5 мин);
5. ДМФА (5×2 мин);
6. Реакция конденсации: 5 экв. активированной Fmoc-аминокислоты (4 ч);
7. ДМФА (3×2 мин);
8. Ацилирование: Ас2О-пиридин-диметилформамид, 20:20:60, (1 ч);
9. ДМФА (3×2 мин);
10. Изопропанол (3×2 мин).
Для активации Fmoc-производных аминокислот DIPCDI/HOBT (N,N'-диизопропилкарбодиимид/1-гидроксибензотриазол)-методом к раствору 5 экв. (1.1 ммоль) Fmoc-защищенной аминокислоты и 150 мг (5 экв., 1.1 ммоль) HOBt в 3-4 мл ДМФА добавляют 170 мкл (5 экв., 1.1 ммоль) DIPCDI, раствор перемешивают 10 мин.
Полноту протекания реакции конденсации контролируют с помощью нингидринового или, в случае N-концевого пролина, изатинового тестов после операции 6 синтетического протокола.
Для синтеза были использованы следующие производные аминокислот: Fmoc-Gly-ОН, Fmoc-Cys(Trt)-OH (для присоединения остатков Cys3 и Cys16), Fmoc-Cys(tBu)-OH (для присоединения остатков Cys2 и Cys8), Fmoc-Ser(tBu)-OH, Fmoc-His(Trt)-OH, Fmoc- Pro-OH, Fmoc-Ala-OH, Fmoc-Asn-OH, Fmoc-Asp(tBu)-OH, Fmoc-Tyr(tBu)-OH.
Отщепление продукта и замыкание дисульфидов.
Для реакции отщепления пептида от полимера и одновременного деблокирования защитных групп боковых цепей аминокислот отбирают 800 мг пептидил-полимера. К пептидил-полимеру приливают 15 мл смеси ТФУ (трифторуксусная кислота)-Н2О в объемном соотношении 97.5:2.5, суспензию перемешивают в течение 2 ч, затем полученный раствор пептида отфильтровывают от полимера, промывают 5 мл ТФУ и избыток ТФУ упаривают при пониженном давлении. Пептид осаждают 100 мл этилового эфира, отфильтровывают и промывают эфиром (5×20 мл). Осадок растворяют в 5 мл 10% уксусной кислоты 20 мин, отфильтровывают и промывают 5 мл 10% уксусной кислоты. Полученный раствор пептида лиофилизируют и обессоливают на колонке (2,5×60 см) с Сефадексом G-10 в 0.1М уксусной кислоте. Очистку пептида проводят с помощью обращенно-фазной ВЭЖХ в градиенте ацетонитрила (от 10% до 70% за 60 мин) в 0.1% ТФУ при расходе элюента 4 мл/мин, поглощение элюата регистрируют при длине волны 226 нм. Фракции, соответствующие основному пику на хроматограмме, собирают и лиофилизируют. Выход пептида GC(tBu)CSHPPC(tBu)AANNPDYC-NH2 в расчете на С-концевую аминокислоту составляет 70%. Время удерживания пептида в условиях аналитической ВЭЖХ составляет 15,1 мин. Экспериментальная молекулярная масса 1759.2, теоретическая молекулярная масса 1759.8.
Пептид растворяют в 50% ацетонитриле в концентрации 0,5 мг/мл и устанавливают рН раствора до 8,5 с помощью диизопропилэтиламина. Реакционную смесь оставляют при перемешивании на 30 часов. Полноту протекания реакции проверяют с помощью теста Эллмана. После завершения реакции рН раствора доводят до 5 с помощью уксусной кислоты и лиофилизируют. Пептид очищают с помощью препаративной обращенно-фазной ВЭЖХ. Выход пептида GC(tBu)CSHPPC(tBu)AANNPDYC-NH2 содержащего дисульфидную связь в положении Cys3/Cys16 в расчете на этап окисления составляет 45%. Время удерживания пептида в условиях аналитической ВЭЖХ составляет 14,8 мин. Экспериментальная молекулярная масса 1757.6, теоретическая молекулярная масса 1757.3.
Для замыкания второй дисульфидной связи пептид растворяют в ТФУ в концентрации 1 мг/мл, затем при перемешивании добавляют дифенилсульфоксид (10 экв.), метилтрихлорсилан (150 экв.) и анизол (100 экв.). Смесь оставляют при перемешивании на 15 мин при температуре 0°С, затем выливают в холодный диэтиловый эфир в объемном соотношении ТФУ-эфир 1:10. Пептид трижды экстрагируют водой. Затем водную фракцию отделяют на делительной воронке и лиофилизируют. Очистку пептида проводят с помощью обращенно-фазовой ВЭЖХ в градиенте ацетонитрила. Время удерживания пептида в условиях аналитической ВЭЖХ составляет 14,3 мин. Экспериментальная молекулярная масса 1646.6, теоретическая молекулярная масса 1646.7.
Пример 2. Синтез радиоактивного производного PnIA[Н5, Y15(125-I)] (SEQ ID NO:1).
Отработка условий синтеза и подтверждение структуры с помощью MALDI масс-спектрометрии йодированных производных PnIA[Н5] проводят с использованием нерадиоактивного изотопа 127-I:
к 3.6 наномолям PnIA[Н5], растворенных в 15 мкл 125 мМ натрий-фосфатного буфера (рН 7.2), добавляли 2.5 наномолей раствора йодида натрия (3.8 мкл в том же буфере) и 44 наномоля водного раствора хлорамина Т (1.2 мкл). Реакционную смесь перемешивают и оставляют на 15 мин при комнатной температуре. Продукты реакции разделяют на колонке Reprosil Gig AQ (5µ; 150×4 мм) в градиенте водного ацетонитрила (от 15% до 35% за 40 мин) в присутствии 0.1% ТФУ при скорости элюции 0.5 мл/мин. Предварительными контрольными заколами в тех же условиях служат 1) аликвота исходного пептида и 2) буферная смесь с йодидом натрия и хлорамином Т без пептида. В результате, два пика новых продуктов, присутствующих в реакционной смеси и отсутствующих в контрольных заколах собирают и анализируют с помощью MALDI масс-спектрометрии. Молекулярные массы первого и второго пиков соответствуют моно- и ди-иодированным производным PnIA[Н5].
По тому же протоколу проводят получение радиоактивных производных PnIA[Н5] с использованием раствора [125-I]йодида натрия:
80 пикомолей PnIA[Н5] смешивают с 65 пикомолями [125-I]йодида натрия в 19 мкл 125 мМ натрий-фосфатного буфера (рН 7.2) с добавлением 4.4 наномолей водного раствора хлорамина Т (1 мкл). Реакционную смесь перемешивают и инкубируют 15 мин при комнатной температуре. Продукты реакции разделяют в вышеприведенных условиях и собирают в коллектор по 0.5 мин на фракцию. Аликвоты фракций просчитывают на γ-счетчике и по результатам полученной радиограммы собирают основной продукт PnIA[Н5, Y15(125-I)] (SEQ ID NO:1) с примерной удельной радиоакивностью 2000 Ки/ммоль, соответствующий по времени выхода первому пику (см. выше), и дополнительное ди-(125-1)-производное с примерной удельной радиоакивностью 4000 Ки/ммоль, соответствующее второму пику. Собранные радиоактивные фракции для удаления ацетонитрила упаривают на 50% объема в присутствии аликвот стоковых растворов Трис-HCl буфера, рН 7.5, и БСА (бычий сывороточный альбумин) из расчета их примерной конечной концентрации в упаренных фракциях 50 мМ Трис-HCl буфера и 0.1 мг/мл БСА.
Пример 3. Функциональная характеристика PnIA[Н5] и PnIA[H5, Y15(125-I)] по связыванию с некоторыми АХСБ и нАХР.
Функциональную активность PnIA[H5] (SEQ ID NO:1) оценивают по его способности конкурировать с радиоактивным альфа-бунгаротоксином ((125-I)-Bgt) за связывание с АХСБ из Aplysia californica и Lymnaea stagnalis, а также альфа7 нАХР человека, трансфецированного в клеточной линии GH4C1 крысы. Связывание различных концентраций пептида с белками проводят в 50 мкл буфера А (фосфатно-солевой буфер (PBS), рН 7.5, содержащий 0.7 мг/мл БСА и 0.05% Твин-20) в течение 2 ч при комнатной температуре. Конечная концентрация АХСБ из A. californica и L. stagnalis в реакционной смеси составляет, соответственно, 140 и 2.4 нМ. После этого к смеси добавляют (125-I)-Bgt в конечной концентрации 0.3 и 0.1 нМ, соответственно, и дополнительно инкубируют 30 мин при комнатной температуре. Удаление несвязавшегося с АХСБ радиолиганда осуществляют быстрой промывкой на вакуумной фильтровальной системе через двойные бумажные ионообменные фильтры DE-81 фирмы Whatman, замоченные предварительно в буфере А, 3 раза по 3 мл буфером А. Уровень неспецифической сорбции радиолиганда оценивают, проводя вышеизложенное связывание в присутствии 2 мкМ альфа-кобратоксина (аналога альфа-бунгаротоксина).
Тестирование на клетках GI4C1 проводят в 50 мкл 20 мМ Трис-HCl буфера, рН 8.0, содержащего 1 мг/мл БСА. Общее количество клеточного белка в реакционной смеси составляет 6.5 мкг, а конечная концентрация токсин-связывающих участков альфа7 нАХР - 0.4 нМ. Связывание различных концентраций пептида с клетками проводят в течение 2.5 ч при комнатной температуре и постоянном перемешивании, после чего к смеси добавляют (125-I)-Bgt до конечной концентрации 0.2 нМ на 5 мин. Удаление несвязавшегося радиолиганда осуществляют быстрой фильтрацией (3 раза по 3 мл 20 мМ Трис-HCl буфера, рН 8.0, содержащего 0.1 мг/мл БСА) через стеклянные фильтры GF/F фирмы Whatman, замоченные предварительно в течение 3 ч в 0.25% полиэтиленимине. Перед нанесением на фильтр реакционной смеси его промывают 3 мл указанного выше буфера. Уровень неспецифической сорбции радиолиганда оценивают, проводя вышеизложенное связывание в присутствии 2 мкМ альфа-кобратоксина.
Анализ конкурентного связывания и построение кривых ингибирования осуществляют с использованием программы ORIGIN 7.5 (OriginLab Corporation) для одно-сайтовой модели по уравнению: % связывания=100/{1+([пептид]/IC50)n}, где IC50 - концентрации пептида, вызывающей 50% ингибирование специфического связывания радиолиганда с мишенями, a n - коэффициент Хилла.
На Рисунках 1а и 1б представлены полученные кривые ингибирования специфического связывания (125-I)-Bgt с АХСБ из Aplysia californica и Lymnaea stagnalis, соответственно, для патентуемого пептида PnIA[H5] (SEQ ID NO:1), а в качестве сравнения и с его наиболее близким по структуре PnIA[L10] аналогом, альфа-конотоксином GI, действующим на мышечный тип нАХР, и альфа-бунгаротоксином.
Эффективность взаимодействия указанных соединений, выраженная в виде значений IC50, представлена в Таблице 1, где также приведены данные сродства этих соединений для альфа7 нАХР человека, трансфецированного в клеточной линии GH4C1 крысы, полученные в аналогичном тесте конкурентного радиолигандного анализа.
| Таблица 1 | |||
| Соединение | Сродство (IC50, нМ) в конкуренции с (125-I)-Bgt на… | ||
| L. stagnalis АХСБ | A. californica АХСБ | альфа7 нАХР человека | |
| альфа-конотоксин PnIA[H5] (SEQ ID NO:1) | 220±80 | 3.1±0.4 | 26000±1000 |
| альфа-конотоксин PnIA[L10] | 200±40 | 55±12 | 14000±1000 |
| альфа-конотоксин GI | 40000±7000 | 25500±6300 | >100000 |
| альфа-бунгаротоксин | 2.2±0.3 | 130±20 | 3.0±0.5 |
Равновесное связывание PnIA[H5, Y15(125-I)] (SEQ ID NO:1) с АХСБ из Aplysia californica проводят в 50 мкл буфера А (см. выше) в течение 2 ч при комнатной температуре. Для получения параметров специфического связывания различные концентрации радиолиганда (от 0.1 до 2.8 нМ) инкубируют с 2.3 нМ конечной концентрации АХСБ из A. californica. Уровень неспецифического связывания определяют пре-инкубацией в течение 1 ч АХСБ с 3.8 мкМ альфа-кобратоксина. Удаление несвязавшегося с АХСБ PnIA[H5, Y15(125-I)] осуществляют быстрой промывкой на вакуумной фильтровальной системе через двойные бумажные ионообменные фильтры DE-81 фирмы Whatman, как описано выше.
Анализ равновесного связывания осуществляют с использованием программы ORIGIN 7.5 (OriginLab Corporation) для одно-сайтовой модели по уравнению: В(х)=Bmax/(1+KD/x), где В(х) - концентрация специфически связанного радиолиганда, х - свободная концентрация радиолиганда (полученная вычитанием из добавленного в реакционную смесь количества радиолиганда, связавшегося с фильтрами и сорбировавшегося на стенках пробирки), Bmax - максимальное количество специфически связанного радиолиганда, a KD - константа диссоциации.
Полученная кривая связывания PnIA[H5, Y15(125-I)] (SEQ ID NO:1) с АХСБ из Aplysia californica представлена на Рисунке 2, а соответствующее значение KD составило 0.48±0.20 нМ, указывая на сохранение высокого сродства к данному белку патентуемого радиоактивного производного. Отсутствие в наномолярном диапазоне концентраций специфического связывания PnIA[H5, Y15(125-I)] (SEQ ID NO:1) с АХСБ из Lymnaea stagnalis свидетельствует о сохранении у патентуемого соединения исключительной селективности к белку из Aplysia californica.
Конкурентный радиолигандный анализ с использованием PnIA[H5, Y15(125-I)] (SEQ ID NO:1) в качестве радиолиганда проводят на АХСБ из Aplysia californica в 50 мкл буфера А (см. выше). Инкубация различных концентраций PnIA[H5] (SEQ ID NO:1), а также PnIA[L10] аналога, альфа-конотоксина GI и альфа-бунгаротоксина с белком (2.3 нМ) длилась 90-100 мин при комнатной температуре, после чего к смеси добавляют 0.6-1.0 нМ PnIA[H5, Y15(125-I)] (SEQ ID NO:1) и дополнительно инкубируют 60-75 мин при комнатной температуре. Уровень неспецифического связывания определяют в присутствии 3.8 мкМ альфа-кобратоксина. Удаление несвязавшегося с АХСБ радиолиганда и анализ конкурентного связывания осуществляют аналогично опытам с применением (125-I)-Bgt (см. выше).
Полученные результаты радиолигандного анализа с использованием PnIA[Н5, Y 15(125-I)] (SEQ ID NO:1) в качестве радиолиганда представлены на Рисунке 3. Соответствующие расчетные значения ICso для PnIA[H5] (SEQ ID NO:1), PnIA[L10], альфа-конотоксина GI и альфа-бунгаротоксина составляют 4.2±0.3, 9.5±1.1, >>1000 и 60±10 нМ, соответственно.
Полученный профиль сродства использованных лигандов в конкуренции с патентуемым соединением PnIA[H5, Y15(125-I)] (SEQ ID NO:1) очень близок к таковому в конкуренции тех же вытеснителей с (125-I)-Bgt (см. Рисунок 1а и Таблицу 1).
Пептид, имеющий высокое сродство и селективность к ацетилхолин-связывающему белку из Aplysia californica и состоящий из аминокислот по следующей формуле SEQ ID NO:1:Glyl-Cys2-Cys3-Ser4-His5-Pro6-Pro7-Cys8-Ala9-Ala10-Asn11-Asn12-Pro13-Asp14-X15-Cys16-NH2, с дисульфидными связями между Cys2 и Cys8, Cys3 и Cys16, где Х - Tyr или (125-I)Tyr.