Выделенный пептид для усиления ранозаживляющей активности кератиноцитов, композиция для заживления ран у млекопитающего и лекарственное средство для применения при заживлении ран у млекопитающего
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению пептидов, обладающих ранозаживляющей активностью, и может быть использовано в медицине. Получают пептиды, имеющие от четырех до четырнадцати остатков, которые представляют собой короткие фрагменты пептида НВ-107 (SEQ ID NO:1), который сам по себе является фрагментом антибактериального белка цекропина В и проявляет стимулирующее, миграционное и противовоспалительное свойства в отношении клетки. Использование полученных пептидов в отношении кератиноцитов, являющихся чрезвычайно чувствительными к данным эффектам, позволяет лечить повреждения кожи, такие как повреждения от диабетических язв. Пептиды также эффективны для предотвращения и уменьшения повреждений поверхности кожи, обусловленных различными повреждающими факторами внешней среды, в концентрациях, равных или больших, чем концентрация пептида НВ-107. 3 н. и 11 з.п. ф-лы, 3 ил., 5 табл., 4 пр.
Реферат
По данной заявке испрашивается приоритет по предварительной заявке США № 60/878849, поданной 5 января 2007 г., которая включена в настоящий документ в качестве ссылки в полном объеме.
Область изобретения
Изобретение относится к пептидам, обладающим биологической и терапевтической активностью. В частности, изобретение относится к коротким пептидам, имеющим от четырех до четырнадцати смежных аминокислотных остатков SEQ ID NO:1, которые проявляют пролиферативную, миграционную и противовоспалительную активности по отношению к клеткам, таким как кератиноциты. Кроме того, изобретение относится к способам применения этих пептидов для лечения различных поражений, затрагивающих кожу и другие относящиеся к организму поверхности, например ротовую полость.
Предпосылки изобретения
Эпидермис кожи состоит из четырех-пяти раздельных слоев, каждый из которых в основном содержит кератиноциты; в эпидермисе также присутствуют другие типы клеток, такие как фибробласты. Большинство кератиноцитов происходят из нижнего базального слоя эпидермиса и постепенно мигрируют в самую поверхностную часть кожи, где они ороговевают и, в конечном итоге, слущиваются. В процессе этой миграции кератиноциты дифференцируются для экспрессии ферментов и структурных белков, необходимых для ороговения (Presland and Dale, 2000). Исходя из их значительной роли в формировании эпидермиса кератиноциты представляют собой основную мишень для лечения поврежденной кожи.
Кератиноциты также являются основным компонентом тканей слизистых оболочек, которые сопряжены с эпидермисом (Presland and Dale, 2000). Такие ткани нуждаются в непроницаемом ороговевающем слое эпидермиса и формируют внутренние выстилающие поверхности, относящиеся к полости рта, носа, горла, уха, анальному отверстию и гениталиям. Аналогично коже поверхности слизистых оболочек важны для предотвращения проникновения возбудителей инфекции в организм; таким образом, повреждение любого из этих типов ткани может подвергнуть риску здоровье индивидуума.
Повреждение кожи и ткани слизистой происходит, когда нарушена целостность эпидермального слоя, например, из-за разрыва, ожога или волдыря. Повреждение может также включать сдавливание или ушиб, которые включают повреждение ткани без одновременного разрыва эпидермиса. Кожные инфекции, а также некоторые хронические заболевания, такие как злокачественная опухоль и аутоиммунные заболевания, также могут вызывать повреждения на поверхности эпидермиса. Язвы, такие как те, которые поражают диабетиков, или те, которые связаны с пролежнями, представляют собой другую форму повреждения кожи; эти раны часто являются действительно трудноизлечимыми, воспаляемыми, подверженными инфекции и требующими длительного заживления. Как правило, считают, что присутствие язвы или каких-либо других хронических ран является следствием нарушения клеточных процессов, вовлеченных в заживление, таких как клеточная сигнализация (Enoch and Price, 2004; Sweitzer et al., 2006). Одним из нарушений является невозможность эпителизации участка повреждения - кератиноциты у края раны, несмотря на способность к пролиферации, не способствуют закрытию язвы (Enoch and Price, 2004). Другим нарушением в отношении диабетических язв является отсутствие определенных сигнальных молекул; этот дефект может препятствовать процессам ремоделирования, которые необходимы для контроля за закрытием раны (Sweitzer et al., 2006).
Другие формы повреждения эпидермиса малозаметны и возникают в течение длительного времени, нарушая, в конечном итоге, функцию кожи при наличии острого повреждения; заживление раны длительно по времени и может происходить неидеально (например, с образованием рубца). Косметические проблемы, такие как образование морщин, сухость, истончение, обвисание и повышенная чувствительность к образованию синяков, являются обычными внешними проявлениями таких нарушений. Неудивительно, что эти проявления изношенности обычно связаны со старением, но также могут возникать преждевременно в результате длительного воздействия повреждающих средств, таких как ультрафиолетовое излучение (фотостарение). Фотореактивные процессы, вызванные солнечным светом, могут способствовать уменьшению толщины и эластичности кожи, а также повышению жесткости кожи (Pelicci, 2004; Fisher et al., 2002).
Заживление острых ран кожи и слизистой контролируется частично через активацию базальных кератиноцитов, которая сопровождает путь пролиферации, миграции и дифференцировки для обеспечения закрытия раны. Этот процесс сопровождается рядом ремоделирующих видов активности в участке повреждения (Enoch and Price, 2004). Кератиноциты, расположенные по периметру раны, пролиферируют и мигрируют для формирования одного слоя над раной в процессе, называемом эпителизацией. Затем при пролиферации и дифференцировке кератиноцитов образуется слой эпидермиса, содержащий нормальные чередующиеся слои. Воспалительные процессы могут способствовать заживлению раны; инфильтрующие моноциты борются с инфекцией, а также высвобождают факторы, которые стимулируют эпителизацию раны. Однако воспалительные процессы могут также затруднять заживление; например, отложение фибрина макрофагами способствует образованию рубца. При условии поддержания антисептических условий было показано, что закрытие раны эпидермисом происходит быстрее и с менее выраженным рубцеванием, если вовлечение иммунитета ограничено (Martin and Leibovich, 2005). Именно благодаря этим взглядам в настоящее время рассматривают способы подавления воспаления при повреждении эпидермиса.
Было показано, что некоторые факторы, включая эпидермальный фактор роста (EGF), основной фактор роста фибробластов (bFGF), фактор роста кератиноцитов (KGF) и факторы роста тромбоцитов (PDGF), стимулируют эпителизацию кератиноцитами в процессе заживления раны в коже и связанных тканях слизистых (Enoch and Price, 2004). Интересно, что про некоторые антибактериальные белки, присутствующие на коже и поверхностях слизистых, также известно, что они играют роль в стимуляции клеточной пролиферации и миграции, необходимых для заживления ран эпидермиса (Shaykhiev et al., 2005; Braff and Gallo, 2006; Zhang and Falla, 2006).
Зная, что определенные факторы роста естественным образом вовлечены в процесс заживления ран, работа была направлена на разработку основанных на факторах роста способов лечения ран, особенно тех, которые, в общем, являются хроническими. Например, способ лечения диабетических язв с помощью PDGF-BB (Mustoe et al., 1994; Steed, 1995) получил одобрение FDA. Однако большинство попыток применения такой стратегии потерпело неудачу в достижении клинически значимых результатов частично из-за затруднений, связанных с использованием терапевтических белков. Одна из проблем связана с неэффективной доставкой факторов роста в область раны; местное применение этих белков позволяет воздействовать только на наружную, в основном мертвую ткань. Другие препятствия связаны с высокой лабильностью и низкой способностью удержания белков факторов роста после доставки в область раны.
Трудности в применении факторов роста и других белков для лечения ран эпидермиса связаны с большим размером используемых белков. Широкое применение способов лечения факторами роста также затруднительно из-за сложности и высокой стоимости, связанных с получением белков большого размера. Таким образом, в настоящее время проводят поиск менее дорогих и более эффективных лекарственных средств в том, что относится к применению белковых факторов в схемах лечения при заживлении ран. Короткие пептиды, которые поддерживают активность крупных белков, из которых они были получены (т.е. исходный белок), удовлетворяют эту потребность. Имеются сообщения о предыдущих примерах таких коротких пептидов (патенты США №№ 6861406 и 6693077; Lee et al., 2004). Помимо непосредственной выгоды от меньшей стоимости, более простого получения, обработки и применения, маленькие биологически активные пептиды также лучше абсорбируются и удерживаются тканью раны. Улучшенные абсорбционные свойства коротких биологически активных пептидов также делают их практически осуществленным вариантом использования не только для обработки острых и хронических ран, а также для лечения проблем кожи, связанных со старением и ультрафиолетовым облучением.
Сущность изобретения
Настоящее изобретение относится к коротким биологически активным пептидам, пригодным для стимуляции заживления ран у млекопитающих. Раны, преимущественно являющиеся мишенями для выделенных пептидов, представляют собой пораженную кожу и связанные поверхности слизистых. Чтобы не ограничиваться какими-либо конкретными механизмами, пептиды по изобретению обладают способностью влиять на заживление ран путем стимуляции клеточной пролиферации и миграции, а также путем ингибирования воспаления, которое может нарушить оптимальные процессы заживления. Пептиды по изобретению применимы обоими способами: in vitro и in vivo и способны индуцировать упомянутые выше виды активности в кератиноцитах.
Один из вариантов осуществления по настоящему изобретению относится к выделенным пептидам, которые содержат от четырех до четырнадцати смежных аминокислотных остатков SEQ ID NO:1. Такие пептиды представляют собой короткие фрагменты пептида HB-107. Выделенные пептиды могут содержать или L-, или D-энантиомерные формы аминокислот или их сочетание. Кроме того, согласно другому варианту осуществления изобретения выделенные пептиды могут быть конъюгированы с белком-носителем или модифицированы амидированием или липидизацией. Эти дополнения усиливают биологическую активность пептидов при нанесении их на кожу и раны.
Согласно конкретным предпочтительным вариантам осуществления настоящего изобретения выделенные пептиды могут содержать аминокислотные остатки метионина, валина, лизина или глутаминовой кислоты на N-конце. Выделенные пептиды могут также содержать аминокислотные остатки лизина, валина, глицина или аспарагина на С-конце. В других предпочтительных вариантах осуществления выделенные пептиды могут содержать SEQ ID NO:3, SEQ ID NO:6 или SEQ ID NO:12. Конкретные варианты осуществления выделенных пептидов представляют собой SEQ ID NO:2, 3, 5, 6, 7, 8, 9, 10, 11, 12 и 15, каждый из которых проявляет один или несколько стимулирующих видов активности в отношении клеточной пролиферации, миграции и противовоспалительного эффекта. Из этих конкретных пептидов SEQ ID NO:2, 3, 5, 6, 7, 9, 10, 11 и 12 обладают пролиферативной активностью в отношении клетки; и из этих пептидов SEQ ID NO:2, 3, 5, 6 и 9 проявляют самую высокую пролиферативную активность. Пептиды SEQ ID NO:3 и 6 проявляют оба вида активности в отношении клетки: пролиферативную и миграционную. SEQ ID NO:12 проявляет в отношении клетки оба вида активности: пролиферативную и противовоспалительную, тогда как SEQ ID NO:8 и 15 проявляют противовоспалительную активность в отношении клетки.
Другой вариант осуществления настоящего изобретения относится к композициям, которые содержат фармацевтически приемлемый носитель и один или несколько из указанных выше пептидов. В таких композициях пептид присутствует в концентрации от приблизительно 0,1 мкг/мл до приблизительно 20 мкг/мл или от приблизительно 0,1 мкг/мл до приблизительно 50 мкг/мл. Предпочтительными формами композиции являются аэрозоли, эмульсии, жидкости, лосьоны, кремы, пасты, мази, порошки и пены.
Настоящее изобретение также относится к способам применения указанных выше композиций для заживления ран у млекопитающих. Как правило, способ лечения включает введение эффективного количества содержащих пептид композиций в раны, особенно раны кожи (эпидермиса) и связанных тканей слизистых, в течение эффективного количества времени. Такие раны включают истирания, волдыри, ожоги, разрывы, язвы, синяки, сыпи, рубцы и проявления старения и воздействия факторов окружающей среды.
Краткое описание фигур
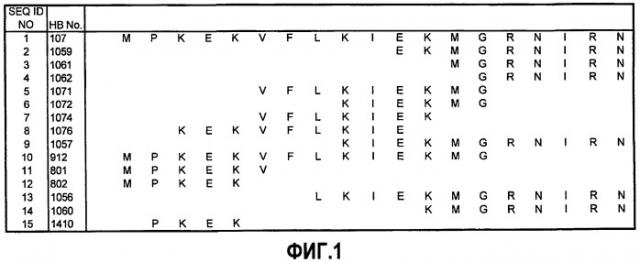
Фиг.1: Приведено расположение пептидов по изобретению относительно исходного пептида HB-107 (SEQ ID NO:1).
Фиг.2: Экспрессия IL6 эпителиальными клетками кожи в ответ на воздействие ультрафиолетовых лучей спектра B (UVB). Клетки подвергали облучению UVB в течение определенного периода времени (0-35 секунд) и измеряли экспрессию IL6 с помощью ELISA спустя двадцать четыре часа после UVB облучения. Каждый опыт повторяли трижды. Относится к примеру 4.
Фиг.3: Влияние коротких пептидов на индуцированную UVB экспрессию IL6 в эпителиальных клетках кожи. Клетки подвергали облучению UVB в течение 35 секунд, после чего клетки инкубировали в полной среде (без сыворотки) с 40 мкг/мл пептида [HB-107 (SEQ ID NO:1), HB-802 (SEQ ID NO:12), HB-1410 (SEQ ID NO:15), HB-801 (SEQ ID NO:31)] в течение двадцати четырех часов. Экспрессию IL6 измеряли с помощью ELISA. Относится к примеру 4.
Подробное описание изобретения
Патенты США № 5962410 и 5861478 содержат информацию, пригодную для понимания настоящего изобретения, и включены в настоящий документ в качестве ссылки в полном объеме. Изобретение относится к коротким биологически активным пептидам, которые, например, получают из пептида HB-107 (SEQ ID NO:1), и способам их применения. Сам по себе пептид HB-107 входит в состав фрагмента цекропина B, который представляет собой антибактериальный белок, присутствующий у разновидности моли. Хотя HB-107 не проявляет бактериостатического действия белка, из которого он был получен, он проявляет свойства заживления ран эпидермиса (Lee at al., 2004).
Пептиды по настоящему изобретению проявляют виды активности, которые важны для активации процессов заживления в эпидермальных тканях, таких как кожа и связанные слизистые (например, ротовая полость). Чтобы не ограничиваться какими-либо конкретными механизмами, эти виды активности направлены на кератиноциты, эпителиальные клетки, ответственные за закрытие раны (т.е. эпителизацию) и образование эпидермальных покровов. Конкретными видами активности, которые пептиды по изобретению проявляют в отношении кератиноцитов, которые непосредственно обусловливают заживление раны, являются стимуляция клеточной пролиферации и миграции, а также способность подавления сигналов воспаления кератиноцитами. Несмотря на то, что HB-107 способен стимулировать все эти виды активности в кератиноцитах, к удивлению, пептиды по настоящему изобретению проявляют эту способность на эквивалентном или более высоком уровнях, чем HB-107. Эти результаты являются и поразительными, и значимыми, так как пептиды по изобретению составляют только 26%-74% от длины HB-107.
Из-за различия в размере пептиды по настоящему изобретению являются более простыми и, таким образом, менее дорогими для получения по сравнению с получением HB-107 и полноразмерных белков, таких как PDGF-BB. Также в отличие от более крупных пептидов раскрываемые пептиды растворяли, подвергали обработке (например, химическому модифицированию) и хранили при более простых условиях. Простота манипуляций с ними реализует большее число вариантов доставки лекарственного средства, например использование носителя, и способов применения. Размер и лучшая растворимость пептидов по изобретению обусловливает их повышенную эффективность для заживления посредством увеличения абсорбции и удержания в области раны; локальные кератиноциты и другие клетки подвергаются воздействию повышенных концентраций пептидов в течение более длительного периода времени.
Биологическими видами активности, проявляемыми пептидами по настоящему изобретению, являются клеточная пролиферация и миграция, а также ингибирование воспаления. Два упомянутых выше процесса играют большую роль в опосредовании функции пептидов при заживлении ран. Пептиды обладают способностью, во-первых, стимулировать миграцию кератиноцитов, находящихся у границы раны, и, во-вторых, стимулировать пролиферацию этих клеток для образования нового слоя эпидермиса над областью раны. Третий вид активности, ингибирование воспаления, достигается посредством раскрытого эффекта подавления пептидами секреции цитокина интерлейкин-6 (IL6) клетками в ране. Было показано, что IL6 секретируется эпидермальными кератиноцитами в ответ на факторы, связанные с повреждением тканей (Sugawara et al., 2001); этот цитокин вызывает инфильтрацию иммунных клеток в ране, процесс, который фактически может затруднять заживление и приводить к образованию рубца (Martin and Leibovich, 2005; Liechty, 2000). Так как воспаление важно для предотвращения инфицирования раны, обеспечение качественных антисептических мероприятий при стандартной обработке раны устраняет любые препятствия, связанные с подавлением воспаления. Хотя упомянутые выше виды активности похожи на те, посредством которых изобретение способствует заживлению раны, отмечено, что применение не ограничено каким-либо одним конкретным спектром биологических механизмов.
В отношении стимулирования клеточной пролиферации и миграции, предпочтительными являются пептиды SEQ ID NO:3 (HB-1061) и SEQ ID NO:6 (HB-1072). Эти пептиды вызывают значительное повышение пролиферации клеток по сравнению со стимулированием посредством HB-107, но пока более кратковременное, чем HB-107 (относится к примерам 1 и 2). Они точно так же, как HB-107, способны к индукции клеточной миграции. Пептиды SEQ ID NO:8 и SEQ ID NO:12 являются предпочтительными в отношении индукции противовоспалительной клеточной активности (относится к примеру 3).
Пептиды по изобретению также проявляют лечебные эффекты относительно проблем, связанных со старением кожи или значительной подверженностью кожи действию повреждающих средств, таких как солнечное излучение. Сами короткие пептиды не изменяют, но посредством химического модифицирования и/или специализированной доставки могут быть подготовлены для абсорбции через эпидермис для воздействия на процессы, противоположные тем, которые являются причиной истончения кожи, появления морщин, хрупкости и огрубления/уплотнения. Основным способом, которым изобретение стимулирует сохранение кожи, является положительный эффект пептидов на рост кератиноцитов. Так как эти клетки являются основным компонентом эпидермальных покровов, а с возрастом и в поврежденной коже их количество снижается (Enoch и Price, 2004), то их восстановление пептидной стимуляцией предполагает обратное развитие указанных выше проблем. Экспрессия IL6 связана с процессами, лежащими в основе аномального утолщения эпидермиса у пациентов с некоторыми аутоиммунными нарушениями (Sato et al., 2001; Oyama et al., 1998); пептиды по изобретению могут блокировать такой исход, связанный с воспалением, ингибированием экспрессии IL6.
Пептиды
Единственно, в качестве направляющей точки, пептиды по изобретению можно получать из фрагмента HB-107 (таблица 1) из белка цекропин B моли. Метаболическими особенностями, связанными с этими пептидами, является их способность индуцировать клеточную пролиферацию, миграцию и/или противовоспалительную активность. Все пептиды по изобретению объединены общей особенностью наличия от четырех до четырнадцати смежных аминокислотных остатков из HB-107 (SEQ ID NO:1). Таким образом, пептиды по изобретению могут состоять из четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати или четырнадцати смежных аминокислотных остатков из HB-107 (SEQ ID NO:1).
Помимо наличия описанных выше композиций аминокислот, описанные выше пептиды могут дополнительно содержать следующие аминокислоты (полное название/трехбуквенная аббревиатура/однобуквенная аббревиатура): аланин/ala/A, аргинин/arg/R, аспарагин/asn/N, аспартат/asp/D, цистеин/cys/C, глутамин/gln/Q, глутамат/glu/E, глицин/gly/G, гистидин/his/H, изолейцин/ile/I, лейцин/leu/L, лизин/lys/K, метионин/met/M, фенилаланин/phe/F, пролин/pro/P, серин/ser/S, треонин/thr/T, триптофан/trp/W, тирозин/tyr/Y и валин/val/V. Эти аминокислотные остатки характеризуют следующим образом: алифатические (аланин, глицин, изолейцин, лейцин, пролин, валин), ароматические (фенилаланин, триптофан, тирозин), кислые (аспартат, глутамат), основные (аргинин, гистидин, лизин), содержащие гидроксильную группу (полярные) (серин, треонин), серосодержащие (полярные) (цистеин, метионин) и амиды (аспарагин, глутамин). В описанный пептид можно включать, но не ограничиваясь ими, нестандартные аминокислотные остатки селенооцистеин, пиролизин и различные циклические формы аминокислот.
Следующие пептиды представляют собой неограничивающие примеры настоящего изобретения и приведены с целью иллюстрации (таблица 1).
| Таблица 1 Пептиды по настоящему изобретению | ||
| SEQ ID NO: | Пептид | Последовательность |
| 1 | HB-107 | MPKEKVFLKIEKMGRNIRN |
| 2 | HB-1059 | EKMGRNIRN |
| 3 | HB-1061 | MGRNIRN |
| 4 | HB-1062 | GRNIRN |
| 5 | HB-1071 | VFLKIEKMG |
| 6 | HB-1072 | KIEKMG |
| 7 | HB-1074 | VFLKIEK |
| 8 | HB-1076 | KEKVFLKIE |
| 9 | HB-1057 | KIEKMGRNIRN |
| 10 | HB-912 | MPKEKVFLKIEKMG |
| 11 | HB-801 | PKEKV |
| 12 | HB-802 | MPKEK |
| 13 | HB-1056 | LKIEKMGRNIRN |
| 14 | HB-1060 | KMGRNIRN |
| 15 | HB-1410 | PKEK |
Пептиды SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12 и SEQ ID NO:15 представляют собой примеры пептидов, ассоциированных с одним или несколькими описанными выше видами активности (пролиферативной, миграционной, противовоспалительной). Пептиды SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11 и SEQ ID NO:12 представляют собой примеры пептидов, которые могут индуцировать клеточную пролиферацию. Пептиды SEQ ID NO:3 и SEQ ID NO:6 представляют собой примеры пептидов, которые могут индуцировать клеточную пролиферацию и миграцию. Пептид SEQ ID NO:12 представляет собой пример пептида, который проявляет обе активности: пролиферативную и противовоспалительную. Пептиды SEQ ID NO:8 и SEQ ID NO:15 представляют собой примеры пептидов, обладающих противовоспалительной активностью.
Каждый из описанных выше пептидов может содержать L- или D-энантиомеры аминокислот либо остатки одной энантиомерной формы или сочетание обеих форм. Пептиды можно дополнительно наращивать или модифицировать или химически, или ферментативно, как описано в следующих неограничивающих примерах. C-конец пептидов может быть кислым (-COOH) или амидированным (например, -CONH2, -CONHR или -CONR2). Амидирование C-конца может обеспечить пептидам по изобретению меньшую чувствительность к протеолитической деградации, повысить их растворимость по сравнению со свободными формами кислот, обеспечивая таким образом повышение терапевтического потенциала. Пептиды также можно подвергнуть липидизации, что может обеспечить улучшенное проникновение через кожу. Модификации пептида можно осуществлять заменой водорода N-концевой аминогруппы, заменой гидроксильной группы (OH) C-концевой карбоксильной группы, полной заменой N-концевой аминогруппы или полной заменой C-концевой карбоксильной группы. Одна или несколько межмолекулярных связей, соединяющих аминокислоты каждого пептида, могут не являться пептидной связью. Такие связи, не являющиеся пептидными, в качестве неограничивающих примеров включают имидо-, сложный эфир гидразина, семикарбазид и азосвязи.
Различные модификации пептидов можно осуществлять до тех пор, пока сохраняются их свойства пролиферации, миграции и противовоспалительного вида активности. Некоторые модификации можно использовать для повышения активности пептида, в то же время другие модификации могут облегчать применение пептида. Функциональные группы пептида, которые обычно подвергают модификации, включают гидроксил, амино, гуанидин, карбоксил, амид, фенол, имидазольные кольца или сульфгидрил. Стандартные, не лимитирующие реакции с этими группами, включают следующие: ацетилирование гидроксильных групп алкилгалогенидами; образование сложных эфиров, амидирование или гидрогенизацию (т.е. превращение в спирт) карбоксильных групп; дезаминирование, ацилирование, алкилирование, арилирование аминогрупп (например, первичная аминогруппа пептида или аминогруппа остатков лизина); галогенирование или нитрирование фенольных групп тирозина.
Пептиды можно подвергать конъюгированию с растворимыми или нерастворимыми молекулами-носителями для модификации их свойств растворимости по мере необходимости и для повышения локальной концентрации пептидов в тканях-мишенях. Примеры растворимых молекул-носителей включают полимеры полиэтиленгликоль (ПЭГ) и поливинилпирролидон; примеры нерастворимых полимеров включают соли кремниевой кислоты, полистирол и целлюлозу. Пептиды также можно подвергать микрокапсулированию для усиления их стабильности в течение и после терапевтического применения; обычно для инкапсулирования и стабилизации пептидов используют микрогранулы полиэфира и ПЭГ.
В зависимости от гидрофильной или гидрофобной природы композиции пептида, подлежащего инкапсулированию, можно использовать различные способы получения микрогранул для инкапсулирования пептида. Примерами протоколов таких способов являются найденные в Wang H.T. et al. (1991, J. Control. Release 17:23-25) и патенте США № 4324683, оба из которых приведены здесь в полном объеме. Исследования высвобождения пептида in vitro можно проводить для определения относительной доступности пептида после инкорпорирования его в микрогранулу. Микрогранулы (200 мг) суспендируют при pH 7,2 в фосфатно-солевом буфере (PBS) (2,5 мл) и перемешивают при 37 градусах C и 100 об/мин в климатическом шейкерном инкубаторе (G-24, New Brunswick Scientific Co., Edison, N.J.). В конкретное время проведения измерения (каждые сутки в течение первых 4 суток и все остальные сутки после этого) буферный раствор полностью удаляли и заменяли свежим PBS. Содержание пептида в PBS измеряли c использованием метода Бредфорда или другого подходящего количественного анализа, используемого обычно для анализа белков.
Все раскрываемые пептиды можно синтезировать с использованием так называемой стандартной твердофазной химии Fmoc (9-флуоренилметоксикарбонил) на синтезаторе Advanced ChemTech Apex 396 Multiple Peptide Synthesizer. Apex 396 оснащен 40-луночным реакционным блоком для получения до 40 пептидов одновременно в количестве 0,15 ммоль. Пептиды можно получать или амидированными, или в качестве последовательностей свободных кислот с использованием стандартных аминокислот. Сначала смолу промывали и заранее подвергали набуханию с помощью N,N-диметилформамида (DMF). Время набухания для смолы Rink-amide составляло один час. Защитную группу Fmoc удаляли с помощью 25% пиперидина в DMF в течение 25 минут, после чего пиперидин полностью удаляли из смолы. Для контроля за процессом рацемизации Fmoc мономеры аминокислот заранее активировали в эквимолярном растворе 1-гидрокси-бензотриазола (HOBt) или 1-гидрокси-7-аза-бензотриазол (HOAt) в DMF с концентрацией 0,5 M. Получение амидных соединений выполняли с использованием 0-(7-аза-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфата (HATU) PyBop® или 2-(1H-бензотриазол-1-ил-)-1,1,3,3-тетраметилуоний гексафторфосфата (HBTU) в качестве активирующего соединения и с 2,5-5,0-кратным молярным избытком аминокислоты при нормальных условиях с использованием пространственно-затрудненного основания (диизопропилэтиламин). Время связывания составляло 1-1,5 часа с последующим промыванием и повторным связыванием для получения двойного или тройного соединения перед удалением защитных групп и удлинением растущей цепи пептида. Эффективность связывания измеряли с использованием стандартного теста Кайзера. Как только синтез пептида с использованием смолы завершали, последнюю группу Fmoc удаляли, как описано выше, и оставляли последовательности в качестве свободных оснований.
Расщепление пептидных связей, неустойчивых к действию кислот, со смолой проводили с использованием 95% трифторуксусной кислоты (TFA) и воды с добавлением подходящего акцептора. После того как позволяли пройти расщеплению в течение приблизительно от 30 минут до одного часа, свободные пептиды немедленно удаляли из блока для расщепления и перемещали в пробирки для удаления TFA при пониженном давлении. Таким образом, пептиды были готовы для очистки и анализа высокоэффективной жидкостной хроматографией (ВЭЖХ) с использованием колонок с обращенной фазой C18 и масс-спектрометрией. Подтверждение первичной последовательности и предварительную очистку проводили с использованием системы LC/MS/MS (ABI API2000).
Согласно приведенному выше протоколу пептиды можно получать с использованием любых способов, известных специалистам в данной области, таких как те, которые описаны в Merrifield, R.B., Solid Phase Peptide Synthesis I., J. AM. CHEM. SOC. 85:2149-2154 (1963); Carpino, L.A. et al., [(9-Fluorenylmethyl)Oxy]Carbonyl (Fmoc) Amino Acid Chlorides: Synthesis, Characterization, And Application To The Rapid Synthesis Of Short Peptides, J. ORG. CHEM. 37:51:3732-3734; Merrifield, R.B. et al., Instrument For Automated Synthesis Of Peptides, ANAL. CHEM. 38:1905-1914 (1966); или Kent, S.B.H. et al., High Yield Chemical Synthesis Of Biologically Active Peptides On An Automated Peptide Synthesizer Of Novel Design, IN: PEPTIDES 1984 (Ragnarsson U., ed.) Almqvist and Wiksell Int., Stockholm (Sweden), p.185-188, которые все в полном объеме включены в настоящий документ в качестве ссылки. Предпочтительно пептиды будут получены автоматическим способом, допускающим последовательное присоединение аминокислот к растущей цепи пептида. Однако пептиды также можно получать с использованием способа в жидкой фазе, который можно применять в целях массового производства.
Способы использования
Дополнительные варианты осуществления настоящего изобретения относятся к способам применения описанных выше пептидов, например, в качестве композиций или в качестве терапевтических средств. Эти способы могут включать применение отдельного пептида или множества пептидов в сочетании.
Пептиды по настоящему изобретению можно использовать для лечения ран кожи (эпидермис, дерма и гиподерма) и связанных тканей слизистых. Как применяют в настоящем документе, термин "связанные ткани слизистых" относится к любой ткани, организованной сходным с кожей образом и содержащей эпителиальные клетки. Кератиноциты представляют собой неограничивающий пример таких эпителиальных клеток. Примерами таких тканей являются ротовая, носоглоточная, ушная и урогенитальная поверхности, а также пальпебральная конъюнктива глаза. Другие примеры связанных тканей слизистых включают внутреннюю выстилку (т.е. просвет) желудочно-кишечного тракта, включая пищевод, желудок, тонкий кишечник, толстый кишечник (толстую кишку) и прямую кишку. Эти последние примеры подвергаются тем же ранениям/повреждениям, которые поражают кожу, и поэтому могут являться мишенями для настоящего изобретения. Примерами ран/поражений/повреждений, которые могут поражать эти ткани и подлежат лечению пептидами по изобретению, являются истирания, волдыри, ожоги, разрывы, колотые раны, язвы, синяки, сыпи и рубцы. Послеоперационные повреждения ткани также подлежат лечению пептидами.
Пептиды по изобретению также можно использовать для предотвращения или обращения влияний возраста на все указанные выше ткани. Сходным образом пептиды можно применять на поврежденной ткани, подвергшейся действию различных внешних факторов, таких как солнечное излучение. Примерами истощений, связанных со старением и облучением, являются образование морщин, сухость, истончение, обвисание и повышенная чувствительность к образованию синяков. Учитывая это, изобретение также можно использовать в качестве косметического средства для достижения более молодого внешнего вида и текстуры кожи и для обеспечения здорового функционирования.
Другие затрагивающие ткани проблемы, которые эффективно лечатся с использованием пептидов по настоящему изобретению, связаны с аллергией или аутоиммунитетом. Такие расстройства включают дерматит, псориаз, склеродермию, пузырчатку и воспалительные заболевания кишечника.
Композициями для доставки пептидов в приведенных выше терапевтических способах могут быть аэрозоли, эмульсии, жидкости, лосьоны, кремы, пасты, мази, порошки или пена или другой фармацевтически приемлемый препарат. Кроме того, пептиды можно доставлять с использованием нерассмотренных препаратов, таких как деионизированная/дистиллированная вода, PBS или обычный медицинский физиологический раствор. Как правило, фармацевтически приемлемый препарат включает любой носитель, пригодный для использования на коже человека. Такие фармацевтически приемлемые носители включают этанол, диметилсульфоксид, глицерин, диоксид кремния, оксид алюминия, крахмал и аналогичные носители и разбавители. Препарат необязательно обладает косметическим назначением и/или содержит такие соединения, как ретиноиды или другие пептиды, которые могут служить в качестве адъювантов для терапевтического действия пептидов по изобретению. К препарату также можно добавлять антибиотики для предотвращения инфицирования, позволяя процессу заживления таким образом протекать максимально. Концентрация пептида в композиции составляет от приблизительно 0,1 мкг/мл до приблизительно 50 мкг/мл или от приблизительно 0,1 мкг/мл до приблизительно 20 мкг/мл; однако конечная используемая концентрация может варьировать вне этих пределов в зависимости от природы происхождения раны/ткани, биологической активности пептида по изобретению и применения каких-либо адъювантов или способов достижения композицией повышенной абсорбции.
Композиции по настоящему изобретению могут содержать один или несколько дополнительных соединений, которые обладают активностью ухода за кожей.
В предпочтительном варианте осуществления настоящего изобретения, где композиция подлежит контактированию с ороговевающим слоем ткани человека, любые дополнительные соединения, помимо пептидов по изобретению, должны быть применимы для нанесения на ороговевающую ткань; то есть если другие такие компоненты, включенные в композицию, проявляют несоответствующую токсичность, несовместимость, неустойчивость, аллергическую реакцию и т.п. в пределах границ тщательной медицинской оценки. В CTFA Cosmetic Ingredient Handbook, Second Edition (1992) описано большое разнообразие неограниченных косметических и фармацевтических компонентов, общеупотребительных в промышленности по уходу за кожей, которые пригодны для использования в композициях по настоящему изобретению. Примеры таких классов компонентов включают: абразивы, абсорбенты, эстетические компоненты, такие как ароматические композиции, пигменты, красящие вещества/красители, эфирные масла, вещества, усиливающие чувствительность кожи, вяжущие средства и т.д. (например, гвоздичное масло, ментол, камфара, эвкалиптовое масло, эвгенол, ментил лактат, дистиллят гамамелиса), средства против угревой сыпи, средства против обезвоживания, противовспениватели, антибактериальные средства (например, йодопропил бутилкарбамат), антиоксиданты, связующие вещества, биологические добавки, буферные средства, наполнители, хелатирующие средства, химические добавки, косметические антисептики, денатурирующие средства, вяжущие лекарственные средства, наружные анальгетики, пленкообразующие соединения или вещества, замутняющие компоненты, регуляторы pH, пропелленты, восстановители, отшелушивающие вещества, средства для отбеливания и осветления кожи (например, гидрохинон, койевая кислота, аскорбиновая кислота, аскорбилфосфат магния, аскорбилглюкозамин), средства для ухода за кожей (например, увлажнители), средства для смягчения и/или заживления кожи (например, пантенол и его производные, алоэ вера, пантотеновая кислота и ее производные, аллантоин, бисаболол и глицирризинат калия двойной), средства для лечения кожи, загустители и витамины и их производные.
Применение пептидов по изобретению и соответствующих композиций можно осуществлять у человека и животных, включая всех млекопитающих. Применение также можно осуществлять в сочетании со стандартными и/или экспериментальными материалами, такими как тканевые лоскуты, препараты культуры клеток ткани, кислород и перевязочные средства. В основном композицию можно вводить местно, перорально, трансдермально, системно или любым другим способом, известным специалистам в данной области, пригодным для доставки пептидов по изобретению в место повреждения. Композиции также можно применять способом in vitro или ex vivo, например, или на клетках, или на растущем в культуре трансплантате пациента.
Подразумевают, что из-за своего маленького размера пептиды способны самостоятельно достигать некоторого уровня проницаемости через кожу; однако можно использовать конкретные способы для усиления этого процесса. Например, к пептидам можно добавлять липофильные (неполярные)