Лекарственная форма с задержкой лекарств для лечения бессонницы
Иллюстрации
Показать всеПредложена лекарственная форма, включающая лекарственное вещество для лечении бессонницы, содержащая слой или покрытие, окружающее матрикс, в котором растворено или диспергировано лекарственное вещество, причем высвобождение указанного лекарственного вещества происходит по истечении времени задержки (по меньшей мере 1 час после ее введения), в течение которого по существу отсутствует высвобождение лекарственного вещества, и материал покрытия содержит менее 5% веществ, которые обладают способностью набухать или образовывать гель, а в матриксе присутствует агент, контролирующий высвобождение. Изобретение позволяет точно установить и соблюсти время задержки до высвобождения активного вещества, что дает пациенту возможность работать перед сном, находясь в несонном состоянии. 19 з.п. ф-лы, 3 ил., 8 табл., 6 пр.
Реферат
Настоящее изобретение относится к способам лечения бессонницы и композициям для лечения бессонницы у людей.
Многие патологии или состояния относятся к нарушениям суточных ритмов. Бессонница представляет собой одно из таких состояний. Однако, несмотря на то, что бессонница является очень распространенным состоянием, среди врачей принято считать, что для решения этой проблемы многим людям может помочь фармакологическое воздействие.
При оценке симптомов бессонницы врачи пришли к заключению, что они делятся в основном на следующие категории: 1) задержку засыпания, 2) продолжительность сна, 3) нарушение характера сна, то есть частые случаи ночного пробуждения, и 4) остаточные эффекты сна после пробуждения, такие как сонливость и ухудшение когнитивных и моторных функций.
В предыдущих методиках лечения бессонницы обычно использовали депрессанты центральной нервной системы (ЦНС), такие как барбитураты. Данные соединения обычно имеют большое время полужизни и имеют хорошо известный спектр побочных эффектов, включая летаргию, спутанность, депрессию и остаточные явления сна на следующий день. Кроме того, их постоянное использование связано с высокой вероятностью привыкания, включая как физическую, так и психологическую зависимость.
Методики лечения уходят от использования барбитуратов и других ЦНС-депрессантов в направлении использования бензодиазепинового класса седативных снотворных агентов. Данный класс соединений, обладающий большими, по сравнению с предшествующими снотворными средствами, резервами безопасности, производит успокаивающее действие, которое у людей и животных вызывает сонливое состояние. Однако многие бензодиазепины обладают побочными эффектами, которые ограничивают их пригодность для некоторых групп пациентов. Эти проблемы включают синергию с другими ЦНС-депрессантами (особенно алкоголем), развитие толерантности при повторном введении, возврат бессонницы после прекращения введения, остаточные явления сна на следующий день и ухудшение психомоторных характеристик и памяти.
В современных методиках лечения бессонницы используют небензодиазепиновые соединения. Примерами одобренных лекарственных продуктов являются Амбиен (золпидем), Соната (залеплон). Залеплон, также известный как N-[3-(3-цианопиразол[1,5-а]пиримидин-7-ил)фенил]-N-этилацетамид, представляет собой пиразолопиримидиновое снотворное, которое избирательно связывается с бензодиазепиновым сайтом типа I в рецепторном комплексе ГАМК-А (γ-аминомасляная кислота, тип А). Другие небензодиазепиновые соединения, полезные в лечении бессонницы, известны из литературы и могут применяться по настоящему изобретению.
Однако очевидно, что у части пациентов и врачей все еще остается неуверенность относительно назначения седативных средств и других ЦНС-активных агентов для постоянного использования. Несмотря на громадный прогресс в области пригодных лекарственных веществ, фармакологическое воздействие не может зависеть исключительно от свойств, присущих только этим лекарственным веществам. Способ, с помощью которого такие лекарственные вещества приготовлены в виде препаратов, оказывает одинаково значительное влияние на их эффективность, профили побочных эффектов и, в конечном счете, на признание как врачами, так и пациентами. При наличии огромного потенциала роста рынка лекарств от бессонницы, неудивительно, что дополнительно к имеющимся терапиям и поиску улучшенных лекарственных веществ многие компании обращают внимание на разработку улучшенных лекарственных форм с использованием существующих лекарственных веществ.
Форма, в которой некоторые седативные средства обычно доступны или разрабатываются, относится к лекарственным формам немедленного высвобождения. Как хорошо известно в данной области техники, лекарственные формы немедленного высвобождения обеспечивают выброс лекарственного вещества вскоре после приема внутрь, вызывая быстрое наступление сна. Несмотря на то, что такие лекарственные формы направлены на решение проблемы задержки засыпания, если лекарственное вещество не имеет длительного времени полужизни, то, чтобы поддерживать эффективные уровни концентрации в плазме крови в течение продолжительного периода времени, пациентам, испытывающим непродолжительный сон или частые случаи ночного пробуждения, в течение ночи необходимо принимать другие лекарственные формы, чтобы поддерживать сон.
Лекарственные формы с модифицированным высвобождением создают начальный выброс лекарственного вещества, вызывая быстрое наступление сна, и продолжают высвобождение лекарственного вещества контролируемым образом, поддерживая эффективные концентрации в плазме в течение продолжительного периода времени, чтобы лучше поддерживать сон. Возможный недостаток данного подхода состоит в продолжительности клиренса активного вещества из организма пациента. Лекарственное вещество, все еще присутствующее на эффективных уровнях, может вызывать остаточные явления сна после пробуждения.
Конкретная лекарственная форма с модифицированным высвобождением описана в патенте США 6485746. В данном патенте описан препарат седативного снотворого соединения, который обеспечивает пульсирующий профиль высвобождения in vivo, посредством чего после введения лекарственное вещество высвобождается быстро, обеспечивая максимальную концентрацию в плазме в промежуток времени от 0,1 до 2 часов после введения. Затем концентрация в плазме проходит через минимум в промежуток времени от приблизительно 2 до 4 часов после введения перед тем, как второй выброс обеспечивает вторую максимальную концентрацию в плазме в промежуток времени от приблизительно 3 до 5 часов. В конце, через 8 часов, концентрация в плазме остается такой, что она составляет не более 20% от второй максимальной концентрации в плазме.
Существующие препараты и разрабатываемые препараты затрагивают только улучшение качества сна и предупреждение остаточных явлений сна. Ни один из них, насколько известно автору заявки, не направлен на решение проблем, которые седативные средства вносят в обычную активность пациента перед сном. Быстрое наступление сонливости и сопутствующее нарушение активности перед сном, такой как чтение и просмотр телепередач, может приводить к увеличению нерешительности врачей назначать лекарство и более неохотному согласию пациентов.
Седация, нарушающая обычную активность перед сном, представляет собой нежелательный аспект действия лекарств от бессонницы, который еще более усугубляется, если принять во внимание, что большая часть страдающих от бессонницы жалуется не на проблемы засыпания, а на непродолжительносить сна и частые случаи ночного пробуждения. Кроме того, имеется доказательство, подтверждающее значительный эффект плацебо, связанный с терапиями, предназначенными инициировать быстрое наступление сна.
Несмотря на возросшую интенсивность разработки лекарств в данной области техники, остается необходимость в том, чтобы предложить пациентам лекарственную форму, которую можно принимать перед сном и которая не только обеспечивает увеличение продолжительности сна и уменьшает или устраняет случаи ночного пробуждения, но которая оставляет пациенту возможность заниматься перед сном какой-либо деятельностью, находясь в несонном состоянии.
Соответственно, в первом аспекте изобретения предложен способ лечения бессонницы у пациента, нуждающегося в таком лечении, включающий введение лекарственной формы, содержащей полезное в лечении бессонницы лекарственное вещество, которая адаптирована для высвобождения указанного лекарственного вещества по истечении времени задержки, в течение которого отсутствует, или по существу отсутствует, высвобождение лекарственного вещества и которое составляет приблизительно по меньшей мере один час после введения лекарственной формы.
В отличие от некоторых лекарственных форм, описанных в известном уровне техники, лекарственная форма, применяемая согласно способу по настоящему изобретению, адаптирована для высвобождения активного лекарственного вещества в зависимости от времени, то есть по истечении заданного времени задержки. Никакие внешние изменения в окружающей среде, такие как изменение pH или температуры, не требуются, чтобы вызвать высвобождение лекарственного вещества из данной лекарственной формы по истечении указанного заданного времени задержки.
Более конкретно, время задержки может составлять от 1 до 4 часов, еще более конкретно - от 1 до 2 или от 2 до 3 часов.
pH желудочного тракта может значительно варьировать в зависимости от того, находится пациент в сытом или голодном состоянии. Соответственно, для достоверного достижения заданного времени задержки предпочтительно, чтобы высвобождение указанного лекарственного вещества из лекарственной формы являлось pH-независимым.
В предпочтительной композиции, пока не закончилось время задержки, любое лекарственное вещество, которое высвобождается, присутствует в таких малых количествах, что эффективные уровни данного лекарственного вещества в плазме крови не достигаются. Предпочтительно, высвобождение лекарственного вещества составляет менее 10% по массе, более конкретно - менее 5%, еще более конкретно - менее 2%, еще более конкретно - менее 1%.
По истечении времени задержки лекарственное вещество высвобождается из лекарственной формы. Лекарственное вещество может высвобождаться, например, быстро (немедленное высвобождение) или может высвобождаться медленно в течение некоторого периода времени (модифицированное высвобождение). Предпочтительно лекарственное вещество может высвобождаться непульсирующим образом. Соответственно, лекарственное вещество может высвобождаться из лекарственной формы с установившейся или постоянной скоростью.
Время задержки может быть измерено in vitro с использованием методик растворения и общеизвестного в данной области техники устройства. В фармакопее США описано несколько таких методик.
В конкретном воплощении настоящего изобретения предложен способ лечения бессонницы у пациента, нуждающегося в таком лечении, включающий введение лекарственной формы, содержащей полезное в лечении бессонницы лекарственное вещество, которая адаптирована для высвобождения указанного лекарственного вещества по истечении времени задержки, в течение которого отсутствует, или по существу отсутствует, высвобождение лекарственного вещества и которое составляет приблизительно по меньшей мере один час после введения лекарственной формы, и которая адаптирована для получения контролируемого высвобождения указанного лекарственного вещества in vitro при измерении с использованием методики перемешивания согласно USP (фармакопее США) (аппарат типа II) при 100 об/мин в 1000 мл водной среды таким образом, что в течение указанного времени задержки высвобождается не более 10% лекарственного вещества.
В другом конкретном воплощении настоящего изобретения предложен способ лечения бессонницы у пациента, нуждающегося в таком лечении, включающий введение лекарственной формы, содержащей полезное в лечении бессонницы лекарственное вещество, которая адаптирована для высвобождения указанного лекарственного вещества по истечении времени задержки, в течение которого отсутствует, или по существу отсутствует, высвобождение лекарственного вещества и которое составляет приблизительно по меньшей мере один час после введения лекарственной формы, и которая адаптирована для получения контролируемого высвобождения указанного лекарственного вещества in vitro при измерении с использованием методики перемешивания согласно USP (аппарат типа II) при 100 об/мин при 37°C в 1000 мл (а) 0,1 М HCl и фосфатного буфера (pH 6,8), или (б) 0,02% лаурилсульфата натрия в 500 мл дистиллированной воды, или (в) очищенной воды таким образом, что в течение указанного времени задержки высвобождается не более 10% лекарственного вещества.
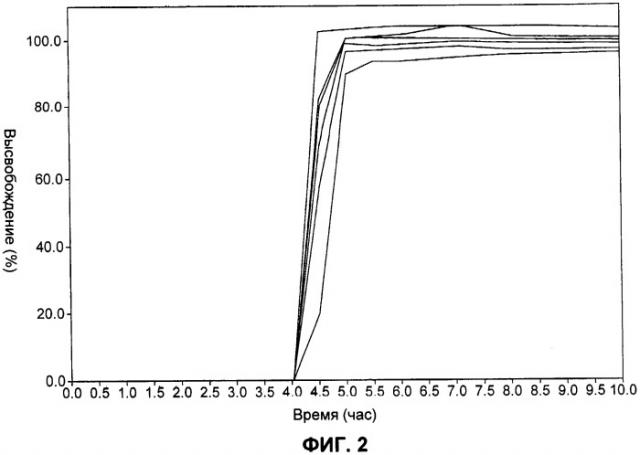
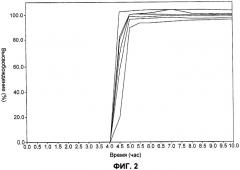
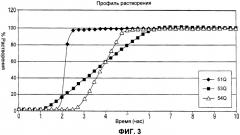
Более конкретно, согласно способу по настоящему изобретению лекарственная форма адаптирована для получения контролируемого высвобождения указанного лекарственного вещества in vitro при измерении с использованием методики перемешивания согласно USP (аппарат типа II) при 100 об/мин в 1000 мл водной среды таким образом, что в течение указанного времени задержки высвобождается не более 10% лекарственного вещества, в течение 5 часов высвобождается по меньшей мере приблизительно от 25 до 60% и через 7 часов высвобождается по меньшей мере приблизительно 80%.
Еще более конкретно, согласно способу по настоящему изобретению лекарственная форма адаптирована для получения контролируемого высвобождения указанного лекарственного вещества in vitro при измерении с использованием методики перемешивания согласно USP (аппарат типа II) при 100 об/мин при 37°С в 1000 мл (а) 0,1 М HCl и фосфатного буфера (pH 6,8), или (б) 0,02% лаурилсульфата натрия в 500 мл дистиллированной воды, или (в) очищенной воды, в водной среде, таким образом, что в течение указанного времени задержки высвобождается не более 10% лекарственного вещества, в течение 5 часов высвобождается по меньшей мере приблизительно от 25 до 60%, и через 7 часов высвобождается по меньшей мере приблизительно 80%.
В изобретении дополнительно предложена лекарственная форма, полезная в вышеуказанных способах. Предпочтительно, данная лекарственная форма предложена в виде стандартной (однокомпонентной) дозы.
Если рассматривать перспективу как имеющихся в продаже, так и разрабытываемых продуктов для лечения бессонницы, действие которых обусловлено тем, что они обеспечивают немедленный выброс лекарственного вещества для борьбы с проблемами задержки засыпания, настоящее изобретение, в соответствии с которым способ введения включает время задержки, является алогичным и имеет некоторые преимущества, которые отсутствуют у имеющихся терапий. В этом отношении, авторы изобретения уже отмечали преимущества для пациента, который теперь имеет возможность заниматься перед сном какой-либо деятельностью, находясь в несонном состоянии.
Хотя лекарственная форма согласно данному изобретению доставляет лекарственное вещество по истечении времени задержки, принимая во внимание значительный эффект плацебо, отмеченный выше, она может быть полезна не только для лечения случаев пробуждения, но также для лечения или решения проблем, связанных с задержкой засыпания.
Другие преимущества становятся очевидными, если принять во внимание биологические процессы, ассоциированные со сном. Считают, что основным движущим механизмом, вызывающим у пациентов необходимость в сне, является так называемый "гомеостатический процесс". Для индивидуума, который ложится спать около 11 часов вечера, движущая сила этого механизма ослабевает в ранние утренние часы, например около 3 часов утра, что еще более усугубляется циркадным сигналом на пробуждение около 5 часов утра, что, как считают, является для пациентов дополнительным механизмом, приводящим к бодрствованию. Время задержки до высвобождения лекарства может обеспечить достижение максимальных концентраций в плазме к тому моменту, когда проходит нескольких часов в цикле сна и когда, вероятно, имеют место случаи ночного пробуждения. Совмещая высвобождение лекарства и, следовательно, его максимальные концентрации в плазме с этими процессами, происходящими в ранние утренние часы, можно использовать более низкие дозы лекарственных веществ, чем это было бы необходимо в другом случае, при использовании традиционных лекарственных форм замедленного высвобождения, которые должны содержать значительное количество лекарственного вещества, чтобы обеспечить исходный выброс лекарства, который должен противодействовать проблемам задержки засыпания.
Кроме того, многие лекарственные вещества метаболизируются изоформой ЗА4 цитохрома CYP450, и этот фермент присутствует в относительно высоких концентрациях в верхних областях кишечно-желудочного (GI) тракта. Лекарственная форма, характеризующаяся временем задержки, может проходить дальше по кишечно-желудочному тракту, доставляя лекарственное вещество в область с более низкой активностью CYP P450 и тем самым потенциально увеличивая эффективность высвобождаемого лекарственного вещества. Наиболее часто используемое седативное снотворное средство Залеплон представляет собой такое лекарственное вещество, которое метаболизируется CYP P450.
Лекарственная форма в соответствии с настоящим изобретением может доставлять лекарственное вещество таким образом, что максимальная концентрация в плазме достигается около 3 часов утра (то есть приблизительно через 4-5 часов после введения). Кроме того, при использовании обычно подходящих эксципиентов замедленного высвобождения (которые будут дополнительно охарактеризованы в данном описании ниже) концентрации лекарственного вещества в плазме можно поддерживать на эффективных уровнях вплоть до 3 часов утра для совмещения с ослаблением гомеостатического процесса и вплоть до 5 часов утра для совмещения с циркадным сигналом на пробуждение, упомянутыми выше.
Некоторые лекарственные формы, описанные в данной области техники, предназначены для достижения пролонгированного периода сна 8 часов. Однако не всегда предпочтительно обеспечивать такой пролонгированный характер сна. Для людей, имеющих менее напряженные графики работы, такой характер сна может быть вполне подходящим, однако есть индивидуумы, например коммивояжеры, которым нужно спать только в течение небольшого количества часов, например от 5 до 6 часов, чтобы проснуться свежими и готовыми к действию. Можно считать, что для таких пациентов ослабление циркадного сигнала на пробуждение не является желательным. Лекарственные формы, полезные в способе по настоящему изобретению, способны высвобождать лекарственное вещество по истечении времени задержки для обеспечения эффективных концентраций лекарственного вещества в плазме и их совмещения с ослаблением гомеостатического механизма сна, а затем позволяют контролируемым образом снизить уровни в плазме, обеспечивая в промежуток времени от приблизительно 6 до 8 часов после введения уровни в плазме ниже эффективных уровней и тем самым предотвращая или уменьшая так называемые "остаточные явления сна".
Возможность предотвращать остаточные явления сна, даже после относительно непродолжительного сна, например порядка 5-6 часов, может быть достигнута более легким способом путем использования седативных средств с коротким временем полужизни. Обычно быстродействующее седативное средство представляет собой соединение, седативный эффект которого может быть обнаружен в любом стандартном анализе, при этом среднее время полужизни соединения в плазме составляет менее 2 часов. Конкретно в этом отношении следует отметить Залеплон, который имеет время полужизни 1 час, Эсзопиклон, Золпидем, Индиплон, Габоксадол и Рамелтеон.
Применение быстродействующего седативного средства в комбинации с нацеленным введением, предусмотренным в лекарственных формах, охарактеризованных в данном описании, предоставляет пациенту возможность иметь относительно непродолжительные интервалы сна и все еще просыпаться без остаточных явлений сна, или с ослабленными явлениями сна, и такое применение составляет особенно предпочтительный аспект настоящего изобретения.
Лекарственные вещества для применения по настоящему изобретению могут представлять собой любые из тех веществ, про которые известно, что они являются полезными для лечения бессонницы.
В частности, в качестве полезных классов лекарственных веществ можно отметить агонисты бензодиазепиновых рецепторов; антигистамины; агонисты ГАМК-А-рецепторов; имидазопиридины; уреиды; четвертичные ацетилиновые спирты; пиперидиновые производные; агонисты ГАМК-рецепторов и агонисты мелатонин-1-рецепторов.
Конкретные лекарственные вещества, которые являются полезными по настоящему изобретению, представляют собой Бротизолам, Лорметазепам, Лопразолам, Флунитразепам, Нитразепам, Эстазолам, Флуразепам, Лопразолам, Лорметазепам, Мидазолам, Нитразепам, Нордазепам, Квазепам, Темазепам, Триазолам, Доксиламин, Дифенгидрамин, Прометазин, Ниапразин, Клометиазол, Паральдегид, Хлоралгидрат, Триклофос, Залеплон, Золпидем, Ацекарбромал, Этхлорвинол, Ниапразин, Тиагабин, Глутетимид, Зопиклон, Эсзопиклон, Рамелтеон, Агомелатин, Индиплон, Эпливансерин, Лирехинил и Габоксадол. Другими веществами, известными в данной области техники по названиям их внутреннего кода, являются Anph 101, Тh 9507, Ly 156735, Org 4420, Ngd 963 и EMR 62218.
Количество лекарственного вещества, которое можно использовать, обычно зависит от типа лекарственного вещества, типа и тяжести состояния, которое лечат, и истории болезни, возраста и веса пациента. Однако, вообще говоря, лекарственные вещества можно вводить в таких количествах, чтобы достигаемая доза составляла от приблизительно 5 до 50 мг в сутки, более конкретно - от 10 до 50 мг в сутки.
В случае Залеплона, стандартная лекарственная форма для применения согласно способу по данному изобретению может содержать от 5 мг до 50 мг лекарственного вещества, более конкретно - от 5 мг до 25 мг лекарственного вещества.
Лекарственные формы для введения лекарственного вещества с целью улучшения характера сна у пациентов, страдающих от бессонницы, могут быть представлены рядом форм, которые способны содержать лекарственное вещество в биодоступной форме в эффективных количествах.
Лекарственные формы, полезные по настоящему изобретению, содержат одно или более лекарственных веществ и агент, контролирующий высвобождение.
Агент, контролирующий высвобождение, может находиться в матриксе, в котором лекарственное вещество растворено или диспергировано. Альтернативно, агент, контролирующий высвобождение, может находиться в слое или покрытии, окружающем матрикс, содержащий лекарственное вещество. Когда агент, контролирующий высвобождение, находится в слое или покрытии, матрикс также может содержать агент, контролирующий высвобождение, или он может быть адаптирован для немедленно высвобождения лекарственного вещества.
Выбирая подходящий матрикс и/или вещества покрытия, можно не только точно контролировать время задержки, но также обеспечить высвобождение всего, или по существу всего, лекарственного вещества по истечении времени задержки с требуемой скоростью для достижения пролонгированного характера сна и устранения или уменьшения случаев ночного пробуждения.
При выборе веществ покрытия предпочтительно не использовать вещества, которые набухают или желатинируются. Такими типичными веществами являются простые эфиры целлюлозы или целлюлозные производные, такие как гидроксиалкилцеллюлозы, например гидроксипропилметилцеллюлоза, или карбоксиалкилцеллюлозы и тому подобное. Такие вещества имеют тенденцию к формированию гелей, которые влияют на эффект, контролирующий высвобождение, путем образования проницаемого барьера, через которое может диффундировать лекарственное вещество. Такие вещества склонны давать ненадежные времена задержки, и следует избегать их использования в количествах, которые оказывают влияние на эффект, контролирующий высвобождение. Их свойства контролировать высвобождение обычно становятся заметны, когда они используются в количествах приблизительно 10% или более. Поэтому, когда какие-либо из вышеупомянутых веществ используют в качестве веществ покрытия, предпочтительно, чтобы они использовались только в небольших количествах, например в количестве менее 10%, более конкретно - менее 5%, еще более конкретно - менее 1%.
Агент, контролирующий высвобождение, может содержать нерастворимые или плохо растворимые в воде гидрофобные вещества, такие как воскообразные и нерастворимые эксципиенты, действие которых заключается в том, что они позволяют проникать водным физиологическим средам через повреждения и каналы в структуре веществ.
Агенты, контролирующие высвобождение, могут включать гидрофильные и/или гидрофобные вещества, такие как камеди, натуральные и синтетические воски, такие как пчелиный воск, гликовакс, гидрированное касторовое масло и карнубский воск, шеллак и минеральные и растительные масла, такие как гидрогенизированное касторовое масло, гидрогенизированное растительное масло, полиалкиленгликоли, замещенные или незамещенные углеводороды с длинной цепью (например от 8 до 50 атомов углерода), такие как жирные кислоты и спирты жирного ряда или эфиры глицерина и жирных кислот.
Агенты, контролирующие высвобождение, могут присутствовать в лекарственной форме в количествах, зависящих от требуемого профиля высвобождения. Такие агенты могут присутствовать в количествах от 1 до 99% от массы лекарственной формы.
Дополнительно к вышеуказанным ингредиентам лекарственная форма может содержать также другие эксципиенты, обычно используемые в пероральных лекарственных формах, такие как разбавители, смазывающие вещества, связующие вещества, такие как алкилцеллюлозы, такие как этилцеллюлоза, гранулирующие кислоты, красящие вещества, корригенты и скользящие вещества. Примеры таких ингредиентов включают микрокристаллическую целлюлозу или гидроортофосфат кальция, дигидрат фосфата кальция, дигидрат сульфата кальция, производные целлюлозы, декстрозу, лактозу, безводную лактозу, высушенную распылением лактозу, моногидрат лактозы, маннит, крахмалы, сорбит и сахарозу.
Данные эксципиенты могут присутствовать в различных количествах, совместимых с получением подходящей пероральной лекарственной формы. Эксципиенты могут присутствовать в количествах от 1 до 99% по массе.
Когда лекарственная форма предназначена для того, чтобы обеспечить немедленный выброс лекарственного вещества по истечении времени задержки, матрикс может содержать эксципиенты, обычно используемые в лекарственных формах немедленного высвобождения.
Матрикс, адаптированнный для немедленного выброса лекарственного вещества по истечении времени задержки, может содержать поверхностно-активный агент, такой как лаурилсульфат натрия, моноглицерат натрия, сорбитмоноолеат, полиоксиэтиленсорбитанмонолаурат, глицерилмоностеарат, глицерилмоноолеат, глицерилмонобутират, любой из поверхностно-активных полимеров плюронилового ряда, или любое другое подходящее вещество с поверхностно-активными свойствами, или любую комбинацию вышеуказанных веществ.
Поверхностно-активные вещества могут присутствовать в лекарственной форме в количествах от 0,5 до 10% по массе.
Другие ингредиенты, обычно используемые в препаратах немедленного высвобождения, включают микрокристаллическую целлюлозу (такую как Avicel), кукурузный крахмал, пептизированный крахмал (такой как Starch 1500 или National 1551), картофельный крахмал, натрий-карбоксиметилированный крахмал, натрий-карбоксиметилированную целлюлозу, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу и этилцеллюлозу, но не ограничены ими. Кроме того, связующие вещества, такие как камеди (например гуаровая смола), природные связующие вещества и производные, такие как альгинаты, хитозан, желатина и производные желатины, также являются полезными. Синтетические полимеры, такие как поливинилпирролидон (PVP), производные акриловой кислоты (Eudragit, Carbopol и так далее.) и полиэтиленгликоль (PEG), также являются полезными в качестве связующих веществ и веществ, формирующих матрикс. Для того чтобы облегчить растворение лекарственного вещества, в матрикс немедленного высвобождения может оказаться желательным включить также дезинтегрирующее вещество. С этой целью здесь может быть использовано любое подходящее таблеточное дезинтегрирующее вещество, такое как сшитая натрий-карбоксиметилцеллюлоза (Ac-Di-Sol), сшитый натрий-карбоксиметилкрахмал (Explotab, Primojel), сшитый PVP (Plasdone XL) или любое другое вещество, обладающее свойствами таблеточных дезинтегрирующих веществ.
Эти ингредиенты могут присутствовать в лекарственной форме в количествах от 1 до 99% по массе.
Специалисту должно быть совершенно очевидно, что, учитывая природу матрикса ядра и его композицию, можно получить большое разнообразие профилей высвобождения. В конкретном воплощении ядро может иметь многослойную конфигурацию и содержать как слой контролируемого высвобождения, так и слой для немедленного высвобождения. В таком воплощении предпочтительно эти слои сделать отличающимися друг от друга. Этого можно достичь, если один слой будет содержать краситель или рентгенонепроницаемое вещество, а другой - нет. Причина этого станет очевидна из описания, которое продолжится ниже.
Вышеописанные лекарственные формы снаружи могут быть покрыты фармацевтически приемлемым пленочным покрытием с эстетическими целями (например, путем включения красителя), в целях стабилизации (например, путем нанесения влагозащитного покрытия), в целях исправления вкуса лекарственного средства или с целью защиты нестабильных лекарственных веществ от агрессивной среды (например, путем использования энтеросолюбильных покрытий).
Вышеописанные лекарственные формы могут быть приготовлены согласно любой из методик известных в данной области техники. Матриксы могут быть образованы путем смешивания агента, контролирующего высвобождение, лекарственного вещества и любых подходящих таблеточных эксципиентов, включая любые из тех веществ, которые упоминались выше, и нанесения покрытия с использованием методик, известных в данной области техники.
Например, покрытия могут быть образованы путем прессования с использованием любого из известных устройств для нанесения прессованных покрытий. Альтернативно, лекарственные формы могут быть приготовлены с помощью методик грануляции и агломерации или созданы путем использования методик распылительной сушки, с последующей сушкой.
Толщину покрытия можно точно контролировать путем использования любой из ранее упомянутых методик. Специалист может выбрать толщину покрытия в качестве средства получения требуемого времени задержки и/или требуемой скорости, с которой лекарственное вещество высвобождается по истечении времени задержки.
Из соображений соответствия желаниям пациентов, предпочтительно, чтобы лекарственная форма была как можно меньше, а покрытие имело минимально-возможную толщину, совместимую с достижением требуемого времени задержки. Путем разумного выбора веществ покрытия можно получить покрытие, которое является относительно стойким к проникновению влаги, и таким образом могут быть достигнуты значительные времена задержки при относительно тонких покрытиях.
Лекарственные формы могут иметь любую подходящую форму, включая капсулы, таблетки и пилюли. Такие лекарственные формы могут быть предназначены для введения любым известным путем, включая пероральный, трансбуккальный и сублингвальный. Предпочтительно, лекарственная форма адаптирована для пероральной доставки и предназначена для приема внутрь.
В особенности предпочтительная лекарственная форма присутствует в форме таблетки с прессованным покрытием. Данная таблетка включает ядро, содержащее лекарственное вещество, и окружающее указанное ядро покрытие, которое наносят путем прессования вещества покрытия вокруг сформованного заранее ядра. Данное покрытие может содержать любой из вышеупомянутых агентов, контролирующих высвобождение.
Покрытие содержит один или более нерастворимых или плохо растворимых в воде гидрофобных эксципиентов. Предпочтительно данные эксципиенты выбраны из жирных кислот или их эфиров или солей; спиртов жирного ряда с длинной цепью; полиоксиэтиленалкиловых эфиров; полиоксиэтиленстеаратов; эфиров сахаров; лауроил-макрогол-32-глицерила, стеароил-макрогол-32-глицерила и тому подобного.
Другие эксципиенты, которые обеспечивают гидрофобные характеристики покрытий, могут быть выбраны из любого воскообразного вещества, про которое известно, что оно используется в качестве таблеточного эксципиента. Предпочтительно они имеют значение HLB (гидрофильно-липофильного баланса) меньше 5 и более предпочтительно - приблизительно 2. Подходящие гидрофобные агенты включают воскообразные вещества, такие как карнубский воск, парафин, микрокристаллический воск, пчелиный воск, воск цетиловых сложных эфиров и тому подобное, или нежирные гидрофобные вещества, такие как соли фосфата кальция, например гидроортофосфат кальция.
Покрытия, включающие вышеупомянутые вещества, обеспечивают время задержки, действуя в качестве барьера для проникновения физиологической среды. Как только среда проникает через покрытие и входит в матрикс, вызывая расширение матрикса, например, в результате набухания, гелеобразование или выделение пузырьков газа, покрытие разрушается, открывая матрикс ядра, и тем самым делает возможным высвобождение лекарственного вещества из данного матрикса. В результате этого покрытие не оказывает никакого, или по существу никакого, влияния на скорость высвобождения по истечении времени задержки.
Предпочтительно ингредиенты покрытия представляют собой соли фосфата кальция, глицерилбегенат и поливинилпирролидон или их смеси и один или более адъювантов, разбавителей, смазывающих веществ или наполнителей.
Предпочтительными компонентами покрытия являются следующие компоненты, присутствующие в обычно подходящих процентных количествах, выраженных в виде процентов от массы покрытия.
Поливинилпирролидон (Povidone) предпочтительно присутствует в количествах от приблизительно 1 до 25% от массы покрытия, более конкретно от 4 до 12%, например от 6 до 8%.
Глицерилбегенат представляет собой эфир глицерина и бегеновой кислоты (С22-жирная кислота). Глицерилбегенат может присутствовать в форме моно-, ди- или три-эфира или в виде их смеси. Предпочтительно он имеет значение HLB меньше 5, более предпочтительно - приблизительно 2. Он может присутствовать в количествах от приблизительно 5 до 85% от массы покрытия, более конкретно составляет от 10 до 70% по массе и в некоторых предпочтительных воплощениях - от 30 до 50%.
Соль фосфата кальция может представлять собой дигидрат гидроортофосфата кальция и может присутствовать в количестве от приблизительно 10 до 90% от массы покрытия, предпочтительно - от 20 до 80%, например от 40 до 75%.
Покрытие может содержать другие эксципиенты, обычно используемые при формовании твердых пероральных лекарственных форм, таких как описано выше.
Как уже отмечено выше, толщина покрытия, окружающего ядро, оказывает влияние на время задержки и, соответственно, может оказывать влияние также на скорость высвобождения лекарства в зависимости от природы выбранных веществ покрытия. Автор заявки обнаружил, что прессованное покрытие обеспечивает особенно эффективное средство для контроля толщины покрытия и, следовательно, для контроля времени задержки.
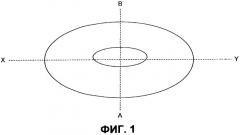
Прессованное покрытие является особенно предпочтительным, так как можно контролировать массу покрытия, диаметр пресс-формы и размер ядра для достижения точно заданной минимальной толщины покрытия в точках на лекарственной форме. Проникновение физиологической среды через покрытие в данных точках будет определять период времени, в течение которого среда достигает ядра и гидратирует его, и время задержки контролируется таким же образом.
Толщина покрытия вдоль и вокруг оси направления движения пуансона в устройстве для нанесения прессованного покрытия (ось "(А-В)"; смотри Фиг.1, приведенную ниже) определяется количеством вещества покрытия, добавленного в пресс-форму и силой сжатия, прикладываемой для формования лекарственной формы. С другой стороны, толщина покрытия вдоль и вокруг оси "(X-Y)" определяется размером ядра, его положением внутри пресс-формы и диаметром пресс-формы в устройстве для нанесения прессованного покрытия. Специалисту очевидно, что, хотя на Фиг.1 показано только двухмерное представление лекарственной формы, имеется множество осей (X-Y), ортогональных оси "А-В", которые направлены радиально от центра лекарственной формы к ее периферии, и когда упоминают толщину покрытия вокруг оси X-Y, упоминается толщина вокруг любой такой оси или вокруг всех таких осей.
При условии, что можно