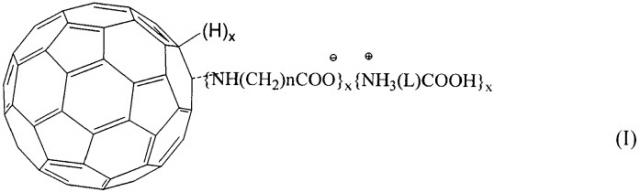Гомо- и гетеро-полиаминокислотные производные фуллерена c60, способ их получения и фармацевтические композиции на их основе
Иллюстрации
Показать всеИзобретение относится к гомо- и гетеро-полиаминокислотным производным фуллерена формулы C60(H)x{NH(CH2)nCOO-}x{NH3 +(L)COOH}x, где n=2-5, х=3, L=-(CH2)m, где m=1-5, либо -СО(CH2)kCH(NH2)-, где k=1-2, которые обладают активностью против вируса герпеса, вируса гепатита С, вирусов гриппа различной природы, ВИЧ, а также противоопухолевой и противопсориатической активностью. Изобретение относится также к способу получения указанных гомо- и гетеро-полиаминокислотных производных фуллерена и фармацевтическим композициям на их основе. 3 н. и 4 з.п. ф-лы, 19 табл., 8 пр.
Реферат
Изобретение относится к фармацевтической промышленности и медицине, а именно к новым гомо- и гетеро-полиаминокислотным производным фуллерена С60 формулы (I), а также к способу их получения и созданию фармацевтических композиций на их основе.
где n=2-5, х=3, L=-(CH2)m или -CO(CH2)kCH(NH2)-, при m=2-5, где k=1-2.
Применение производных фуллерена в медицине основано на липофильных свойствах фуллеренового ядра, позволяющих фуллереновым производным проникать через клеточные мембраны, и способности фуллерена с высоким квантовым выходом генерировать синглетный кислород, расщепляющий ДНК. Эти свойства обеспечивают функциональным производным фуллерена проявление цитотоксических, антивирусных и других свойств (Bedrov D., Smith G.D., Davande H., "Passive transport of fullerenes through a lipid membrane." J. Phys. Chem., B, 2008, v.112., p.2078-84, Qiao R., Roberts A.E., "Translocation of fullerene and its derivatives across a lipid bilayer", Nano Lett., 2007, v.7, p.614-9. Nelsen G.D., и др., "In vivo biology and toxicology of fullerenes and their derivatives". Basic and Clinical Pharmacology and Toxicology, 2008, v.103, p.197-208, Pat. US 6204391, 2005, "Water soluble fullerenes with antiviral activity").
Основной проблемой, затрудняющей биологические исследования производных фуллеренов и создания лечебных препаратов на их основе, является нерастворимость фуллеренов в воде, что затрудняет их прямое введение в организм человека. Одним из возможных вариантов преодоления этих трудностей является введение молекул фуллерена в солюбилизирующие матрицы. Известны способы получения водорастворимых форм фуллерена за счет образования аддукта с поливинилпирролидоном (Kiselev O.I. et al. // Mol. Materials. 1998. V.11. P.121; Piotrovsky L.B. et al. // Ibidem. 2000. V.13. P.41). Показана его эффективность против вируса гриппа А- и В-типа.
Известен также способ получения фуллеренов, включающий смешивание предварительно растворенных в органическом растворителе фуллеренов с полимерной матрицей в хлороформе, выпаривание смеси под вакуумом до полного удаления растворителей, растворение полученного комплекса в фосфатно-солевом буфере (рН 7,4-7,6) с последующей обработкой продукта ультразвуком (RU №2162819, 02.10.01). При этом в качестве водорастворимой полимерной матрицы используют мембранные кефалины. Продукты, полученные в результате таких модификаций, являются нестабильными композициями с ограниченными возможностями хранения.
Перспективным методом получения водорастворимых фуллереновых композиций является химическая модификация сферы фуллерена введением гидрофильных солюбилизирующих лигандов. В международной заявке WO 2005/070827 представлена серия аминокислотных производных фуллерена, полученных по реакции циклоприсоединения аминокислотных фрагментов к фуллерену, и продуктов их внедрения в биологически-активные органические субстраты. Представленные в данном техническом решении методы синтеза многостадийны и нетехнологичны. Полученные соединения имеют низкую растворимость в воде.
В настоящее время получен большой ряд функционализированных фуллеренов, содержащих гидрофильные фрагменты как в боковой цепи присоединенных к фуллерену лигандов (детергентный тип комплексов), так и сферический тип производных, когда имеются полярные группы, распределенные по фуллереновой сфере (такой тип включает фуллеренолы, аминоаддукты).
Наиболее перспективными для использования являются аминокислотные производные фуллерена.
Аналогами настоящего изобретения являются соединения и способы их получения, описанные в международной заявке WO 2009/00203, а также патенте РФ №2236852.
В международной заявке WO 2009/00203 описаны полифункциональные аминокислотные производные фуллерена формулы , где R=Н, моно- или дигидроксиалкил, галоидалкил, моно- или динитроксиалкил, малеинимид; N-Z представляет собой фрагмент α, β, γ, ω-аминокислоты общей формулы -NH-CmH2m-COOM или C4H8N-COOM, где m=2-5, а М представляет собой нитроксиалкильную группу, алкильную группу или соль щелочного металла, или дипептид. Данные соединения получены по реакции эквимолярного присоединения аминокислот к фуллерену с последующим замещением активного водорода органическим биологически активным лигадом с образованием соединений типа. Полученные соединения, обладают ингибирующей активностью в отношении метастазов опухоли, усиливают антилейкемическую активность циклофосфамида, и могут быть пригодны в качестве доноров монооксида азота или в качестве вазодилататоров быстрого действия для антигипертинезивной терапии.
Основным недостатком соединений по данной заявке является то, что они являются продуктами ковалентного присоединения, содержат малое количество полярных групп и имеют низкую растворимость в воде.
Наиболее близким по технической сущности и достигаемому результату является средство для ингибирования репродукции оболочечных вирусов и способ его получения (патент РФ №2236852). В результате взаимодействия фуллерена с солью аминокислоты в среде органического растворителя в присутствии полиалкиленоксида получены фуллеренполикарбоновые анионы общей формулы
C60Hn[NH(СН2)mC(O)O-]n,
где С60 - фуллереновое ядро, NH(CH2)mC(O)O- - аминокарбоновый анион; m равно целому числу от 1 до 5, п равно целому числу от 2 до 12.
Для получения этих соединений к раствору фуллерена в о-дихлорбензоле (толуоле или любом другом органическом растворителе) вносят аминокислоту в виде соли (калиевой или натриевой), затем добавляют солюбилизатор. Порядок внесения в реакционную среду аминокислоты и солюбилизатора не важен, можно вносить их в виде комплекса, предварительно смешав. В качестве солюбилизатора используют различные полиалкиленоксиды: полиэтиленгликоли мол. массы от 150 до 400, и выше 400 (например, ПЭГ-1500), а также диметиловый эфир полиэтиленгликоля мол. массы 500. Для увеличения скорости реакции добавляют любой сильный восстановитель (щелочные металлы).
Соотношение фуллерена и аминокислоты увеличено более чем в 50 раз. Превращение в желаемую фармацевтически приемлемую соль, особенно натриевую или калиевую, выполнялось путем обработки кислоты подходящим основанием или путем добавления соли слабой летучей кислоты. В частности, не растворимая в воде фуллеренполикарбоновая кислота превращается в более предпочтительные фармацевтически приемлемые соли, такие как натриевая соль, которые растворимы в воде. Добавление соли слабой летучей кислоты происходит путем обработки раствора солью щелочного металла и слабой летучей кислоты. При концентрировании раствора путем выпаривания или лиофилизации слабая кислота удаляется, а фуллеренполикарбоновые кислоты выделяются в виде их солей щелочных металлов. Целевой продукт по данному изобретению характеризуется постоянством состава, содержание в целевом продукте основного вещества составляет всего 87,8%. В описании отсутствуют технологические регламенты, связанные с определением оптимальных количеств исходных соединений, соотношений количеств используемых растворителей и, особенно, описания методов выделения искомых соединений.
Основными недостатками фуллеренаминокислотных производных, полученных представленным в патенте методом получения является то, что данным способом получают смесь фуллеренкарбоксилатных анионов, как солевых, так и кислотных форм. Получить индивидуальное соединение способом, описанным в патенте, не представляется возможным. Также фуллерен-полиаминокислоты, полученные запатентованным способом, в кислотной форме практически нерастворимы в воде. Получить стабильную фармацевтическую композицию с фуллеренполикарбоновыми анионами не удалось, т.к. в процессе хранения соединения выпадают в осадок.
Применение в синтезе большого избытка калиевой или натриевой солей аминокислот и больших избытков растворителей приводит к возникновению экологических проблем, связанных с утилизацией отходов производства, а также к удорожанию процесса производства. Использование щелочных металлов для увеличения скорости реакции является технологически невозможным при использовании хлорированных ароматических растворителей.
Однако представленные в патенте уникальные биохимические свойства препаратов на основе соединений фуллерена с аминокислотными фрагментами ставят задачу получения новых производных фуллерена, разработки высокотехнологичного способа их промышленного получения, отличающегося простотой и эффективностью процесса, чистотой, экологичностью и доступностью исходных реагентов.
Для решения данной задачи предлагается группа изобретений, объединенных единым изобретательским замыслом, а именно: гомо- и гетеро-полиаминокислотные производные фуллерена, способ получения производных фуллерена и фармацевтические композиции, включающие гомо- и гетеро-полиаминокислотные производные фуллерена в качестве действующего вещества. Варьируя соотношение реагентов и условия проведения процесса, по заявляемому способу можно получать различные производные фуллерена.
Указанная задача решается гомо- и гетеро-полиаминокислотными производными фуллерена общей формулы (II):
В случае, когда m=n получают гомо-полиаминокислотные производные фуллерена, при m≠n - гетеро-полиаминокислотные производные фуллерена.
Указанная задача решается способом получения гомо- и гетеро-полиаминокислотные производных фуллерена, образующихся при взаимодействии фуллерена с 10-кратным мольным избытком безводных калиевых солей аминокислот в среде органического ароматического растворителя при добавлении к полученной суспензии межфазного катализатора при перемешивании и нагревании до температуры не выше 60°С до полного обесцвечивания раствора и формирования твердого осадка, который затем выделяют, растворяют в воде, после чего осуществляют обработку водных растворов калиевых солей фуллеренполиаминокислот 1Н раствором органических или минеральных кислот с последующим добавлением растворов аминокислот в полярных растворителях. В способе используют свежеприготовленные безводные калиевые соли аминокислот в мелкодисперсном состоянии, а выделение твердого осадка калиевых солей фуллеренполиаминокислот осуществляют фильтрованием, промывкой этиловым спиртом и высушиванием. В процессе экспериментов было выявлено, что фуллеренполиаминокислоты указанного состава могут быть получены только при использовании свежеприготовленных безводных калиевых солей аминокислот. В качестве межфазного катализатора используют метиловые эфиры полиэтиленоксидов молекулярной массы 200, 400, 500.
Указанная задача решается также созданием фармацевтических композиций, содержащих в качестве активного вещества гомо- и гетеро-полиаминокислотные производные фуллерена формулы (II), обладающих активностью против вируса герпеса, вируса гепатита С, вирусов гриппа различной природы, ВИЧ, а также противоопухолевой и противопсориатической активностью. Фармацевтические композиции могут быть выполнены в форме таблеток, капсул, мазей, эмульсий, суппозиториев, растворов, спреев.
Фармацевтические композиции по предложенному техническому решению содержат соединение общей формулы (II) в количестве, эффективном для достижения желаемого результата, и могут быть введены в виде стандартных лекарственных форм (например, в твердой, полутвердой или жидкой формах), содержащих соединения предложенного технического решения в качестве активного ингредиента в смеси с носителем или наполнителем, пригодным для внутримышечного, внутривенного, перорального, сублингвального, ингаляционного, местного, назального, ректального и вагинального введения. Активный ингредиент может быть включен в композицию вместе с обычно используемыми нетоксичными фармацевтически приемлемыми носителями, пригодными для изготовления растворов, таблеток, пилюль, капсул, драже, суппозиториев, эмульсий, суспензий, мазей, гелей и любых других лекарственных форм.
Конкретный уровень дозировок и частота приема лекарства для каждого конкретного пациента будет зависеть от большого числа факторов, включая активность конкретного производного фуллерена, метаболическую стабильность и длительность действия, скорость выделения, возраст пациента, вес тела, общее состояние здоровья, пол, лекарственные комбинации, а также тяжесть заболевания у индивида, подвергаемого лечению.
Для орального применения в виде суспензий композиции готовят согласно методам, широко известным в области приготовления фармацевтических рецептур, и они могут содержать микрокристаллическую целлюлозу или ее производные для обеспечения массы, альгиновую кислоту или альгинат натрия в качестве суспендирующего агента, метилцеллюлозу в качестве усилителя вязкости и подслащивающие агенты и/или отдушки, известные в этой области. В форме таблеток такие композиции могут содержать микрокристаллическую целлюлозу, кальций фосфат, крахмал, стеарат магния и лактозу и/или другие эксципиенты, связующие вещества, расширители, дезинтеграторы, разбавители и смазывающие вещества, известные в данной области.
При применении в виде назальных аэрозолей или путем ингаляции такие композиции готовят методами, хорошо известными в области фармацевтических рецептур, и они могут выпускаться в виде растворов на физиологическом растворе, с использованием бензойной кислоты или других подходящих консервантов, промоторов адсорбции для усиления биоприменимости, и/или других солюбилизирующих или диспергирующих агентов, известных в данной области.
Растворы или суспензии для инъекций могут формироваться согласно известным методам, с использованием нетоксичных, парентерально применимых разбавителей или растворителей, таких как маннит, 1,3-бутандиол, вода, раствор Рингера или изотонический раствор хлористого натрия или подходящих диспергирующих или смачивающих и суспендирующих агентов, таких как стерильные, мягкие, устойчивые масла, включая синтетические моно- или диглицериды, или жирные кислоты, включая олеиновую кислоту.
При ректальном или вагинальном применении в виде свечей такие композиции могут готовиться путем смешивания лекарства с таким нераздражающим эксципиентом, как масло какао, синтетические глицеридные сложные эфиры или полиэтиленгликоли, которые являются твердыми веществами при обычных температурах, но сжижаются и/или растворяются в полости тела с выделением лекарства.
При местном применении в виде мазей, гелей, кремов, линиментов и т.д. такие композиции могут готовиться путем смешивания активных ингредиентов с приемлемой мазевой основой.
В качестве мазевой основы могут быть использованы жировые, углеводородные или гидрофильные основы, например вазелин, вазелиновое масло, парафин, воск, ланолин, полиэтиленгликоль и др.
В качестве основы для гелей могут быть использованы метилцеллюлоза, натриевая соль карбоксиметилцеллюлозы, оксипропилцеллюлоза, полиэтиленгликоль или полиэтиленоксид, карбопол, поливинилпирролидон, поливиниловый спирт и т.д.
Технический результат изобретения состоит в том, что получены новые гомо- и гетеро-полиаминокислотные производные фуллерена формулы: где n=2-5, х=3, L=-(СН2)m, где m=1-5, либо -CO(CH2)kCH(NH2)-, где k=1-2, характеризующиеся тем, что соединения содержат ковалентно-связанные аминокислотные группы и полярные ионные формы аминокислот, разработан новый промышленный способ получения аминокислотных производных фуллерена С60 с различным соотношением компонентов с использованием реакции нуклеофильного присоединения к фуллерену аминокислоты с образованием продуктов полиприсоединения. Предложены фармацевтические композиции, содержащие в качестве активного вещества гомо- и гетеро-полиаминокислотные производные фуллерена формулы (II), обладающие активностью против вируса герпеса, вируса гепатита С, вирусов гриппа различной природы, ВИЧ, а также противоопухолевой и противопсориатической активностью. Фармацевтические композиции выполнены в форме таблеток, капсул, мазей, суппозиториев, растворов, спреев.
Соединения обладают новыми свойствами:
- растворимостью в смеси диметилсульфоксид - вода (1:100, 1:200);
- высокой биодоступностью;
- высокой эффективностью воздействия на инфицированные клетки;
- низкой токсичностью.
Заявляемый способ позволяет получить различные гомо- и гетеро-полиаминокислотные производные фуллерена в зависимости от соотношения реагентов и условий проведения процесса. Способ основан на использовании в стадии синтеза оптимальных соотношений исходных реагентов (1:10), минимальных количеств органического растворителя и межфазного катализатора, с последующем выделением заявляемых композиций с использованием концентрированных растворов органических и минеральных кислот, с последующим введением аминокислот ряда NH2LCOOH, где L=-(СН2)m, либо -CO(CH2)kCH(NH2), что приводит к количественному получению фуллеренаминокислотных композиций определенного состава и возможности применения заявляемого способа для их промышленного синтеза, отличающегося эффективностью и экологичностью.
Заявляемое изобретение иллюстрируется следующими примерами.
Пример 1. Получение фуллеренполиаминокапроновой кислоты формулы
К раствору 7,2 г (0,01 моля) фуллерена С60 в 400 мл о-дихлорбензола добавляют 17 г (0,1 моля) свежеполученной тонкоизмельченной безводной калийной соли ε-аминокапроновой кислоты. К полученной суспензии при перемешивании и нагревании не выше 80°С прибавляют в течение 2-х часов смесь о-дихлобензола и метилового эфира полиэтиленгликоля 400 в соотношении 2,5:1. Реакционную смесь перемешивают при температуре не выше 60°С в течение 2-3 часов до полного обесцвечивания раствора и формирования твердого осадка. Затем смесь фильтруют, осадок на фильтре промывают несколькими порциями этилового спирта и высушивают в вакууме при температуре не выше 60°С. Выделенную калиевую соль фуллеренаминокислоты растворяют в 2 л дистиллированной воды. В раствор медленно при перемешивании добавляют 1Н раствор соляной кислоты до рН 5,1. Смесь отстаивают до полного высаживания продукта. Затем водный слой декантируют. К осадку, представляющему собой тонкую взвесь твердого продукта в воде, медленно при перемешивании добавляют раствор аминокапроновой кислоты в смеси диметилсульфоксида с водой (1:10). Смесь перемешивают до полного растворения. Затем растворители удаляют отгонкой в вакууме. Твердый остаток высушивают при температуре не выше 60°С в вакуумном сушильном шкафу.
Выход целевого продукта количественный по отношению к исходному фуллерену. Соединение представляет собой темно-коричневое твердое вещество, растворимое в смеси диметилсульфоксид: вода - 1:200, ограниченно растворимое в смесях CH3CN:H2O - 1:1 и ДМФА - Н2О.
Термогравиметрический анализ продукта показывает наличие в комплексе 3 молей слабосвязанной аминокапроновой кислоты, отщепляющейся с разложением при температуре 200°С. Термическое разложение фуллеренполиаминокислоты проходит при температуре 345°С с выделением фуллерена и продуктов его окисления. Количество твердого остатка после разложения соединения, представляющего собой по данным дифракционного анализа незамещенный фуллерен, соответствует соотношению С60:аминокислотный фрагмент как 1:6.
Кислотный гидролиз соединения 0,1 молярным раствором HCl приводит к выделению гидрохлорида аминокапроновой кислоты в количестве 3 молей на моль исходного вещества.
Адсорбция соединения на поверхности силикагеля приводит к расщеплению ионных связей и выделению свободной аминокапроновой кислоты. Последующим фотометрическим анализом продуктов реакции аминокапроновой кислоты с нингидрином определено количество ионносвязанных аминокислотных групп. Их количество соответствует составу заявляемых соединений.
Электронный спектр поглощения продукта не содержит полос поглощения свободного фуллерена.
ИК-спектр продукта содержит полосы поглощения, характерные для N-замещенных аминокислот: группа -СООН - 1704 см-1, 1658 см-1, группы - 3100, 2550, 2000 см-1, -N-H-валентные колебания 3300 см-1, N-H-деформационные 1552 см-1, полосы поглощения С60-NH-R - 1104 см-1, 930 см-1, 830 см-1.
Элементный анализ продукта показывает следующие соотношения элементов: %С=76,84; %Н=4,80; %N=5,15, для брутто-формулы C96H75N6O12 (молекулярная масса 1503) рассчитано: %С=76,49, %Н=4,90, %N=5,57.
Пример 2. Получение N-фуллерен-γ-аминомасляной кислоты с β-аланином формулы:
К раствору 7,2 г (0,01 моля) фуллерена С60 в 400 мл о-дихлорбензола добавляют 14 г (0,1 моля) свежеполученной безводной калиевой соли γ-аминомасляной кислоты. К полученной суспензии при перемешивании и нагревании не выше 60°С прибавляют в течение 2-х часов смесь о-дихлобензола и метилового эфира полиэтиленгликоля 400 в соотношении 3:1. Реакционную смесь перемешивают при температуре не выше 60°С в течение 2-3 часов до полного обесцвечивания раствора и формирования твердого осадка. Затем смесь фильтруют, осадок на фильтре промывают несколькими порциями этилового спирта и высушивают в вакууме при температуре не выше 60°С. Выделенный продукт растворяют в дистиллированной воде. В раствор медленно при перемешивании добавляют 1Н раствор соляной кислоты до рН 5,1. Смесь отстаивают до полного высаживания продукта. Затем водный слой декантируют. К осадку, представляющему собой тонкую взвесь твердого продукта в воде, медленно при перемешивании добавляют спиртовой раствор 2,7 г (0,03 моля) β-аланина. Смесь перемешивают в течение 2 часов до полного растворения осадка. После удаления растворителя выделено 12 г продукта.
Соединение представляет собой темно-коричневое твердое вещество, растворимое в смеси диметилсульфоксид:вода - 1:200, ограниченно растворимое в смесях CH3CN:H2O - 1:1 и ДМФА - H2O.
Термогравиметрический анализ продукта показывает наличие в комплексе 3 молей слабосвязанного β-аланина, отщепляющегося при температуре 210°С. Термическое разложение всего комплекса проходит при температуре 335°С с выделением фуллерена в количестве соответствующем соотношению С60: аминокислотные фрагменты как 1:6.
Кислотный гидролиз полученного соединения 0,01 молярным раствором HCl приводит к образованию гидрохлорида β-аланина в количестве 3 молей на моль исходного вещества.
Спектры продукта в растворах в диметилсульфоксиде и в 0,1 Н водном растворе NaOH содержат полосы поглощения в области 217, 260, 335 нм, характерные для производных фуллерена и не содержат полос поглощения свободного фуллерена.
ИК-спектр соединения содержит полосы поглощения, характерные для N-замещенных аминокислот и катионных форм аминокислот: группы -СООН- 1717 см-1, 1710 см-1, 1658 см-1, группы 3100, 2550, 2000 см-1, N-H-валентные колебания 3400 см-1, N-H-валентные колебания - 3400 см-1, N-H-деформационные - 1552 см-1, полосы поглощения С60-NH-R - 1104 см-1, 930 см-1, 830 см-1.
Элементный анализ продукта показывает следующие соотношения элементов: %С=75,24; %Н=3,80; %N=6,25, для брутто-формулы C81H48N6O12 (молекулярная масса 1296) рассчитано: %С=75,00, %Н=3,70, %N=6,48.
Пример 3. Получение N-фуллерен-ε-аминокапроновой кислоты с глутамином формулы:
Процесс проводят так же, как в примере 1. Только на стадии обработки осадка после осаждения кислой формы фуллерен-аминокапроновой кислоты добавляют раствор 4,5 г глутамина в смеси диметилсульфоксид - вода. Растворители удаляют отгонкой в вакууме.
Элементный анализ твердого продукта показывает следующие соотношения элементов: %С=71,34; %H=4,80; %N=8,25, для брутто-формулы C93H69N9O15 (молекулярная масса 1551) рассчитано: %С=71,95, %Н=4,50, %N=8,12.
ИК-спектр соединения содержит полосы поглощения, характерные для N-замещенных аминокислот и катионных форм аминокислот: группы -СООН - 1714 см-1, 1707 см-1, -С=O(NH-С60) 1658 см-1, группы 3000, 2550, 2000 см-1, N-H-валентные колебания 3400 см-1, N-H-деформационные 1552 см-1, полосы поглощения С60-NH-R - 1104 см-1, 930 см-1, 830 см-1.
Кислотный гидролиз соединения приводит к выделению глутамин гидрохлорида в количестве 3 молей на моль исходного вещества.
Была изучена противовирусная активность соединений в отношении ВИЧ, ВПГ, вируса гриппа, а также противоопухолевая активность. В приведенных ниже примерах препарат, полученный способом, описанным в примере 1, назван по тексту препарат №1 (фуллеренполиаминокапроновая кислота).
Пример 4. Исследование активности препарата фуллеренполиаминокапроновой кислоты в отношении вируса иммунодефицита человека.
Исследования проводились в лаборатории вирусов иммунодефицита с испытательным Центром по экспертной оценке противовирусных и дезинфекционных средств (ГУ НИИ вирусологии им. Д.И.Ивановского РАМН).
К клеткам добавляли исследуемый препарат и инфицировали вирусом в дозе 0,01 ТЦИД50/клетка. Инкубировали культуры клеток при 37°С в атмосфере с 5% CO2 и 98% влажности 4-5 дней. Учет результатов проводили окрашиванием клеток с помощью красителя и световой микроскопии: исследование цитопатического эффекта вируса (ЦПД) и вирусиндуцируемого синци-тийобразования (синцитий - конгломерат нескольких клеток с общей клеточной оболочкой, образовавшейся в результате слияния их мембран).
Степень цитодеструкции оценивали под микроскопом по общепринятой четырехкрестовой системе знаками + или - соответственно количеству погибших клеток в каждой из четырех лунок, соответствующих одному исследуемому показателю.
++++ - 100%ая гибель клеток в четырех лунках, использованных в опыте на одно разведение
+++ - 75%ая гибель клеток в каждой из четырех лунок,
++ - 50%ая гибель клеток в каждой из четырех лунок,
+ - 25%ая гибель клеток в каждой из четырех лунок,
+- - начало дегенерации,
- - отсутствие цитодеструкции.
Результаты исследования представлены в таблицах 1-2.
Полученные данные (таблица 1, 2) показали, что исследованные препараты фуллеренполиаминокапроновой кислоты обладали противовирусной активностью в отношении вируса иммунодефицита человека типа 1. ЭК50 (50%-эффективная концентрация) препарата 0,9 мкг/мл. Препарат в концентрациях 0,5-10 мкг/мл не обладал цитотоксическим действием на клетки.
Пример 5. Исследование противогерпетической активности препарата фуллеренполиаминокапроновой кислоты в экспериментах in vitro. Исследование выполнялось ГУ НИИ вирусологии им. Д.И.Ивановского РАМН, г.Москва.
В процессе исследования были изучены цитотоксическая и противогерпетическая активность препарата в клеточных культурах Vero.
В исследовании были использованы: перевиваемая культура клеток почки обезьян (VERO), полученная из коллекции культур тканей Института вирусологии им. И.Д.Ивановского РАМН; вирус герпеса простого (Herpes simplex virus), тип 1, штамм Л2, размноженный в клетках Vero. Клетки инфицировали вирусом в дозе 100 ТЦИД50/0,2 мл и 1000 ТЦИД50/0,2 мл.
Для исследования представлен образец субстанции в виде порошка темного цвета.
Препарат первоначально растворяли в диметилсульфоксиде (ДМСО) в соотношении 1:20, а затем готовили рабочие концентрации на среде ИГЛА MEM. Оценку активности испытанных образцов проводили по степени защиты клеток от вирусиндуцированного цитотоксического действия ВПГ микроскопическим методом и методом МТТ по оптической плотности.
Результаты исследования. Исследована токсичность веществ в использованных концентрациях, а также растворителя (1,5 мл ДМСО в 50 мл воды).
Препарат в конечных концентрациях от 50 до 1000 мкг/мл добавляли к монослою клеточной культуры VERO и инкубировали в атмосфере 5,0% CO2 при 37°С в течение 24-48 часов. Монослой клеток окрашивали 0,4% раствором трипанового синего и исследовали под микроскопом.
Образец в концентрации до 100 мкг/мл не оказывал токсического действия на культуру клеток VERO, при концентрации 200 мкг/мл появляются признаки токсического действия - отмечается гибель 25% клеток. Концентрации в 500 мкг/мл и более уже токсичны для Vero клеток (табл.3).
Исследование защитных свойств образца проводили при одной схеме введения - за час до инфицирования, и при двух дозах вируса - 100 ТЦИД50 и 1000 ТЦИД50.
Результаты представлены в таблицах 3-7.
Проведенные исследования показали, что введение за 60 минут образца препарата до инфицирования клеточной культуры вирусом герпеса простого в дозе 100 ТЦИД50 полностью защищает клетки от цитодеструктивного действия вируса при всех испытанных концентрациях - от 5,0 мкг/мл и выше (см. табл.4 и 5).
При увеличении инфицирующей дозы вируса герпеса до 1000 ТЦИД50/0,2 мл (см. табл.6 и 7), образец препарата обеспечивает полную защиту чувствительной культуры клеток от цитодеструктивного действия вируса при данной схеме испытания (инфицирование клеток вирусом через 60 минут после внесения препарата в культуральную среду).
Пример 6. Изучение активности фуллеренполиаминокапроновой кислоты (препарат №1) в отношении вируса гриппа A/IIV-Moscow/01/2009 (H1N1)swl.
Исследования проводились в ГУ НИИ вирусологии им. Д.И.Ивановского РАМН, г.Москва. В задачу исследований входило изучение противовирусной активности этих препаратов в культуре клеток MDCK в отношении вируса гриппа A/IIV-Moscow/01/2009 (H1N1)swl.
Препарат разводили в ДМСО (5 мг субстанции + 0,5 мл ДМСО) с последующим добавлением 4,5 мл среды для культур клеток MEM, получая, таким образом, сток в концентрации 1,0 мг/мл. В последующем проводили разведения стоков средой MEM до рабочих концентраций 6,5 мкг/мл - 12,5-25,0-50,0-100 мкг/мл.
Определение противовирусной активности веществ проводили по снижению репродукции вируса гриппа в культуре клеток MDCK, выявляемой ИФА.
С этой целью клетки МДСК выращивали в 96-луночных планшетах до полного монослоя, отмывали от ростовой среды и вносили вещества в двукратной концентрации в 100 мкл среды MEM. Инфицирование вирусом в рабочей дозе 100-1000 ТЦИД50 проводили в двух режимах: через 2 часа после внесения веществ и одномоментно. Планшеты инкубировали в термостате с CO2 в течение 24 часов при 37°С. После инкубации среду удаляли и клетки фиксировали 80% ацетоном в PBS в течение 15 минут, хорошо высушивали и осуществляли постановку ИФА, проводя последовательно адсорбцию специфических реагентов - моноклональных антител, конъюгата и субстрата (ортофенилендиамин). Реакцию учитывали по оптической плотности при 492 нМ на спектрофотометре фирмы «Биоком». Каждое разведения вируса исследовали в 3-х повторах, для которых вычисляли среднее значение оптической плотности (ОП). Процент ингибирования определяли, как отношение между разницей ОП опыта и ОП клеточного контроля, разделенное на разницу ОП вирусного контроля и ОП клеточного контроля, умноженное на 100%. На основании полученных данных определены значения минимальной концентрации вещества, вызывающей 50,0% ингибирование вирусной репродукции (МИК50).
Оценку подавления репродукции вируса гриппа A(H1N1) проводили в 3-х опытах при разной множественности заражения. Результаты представлены в табл.8 (протоколы 3 опытов) и табл.9 (средние значения полученных результатов 3 опытов).
Как видно из таблицы 9, четко прослеживается зависимость степени репродукции и концентрации препарата: с повышением концентрации - снижается репродукция вируса. Кроме того, значительных отличий в показателях при разных режимах инфицирования (через 2 часа после внесения препарата или одномоментно) не отмечено.
Таким образом, полученные результаты изучения активности разных разведении препарата в отношении вируса гриппа A/IIV-Moscow/01/2009 (H1N1)swl выявили высокую активность подавления его репродукции в культуре клеток MDCK. При этом режимы внесения препаратов за 2 часа до инфицирования или одновременно с инфицированием не влияли на их активность в культуре клеток MDCK.
Пример 7. Изучение противовирусной активности фуллеренполиа-минокапроновой кислоты (препарат №1) на модели гриппозной пневмонии мышей.
Исследования выполнялись в центре химии лекарственных средств (ЦХЛС-ВНИХФИ), г.Москва.
В работе использовали препарат в виде темно-коричневого кристаллического порошка. Для перорального применения готовили необходимые дозы препарата, растворяя навески в 1% растворе крахмала, сваренного на воде. Для внутрибришинного и внутримышечного применения навески препарата растворяли в 1,5% растворе ДМСО.
В работе был использован вирус гриппа А/Аичи/2/69 (H3N2), адаптированный к мышам. Данный вирус широко используется для определения эффективности противовирусных препаратов на модели гриппозной пневмонии мышей и был получен из музея вирусных штаммов и клеточных культур ГУ НИИ вирусологии РАМН. Для подготовки инфицирующего материала мышей заражали интраназально аллантоисным вирусом, после проявления признаков болезни их забивали и в стерильных условиях получали гомогенат легочной ткани. Далее этот гомогенат использовали для заражения 10-дневных куриных эмбрионов, из которых получали аллантоисный вирус и после титрования на его мышах использовали для инфицирования животных.
Белых беспородных мышей (самки) массой 12-14 г получали из питомника «Андреевка» (Московская обл.) и содержали на стандартном рационе в регламентированных условиях вивария.
Предварительно взвешенные мыши (самки нелинейные, средний вес 12-14 г) инфицировались интраназально под легким эфирным наркозом вирусом гриппа А/Аичи/2/69 (H3N2) (10ЛД50 в 100 мкл). В предварительном опыте было проведено определение ЛД50 путем титрования аллантоисного вируса на таких же мышах, которые затем использовались в основном опыте. Была использована следующая схема лечения исследуемым препаратом: за 24 часа до инфицирования, за 1 час до инфицирования, через 24 часа и далее 1 раз в день через 24 часа в течение 5 дней. Для перорального введения использовали одноразовый инсулиновый шприц со специальной иглой (лаваж), каждую дозу вводили в объеме 100 мкл. Для внутрибрюшинного и внутримышечного лечения также каждую дозу вводили в объеме 100 мкл. Группа вирусного контроля представляла собой 10 мышей, инфицированных вирусом, но не леченных препаратами. Также в опыте было две группы по 10 неинфицированных мышей, которым вводили внутрибрюшинно и внутримышечно по 100 мкл 1,5% ДМСО, который использовался в качестве растворителя препаратов. В остальных группах также изначально было по 10 животных. За леченными и контрольными животными велось ежедневное наблюдение, в первые 5 дней после инфицирования мыши взвешивались каждый день, далее - через день. Химиотерапевтическую активность препарата на модели гриппозной пневмонии мышей оценивали по трем критериям: показатель защиты от смертельной вирусной инфекции, увеличение средней продолжительности жизни и уменьшение снижение веса в группах животных, леченных препаратом по сравнению с контрольной группой.
Лечение фуллеренаминокапроновой кислотой было эффективно, уменьшая смертность мышей от гриппозной пневмонии и потерю их веса и увеличивая среднюю продолжительность жизни по сравнению с вирусным контролем. Эффективность данного лечения зависела от дозы препарата и способа лечения. Результаты представлены в таблицах 10-11.
Наиболее эффективным по всем трем параметрам (показатель защиты от смертности, средняя продолжительность жизни и потеря веса) было лечение фуллеренполиаминокапроновой кислотой внутримышечно, которое в дозах 100 и 200 мг/кг/день предотвращало гибель 60-70% зараженных животных и потерю их веса, а также увеличивало продолжительность их жизни почти в 2 раза. Внутрибрюшинное лечение фуллеренполиаминокапроновой кислотой было эффективно только в дозах 50 и 100 мг/кг/день. Гибель животных, значительное снижение средней продолжительности жизни и веса мышей при внутрибрюшинном лечении их фуллеренполиаминокапроновой кислотой в дозе 200 мг/кг/день дают основание полагать, что данная