Способ выделения кверцетина из водного раствора
Иллюстрации
Показать всеИзобретение относится к способу выделения кверцетина из водного раствора, включающего его пассивную диффузию через предварительно полученную молекулярно-импринтированную полимерную мембрану. Импринтированную кверцетином мембрану получают полимеризацией метакриловой кислоты в качестве функционального мономера, этиленгликольдиметакрилата в качестве сшивателя и 2-гидрокси-2-метил-1-фенилпропанона-1 в качестве фотоинициатора, вводя в состав полимеризационной смеси сульфат меди (II) или ацетат никеля (II). Диффузию кверцетина через полученную мембрану проводят из смеси тетрагидрофуран - ацетатный буферный раствор в тетрагидрофуран или из ацетатного буферного раствора в этилацетат или в смесь этанол - уксусная кислота (9:1 об.). Технический результат - повышение селективности процесса. 2 табл., 2 пр., 1 ил.
Реферат
Краткое описание изобретения. Изобретение относится к аналитической химии и может быть использовано для отделения кверцетина от других биофлавоноидов (что может быть использовано для последующего определения его концентрации, но не входит в предмет данного патента). Выделение кверцетина осуществляют методом пассивной диффузии через полимерную молекулярно-импринтированную мембрану. Мембрану предварительно получают методом фотоинициированной полимеризации мономера и сшивателя в присутствии кверцетина и растворителя с последующим вымыванием кверцетина из полученной мембраны.
Определения используемых понятий. Молекулярный импринтинг - метод получения селективных полимерных сорбентов и мембран, основанный на полимеризации функционального мономера в присутствии сшивателя и порогенного растворителя, при котором в полимеризационную смесь вводят будущий аналит, называемый в данном случае темплатом. После полимеризации и вымывания темплата получают импринтированный полимер, в котором образовались молекулярные отпечатки, комплементарные молекулам темплата. Сорбция темплата импринтированным полимером повышена по сравнению с соответствующим полимером, полученным в отсутствие темплата [1]. Если импринтированный полимер получен в виде мембраны (молекулярно-импринтированная мембрана), то наличие молекулярных отпечатков повышает концентрацию темплата в фазе мембраны, что может способствовать более быстрой диффузии темплата через такую мембрану [2].
Выделение аналита из смеси с помощью импринтированной мембраны проводят методом пассивной диффузии. Для этого используют ячейку, в которой два раствора - исходный и принимающий - разделены импринтированной мембраной.
Величины, используемые как характеристики проницаемости и селективности мембраны.
Степень переноса флавоноидов, продиффундировавших через мембрану, рассчитывали как
где С1 - концентрация флавоноида в принимающей фазе после диффузии через мембрану, С2 - концентрация флавоноида в исходной фазе. Концентрации определяли спектрофотометрически, зная молярные коэффициенты поглощения, л/моль∙см: εкварцетин=2,2∙104, εнарингенин=1,7∙104, εрутин=1,1∙104 .
Селективность разделения флавоноидов А и В характеризовали фактором разделения Sf, который определяется как отношение концентраций А и В после проведения разделения. Поскольку объемы исходной и принимающей фаз и другие условия были идентичными, для расчета фактора разделения вместо концентраций использовали степени переноса флавоноидов через мембрану:
где СА и СB - концентрации флавоноидов А и В, RA и RB - их степени переноса.
Импринтинг-фактор рассчитывали как отношение степеней переноса флавоноида при использовании импринтированной мембраны и неимпринтированной мембраны, полученной в отсутствие темплата:
где RA и R' A - степени переноса флавоноида через импринтированную и неимпринтированную мембраны соответственно. Если импринтинг-фактор превышает единицу, то можно говорить о получении молекулярного отпечатка.
Аналоги изобретения. Известные сорбенты, селективные, в частности, к кверцетину, получают путем полимеризации в массе [3, 4, 6-9]. Недостатки такого метода получения сорбентов - необходимость измельчения слитка полученного полимера и разделения порошка на фракции; невозможность использования полученного сорбента в качестве мембранного материала. Десорбция темплата даже из измельченного сорбента часто требует нескольких часов [3, 4]. Получение импринтированного полимера в виде тонкой пленки открывает возможность проведения мембранной диффузии. Кроме того, остается возможность использования такой пленки и в качестве сорбента, однако в этом случае не требуется его измельчение и рассеивание, а вымывание темплата происходит быстро.
При молекулярном импринтинге полимеризацию обычно инициируют термически, чаще всего с помощью 2,2'-азо-бис-изобутиронитрила (АИБН), проводя ее при повышенной температуре (65-75°C), причем для обеспечения полноты полимеризации требуется длительное время - от 4 до 24 ч [4, 7-9]. Проведение полимеризации при комнатной температуре возможно, но для этого необходимы специальные приемы (например, atom transfer radical polymerization [6]). Если же требуется получить тонкую пленку полимера, можно использовать фотохимически инициированную полимеризацию [10]. В таком случае затраты времени на получение полимера в несколько раз ниже по сравнению с полимеризацией, инициированной термически.
Известен способ получения сорбента с молекулярными отпечатками кверцетина на основе полимера, полученного полимеризацией метакриловой кислоты (МАК) и этиленгликольдиметакрилата (ЭГДМА) в присутствии комплекса кверцетина с медью (II). Способ длителен: для приготовления такой смеси требовалось не менее 2 ч, а полимеризацию проводили в течение 12 ч при 60°C; сорбцию кверцетина проводили в течение 20-240 мин. Полученный полимер позволял отделить кверцетин от нарингенина и рутина с факторами разделения 7.2 и 5.4 соответственно, а импринтинг-фактор был равен 4 [8].
Известен способ получения сорбента с молекулярными отпечатками кверцетина на основе полимера, содержащего акриламид и ЭГДМА. Полимеризацию смеси, содержащей ацетон в качестве растворителя, проводили в течение 24 ч при 60°C. Сорбцию проводили в течение 1 ч. При этом был получен полимер, характеризующийся следующими факторами разделения: кверцетин/рутин (30), кверцетин/нарингенин (1), кверцетин/нарингин (18), кверцетин/морин (7), кверцетин/хризин (0,8). Импринтинг-фактор был равен 6 [7].
Ближайшим аналогом предлагаемого является способ диффузионного выделения кверцетина, основанный на использовании мембраны, полученной методом молекулярного импринтинга [5]. Для получения такой мембраны смесь мономера, сшивателя, порообразователя и темплата (кверцетина) полимеризовали с фотохимическим инициированием в присутствии АИБН в качестве инициатора. Использовали 4-винилпиридин (ВП) в качестве мономера, ЭГДМА в качестве сшивателя, полиэтиленгликоль (ПЭГ) в качестве порообразователя; в смесь также вводили кверцетин и соль цинка. Для гомогенизации смесь 1.2 ммоль кверцетина, 1.2 ммоль ацетата цинка и 18 мл смеси тетрагидрофуран (ТГФ)/метанол (1:3 об.) подвергали воздействию ультразвука в течение 2 ч. После этого добавляли 3.6 ммоль ВП и еще раз обрабатывали ультразвуком в течение 2 ч для полного растворения всех компонентов, после чего вводили 36 ммоль ЭГДМА и 50 мг АИБН и дегазировали раствор в течение 15 мин азотом. В смесь добавляли от 5 до 15% об. ПЭГ молекулярной массой 600 для повышения проницаемости мембран. В качестве подложки использовали нетканый полипропиленовый материал, который выдерживали в полученной смеси 30 мин, после чего зажимали их между двумя стеклами и облучали в течение 4 ч УФ-лампой (400 Вт, 365 нм). Полученные полимерные мембраны отмывали в экстракторе Сокслета в смеси уксусной кислоты и метанола (2:8 об.) до полного удаления темплата (контроль отмывки спектрофотометрический, при 258 нм). После этого промывали мембрану 1∙10-4 М раствором ЭДТА для удаления ионов металла, а затем водой и метанолом. Отмытый полимер сушили при 60°C в вакууме. Аналогичным способом синтезировали полимеры сравнения: мембрану с кверцетином, но без ацетата цинка и мембрану без ацетата цинка и без кверцетина.
Проницаемость мембраны-прототипа изучали в диффузионной ячейке, состоящей из двух камер, соединенных стеклянным цилиндром с диаметром сечения 5.5 см, в котором зафиксирована изучаемая мембрана. Обе камеры заполняли смесью метанол-ТГФ (3:1 об.), в одну из камер добавляли изучаемый флавоноид (а в некоторых случаях - также соль металла). Диффузию проводили в течение 30 ч. Были изучены следующие мембраны: импринтированные кверцетином, комплексом кверцетина с цинком и мембрана, полимеризованная без темплата (кверцетина). Авторы добились довольно высоких факторов разделения: до 6.8 для пары кверцетин/нарингенин и до 9.5 для пары кверцетин/рутин. Однако при этом степень переноса кверцетина через мембрану составляла не более 2.3% за 30 ч диффузии.
Недостатками прототипа являются, во-первых, длительность получения полимерных мембран, вызванная использованием АИБН, не являющимся эффективным фотоинициатором, проведением дегазации полимеризационной смеси для удаления кислорода перед полимеризацией (лишняя стадия); во-вторых, низкая степень переноса кверцетина в принимающую фазу и ограниченная селективность отделения кверцетина от других флавоноидов (рутина и нарингенина), вызванные использованием неоптимальных функциональных мономеров при получении мембраны и неоптимальных органических растворителей при проведении диффузионного выделения кверцетина.
Цели изобретения: 1) упрощение способа выделения кверцетина за счет сокращения времени, затрачиваемого на получение импринтированной мембраны; 2) повышение степени переноса кверцетина через импринтированную мембрану; 3) повышение селективности отделения кверцетина от других биофлавоноидов - рутина и нарингенина.
Поставленные цели достигаются тем, что в способе выделения кверцетина из водного раствора, включающем его пассивную диффузию через предварительно полученную молекулярно-импринтированную полимерную мембрану, согласно изобретению используют мембрану, полученную полимеризацией метакриловой кислоты в качестве функционального мономера, полимеризацию проводят в присутствии 2-гидрокси-2-метил-1-фенилпропанона-1 (торговое название - Дарокур 1173) в качестве фотоинициатора, в состав полимеризационной смеси вводят сульфат меди(II) или ацетат никеля(II), а диффузию кверцетина через полученную мембрану проводят из смеси ТГФ - ацетатный буферный раствор в ТГФ или из ацетатного буферного раствора в этилацетат или в смесь этанол - уксусная кислота (9:1 об.)
Описание изобретения
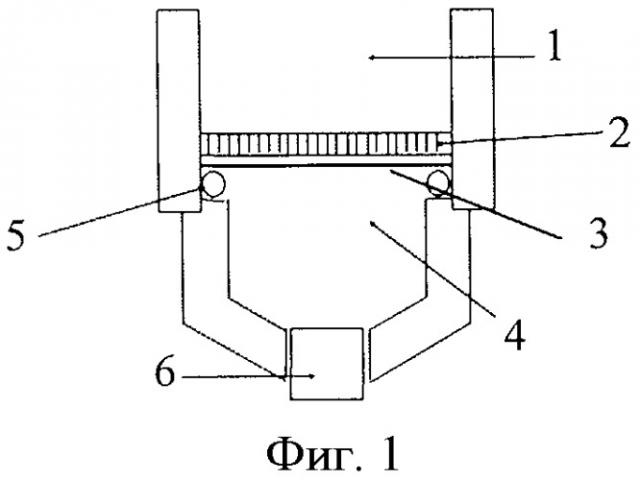
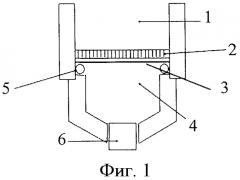
Изобретение иллюстрируется фиг.1, на котором изображена схема ячейки для диффузионного выделения кверцетина. Обозначения: 1 - исходный раствор, 2 - пластиковая решетка, 3 - мембрана, 4 - принимающий раствор, 5 - уплотнитель, 6 - пробка.
Получение мембраны. Необходимое количество кверцетина и соли металла (сульфата меди или ацетата никеля) растворили в смеси метанол-ТГФ в течение 5 мин, затем добавили необходимое количество МАК и оставили смесь на 15 мин для образования предполимеризационного комплекса. После этого добавили 0.5 ммоль сшивателя (ЭГДМА) и 5 мкмоль инициатора Дарокур 1173 и через 5 мин нанесли полученную полимеризационную смесь на подложку, представляющую собой лавсановую трековую мембрану диаметром 2.5 см, толщиной 10 мкм с диаметром пор 0.4 мкм, которую помещали на пластиковую решетку 2 (фиг.1). Дали полимеризационной смеси впитаться в течение 30 с, при этом излишек смеси просачивался через мембрану и пластиковую решетку, тем самым удаляясь из системы. Пропитанную смесью мембрану закрепили между двумя предметными стеклами (2.5×6 см) и поместили ее под УФ-лампу на 1 ч для полимеризации. Удалили из мембраны избыток темплата, фотоинициатор и соль металла путем промывки в смеси метанол-уксусная кислота (9:1 об.) - два раза по 2 мл и затем в 2 мл 0.001 М ЭДТА, что занимает не более 30 мин. Контроль отмывки проводили спектрофотометрически.
Диффузия флавоноидов. Для осуществления диффузионного разделения используют ячейку, которая представляет собой полипропиленовую шприцевую насадку «Swinnex» (Millipore) диаметром 2.5 см с дополнительными отверстиями (фиг.1). Импринтированную мембрану помещают в ячейку, нижнюю часть ячейки с помощью шприца заполняют принимающим раствором (органический растворитель или буфер, объемом 1.2 мл), после чего ячейку затыкают снизу пробкой. В верхнюю часть ячейки наливают исходный раствор, содержащий флавоноид, 2 мл органического растворителя или водно-органической смеси или буфера, и этот момент является моментом начала диффузии. Через фиксированное время (обычно 15 мин) принимающий раствор извлекают из ячейки с помощью шприца и измеряют его спектр поглощения на спектрофотометре в диапазоне длин волн 220-400 нм в кювете длиной 1 см. Содержание флавоноида определяют по заранее построенному градуировочному графику при определенной длине волны: 374 нм (кверцетин), 290 нм (нарингенин) или 358 нм (рутин). Проводят три параллельных измерения, по которым рассчитывают доверительный интервал при Р=0.95.
Пример 1. Диффузионное выделение кверцетина (цель - достижение максимальной проницаемости)
а) Получение импринтированной мембраны
Согласно общей методике получения мембран (см. выше) растворили 4 мкмоль кверцетина, 4 мкмоль ацетата никеля и 30 мкмоль МАК в 80 мкл смеси метанол-ТГФ (1:3 об.). Добавили 0.5 ммоль ЭГДМА и 5 мкмоль Дарокура 1173. Провели полимеризацию и отмывку мембраны от темплата согласно вышеприведенной методике. Общее время, необходимое для получения мембраны, - около 2 ч.
б) Диффузия кверцетина через мембрану
Мембрану поместили в диффузионную ячейку, нижнюю часть которой заполнили 1.2 мл ТГФ (принимающий раствор), а в верхнюю часть поместили 1.6 мл ацетатного буферного раствора (pH 5.4), 400 мкл ТГФ и 100 мкл 0.01 М раствора кверцетина в этаноле (исходный раствор). Спустя 15 мин отобрали аликвоты раствора из верхнего и нижнего раствора. Оптическую плотность измеряли при 374 нм.
Расчеты проводили по формуле 1. В таких условиях максимальная степень переноса кверцетина через мембрану достигает 47±4%, что соответствует максимально возможному значению при пассивной диффузии (50%) и в 20 раз выше, чем в случае прототипа (табл.1).
| Таблица 1 | ||
| Степени переноса флавоноидов (%) из смеси ТГФ - ацетатный буфер (1:4 об.) (исходный раствор) через импринтированную и неимпринтированную мембраны в ТГФ (принимающий раствор), n=3, Р=0.95 | ||
| Вещество | Импринтированная | Неимпринтированная мембрана |
| Кверцетин | 47±4 | 6±1 |
| Нарингенин | 38±3 | 23±3 |
| Рутин | 15±3 | 1,6±0,3 |
| Импринтинг-фактор составляет 7.9, что свидетельствует о получении молекулярного отпечатка. Другие флавоноиды переносятся слабее, чем кверцетин, однако данная мембрана не обладает максимально возможной селективностью. |
Пример 2. Диффузионное разделение флавоноидов (цель - достижение максимальной селективности)
а) Получение импринтированной мембраны
Для получения полимеризационной смеси 18 мкмоль кверцетина и 30-60 мкмоль сульфата меди растворили в 80 мкл смеси: метанол-ТГФ (1:3 об.), 58 мкмоль МАК, 500 мкмоль ЭГДМА и 5 мкмоль Дарокура 1173 согласно вышеприведенной методике. Полимеризацию и отмывку мембраны от непрореагировавших компонентов смеси проводили, как указано выше. Общее время, необходимое для получения мембраны, около 2 ч.
б) Диффузия флавоноидов через мембрану
Импринтированную мембрану закрепили в диффузионной ячейке, нижнюю часть которой заполнили 1.2 мл этилацетата или 1.2 мл смеси этанол - уксусная кислота (9:1 об.) (принимающий раствор), а в верхнюю часть налили 2 мл 0.5 М ацетатного буфера (pH 5.4) и 100 мкл 0.01 М этанольного раствора кверцетина, рутина или нарингенина (исходный раствор). Спустя 15 мин отобрали аликвоты исходного и принимающего раствора и записали их УФ-спектры поглощения. Расчет степеней переноса проводили по формуле 1, а факторы разделения рассчитывали по формуле 2. При использовании этилацетата в качестве принимающей фазы удовлетворительно разделяются кверцетин и рутин (фактор разделения Sf=15), а при использовании смеси этанол-уксусная кислота (9:1) в качестве принимающей фазы разделяются кверцетин и нарингенин (Sf=12) (таблица 2). Селективность полученной мембраны выше, чем прототипа [5], для которого фактор разделения кверцетин/рутин был равен 10, а кверцетин/нарингенин - 6.
| Таблица 2 | |||
| Степени переноса флавоноидов из ацетатного буферного раствора (pH 5.4) через импринтированную мембрану для разных составов принимающего раствора | |||
| Растворитель в принимающей фазе | Вещество | Степень переноса, % | Фактор разделения |
| Кверцетин | 24,2±1,3 | ||
| Этилацетат | 15 | ||
| Рутин | 1,6±0,2 | ||
| Этанол-уксусная | Кверцетин | 9,7±0,7 | |
| кислота | 12 | ||
| (9:1 об.) | Нарингенин | 0,8±0,1 |
Таким образом, цель изобретения достигнута: как видно из описания изобретения, на получение мембраны требуется не более 2 ч (в прототипе - не менее 9 ч). Из примера 1 видно, что добавка к исходному буферному раствору, содержащему кверцетин, тетрагидрофурана до соотношения ТГФ : буферный раствор, равного 1:4 (об.), и использование в качестве принимающего раствора чистого ТГФ позволяет повысить степень переноса кверцетина через мембрану в 20 раз по сравнению с прототипом. Из примера 2 видно, что при использовании соответствующих составов исходного и принимающего растворов факторы разделения кверцетина и других флавоноидов превышают соответствующие значения для прототипа.
Литература
1. Molecular imprinting of polymers. Piletsky S. and Turner A., eds. 2006. 208 pp.
2. Ulbricht M. // J. Chromatogr. B. 2004. V.804. P.113-125.
3. Batlokwa B.S., Mokgadi J., Nyokong Т., Torto N. // Chromatographia. 2011. V.73. No5. P.589-593.
4. Song X.L., Wang J., Zhu J. // Mater. Res. 2009. V.12. No3. P.299-304.
5. Fan P.M., Wang B. // Acta Chimica Sinica. 2010. V.68. No24. P.2543-2550.
6. Gam-Derouich S., Minh Ngoc Nguyen, Madani A., Maouche N., Lang P., Perruchota C., Chehimi M.M. // Surf. Interf. Anal. 2010. V.42. No6-7. P.1050-1056.
7. Кудринская В.А., Дмитриенко С.Г., Золотов Ю.А. // Вестник МГУ. Сер.2. Химия. 2009. Т.50. №3. С.156-163.
8. Shan J., Wang В. // Sep. Sci. Technol. 2011. V.46. No1. P.164-171.
9. Song X., Li J., Wang J., Chen L. // Talanta. 2009. V.80. No2. P.694-702.
10. He D., Susanto D., Ulbricht M. // Progr. Polym. Sci. 2009. V.34. P.62-98.
Способ выделения кверцетина из водного раствора, включающий его пассивную диффузию через предварительно полученную молекулярно-импринтированную полимерную мембрану, отличающийся тем, что используют мембрану, полученную полимеризацией метакриловой кислоты в качестве функционального мономера, полимеризацию проводят в присутствии 2-гидрокси-2-метил-1-фенилпропанона-1 в качестве фотоинициатора, в состав полимеризационной смеси вводят сульфат меди (II) или ацетат никеля (II), а диффузию кверцетина через полученную мембрану проводят из смеси тетрагидрофуран - ацетатный буферный раствор в тетрагидрофуран или из ацетатного буферного раствора в этилацетат или в смесь этанол - уксусная кислота (9:1 об.).