Способ получения l-цистеина с использованием бактерии семейства enterobacteriaceae
Иллюстрации
Показать всеНастоящее изобретение относится к биохимии. Описана бактерия - продуцент L-цистеина, относящаяся к роду Pantoea или Escherichia семейства Enterobacteriaceae, модифицированная таким образом, что в ней усилена экспрессия одного или более генов, выбранных из группы, состоящей из кодирующих глутаредоксины генов grxC и grxB, и гена, кодирующего глутатионредуктазу {gorA). Предложен способ получения L-цистеина, включающий выращивание указанной бактерии в питательной среде, содержащей тиосульфат, и выделение L-цистеина из культуральной жидкости. Изобретение позволяет увеличить выход L-цистеина. 2 н. и 7 з.п. ф-лы, 4 табл., 4 ил., 5 пр.
Реферат
Уровень техники
Область техники
Настоящее изобретение относится к микробиологической промышленности, в частности к способу получения L-цистеина с использованием бактерии семейства Enterobacteriaceae, которая модифицирована таким образом, что в ней усилена экспрессия одного или нескольких генов, кодирующих глутаредоксины и глутатионредуктазу.
Предшествующий уровень техники
Традиционно L-аминокислоты в промышленном масштабе могут быть получены методом ферментации с использованием штаммов микроорганизмов, полученных из природных источников, или их мутантов. Обычно микроорганизмы модифицированы для того, чтобы увеличить продукцию L-аминокислот.
Описано множество методов увеличения продукции L-аминокислот, например, путем трансформации микроорганизма рекомбинантной ДНК (см., например, патент США 4278765). Другие методы основаны на повышении активности ферментов, вовлеченных в биосинтез аминокислот и/или уменьшении чувствительности целевого фермента к ингибированию продуцируемой L-аминокислотой по типу обратной связи (см., например, заявка РСТ WO95/16042 или патенты США № 4346170; 5661012; и 6040160).
Неорганический сульфат ( S+VI) in vivo восстанавливается до сульфита ( S+IV) с помощью фосфоаденилилсульфатредуктазы (PAPS-редуктаза). Мутант Escherichia coli, лишенный глутатионредуктазы и глутаредоксинов (gor-grxA-grxB-grxC-), практически не растет на сульфате. С помощью метода, основанного на тиолспецифичном флуоресцентном алкилировании и гель-электрофорезе, было показано, что глутатионилированная PAPS-редуктаза восстанавливается до глутаредоксинов через монотиольный механизм. Обратимое глутатионилирование может регулировать активность PAPS-редуктазы in vivo (Lillig С.Н. et al., J Biol Chem.; 278(25):22325-30 (2003)).
Глутаредоксины представляют собой повсеместно распространенные белки, которые катализируют восстановление дисульфидов (S-S-белки) или смешанных дисульфидов, образующихся между белками и глутатионом (GSH) (белок-S-SG) в сопряженной системе с GSH, NADPH и GSH-редуктазой. Глутаредоксины могут таким образом рассматриваться как восстановители дисульфидов через GSH. Бактерия Е.coli обладает тремя глутаредоксинами (Grx1, Grx2 и Grx3) и двумя тиоредоксинами (Trx1, Trx2). Grx3 (9 кДа, кодируемый геном grxC) был вьщелен из мутанта E.coli, полностью дефектного по Grx1 и Trx1. Grx1 и Grx3 идентичны по последовательности на 33% и имеют сходную структуру (тиоредоксиновую/глутаредоксиновую складку). Grx3 может восстанавливать RR1a (рибонуклеотидредуктаза класса 1а из Е.coli) с 5% каталитической эффективностью Grx1. Grx2 и Grx3, по-видимому, не участвуют в восстановлении сульфата до сульфита, которое катализируется в Е.coli PAPS-редуктазой. Было показано, что штамм дикого типа и штамм trxB-grxC- демонстрируют одинаковые темпы роста на богатой LB-среде, что дает основания предполагать, что Е.coli может восполнять основные нарушения тиоредоксинового/глутаредоксинового путей, когда в полной мере обеспечена питательными веществами. На минимальной среде М9 дикий тип и мутант trxB-grxC- росли также одинаковыми темпами, a trxA-grxC- рос очень медленно и достигал более низкого окончательного уровня роста (Vlamis-Gardikas А. et al., J Biol Chem.; 277(13):10861-8(2002)).
Предполагается, что Grx3, связанный с клеточным GSH, является третьей системой доноров водорода в отсутствие тиоредоксина и классического глутаредоксина (Grx1). При обычных условиях, очевидно, что Grx3 должен иметь другие функции в клетке (Aslund F. et al., PNAS, 91, 9813-7(1994)).
Транскрипция gor индуцируется H2O2, картирован предполагаемый OxyR-сайт связывания и начало OxyR-регулируемого транскрипта перед геном gorA из Е.coli (Toledano М.В. et al., Cell, 78, 897-909 (1994)).
Было установлено, что ген gor регулируется не только через OxyR, но также с помощью rpoS. Было обнаружено, что в стационарной фазе rpoS регулирует не только ферментативную активность gor, но также и транскрипционную активность. Отсутствие указанного выше белка увеличивает устойчивость Е.coli к некоторым веществам окислительного стресса, таким как Н2О2 и NEM (N-этилмалеимид). Поэтому, вероятно, что gor не функционирует как типичный антиоксидант (Becker-Hapak М. and Eisenstark A., FEMS Microbiology Letters 134(1), 39-44 (1995)).
Совместная экспрессия нескольких генов в Е.coli измерялась с помощью обратной транскрипции-мультиплексной флуоресцентной ПЦР. Было показано, что транскрипция gorA активируется по мере роста бактерии дикого типа. GorA был активирован в течение экспоненциальной фазы роста. Максимальная индукция составила 4.6. Обработка Н2О2 стимулировала экспрессию гена gorA, ранее идентифицированного в качестве компонента OxyR регулона. Индукция посредством Н2О2 была значительно быстрее и являлась обратимой реакцией, и имела место быть при OxyR-зависимом и σS-независимом типе. NaCl индуцировал экспрессию генов, контролируемых OxyR(Michán С. et al., J Bacteriol.; 181(9):2759-64 (1999)).
Оценивалась экспрессия до 16 генов Е.coli, кодирующих компоненты и глутаредоксиновой, и тиоредоксиновой систем и компоненты OxyR и SoxRS регулонов. Была продемонстрирована обратная зависимость между экспрессией nrdAB
и экспрессией генов, кодирующих компоненты и глутаредоксиновой (grxA, gorA) и тиоредоксиновой (trxB, trxC) систем (Prieto-Alamo M.J. et al., J Biol Chem.; 275(18):13398-405 (2000)).
Для изучения роли в защите от окислительного стресса и редоксзависимого формирования фотосинтетических комплексов были сконструированы мутанты с нарушениями в компонентах глутатион-глютаредоксиновой (GSH/Grx) системы Rhodobacter capsulatus. Отсутствие гена глутаредоксина 3 (grxC) или гена глутатионсинтетазы В (gshB) приводило к замедлению темпов роста при аэробных условиях и повышению чувствительности к окислительному стрессу, подтверждающему роль GSH/Grx системы в защите от окислительного стресса. Оба мутанта были высокочувствительны к дисульфидному стрессу, что показывает значительный вклад системы GSH/Grx в тиолдисульфидную оксилительно-восстановительную буферную систему цитоплазмы. Как и мутации в тиоредоксиновой системе, мутации в GSH/Grx системе влияли на формирование редокс-зависимых фотосинтетических комплексов в R. capsulatus. Экспрессия генов глутаредоксина1 grxC, gshB, grxA и глутатионредуктазы gorA, кодирующих компоненты GSH/Grx системы, не индуцировалась окислительным стрессом. Мутации в генах grxC и/или gshB, и/или trxC (тиоредоксин 2) влияли на экспрессию этих генов, демонстрируя тем самым взаимодействие различных систем защиты от окислительного стресса. OxyR и SoxRS регулоны контролируют экспрессию многих генов, вовлеченных в защиту от окислительного стресса у Е.coli в ответ на Н2О2 и супероксид, соответственно. Полученные данные и известная геномная последовательность R.capsulatus дают основания полагать, что у R.capsulatus SoxRS система отсутствует, но существует другой супероксид-чувствительный регулятор. В то же время, экспрессия gorA и grxA регулируется Н2О2 в Е.coli, но не в R.capsulatus, таким образом, OxyR регулоны двух этих видов совершенно разные (Li K. et al., J Bacteriol.; 186(20):6800-8 (2004)).
Из Salmonella typhimurium LT2 были выделены мутанты, имеющие нарушения в цистеинсинтазе А или В, или в обеих. Родительские штаммы были способны расти на минимальной среде, содержащей сульфат, сульфит, сульфид или тиосульфат в качестве источника серы. Мутанты без цистеинсинтазы В были не способны расти на тиосульфате, в то время как мутанты без цистеинсинтазы А росли с незначительными различиями в темпе роста на четырех вышеупомянутых источниках неорганической серы. Мутанты без обеих цистеинсинтаз не росли на среде, содержащей какой-либо из анализируемых источников неорганической серы. Выделение цистеинсинтазы В сопровождалось выделением и S-сульфоцистеинсинтазы. Кроме того, обе эти активности также вместе трансдуцировались. Указанные активности, вероятно, ассоциированы с геном cysM и могут с высокой частотой кодрансдуцироваться с геном cysK. Исходя из этих результатов можно сделать вывод о том, что тиосульфат ассимилируется только через S-сульфоцистеин только с помощью S-сульфоцистеинсинтазы (Nakamura Т. et al., J.Bacteriology, 156(2), 656-62 (1983)).
Метаболизм S-сульфоцистеина изучался в S.typhimurium. С эксперимента с подпиткой мутантов, нуждающихся в сульфите и сульфиде, было установлено, что указанная аминокислота превращается в цистеин и сульфит, и служит единственным источником серы. В первичных экстрактах были выявлены две различные NADPH-зависимые системы, способные участвовать в метаболизме S-сульфоцистеина. Обе системы были очищены и идентифицированы как глутатион-глутатионредуктаза и тиоредоксин-тиоредоксинредуктаза (Funane K. et al., Agric. Biol. Chem., 51(5), 1247-56 (1987)).
Но в настоящее время нет данных об усилении экспрессии одного или более генов, кодирующих глутаредоксины и глутатионредуктазу, с целью продукции L-цистеина бактерией семейства Enterobacteriaceae.
Описание изобретения
Целью настоящего изобретения является увеличение продуктивности штаммов-продуцентов L-цистеина, и предоставление способа получения L-цистеина с использованием указанных штаммов.
Данная цель была достигнута за счет обнаружения того факта, что усиление экспрессии одного или более генов среди генов, кодирующих глутаредоксины и глутатионредуктазу, может увеличивать продукцию L-цистеина.
Настоящее изобретение предоставляет бактерию, принадлежащую к семейству Enterobacteriaceae, в частности бактерию, принадлежащую к роду Pantoea или Escherichia, обладающую повышенной способностью к продукции L-цистеина.
Целью настоящего изобретения является предоставление бактерии семейства Enterobacteriaceae - продуцента L-цистеина, отличающейся тем, что указанная бактерия модифицирована таким образом, что в ней усилена экспрессия одного или более генов среди генов, кодирующих глутаредоксины и глутатионредуктазу.
Также целью настоящего изобретения является предоставление описанной выше бактерии, отличающейся тем, что указанная бактерия принадлежит к роду Pantoea.
Также целью настоящего изобретения является предоставление описанной выше бактерии, отличающейся тем, что указанная бактерия принадлежит к роду Escherichia.
Также целью настоящего изобретения является предоставление описанной выше бактерии, отличающейся тем, гены, кодирующие глутаредоксины, выбраны из группы, включающей ген grxC из Pantoea ananatis, ген grxB из Escherichia coli и ген grxC из Escherichia coli.
Также целью настоящего изобретения является предоставление описанной выше бактерии, отличающейся тем, что ген, кодирующий глутатионредуктазу, является геном gorA.
Также целью настоящего изобретения является предоставление описанной выше бактерии, отличающейся тем, что экспрессия указанного(ых) гена(ов) усилена за счет увеличения числа копий указанного(ых) гена(ов).
Также целью настоящего изобретения является предоставление описанной выше бактерии, отличающейся тем, что экспрессия указанного(ых) гена(ов) усилена за счет модификации последовательности, контролирующей экспрессию, таким образом, что экспрессия указанного(ых) гена(ов) усилена.
Также целью настоящего изобретения является предоставление описанной выше бактерии, отличающейся тем, что природный(ые) промотор(ы) указанного(ых) гена(ов) замещен(ы) более сильным(ыми) промотором(ами).
Также целью настоящего изобретения является предоставление способа получения L-цистеина, который включает выращивание бактерии в питательной среде, содержащей тиосульфат, и выделение L-цистеина из культуральной жидкости с целью его продукции и накопления.
Также целью настоящего изобретения является предоставление описанного выше способа получения L-цистеина, отличающегося тем, что в указанной бактерии усилена экспрессия генов, вовлеченных в биосинтез L-цистеина.
Настоящее изобретение более детально описано ниже.
Подробное описание наилучшего способа осуществления изобретения
1. Бактерия согласно настоящему изобретению
Бактерией, согласно настоящему изобретению, является бактерия, принадлежащая к семейству Enterobacteriaceae - продуцент L-цистеина, модифицированная таким образом, что экспрессия одного или более генов среди генов, кодирующих глутаредоксины и глутатионредуктазу, указанной бактерией усилена.
Согласно настоящему изобретению, термин «бактерия - продуцент L-цистеина» означает бактерию, способную производить и накапливать L-цистеин в среде, когда такая бактерия культивируется в питательной среде.
Термин «бактерия - продуцент L-цистеина» также означает бактерию, способную производить и накапливать в культуральной среде L-цистеин в количествах, больших, чем природный или родительский штаммы, например Pantoea, такие как Pantoea ananatis {Enterobacter agglomerans) штаммы AJ13355 (FERM BP-6614), AJ13356 (FERM BP-6615), AJ13601 (FERM BP-7207), SC17 (патент США 7090998), или Е.coli, такие как Е.coli K-12. Термин «бактерия - продуцент L-цистеина» также означает, что микроорганизм способен производить и накапливать в среде L-цистеин в концентрациях не меньше, чем 0,5 г/л, и, более предпочтительно, не меньше, чем 1,0 г/л.
Семейство Enterobacteriaceae включает бактерии, относящиеся к родам Escherichia, Enterobacter, Erwinia, Klebsiella, Pantoea, Photorhabdus, Providencia, Salmonella, Serratia, Shigella, Morganella, Yersinia и другие. В особенности предпочтительны бактерии, отнесенные к семейству Enterobacteriaceae согласно классификации базы данных NCBI (National Center for Biotechnology Information, ttp://www.ncbi.nlm.nih.gov/Taxonomy/Browser/wwwtax.cgi?id=91347). Предпочтительны бактерии, принадлежащие к роду Escherichia или Pantoea.
Термин «бактерия, относящаяся к роду Pantoea)) означает, что бактерия относится к роду Pantoea согласно системе классификации, известной специалисту в области микробиологии. Некоторые виды Enterobacter agglomerans недавно были переклассифицированы в Pantoea agglomerans, Pantoea ananatis, Pantoea stewartii или другие аналогичные, на основании нуклеотидного анализа последовательности 16S РНК, и других (Int. J. Syst. Bacteriol., 43, 162-173 (1993)).
Термин «бактерия, принадлежащая к роду Escherichia)) означает, что бактерия относится к роду Escherichia в соответствии с классификацией, известной специалисту в области микробиологии. Среди примеров бактерий, принадлежащих к роду Escherichia, но не ограничивающихся ими, может быть упомянута бактерия Escherichia coli (Е.coli).
Круг бактерий, принадлежащих к роду Escherichia, которые могут быть использованы в настоящем изобретении, не ограничен каким-либо образом, однако, например, бактерии, описанные в книге Neidhardt F.C. et al. (Escherichia coli and Salmonella typhimurium, American Society for Microbiology, Washington D.C., 1208, Таблица 1), могут быть включены в число бактерий согласно настоящему изобретению.
Фраза "бактерия была модифицирована таким образом, что экспрессия гена усилена" означает, что уровень экспрессии гена в модифицированной бактерии выше, чем в немодифицированном штамме, например штамме дикого типа. Примерами такой модификации могут служить увеличение числа копий экспрессируемого(ых) гена(ов) в пересчете на клетку или повышение уровня экспрессии гена(ов) и другие. Количество копий экспрессируемого гена можно измерить, например, с помощью рестрикции хромосомной ДНК и последующей гибридизацией по Саузерну, с использованием зонда, сконструированного на основе нуклеотидной последовательности гена, флуоресцентной гибридизации in situ (FISH) и подобных методов. Уровень экспрессии генов может быть измерен с помощью различных методов, включая гибридизацию по Нозерну, количественную ОТ - ПЦР (RT-PCR) и подобные им. В качестве контроля могут служить штаммы дикого типа, например, Pantoea ananatis FERM ВР-6614.
Термин «экспрессия» означает образование белкового продукта, кодируемого геном.
Фраза «последовательность, контролирующая экспрессию» относится к нуклеотидным последовательностям, локализованным перед, внутри или после кодирующего участка, контролирующим транскрипцию и/или экспрессию кодирующего участка во взаимодействии с аппаратом белкового биосинтеза клетки. Данная фраза обычно используется для обозначения промоторов, сайтов связывания рибосом (RBS), операторов и/или других элементов генома, участвующих в регуляции уровня экспрессии гена.
Усиление экспрессии гена может быть достигнуто за счет введения нескольких копий гена в бактериальную хромосому, например, с помощью метода гомологичной рекомбинации, Mu-интеграции, или других подобных методов. Например, один акт Mu-интеграции позволяет ввести в бактериальную хромосому до 3-х копий гена.
Увеличение числа копий гена также может быть достигнуто за счет введения нескольких копий гена в хромосомную ДНК бактерии. Для того чтобы ввести несколько копий гена в бактериальную хромосому, может быть осуществлена гомологичная рекомбинация с использованием последовательности, несколько копий которой присутствуют в качестве мишени в хромосомной ДНК. Последовательности, имеющие несколько копий в хромосомной ДНК, включают, но не ограничиваются ими, повторяющуюся ДНК, или инвертированные повторы на концах подвижных элементов. Также возможно ввести ген в транспозон и обеспечить его перемещение для введения нескольких копий гена в хромосомную ДНК.
Усиление экспрессии гена, согласно настоящему изобретению, может быть достигнуто помещением фрагмента ДНК под контроль более сильного, чем природный, промотора. Например, lac-промотор, trp-промотор, trc-промотор, PR, или PL промоторы фага λ, известны как сильные промоторы. Сильный промотор может быть использован совместно с увеличением числа копий гена. Термин "природный промотор" означает существующую в природном организме область ДНК, расположенную перед открытой рамкой считывания (ORF - opened reading frame) гена/кластера генов и способствующую экспрессии этого гена/кластера генов. Сила промотора определяется частотой акта инициации синтеза РНК.
Также действие промотора может быть усилено, например, введением мутаций в промотор для повышения уровня транскрипции гена, расположенного после указанного промотора. Кроме того, известно, что на трансляционную способность РНК оказывают значительное влияние замены некоторых нуклеотидов между сайтом связывания рибосом (RBS-ribosome binding site) и стартовым кодоном, а главным образом, последовательности, расположенные непосредственно перед стартовым кодоном. Например, в зависимости от природы трех предшествующих стартовому кодону нуклеотидов, наблюдается 20-кратное различие в уровне экспрессии (Gold et al., Annu. Rev. Microbiol., 35, 365-403, 1981; Hui et al., EMBO J., 3, 623-629, 1984).
Более того, возможно введение нуклеотидной замены в промоторный район гена в бактериальной хромосоме, приводящее к усилению функционирования промотора. Изменение контролирующей экспрессию последовательности может быть осуществлено, например, таким же способом, как осуществляется процедура замены гена с использованием термочувствительной плазмиды, описанная в заявке РСТ WO 00/18935 и заявке Японии JP 1-215280 А.
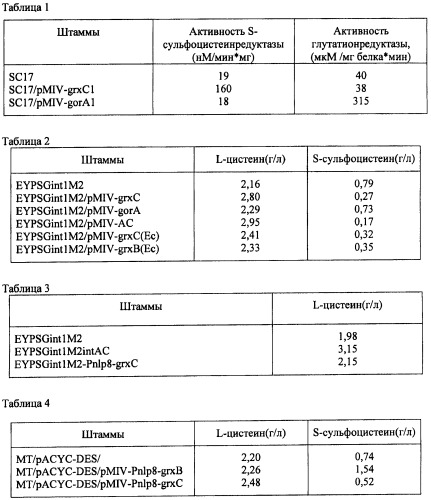
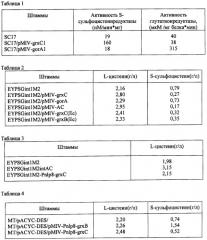
Ген grxB из Е.coli кодирует белок глутаредоксин 2. Ген grxC из Е.coli кодирует белок глутаредоксин 3. Ген gorA из Е.coli кодирует белок глутатионредуктазу. Глутатионредуктаза катализирует реакцию восстановления дисульфидглутатиона: дисульфидглутатион + НАДФН + Н+ <=> 2 глутатион + NADP+.
Нуклеотидная последовательность генов gorA, grxB и grxC из Е.coli уже определена. Ген gorA (синонимы: ECK3485, b3500; нуклеотиды с 3644322 по 3645674 в последовательности, представленной в базе данных GenBank с инвентарным номером NC_000913.2; gi: 16131372) расположен между генами yhiR и dinQ на хромосоме бактерии Е. coli K12. Ген grxB (синонимы: ECK1049, b1064; нуклеотиды, комплементарные нуклеотидам в позиции с 1122630 по 1123277; в последовательности, представленной в базе данных GenBank с инвентарным номером NC_000913.2; gi: 16129027) расположен между генами yceB и mdtH на хромосоме бактерии Е. coli K12. Ген grxC (синонимы: ECK3600, b3610, yibM; нуклеотиды, комплементарные нуклеотидам в позиции с 3782214 по 3782465; в последовательности, представленной в базе данных GenBank с инвентарным номером NC_000913,2; gi: 16131481) расположен между генами secB и yibN на хромосоме бактерии Е. coli K12.
Нуклеотидные последовательности генов gorA и grxC из Р. ananatis до сих пор не были известны. Нуклеотидная последовательность гена grxC из Р. ananatis представлена в SEQ ID NO: 1. Нуклеотидная последовательность remgorA из Р. ananatis представлена в SEQ ID NO: 2.
В связи с тем, что последовательности ДНК могут различаться среди видов и штаммов рода Pantoea или Escherichia, гены gorA, grxB и grxC не ограничиваются последовательностями, представленными в SEQ ID NO: I, SEQ ID NO: 2 или в базе данных GenBank, и могут включать гены, гомологичные указанным выше генам.
Таким образом, гены gorA, grxB и grxC могут быть вариантами, которые гибридизуются при жестких условиях с нуклеотидными последовательностями, представленными в SEQ ID NO: I, SEQ ID NO: 2 или в GenBank, или с зондами, которые могут быть синтезированы на основе указанных нуклеотидных последовательностей. «Жесткие условия» включают такие условия, при которых специфические гибриды, например, гибриды со степенью гомологии не менее 60%, предпочтительно, не менее 70%, более предпочтительно, не менее 80%, еще более предпочтительно, не менее 90%, наиболее предпочтительно, не менее 95%, образуются, а неспецифические гибриды, например, гибриды со степенью гомологии ниже вышеуказанной - не образуются. Практическим примером жестких условий является однократная или многократная отмывка, предпочтительно двух- или трехкратная, при концентрации солей, соответствующей стандартным условиям отмывки при гибридизации по Саузерну, например, I×SSC, 0.1% SDS, предпочтительно 0.1×SSC, 0.1% SDS, при 60°С.
Продолжительность отмывки зависит от типа используемой для блоттинга мембраны и, как правило, рекомендуется производителем. Например, рекомендуемая продолжительность отмывки для нейлоновой мембраны Hybond™ N + (Amersham) при жестких условиях составляет 15 минут. Предпочтительна двух- или трехкратная отмывка. Длина зонда может быть выбрана в зависимости от условий гибридизации, обычно она составляет от 100 п.н. до 1 т.п.н.
Методы получения плазмидной ДНК, расщепления и дотирования ДНК, трансформации, подбора олигонуклеотидов в качестве праймеров и другие подобные методы являются обычными методами, хорошо известными для специалиста в указанной области техники. Перечисленные методы описаны в Sambrook, J. and Russell D., "Molecular Cloning A Laboratory Manual, Third Edition", Cold Spring Harbor Laboratory Press (1989).
2. Способ согласно настоящему изобретению.
Способом продукции L-цистеина является способ, включающий стадии культивирования бактерии согласно настоящему изобретению в питательной среде, содержащей тиосульфат в качестве источника серы, с целью накопления L-цистеина в питательной среде и выделения L-цистеина из культуральной жидкости.
Согласно настоящему изобретению, выращивание бактерии, выделение из культуральной жидкости и очистка L-цистеина могут быть осуществлены ферментативными способами, традиционно используемыми для аминокислоты, которая продуцируется бактерией.
Питательная среда для выращивания может быть как синтетической, так и натуральной, при условии, что она содержит источники углерода, азота, минеральные соединения и, если необходимо, питательные добавки в количестве, необходимом для роста бактерии. Источники углерода включают в себя различные углеводы, такие как глюкоза и сахароза, и различные органические кислоты. В зависимости от способа ассимиляции используемых бактерий, могут быть использованы спирты, такие как этанол и глицерин. В качестве источников азота используются аммиак, различные соли аммония, такие как сульфат аммония, другие соединения азота, такие как амины, природные источники азота, такие как пептон, гидролизат соевых бобов и микробный ферментолизат. В качестве источников серы, согласно настоящему изобретению, используются сульфат аммония, сульфат магния, сульфат железа, сульфат марганца и подобные им. В качестве минеральных соединений используются однозамещенный фосфат калия, хлорид натрия, хлорид кальция, соли магния, соли железа, соли марганца и подобные им. В качестве витаминов используются тиамин, дрожжевой экстракт и подобные им.
Выращивание проводят предпочтительно в аэробных условиях, таких как взбалтывание и аэрация с перемешиванием, при температуре от 20°С до 40°С, предпочтительно от 30°С до 38°С. Значение pH обычно варьирует в пределах от 5 до 9, предпочтительно в пределах от 6.5 до 7.2. pH среды может быть скорректирован аммиаком, карбонатом кальция, различными кислотами, основаниями и буферами. Обычно, выращивание в течение от 1 до 5 дней приводит к накоплению целевой L-аминокислоты в культуральной жидкости.
После выращивания, нерастворимые компоненты, такие как клетки, могут быть удалены из питательной среды методом центрифугирования или фильтрации на мембране, после чего целевая L-аминокислота может быть выделена и очищена методами ионного обмена, концентрации или кристаллизации.
Краткое описание рисунков
На Фигуре 1 изображены последовательности природного промотора Pnlp и промотора Pnlp8.
На Фигуре 2 изображена конструкция плазмиды pM12-ter(thr).
На Фигуре 3 изображена конструкция интегративной кассеты intJS.
На Фигуре 4 изображена конструкция плазмиды pMIV-5JS.
Примеры
Настоящее изобретение будет более подробно описано ниже со ссылкой на следующие не ограничивающие настоящее изобретение Примеры.
Пример 1. Конструкция штамма с усиленной экспрессией гена cysM
1. Конструкция штамма P.ananatis EYPSG8
ДНК-фрагмент, содержащий промотор гена nlpD из Е.coli, был получен с помощью ПЦР. Хромосомная ДНК штамма Е.coli MG1655 (АТСС 700926) была использована в качестве матрицы, в качестве праймеров использовали P1 (SEQ ID No:6) и Р2 (SEQ ID No:7). Праймер P1 (SEQ ID No:6) содержит сайт для рестриктазы SalI на 5'-конце. Праймер Р2 (SEQ ID No:7) содержит сайт для рестриктазы PaeI на 5'-конце. Условия ПЦР были следующими: денатурация 3 мин при 95°С; условия для первых двух циклов: 1 мин при 95°С, 30 с при 50°С, 40 с при 72°С; условия для последующих 25 циклов: 20 с при 94°С, 20 с при 55°С, 15 сек при 72°С; финальная элонгация: 5 мин при 72°С. Амплифицированный ДНК-фрагмент имел длину около 0, 2 т.п.н., его очистка осуществлялась с помощью агарозного гель-электрофореза. Затем очищенный фрагмент обрабатывался эндонуклеазами PaeI и SalI. Полученный ДНК-фрагмент лигировали с плазмидой pMIV-5JS (конструирование плазмиды pMIV-5JS описано в Справочном примере 1), предварительно обработанной эндонуклеазами PaeI и SalI. Смесь для лигирования инкубировали в течение ночи при 4°С и затем использовали для трансформации штамма Е.coli MG1655 методом электропорации. Полученные трансформанты высевали на LB-агар с ампициллином (50 мг/л), чашки инкубировали в течение ночи при 37°С до образования различимых индивидуальных колоний. Из полученных трансформантов выделяли плазмиды и анализировали с помощью рестрикционного анализа. Полученная плазмида содержала промотор гена nlpD из Е.coli, и была названа pMIV-Pnlp0.
ДНК-фрагмент, содержащий терминатор гена rrnB из Е.coli, был получен с помощью ПЦР. Хромосомная ДНК штамма Е.coli MG1655 была использована в качестве матрицы, в качестве праймеров использовали олигонуклеотиды Р3 (SEQ ID No:8) и Р4 (SEQ ID No:9). Праймер Р3 (SEQ ID Nо:8) содержит сайт для рестриктазы XbaI на 5'-конце. Праймер Р4 (SEQ ID No:8) содержит сайт для рестриктазы BamHI на 5'-конце. Условия ПЦР были следующими: денатурация 3 мин при 95°С; условия для первых двух циклов: 1 мин при 95°С, 30 с при 50°С, 40 с при 72°С; условия для последующих 25 циклов: 20 с при 94°С, 20 с при 59°С, 15 сек при 72°С; финальная элонгация: 5 мин при 72°С. Амплифицированный ДНК-фрагмент имел длину около 0,3 т.п.н., его очистка осуществлялась с помощью агарозного гель-электрофореза. Затем очищенный фрагмент обрабатывали эндонуклеазами BamHI и XbaI. Полученный ДНК-фрагмент лигировали с плазмидой pMIV-Pnlp0, предварительно обработанной эндонуклеазами BamHI и XbaI. Смесь для лигирования инкубировали в течение ночи при 4°С и затем использовали для трансформации штамма Е.coli MG1655 методом электропорации. Полученные трансформанты высевали на LB-агар с ампициллином (50 мг/л), чашки инкубировали в течение ночи при 37°С до образования различимых индивидуальных колоний. Из полученных трансформантов выделяли плазмиды и анализировали с помощью рестрикционного анализа. Полученная плазмида содержала терминатор гена rrnB Е.coli, и была названа pMIV-Pnlp0-ter.
ДНК-фрагмент, содержащий ген yeaS из Е.coli, был получен с помощью ПЦР. Хромосомная ДНК штамма Е.coli MG1655 была использована в качестве матрицы, в качестве праймеров использовали олигонуклеотиды Р5 (SEQ ID No:10) и Р6 (SEQ ID No: 11). Праймер Р5 (SEQ ID No:10) содержит сайт для рестриктазы SalI на 5'-конце. Праймер Р6 (SEQ ID No: 11) содержит сайт для рестриктазы XbaI на 5'-конце. Условия ПЦР были следующими: денатурация 3 мин при 95°С; условия для первых двух циклов: 1 мин при 95°С, 30 с при 50°С, 40 с при 72°С; условия для последующих 25 циклов: 20 с при 94°С, 20 с при 55°С, 15 с при 72°С; финальная элонгация: 5 мин при 72°С. Амплифицированный ДНК-фрагмент имел длину около 0,7 т.п.н., его очистка осуществлялась с помощью агарозного гель-электрофореза. Затем очищенный фрагмент обрабатывали эндонуклеазами SalI и XbaI. Полученный ДНК-фрагмент лигировали с плазмидой pMIV-Pnlp0-ter, предварительно обработанной эндонуклеазами SalI и XbaI. Смесь для лигирования инкубировали в течение ночи при 4°С и затем использовали для трансформации штамма Е.coli MG1655 методом электропорации. Полученные трансформанты высевали на LB-агар с ампициллином (50 мг/л), чашки инкубировали в течение ночи при 37°С до образования различимых индивидуальных колоний. Из полученных трансформантов выделяли плазмиды и анализировали с помощью рестрикционного анализа. Полученная плазмида содержала ген yeaS из Е.coli, и была названа pMIV-Pnlp0-yeaS3.
Затем была выполнена рандомизация района -10 промотора PnlpD и селекция промотора Pnlp8. 3'-конец промотора PnlpD был получен с помощью ПЦР-амплификации. Плазмиду pMIV-Pnlp0 использовали в качестве матрицы, а в качестве праймеров использовали олигонуклеотиды P1 (SEQ ID No:6) и Р7 (SEQ ID No: 12). Праймер Р7 содержит случайные нуклеотиды, указанные в последовательности SEQ ID NO: 12 обозначением "n" (для А или G, или С или Т), и сайт для рестриктазы BglII на 5'-конце. Условия ПЦР были следующими: денатурация 3 мин при 95°С; условия для первых двух циклов: 1 мин при 95°С, 30 с при 50°С, 40 с при 72°С; условия для последующих 25 циклов: 20 с при 94°С, 20 с при 60°С, 15 сек при 72°С; финальная элонгация: 5 мин при 72°С. 5'-конец промотора PnlpD был получен с помощью ПЦР-амплификации. Плазмиду pMIV-Pnlp0 использовали в качестве матрицы, а в качестве праймеров использовали олигонуклеотиды Р2 (SEQ ID No:7) и Р8 (SEQ ID No: 13). Праймер Р8 содержит случайные нуклеотиды, указанные в последовательности SEQ ID NO: 13 обозначением "n" (для А или G, или С, или Т), и сайт для рестриктазы BglII на 5'-конце. Условия ПЦР были следующими: денатурация 3 мин при 95°С; условия для первых двух циклов: 1 мин при 95°С, 30 с при 50°С, 40 с при 72°С; условия для последующих 25 циклов: 20 с при 94°С, 20 с при 60°С, 15 с при 72°С; финальная элонгация: 5 мин при 72°С. Оба амплифицированных ДНК-фрагмента очищали с помощью агарозного гель-электрофореза. Затем полученные фрагменты обрабатывали эндонуклеазой BglII с последующим лигированием фрагментов в эквимолярном соотношении. Смесь для лигирования инкубировали в течение ночи при 4°С и затем использовали в качестве матрицы для следующей реакции ПЦР, в качестве праймеров использовали олигонуклеотиды P1 (SEQ ID No:6) и P2 (SEQ ID No:7). Условия ПЦР были следующими: денатурация 3 мин при 95°С; условия для первых двух циклов: 1 мин при 95°С, 30 с при 50°С, 40 с при 72°С; условия для последующих 12 циклов: 20 с при 94°С, 20 с при 60°С, 15 с при 72°С; финальная элонгация: 5 мин при 72°С.
Амплифицированный ДНК-фрагмент имел длину около 0,2 т.п.н., его очистка осуществлялась с помощью агарозного гель-электрофореза. Затем очищенный фрагмент обрабатывали эндонуклеазами PaeI и SalI. Далее, полученный ДНК-фрагмент лигировали с плазмидой pMIV-Pnlp0-yeaS3, предварительно обработанной эндонуклеазами PaeI и SalI. Смесь для лигирования инкубировали в течение ночи при 4°С и затем использовали для трансформации штамма Е.coli MG1655 методом электропорации. Полученные трансформанты высевали на LB-агар с ампициллином (50 мг/л), чашки инкубировали в течение ночи при 37°С до образования различимых индивидуальных колоний. Из полученных трансформантов выделяли плазмиды и анализировали с помощью рестрикционного анализа. Полученная плазмида содержала промотор Pnlp8 (Фиг.1), и была названа pMIV-Pnlp8-yeaS7.
Затем плазмиду pMIV-Pnlp8-yeaS7 обрабатывали эндонуклеазой HindIII с последующей очисткой и добавлением большого фрагмента ДНК-полимеразы I (фрагмент Кленова). Полученный ДНК-фрагмент очищали и обрабатывали эндонуклеазой NcoI. Далее полученный ДНК-фрагмент очищали и лигировали в эквимолярном соотношении с плазмидой pMW-Pomp-cysE5 (pMT-Pomp-cysE5 была получена из pMIV-Pomp-cysE5 путем клонирования фрагмента XbaI-Eco88I, обработанного фрагментом Кленова, из pACYC-184 (tet-R) по PvuI сайту плазмиды pMIV-Pomp-cysE5; плазмида pMIV-Pomp-cysE5 была получена путем субклонирования фрагмента PaeI+SacI из pMW-Pomp-cysE5 (см. заявку РСТ WO 2005007841), по тем же сайтам плазмиды pMIV-5JS), предварительно обработанной эндонуклеазами SmaI и NcoI. Смесь для лигирования инкубировали в течение ночи при 4°С и затем использовали для трансформации штамма Е.coli MG1655 методом электропорации. Полученные трансформанты высевали на LB-агар с ампициллином (50 мг/л), чашки инкубировали в течение ночи при 37°С до образования различимых индивидуальных колоний. Из полученных трансформантов выделяли плазмиды и анализировали с помощью рестрикционного анализа. Полученные плазмиды содержали ген cysE5, и были названы pMIV-EY2. Для подтверждения исправности cysE5 аллеля в полученных трансформантах была измерена ферментативная активность серинацетилтрансферазы.
Следующим этапом была интеграция генов cysE5 и yeaS в хромосому штамма SC17 P.ananatis (патент США 6596517). Плазмида рМН10 (Зименков Д. и др., Биотехнология, 6, 1-22 (2004)) была использована для трансформации штамма SC17 P.ananatis методом электропорации. Полученные трансформанты высевали на LB-агар с канамицином (20 мг/л), чашки инкубировали в течение ночи при 30°С до образования различимых индивидуальных колоний. Полученный штамм SC17/pMH10 дважды пересевали. Затем с помощью метода электропорации проводили трансформацию бактерий P.ananatis полученного штамма SC17/pMH10 (этот штамм растет при 30°С) плазмидой pMIV-EY2. Полученные трансформанты подвергали тепловому шоку при высокой температуре (42°С, 20 минут) и высевали на LB-агар, содержащий хлорамфеникол (20 мг/л), чашки инкубировали в течение ночи при 39°С до образования различимых индивидуальных колоний. Около 50 клонов пересевали при 39°С, и каждый из них засевался в 1 мл LA-среды и инкубировали 48 часов при 39°С. После инкубации все 50 вариантов тестировали на утрату плазмид рМН10 и pMIV-EY2, и отбирали варианты, устойчивые к хлорамфениколу (20 мг/л), но чувствительные к канамицину (20 мг/л) и ампициллину (50 мг/л). Желаемые интегранты были идентифицированы с помощью ПЦР анализа с праймерами Р1 и Р6. Полученная линия штаммов была названа EY01-EY50, все из них были проверены на способность продуцировать цистеин в пробирках для ферментации. Для дальнейших экспериментов был отобран наилучший продуцент - штамм EY19.
Чтобы избавить штамм P.ananatis EY19 от устойчивости к хлорамфениколу, EY19 был трансформирован плазмидой pMT-Int-Xis2 (WO 2005/010175) методом электропорации. Полученные трансформанты высевали на LB-агар с тетрациклином (10 мг/л), чашки инкубировали в течение ночи при 30°С до образования различимых индивидуальных колоний. Желаемые трансформанты были идентифицированы за счет отбора вариантов, чувствительных к хлорамфениколу (20 мг/л). Такой «вылеченный» штамм был назван EY19(s).
Следующим этапом была замена у штамма EY19(s) промоторного района cysPTWA-генов промоторным районом Pnlp8. ПЦР была выполнена с использованием плазмиды pMIV-Pnlp8 -yeaS7 в качестве матрицы и праймерами P1 and Р2. Условия ПЦР были следующими: денатурация 3 мин при 95°С; условия для первых двух циклов: 1 мин при 95°С, 30 с при 50°С, 40 с при 72°С; условия для последующих 20 циклов: 20 с при 94°С, 20 с при 59°С, 15 с при 72°С; финальная элонгация: 5 мин при 72°С. Амплифицированный ДНК-фрагмент имел длину около 0,2 т.п.н., его очистка осуществлялась с помощью агарозного гель-электрофореза. Затем очищенный фрагмент обрабатывался фрагментом Кленова. После этого, полученный ДНК-фрагмент лигировали в эквимолярном соотношении с плазмидой pMW118-(λattL-Kmr-λattR) (Справочный пример 2), предварительно обработанной эндонуклеазой XbaI и фрагментом Кленова. Смесь для лигирования инкубировали в течение ночи при 4°С и затем использовали для трансформации штамма Е.coli MG1655 методом электропорации. Полученные трансформанты высевали на LB-агар с канамицином (20 мг/л), чашки инкубировали в течение ночи при 37°С до образования различимых индивидуальных колоний. Из полученных трансформантов выделяли плазмиды из и анализировали с помощью рестрикционного анализа. Полученная плазмида, содержащая промотор Pnlp, была названа pMW-Km-Pnlp8. Затем пр