Способ получения индуцированных плюрипотентных стволовых клеток из фибробластов пациентов с болезнью хангингтона
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описан способ получения индуцированных плюрипотентных стволовых клеток (ИПС клеток) из фибробластов кожи пациента больного хореей Гентингтона, включающий получение и размножение фибробластов, посев указанных фибробластов на лунки плотностью 30% монослоя в среде DMEM+P/S+L-Glu+10% FBS+bFGF 2 нг/мкл, инфицирование клеток при достижении плотности 60% монослоя четырьмя вирусами LeGO-hOct4-MOI 5, LeGO-hSox2-MOI 5, LeGO-hc-Myc-MOI 2.5, LeGO-hKlf4-MOI 5. Через 4 дня клетки пересевают на пластик 1 к 22.5 в среде DMEM+P/S+L-Glu+10% FBS, через день среду меняют на ESmed и культивируют в течение 8-10 дней, при этом среду меняют раз в 2 дня, осуществляют механический пересев 1 к 1 на матригель в среде mTeSRI, осуществляют культивирование до роста колоний, морфологически похожих на ЭСК, через неделю производят отбор клонов. Представлена линия клеток, полученная описанным способом, предназначенная для лечения хореи Гентингтона, которая имеет следующие морфомолекулярные характеристики: размер порядка 20 мкм, большое ядро, рост компактными колониями с плотным контактом, период удвоения, как и ЭСК, учитывая погрешность, нормальный кариотип 46 хромосом, экспрессию Oct4, SOX2, FOXD3, HESX1, Nanog, Sall4. 2 н.п. ф-лы, 5 ил., 2 табл., 1 пр.
Реферат
Изобретение относится к биотехнологии, а именно к способу получения индуцированных плюрипотентных стволовых клеток и линии клеток, полученной представленным способом. Изобретение направлено на расширение арсенала средств, предназначенных для борьбы с болезнью Хангтингтона.
Болезнь (хорея) Хангтингтона или Гентингтона (БГ) - одно из наиболее известных экстрапирамидных наследственных нейродегенеративных заболеваний. Распространенность БГ колеблется от 0,1-0,38 (Япония, страны Африки) до 3-7 (страны Западной и Восточной Европы, США, Канада) на 100000 населения [Bates et al., 2002], в некоторых популяциях доходя до 15-17 и выше на 100000 человек (остров Тасмания, Венесуэла). Вот уже более 100 лет БГ приковывает к себе пристальное внимание исследователей во всем мире. Это связано, прежде всего, с особой тяжестью страдания, характеризующегося развитием и неуклонным прогрессированием хореических гиперкинезов, личностных и когнитивных нарушений, вплоть до развития тяжелой деменции, и отсутствием до настоящего времени каких-либо эффективных этиопатогенетических методов лечения. Весьма драматично то, что клиника заболевания развивается обычно на 4-5 десятилетиях жизни (средний возраст начала 35-44 лет [Bates et al., 2002]), причем, вследствие практически полной пенетрантности мутантного гена БГ, его носитель неизбежно заболевает. До момента дебюта заболевания человек, являясь носителем гена БГ, остается практически здоровым, успев обзавестись семьей. Дети больного относятся к группе риска с вероятностью передачи им мутантного гена 50%.
Это тяжелейшее нейродегенеративное заболевание с аутосомно-доминантным типом наследования было одним из первых в неврологии, для которого еще в 1983 г. группой исследователей из Гарвардского университета во главе с J. Gusella был картирован хромосомный локус на коротком плече 4-й хромосомы (4р16.3) при изучении крупнейшей в мире когорты больных БГ - коренных жителей Венесуэлы (около 3000 больных), компактно живущих на островах озера Маракаибо [Wexler et al., 2004]. Клонирование гена БГ в 1993 году [HD Collaborative Research Group] явилось первым важнейшим шагом в изучении молекулярной биологии БГ. Распространенность заболевания, закономерности течения нейродегенеративного процесса, высокая пенетрантность мутантного гена и поздняя манифестация позволяют фактически рассматривать БГ в качестве «модельного» заболевания при изучении молекулярных механизмов нейродегенерации, а также вопросов медико-генетического консультирования и прогностического тестирования в современной нейрогенетике.
Клиническая картина БГ складывается из триады клинических симптомов - сочетания распространенных моторных нарушений, эмоционально-волевых и когнитивных расстройств, неуклонно прогрессирующих вплоть до развития деменции вследствие селективной гибели нейронов подкорковых узлов, в первую очередь, неостриатума, а также нейронов преимущественно IV, V и VI слоев коры полушарий головного мозга [Van Raamsdonk et al., 2005; Cowan, Raymond, 2006]. Патологические изменения также обнаруживаются в периферических тканях, включая различные отделы пищеварительного тракта [Björkqvist et al., 2008; van der Burg et al. 2009]. Условно моторные расстройства при БГ можно разделить на две группы - непроизвольные движения и нарушение произвольных движений [Folstein, 1989]. К первой группе относятся характерные хореические гиперкинезы, атетоидные движения, двигательное беспокойство, дистонические проявления, тремор и, изредка, миоклонии. Ко второй группе обычно относят окуломоторные нарушения (медленные саккады), координаторные расстройства, нарушения речи, глотания и походки. Если непроизвольные движения прогрессируют, как правило, лишь на ранних стадиях заболевания, то нарушения произвольных движений находятся в строгой линейной зависимости от времени, прошедшего с момента дебюта БГ. Когнитивные нарушения выражаются в постепенном снижении памяти, преимущественно, кратковременной, внимания, концентрации, способности к усвоению новых фактов и навыков, замедленностью мышления, что в итоге приводит к развитию грубой деменции подкоркового типа. Показано, что легкие когнитивные нарушения могут присутствовать у «асимптомных» носителей гена БГ из группы риска задолго до первых моторных проявлений БГ [Клюшников, 1998; Bourne et al., 2006; Montoya et al., 2006; Paulsen et al., 2008; Tabrizi et al., 2009; Rupp et al. 2010]. Таким образом, при данном страдании существует достаточно продолжительная многолетняя стадия «предболезни», связанная с постепенным нарастанием субклинических нейродегенеративных и биохимических изменений в веществе мозга.
Эмоционально-волевые и личностные нарушения первоначально проявляются в виде повышенной нервозности, раздражительности, вспыльчивости, иногда доходящей до приступов агрессии по отношению к окружающим. Характерны аффективные расстройства в виде депрессии, либо маниакальных проявлений, психопатизация личности. Нередки шизофреноподобные симптомы в виде галлюцинаторно-бредовых проявлений [Rosenblatt, 2007]. Хореическая деменция развивается на фоне нарушений в эмоционально-волевой сфере, что весьма характерно для деменций подкоркового типа. В 9% случаев у больных БГ имеет место явная клиника шизофрении, при этом грубые личностные изменения, требующие вмешательства психиатра, обнаруживаются более чем в 70% случаев. Среди больных БГ повышена частота суицидов на фоне выраженной депрессии - по данным Lipe, до 5-10%.
Клинические проявления БГ могут сочетаться друг с другом в различной степени, что является основой широкого фенотипического полиморфизма при этом заболевании. В настоящее время выделяют в качестве основных клинических форм БГ гиперкинетическую, при которой определяющим является наличие распространенных хореических гиперкинезов, и акинетико-ригидную. Последняя подразделяется на ювенильную и позднюю акинетико-ригидную формы. Ювенильная форма заболевания (вариант Вестфаля) дебютирует в возрасте до 20 лет и проявляется акинетико-ригидным синдромом при не резко выраженных гиперкинезах или их полном отсутствии, нередко, миоклониями и эпилептическими припадками, грубыми нарушениями интеллекта и психики. Эта атипичная форма заболевания протекает наиболее злокачественно и быстро приводит к смерти. По данным Nance, Myers (2001), Gonzalez-Alegre, Afifi (2006) частота акинетико-ригидной формы БГ составляет от 5 до 10% всех случаев заболевания. Эта форма БГ, как правило, встречается при наследовании БГ от больного отца. Поздняя форма является следствием морфогенеза типичной гиперкинетической формы заболевания, когда через 15-20 лет от ее начала развивается акинетико-ригидный синдром при постепенном угасании гиперкинезов. Некоторые авторы выделяют еще психическую форму заболевания, при которой психические нарушения резко превалируют над моторными расстройствами [Wagle et al., 2000].
БГ неуклонно прогрессирует и неизбежно заканчивается полным распадом личности и обездвиженностью больных, требующих постоянного ухода. Смерть, как правило, наступает вследствие интеркуррентных инфекций, общего истощения, либо аспирации твердой или жидкой пищи. Медиана выживаемости при БГ составляет 15-18 лет (колебания от 5 до >25 лет), средний возраст смерти - 54-55 лет [Harper et al., 2005].
Клонирование гена БГ в 1993 году [HD Collaborative Research Group] позволило установить, что БГ относится к группе болезней, обусловленных динамическими мутациями: в частности, при БГ имеет место аномальное увеличение («экспансия») тринуклеотидных цитозин-аденин-гуаниновых (CAG) повторов в первом экзоне гена НТТ (IT-15) в локусе 4р16.3. Удлиненные мутантные аллели характеризуются выраженной генетической нестабильностью в процессе репликации ДНК, особенно в мужском гаметогенезе, что нередко приводит к дальнейшему изменению (чаще - нарастанию) числа повторов при передаче гена в следующее поколение. Ген НТТ состоит из 67 экзонов и имеет длину более 200 kb. Обычно он экспрессируется в виде двух транскриптов (10,3 kb и 13,6 kb), различающихся длиной 3' UTR. Нормальные аллели гена НТТ содержат 10-35 повторов (медиана - 18), наиболее обычные аллели в популяции - 15-20 CAG-повторов [Warby et al., 2009]. При этом аллели с числом CAG-повторов 27-35 называют промежуточными или «мутабельными» [Potter et al 2004], так как они являются источником экспансии CAG-повторов в последующих поколениях с риском 6-10% [Semaka et al., 2006], однако их носители имеют нулевой риск развития заболевания. Количество повторов 36-39 называют «зоной неполной пенетрантности», так как у носителей подобных аллелей клинически манифестная БГ развивается в редких случаях (частота не описана), нередко, в атипично мягкой форме и в весьма преклонном возрасте [Telenius et al., 1993; Britton et al., 1995]. Иногда такие аллели обнаруживают у пожилых, клинически здоровых индивидуумов из группы риска. У больных с типичными клинически манифестными формами БГ число CAG-триплетов составляет 40 и более, в редких случаях может превышать 100 и более, составляя более 60 копий при ювенильном варианте БГ. Гомозиготные носители мутантного гена НТТ не имеют особенностей клинических проявлений и течения заболевания [Dürr et al., 1999]. Расшифровка структуры гена НТТ стала основой разработки эталонной ДНК-диагностики заболевания для случаев экспансии CAG-повторов менее 115 (ПЦР-анализ) и более 115 (Southern blot анализ, применяемый также для подтверждения случаев гомозиготного носительства мутантного гена) [Potter et al., 2004; Levin et al., 2006].
Различными группами исследователей были выявлены разнообразные значимые клинико-генетические корреляции при БГ. Показано, что с увеличением числа копий CAG-повторов снижается возраст начала БГ [Andrew et al., 1993; Langbehn et al., 2004; Langbehn et al., 2010], возраст дебюта отдельных клинических симптомов и возраст смерти [Rosenblatt et al., 2006; Aziz et al,, 2009], а также ускоряется темп прогрессирования заболевания [Illarioshkin et al., 1994; Иллариошкин и др., 1996]. Изучение молекулярной биологии гена БГ позволило объяснить эти феномены природой гена БГ, кодирующего белок гентингтин, состоящий из 3144 аминокислотных остатков, с молекулярной массой 348 kd. Гентингтин широко экспрессируется в различных органах и тканях. При БГ методом электронной микроскопии в нейронах стриатума выявляются характерные внутриядерные включения, представляющие собой высокомолекулярные амилоидоподобные агрегаты [Roizin et al., 1979]. Присутствие в составе включений мутантного белка гентингтина подтверждается с помощью иммуногистохимического исследования [Li et al., 1995; DiFiglia et al., 1997]. Аналогичные гентингтин-позитивные включения выявляются также в аксонах и дендритах. Накопление внутриядерных агрегатов, как правило, сопровождается разнообразными аномалиями ядерной мембраны (инвагинации, повышенная кластеризация пор и др.) [Feigin, 1998]. Функция данного белка до сих пор точно неизвестна, ее изучение представляется, таким образом, одной из актуальных проблем современной нейробиологии. Гомолог гена гентингтина имеется у целого ряда низших млекопитающих (например, ген HDh у мышей), что оказалось весьма ценным с экспериментальной точки зрения. Рядом исследовательских групп были созданы линии мышей с инактивированным («нокаутированным») геном HDh [Bates et al., 1997]. Во всех экспериментах инактивация обеих копий гена HDh оказалась летальной уже на ранней эмбриональной стадии, что свидетельствует о важной роли гентингтина в эмбриональном развитии и регуляции жизненного цикла клеток, подверженных апоптозу. В то же время инактивация одной копии гена HDh в большинстве случаев не сопровождалась развитием у таких животных каких-либо определяемых фенотипических нарушений. Мыши, у которых собственный ген HDh был полностью инактивирован, сохраняли нормальное, раннее эмбриональное развитие при условии введения в их геном функционально активного гена человеческого гентингтина с экспансией CAG-повторов [White et al., 1997]; это свидетельствует о том, что в случае экспансии CAG-повторов собственная нормальная функция гентингтина остается сохранной. Таким образом, предполагается, что он играет важную роль на ранних стадиях нейрогенеза у эмбрионов [Godin et al., 2010], а также является фактором транскрипции. Гентингтин ассоциирован с микротрубочками, везикулярными мембранами и синаптосомами нейронов, что позволяет обсуждать вопрос об участии данного белка в эндоцитозе и цитоплазматическом транспорте [Albin, Tagle, 1995; Feigin, 1998].
Трансгенные модели БГ у мышей были созданы путем встраивания в их геном различных конструкций на основе человеческого гена НТТ, несущих экспандированный (CAG)n-участок с числом повторов от 48 до 156 [Bates et al., 1997; Reddy et al., 1998; Schilling et al., 1999]. Экспрессия данных генетических конструкций приводила к прогрессирующему снижению массы мозга животных, начиная с 12-й недели жизни, гибели нейронов и астроцитарному глиозу в стриатуме и других отделах мозга, появлению гентингтин-позитивных включений в ядрах и отростках дегенерирующих нейронов, снижению общей массы тела и манифестации у трансгенных животных полиморфных неврологических нарушений (гиперкинезы, нарушения общей подвижности и походки, эпилептические припадки) на 2-м-5-м месяце жизни. При дальнейшем скрещивании и появлении потомства трансгенных мышей, гомозиготных по экспандированному (CAG)n-аллелю, возраст манифестации болезни снижался, и темп ее прогрессирования нарастал. При этом трансгенные мыши, имевшие CAG-участок гена с числом повторов ниже патологического порога (6-26 повторов), всегда оставались фенотипически здоровыми. Был сделан вывод, что для манифестации болезни у трансгенных животных необходимым условием является не просто экспрессия нового пептида на основе человеческого гентингтина, а экспрессия в тканях-мишенях именно патологически удлиненного белкового эпитопа. Данные эксперименты внесли ключевой вклад в понимание патогенеза БГ и позволили сформировать концепцию «полиглутаминовых болезней». Поскольку нуклеотидный триплет CAG кодирует аминокислоту глутамин, экспансия CAG-повторов приводит к пропорциональному удлинению и изменению конформации полиглутаминовых цепей в составе соответствующих белков, поскольку в норме полиглутаминовые цепи играют важную роль в реализации сложных межмолекулярных взаимодействий, в том числе взаимодействий типа «протеин-протеин» [Housman, 1995; Ross, 1995]. Мутантные белки с удлиненным полиглутаминовым трактом приобретают новые, цитотоксичные функции. Предполагается, что удлиненный полиглутаминовый участок молекулы способствует формированию патологических межмолекулярных связей с рядом тканеспецифических белков ЦНС и факторов транскрипции, агрегации амилоидогенных белковых комплексов в ядре и цитоплазме, индукции митохондриальных нарушений и апоптоза. Согласно современным представлениям все нейродегенеративные заболевания, обусловленные экспансией транслируемых CAG-повторов, объединяются в единую молекулярную группу полиглутаминовых болезней, к которым относятся БГ, 6 форм аутосомно-доминантных спиноцеребеллярных атаксий (СЦА1, 2, 3, 6, 7, 17), дентаторубро-паллидолюисовая атрофия и спинально-бульбарная амиотрофия Кеннеди [Hardy, Gwinn-Hardy, 1998; Kakizuka, 1998; Paulson, 1999]. Патофизиология полиглутаминовых болезней характеризуется сходными механизмами, позволяя выделять их в качестве самостоятельной разновидности так называемых конформационных болезней мозга, объединяющих, помимо полиглутаминовых болезней, болезнь Паркинсона, таупатии, болезнь Альцгеймера и другие формы церебральных амилоидозов, прионные болезни, БАС [Иллариошкин, 2003]. Ключевыми звеньями патогенеза являются [Не et al., 2010; Ross, Tabrizi, 2011] изменение пространственной укладки (конформации) белков с удлиненным полиглутаминовым трактом, их преципитация в нерастворимые амилоидоподобные образования, запуск защитных внутриклеточных механизмов, направленных на деградацию аномальных пептидов (в частности, экспрессия белков-шаперонов, способствующих «распрямлению» неправильной укладки аномальных белков и активация убиквитин-протеасомного пути деградации аномальных пептидов), срыв защитных механизмов, дальнейшая преципитация белков с накоплением их в ядрах дегенерирующих нейронов с формированием внутриядерных включений, активация ферментов-каспаз, ответственных за запуск механизма программируемой гибели клеток по типу апоптоза, нарушение внутриклеточных ионных каналов с активацией NMDA-рецепторов глутамата и эксайтотоксического эффекта. Токсичные полиглутамины связывают целый ряд внутриклеточных и внутриядерных белков, в частности факторов транскрипции генов, в клетке нарушается синтез многих белков, энергетический метаболизм, развивается оксидантный стресс, что, в конечном итоге, и приводит к гибели специфических популяций нейронов.
Полиглутаминовые заболевания имеют ряд общих клинико-генетических особенностей, столь характерных для БГ, обусловленных природой мутации [Иллариошкин и др., 1995; Rosenberg, 1996; Brice, 1998; Stevanin, 2000, Djousse et al., 2003; Aziz et al., 2009; Semaka et al., 2010]: 1) доминантный характер реализации мутации. Все полиглутаминовые болезни (за исключением болезни Кеннеди) наследуются по аутосомно-доминантному типу; 2) высокий уровень экспрессии мутантных генов в различных тканях организма и различных отделах ЦНС, в том числе тех, которые не вовлекаются в дегенеративный процесс и остаются сохранными. Несмотря на экспрессию мутантных продуктов во всех клетках организма, начиная с рождения, полиглутаминовые заболевания характеризуются длительным латентным периодом и появлением клинических симптомов лишь в сравнительно позднем возрасте; 3) близкие границы нормальных и мутантных аллелей; 4) тяжесть клинических проявлений полиглутаминовых заболеваний прямо пропорционально коррелирует с величиной экспансии CAG-повторов; 5) феномен антиципации, обусловленный нестабильностью патологического CAG-участка и нарастанием его длины при передаче мутантного гена потомкам; 6) эффект «отцовской передачи», связанный с преимущественным удлинением мутантного CAG-повтора в мужском гаметогенезе и проявляющийся манифестацией более ранних и тяжелых случаев болезни у потомков больного отца. 7) вариабельная экспрессивность полиглутаминовых болезней - от субклинических и «мягких» форм до тяжелых развернутых случаев с быстрым, фатальным течением (в том числе даже в рамках одной семьи); 8) соматический мозаицизм числа CAG-повторов - определенные различия числа тринуклеотидных повторов в клетках различных тканей, обусловленные нестабильностью мутантного тринуклеотидного участка при делении ядер соматических клеток; 9) происхождение мутаций de novo от имеющихся в популяции редких аллелей с «промежуточным» числом CAG-повторов. Такие аллели сами по себе не приводят к болезни, но являются генетически нестабильными и способны переходить в «полную мутацию» при передаче гена потомкам.
В настоящее время ведется интенсивная поисковая работа, направленная на уточнение известных и поиск новых звеньев патогенеза БГ. Изучается роль генов-модификаторов (Glur6, APOE, GRIN2B, НАР1 и др.), влияющих на дебют и течение заболевания [MacDonald et al., 1999; Kehoe et al., 1999; Arning et al., 2007; Metzger et al., 2008]. Анализируются механизмы агрегации мутантного гентингтина и их цитотоксического действия [Arrasate et al., 2004; Poirier et al., 2005; Gidalevitz et al., 2006; Bennett et al., 2007; Jeong et al., 2009], а также нарушений взаимодействий типа «протеин-протеин» [Goehler et al., 2004; Bae et al., 2006; Luo et al., 2008]. Большое значение также уделяется изучению роли апоптоза, белков теплового шока, митохондриальной дисфункции и оксидантного стресса в цитопатологии нейронов при БГ [Wyttenbach et al., 2002; Greenamyre, 2007], нарушений биосинтеза холестерола и его метаболитов в мозге [Valenza, Cattaneo 2010; Leoni et al., 2011]. Полная расшифровка всех механизмов нейродегенерации при БГ и других подобных тяжелых страданиях даст ключ к эффективной этиопатогенетической терапии, направленной на предупреждение и приостановку развития заболевания у лиц, унаследовавших мутантный ген. В настоящее время основными направлениями исследований перспективных патогенетических методов лечения БГ являются:
1) поиск нейропротекторов-ингибиторов апоптоза, оксидантного стресса, эксайтотоксичности, а также блокирующих воспалительные реакции и модулирующих трансглутаминазную активность. В рамках данных исследований показано модифицирующее влияние на течение БГ (как на анимальных моделях, так и в предварительных клинических триалах) таких препаратов, как коэнзим Q10, идебенон, миноциклин, бутират натрия, комплекс эссенциальных жирных кислот, рацемид, креатин, цистамин, рилузол, мемантин [Walker, Raymond, 2004; Bender et al., 2005; Puri et al., 2005; Bonelli, Wenning, 2006; Hersch et al., 2006; Okamoto et al. 2009];
2) поиск субстанций («малых молекул»), повышающих экспрессию молекулярных шаперонов и активность протеасомного комплекса с целью ингибирования агрегации полиглутаминовых белков и подавления нейродегенеративного процесса [Zhang et al., 2005; Fecke et al., 2009; Varma, 2010]. В настоящее время достигнуты определенные достижения in vivo;
3) исследования возможностей клеточной терапии с подсадкой модифицированных стволовых клеток. Достигнутые результаты неоднозначны, до последнего времени число наблюдений остается недостаточным [Furtado et al., 2005; Bachoud-Levi et al., 2006; Farrington et al. 2006; Dunnett, Rosser, 2007; Dey et al., 2010; Kandasamy et al., 2010; Meyer, 2010; Rossignol et al., 2010; Cicchetti et al., 2011]. Данное направление исследований весьма перспективно;
4) генная терапия, в первую очередь, исследования феномена РНК-интерференции (RNAi) путем применения «антисмысловых» РНК-последовательностей для блокирования матричной РНК клеток-мишеней с целью подавления синтеза мутантного гентингтина и снижения загруженности клеток продуктами нарушенного белкового метаболизма. Данное направление исследований также весьма многообещающе и перспективно [Denovan-Wright et al., 2008; Franich et al., 2008; McBride et al., 2008; Boudreau et al, 2009; Pfister et al., 2009; Maxwell 2009, Hu et al., 2010; Soldati et al., 2011; Sah, Aronin, 2011].
Наиболее перспективным вариантом лечения болезни Хангтингтона, на наш взгляд, является подход, основанный на клеточной терапии.
Плюрипотентные клетки способны дифференцироваться во все типы клеток взрослого организма, что делает их весьма интересным объектом для фундаментального исследования процессов дифференцировки, а также для медицинских целей. Для многих болезней не существует медикаментозного лечения, к таким заболеваниям относятся инфаркты, сахарный диабет первого типа, различные нейродегенеративные заболевания (болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, миодистрофия Дюшена и др.). В ходе развития этих заболеваний пациент необратимо утрачивает клетки определенного типа, и медикаментозное лечение не может восполнить эти потери. Заменить утраченные клетки можно методом клеточной терапии. Клеточные материал для трансплантации должен быть гомогенен и состоять, преимущественно, из клеток целевого типа. Из плюрипотентных клеток можно получить культуры, обогащенные определенным типом клеток (Zhang et al., 2009; Paige S.L. et al., 2010; Hu B.-Y. et al., 2010; Ohta S. et al., 2011). В настоящее время известно два типа плюрипотеных клеток: эмбриональные стволовые (ЭС) клетки и индуцированные плюрипотентные стволовые (ИПС) клетки.
Получение ЭС клеток и разработку методов манипулирования с ними, безусловно, следует отнести к одному из самых замечательных и важных достижений науки в конце XX века. Поскольку ЭС клетки млекопитающих представляют собой практически неисчерпаемый источник недифференцированных и нетрансформированных клеток с нормальным диплоидным кариотипом, они будут оставаться важнейшим объектом для исследователей, занимающихся изучением путей эмбрионального развития, формирования и функционирования отдельных типов тканей в норме и при различных патологиях. Кроме того, ЭС клетки человека, в частности генетически модифицированные, в перспективе, безусловно найдут применение в клеточной терапии тяжелых заболеваний человека. Тем не менее, применение ЭС клеток в клеточной терапии сталкивается с рядом сложностей как медицинского, так и этического характера.
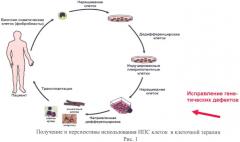
Однако результаты последних исследований открывают совершенно новые возможности в области клеточной терапии. Речь идет о репрограммировании соматических клеток человека в плюрипотентные стволовые клетки с дальнейшей их дифференцировкой в клетки различных типов, а также, в перспективе, трансплантацией таких клеток пациентам, страдающим различными тяжелыми заболеваниями (рис.1).
Раньше считалось, что развитие организма идет однонаправленно: от тотипотентной зиготы к высокодифференцированным клеткам различных тканей взрослого организма. Однако оказалось, что процесс дифференцировки можно повернуть вспять и получить из дифференцированных клеток плюрипотентные. В 2006 г. японским исследователям Takahashi К. и Yamanaka S (Takahashi К. et al, 2006) удалось осуществить репрограммирование взрослых и эмбриональных фибробластов мыши в плюрипотентные стволовые клетки путем введения в эти клетки с помощью ретровирусных векторов четырех транскрипционных факторов Oct3/4, Sox2, c-Myc и Klf4. Авторы назвали эти клетки индуцированными плюрипотентными стволовыми (ИПС) клетками. Полученные в результате такой обработки ИПС клетки обладали сходной с ЭС клетками морфологией, ростовыми свойствами и экспрессировали специфические маркеры, присущие ЭС клеткам. Уже через год Takahashi К. с сотр. (Takahashi К. et al, 2007) и Nakagawa с сотр. (Nakagawa, M. et al, 2008) из той же лаборатории Киотского университета сообщили об успешной дедифференцировке фибробластов взрослого человека и получении ИПС клеток с помощью тех же факторов (Oct4, Sox2, c-Myc и Klf4).
Репрограммированные клетки экспрессируют все основные маркеры плюрипотентности, присущие ЭС клеткам. Недифференцированное состояние плюрипотентных клеток характеризуется различными признаками. Недифференцированные ИПС клетки характеризуются высокой активностью щелочной фосфатазы (Takahashi К. et al, 2007), экспрессией протеогликанов TRA-1-60 и TRA-1-81 (Lowry W.E. et al, 2008) и гликолипида SSEA-4 и в меньшей степени гликолипида SSEA-3 (Park I.-H. et al., 2008). SSEA-4 и SSEA-3 характерны только для плюрипотентных клеток человека и приматов, ИПС клетки мыши несут на своей поверхности только гликопротеин SSEA-1 (Takahashi К. et al, 2006).
Внутриклеточными маркерами недифференцированного состояния являются транскрипционные факторы, необходимые для поддержания плюрипотентности ИПС, такие как Oct4, Nanog и Sox2 (Maherali N. et al, 2007; Yu J. et al., 2007; Brambrink T. et al., 2008). Также ИПС клетки отличаются от дифференцированных клеток по эпигенетическому состоянию генома. Так, в плюрипотентных клетках, в отличие от дифференцированных клеток, промоторы генов Oct4 и Nanog деметилированы (Hanna J. et al., 2008).
Кроме белковых маркеров существуют функциональные тесты на плюрипотентность. Самым простым из них является спонтанная дифференцировка ИПС клеток in vitro. После культивирования ИПС клеток человека в отсутствие фидера из мышиных эмбриональных фибробластов в дифференцировавшихся клетках обнаруживается экспрессия маркеров эндодермы, мезодермы и эктодермы. Единственным возможным для человеческих плюрипотентных клеток тестом на плюрипотентность in vivo является образование тератом при введении их иммунодефицитным (SCID) мышам. В тератомах обнаруживаются такие ткани, как кишечный эпителий (эндодерма); хрящ, кость и гладкие мышцы (мезодерма); нейральный эпителий (эктодерма) (Takahashi К. et al., 2007; Brambrink Т. et al., 2008). ИПС клетки, полученные из дифференцированных клеток мыши, могут включаться не только в соматические ткани химерного животного, но и образовывать клетки половой линии (Maherali et al., 2007; Zhou et al., 2009).
ЭС и ИПС клетки практически идентичны по морфологическим и функциональным характеристикам, однако отношение общества к этим типам плюрипотентных клеток и их потенциальные области применения значительно различаются. ЭС клетки имеют ряд недостатков, ограничивающих их применение в медицине и лабораторной практике (Таблица 1). Говоря о клеточной терапии, следует отметить один из основных недостатков ЭС клеток - возможное развитие иммунного ответа на трансплантант. Поскольку существует ограниченное количество линий ЭСК, не для всех реципиентов можно подобрать подходящий по антигенам лейкоцитов человека (HLAs) трансплантат. Выходом из этого положения могут служить генетически измененные ЭС клетки человека с генами HLA реципиента, но такой подход сложный и трудоемкий, никто не знает, сколько клонов необходимо будет получить. Другой альтернативой является получение новой пациент-специфичной линии ЭС клеток путем переноса ядра соматической клетки в энуклеированный ооцит. Эта методика позволит избежать развития иммунного ответа у реципиента, но она сопряжена с получением человеческого эмбриона и последующим его разрушением для выделения ЭС клеток, то есть данная методика объединяет в себе клонирование человека и разрушение человеческого эмбриона, два наиболее этически и политически спорных вопроса (O'Mathuna D.P. et al., 2002). Правовой статус эмбриона, а значит и возможность или невозможность разрушить его для получения ЭС клеток обсуждается больше 10 лет политиками, биоэтиками, правозащитниками и журналистами.
Другой интересной областью применения плюрипотентных клеток является изучение механизмов развития различных генетически обусловленных болезней и скрининг лекарственных препаратов на культурах клеток, несущих соответствующую данной болезни мутацию. Как получить такие «больные» клетки? Самый простой выход - выделить первичные культуры клеток из пациентов, страдающих интересующим нас заболеванием. Но не все клетки человеческого организма способны длительное время находиться в культуре, а некоторые типы клеток (например, нейроны) практически невозможно получать от живых доноров. Плюрипотентные клетки способны дифференцироваться в любые типы клеток взрослого организма. При использовании ЭС клеток из невостребованных при процедуре экстракорпорального оплодотворения бластоцист исследователь может узнать, несет ли данный эмбрион какую-либо мутацию, но это связано с трудоемкой процедурой анализа единичного бластомера. При получении ЭС клеток методом переноса ядра соматической клетки в энуклеированный ооцит вопрос о наличии мутации решен, но мы возвращаемся к другому камню преткновения - клонированию человека. Таким образом, получение ИПС клеток с известной мутацией от взрослого донора является в настоящее время наиболее предпочтительным (Таблица 1). Такие клетки позволяют изучать механизмы развития болезни и тестировать лекарственные препараты. Также в сочетании с исправлением мутантных генов пациента специфичные ИПС клетки могут служить потенциально неиссякаемым ресурсом для клеточной терапии генетических заболеваний человека.
| Таблица 1 | ||
| Сравнение свойств ИПС и ЭС клеток | ||
| Характеристики | ЭС клетки | ИПС клетки |
| Плюрипотентность | + | + |
| Источник | Эмбрион (бластоциста) | Взрослый организм |
| Этические проблемы | + | - |
| Возможность получения «больных» клеток | - | + |
| Пациентоспецифичность | - | + |
Существует достаточно большое разнообразие методов индукции плюрипотентности. Исторически первыми были вирусные системы индукции: ретровирусная трансфекция (Takahashi К. et al., 2006), лентивирусная трансфекция (Yu J. et al., 2007). Но клетки, несущие в своем геноме вирусные вставки, не могут применяться для клеточной терапии из-за опасности активации трансгенов в организме пациента, что может привести к развитию злокачественных заболеваний. В связи с этим стали разрабатываться безвирусные методы индукции плюрипотентности: piggyBac транспозон, несущий транскрипционные факторы Oct4, Sox2, c-Myc, Klf4, слитые через 2А пептиды (Kaji К. et al., 2009), плазмидные ДНК (Okita К., 2008), рекомбинантные транскрипционные факторы (Oct4, Sox2, c-Myc, Klf4) (Zhou H. 2009). Однако невирусные методы также не лишены недостатков. Система транспозон-транспозаза предполагает внесение двух двунитевых разрывов при встраивании целевой последовательности и при ее удалении, репарация двунитевых разрывов может пройти с ошибками, что приведет к возникновению потенциально опасной мутации. Репрограммирование с помощью неинтегрирующихся векторов, как и с помощью белков, проходит с очень низкой эффективностью (Таблица 2). Новейшей разработкой в данной области является индукция плюрипотентности с помощью трансфекции соматических клеток мРНК факторов репрограммирования (Oct4, Sox2, c-Myc, Klf4) (Warren L. et al., 2010). Данная методика является безопасной, так как мРНК полностью разрушается в клетке, а ее синтез in vitro не связан с использованием материалов животного происхождения.
| Таблица 2 | ||
| Эффективность репрограммирования с помощью различных методов | ||
| Способ репрограммирования | Эффективность репрограммирования (%) | Источник |
| Лентивирусная трансфекция | 0,02-0,2 | (Yu J. et al., 2007) (Brambrink Т. et al., 2008) |
| Ретровирусная трансфекция | 0,1 | (Takahashi K. et al., 2007) |
| Система транспозон-транспозаза | 0,1 (4 фактора*)1 (6 факторов**) | (Yu J.. et al., 2009) |
| Плазмидные ДНК | 0,0001-0,003 | (Okita K. et al., 2008) |
| Рекомбинантные белки | 0,006 | (Zhou H. et al., 2009) |
| мРНК | 2 | (Warren L. et al., 2010) |
| *- Oct4, Sox2, Nanog, LIN28 | ||
| **- Oct4, Sox2, Nanog, LIN28, Klf4, c-Myc |
Как видно из Таблицы 2, процесс репрограммирования, в принципе, является низкоэффективным (<2%). Однако существует ряд низкомолекулярных соединений, которые способны увеличить эффективность репрограммирования. Ингибиторы ДНК-метилтрансферазы (Huangfu D. et al., 2008a), метилазы гистонов (BIX) (Shi Y. et al., 2008a), деацетилазы гистонов (VPA) (Huangfu D. et al., 2008a) повышают эффективность репрограммирования в несколько раз, так как репрограммирование связано с эпигенетическими перестройками в соматических клетках. Так, репрограммирование с помощью рекомбинантных белков не происходит в отсутствие VPA (Zhou H. et al., 2009). Известно также, что эффективность репрограммирования эмбриональных фибробластов мыши можно повысить с помощью малой молекулы Bayk8644, которая является антагонистом кальциевых каналов L-типа (Shi Y. et al., 2008b). Некоторые малые молекулы способны заменять факторы репрограммирования. Так, при репрограммировании фибробластов мыши соединение kenpaullone замещает Klf4 и обеспечивает индукцию Nanog и получение полноценных ИПС клеток в присутствии лишь трех транскрипционных факторов (Oct4, Sox2, c-Myc) (Lyssiotis C.A. et al., 2009). Комбинация двух малых молекул BIX и Bayk8644 позволяет осуществлять репрограммирование эмбриональных фибробластов мыши с помощью только двух транскрипционных факторов Oct4 и Klf4 (Shi Y. et al., 2008b). Фибробласты человека можно вернуть в эмбриональное состояние с помощью транскрипционных факторов Oct4 и Sox2 в присутствии VPA (Huangfu D. et al., 2008b).
Авторами разработан способ получения индуцированных плюрипотентных стволовых клеток из фибробластов кожи пациентов с хореей Гентингтона.
Примеры
Выделение фибробластов кожи
Фибробласты были выделены из кожи 2-х пациентов женского пола с диагнозом Хорея Гентингтона. Причина заболевания: экспансия тандемных CAG-повторов в 1-м экзоне гена IT-15 (хромосома 4р16). Число копий CAG-повторов в мутантном аллеле - 42.
Конструирование плазмид
Были сконструированы плазмиды на основе LeGO vector system LeGO-hOct4, LeGO-hSox2, LeGO-hc-Myc, LeGO-hKlf4 для сборки лентивирусов. В отличие от оригинальных плазмид лаборатории Яманака в плазмидах LeGO трансген фланкирован LoxP сайтами, что позволяет его потенциально удалить из геномной ДНК клетки. Более того, новые плазмиды обеспечивают более эффективную сборку лентивирусов, что приводит к более высокому титру вируса в вирусосодержащем супернатанте над паковочными клетками. Это позволяет отказаться от концентрирования вирусов перед использованием, упростить и удешевить процедуру их получения.
Сборка лентивирусов
Была произведена сборка лентивирусов LeGO-hOct4, LeGO-hSox2, LeGO-hc-Myc, LeGO-hKlf4 и LeGO-G2 в качестве контроля. Определен титр вирусов LeGO-hOct4, LeGO-hSox2, показано, что титр этих вирусов одинаков в пределах погрешности, показана экспрессия транскрипционных факторов hOct4, hSox2.
Получение ИПС клеток
Фибробласты кожи пациента больного Хореей Гентингтона были разморожены и посеяны на лунки 12-луночного планшета с плотностью 30% монослоя в среде DMEM+P/S+L-Glu+10% FBS+bFGF 2нг/мкл. Через 2 дня после рассева клетки достигли плотности 60% монослоя и, в этот момент, были инфицированы всеми четырьмя вирусами в следующем количестве LeGO-hOct4-MOI 5, LeGO-hSox2-MOI 5, LeGO-hc-Myc-MOI 2.5, LeGO-hKlf4-MOI 5. Через 4 дня клетки были пересеяны на пластик 1 к 22,5 в среде DMEM+P/S+L-Glu+10% FBS. На следующий день среда была заменена на среду ESmed. Затем клетки культивировали в этой среде в течение 8-10 дней, среду меняли раз в 2 дня. К этому м