Способ получения эмбриональных стволовых клеток млекопитающих, модифицированных геном фактора роста нервов человека
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описан способ получения эмбриональных стволовых клеток млекопитающих, исключая человеческие, модифицированных геном фактора роста нервов человека, включающий культивирование эмбриональных стволовых клеток в среде аМЕМ с добавками, посев клеток на чашку, трансфекцию эмбриональных стволовых клеток векторами pMT-NGF и pcNGF и последующий отбор стабильных трансфектантов на селективной среде. Изобретение позволяет получать генетически-модифицированные эмбриональные стволовые клетки млекопитающих, продуцирующие в среду фактор роста нервов человека, что позволит использовать их для создания модели нейрональной дифференцировки клеток in vitro, а также использовать эти клетки для трансплантации в мозг экспериментальных животных и скрининга соединений на наличие нейропротекторной активности. 4 ил., 3 пр.
Реферат
Изобретение относится к биотехнологии. Изобретение позволяет получать генетически-модифицированные эмбриональные стволовые клетки млекопитающих, продуцирующие в среду фактор роста нервов человека, что позволит использовать их для создания модели нейрональной дифференцировки клеток in vitro, а также использовать эти клетки для трансплантации в мозг экспериментальных животных и использовать такие клетки для скрининга соединений на наличие нейропротекторной активности.
Клеточная терапия - трансплантация клеток, замещающих утраченные клетки реципиента или обеспечивающих трофическую поддержку для клеток реципиента. Этот подход представляется перспективным для лечения нейродегенеративных расстройств - болезни Паркинсона [Dass, Kordower 2006], рассеянного склероза [Henriques, Schneider 2010], последствий инсульта и травм спинного мозга [Wyman, Machida 1999]. Ограничениями в этом подходе являются доступность здоровой ткани, наличие технологии получения из нее материала, пригодного для трансплантации, и иммунологическая совместимость.
Получение пригодного для трансплантации клеточного материала от взрослых доноров в случае нервной ткани невозможно. Использование эмбрионального материала представляет этические и иммунологические трудности. Альтернативным источником любых клеток нервной ткани являются эмбриональные стволовые (ЭС) клетки.
ЭС клетки - являются потенциальным источником любых типов клеток. Разработаны протоколы дифференцировки ЭС клеток в нейральные предшественники [Cai, Grabel 2007] и взрослые нейроны, по всем своим свойствам аналогичные получаемым из фетальной ткани.
Эти протоколы дифференцировки клеток основаны на добавлении в культуральную среду специфических рекомбинантных факторов роста и дифференцировки, использования совместного культивирования стволовых клеток с другими типами клеток, например, как это показано в Ann N Y Acad Sci. "Culture and genetic modification of mouse germline stem cells", Kanatsu-Shinohara M et al, 2007 Dec; 1120: 59-71. Выживаемость и миграция клеток, получаемых из ЭС клеток, и образование кровеносных сосудов в зоне трансплантации ограничены. Эти характеристики транспланта могут быть заметно улучшены за счет одновременного применения нейротрофических факторов в зоне трансплантации.
Нейротрофические факторы включают в себя несколько семейств: семейство нейротрофинов, белки семейства GDNF, семейство факторов роста фибробластов и ряд других. Нейротрофические факторы являются необходимыми для роста, дифференцировки и выживаемости специфических популяций нейронов центральной и периферической нервной системы. Нейротрофины, в свою очередь, представляют собой семейство полипептидных факторов, представителями которого являются: фактор роста нервов (ФРН), нейротрофический фактор мозга (НФМ или в английской транскрипции BDNF), нейротрофины (НТ) 3,4/5, 6,7. При повреждениях нервной системы и в нейротрансплантах показано усиление экспрессии рецепторов к нейротрофическим факторам. [Lee Itoyama 1998].
Наиболее изученным нейротрофическим фактором является фактор роста нервов (ФРН). Данный пептид экспрессируется в эмбриогенезе и регулирует иннервацию периферических органов. [Shelton Reichardt 1984]. ФРН индуцирует дифференцировку и выживаемость моторных и сенсорных нейронов, рост аксонов и сосудообразование в трансплантированных графтах (ФРН). [Calzà, Levi-Montalcini, 2001].
Таким образом, ЭС клетки являются удобным источником материала для нейротрансплантации, и нейротрофические факторы способны увеличить выживаемость и миграцию клеток транспланта, а также повысить способность пересаженных клеток образовывать синаптические контакты с клетками реципиента за счет увеличения роста дендритов. Изучение сочетания клеточной терапии и генной терапии применения нейротрофических факторов представляет на сегодняшний день значительный интерес. Для изучения потенциальных возможностей данного подхода к терапии нейродегенеративных расстройств была создана модель на основе ЭС клеток. С помощью методов генной инженерии были сконструированы плазмидные вектора, позволяющие экспрессировать рекомбинантный человеческий фактор роста нервов в ЭС клетки млекопитающих. Данными векторами были трансфицированы ЭС клетки мыши, и с помощью селективного маркера были отобраны линии клеток, имеющие стабильную геномную интеграцию гена ФРН человека hNGF.
Примеры.
Пример 1.
Конструкция векторов.
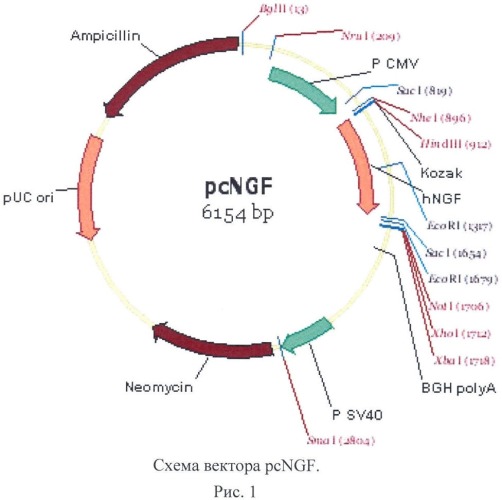
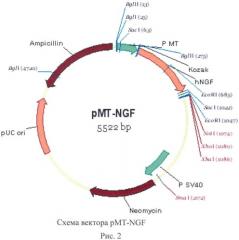
Для конститутивной и регулируемой экспрессии ФРН человека в ЭС клетках млекопитающих авторами были сконструированы плазмидные вектора pcNGF (рис.1) и pMT-NGF (рис.2).
pcNGF представляет собой плазмиду длиной 6154 п.о., несущую гены устойчивости к ампициллину, гентамицину, и ген ФРН человека под регуляцией конститутивного цитомегаловирусного промотора Р CMV. Последовательность препропептида ФРН человека, кодируемая 3'-экзоном человеческого гена NGFB, была клонирована в плазмиду pUC19 из кДНК библиотеки, полученной из гиппокампа человека в институте Молекулярной Генетики РАН, сотрудниками лаборатории белковой инженерии.
Последовательность ФРН была амплифицирована с помощью ПЦР с использованием малоошибочной полимеразы pfu (из Pyrococcus Furiosus) и pUC19-hNGF в качестве матрицы. В реакции использовали праймеры, фланкированные сайтами рестрикции HindIII и BamHI. ПЦР ампликон был рестрицирован по вышеозначенным сайтам и лигирован в полилинкер вектора pcDNA3.1(+) (Invitrogen, США).
pMT-NGF представляет собой аналогичный вектор с генами неомициновой и ампициллиновой устойчивости, в котором промотор CMV заменен на мышиный промотор металлотионеина-I Р MT-I. Активность данного промотора регулируется ионами тяжелых металлов [Stuart GW, Palmiter RD, 1984]. Показано, что ионы двухвалентного цинка в концентрациях 150-300 мкМ способны вызывать высокий уровень экспрессии трансгенов под этим промотором в культурах клеток [Wyman, Machida 1999]. Плазмида pcDNA3.1(+) была рестрицирована по сайтам BglII и HindIII, при этом был удален фрагмент промотора Р CMV, и вместо него лигирована линкерная вставка BglII-EcoRI и последовательность 256 bp промотра Р МТ, вырезаная по сайтам EcoRI и HindIII из плазмиды pBS-MT1.
Пример 2.
Культура клеток и трансфекция.
Стволовые клетки культивировали в среде аМЕМ с добавками глутамина, пирувата натрия, заменимых аминокислот, нуклеозидов, витаминов, меркаптоэтанола и гентамицина и 15% фетальной сыворотки коровы. В среду также добавляли рекомбинантный фактор, ингибирующий лейкемию (LIF), обеспечивающий сохранение клетками плюрипотентного фенотипа.
Плазмидами pMT-NGF и pcNGF были трансформированы компетентные клетки Е.Coli штамма XL-1, имеющего эндогенную устойчивость к тетрациклину, и трансформанты рассевали на жидкую среду Лурье-Бретони, содержащую ампициллин и тетрациклин. Плазмидная ДНК выделялась с помощью S.N.A.P. midiprep kit (США, invitrogen).
Описанными выше плазмидами pMT-NGF и pcNGF с помощью липосомального агента Metafectene (Biontex, Германия) были трансфицированы эмбриональные стволовые клетки мыши линии R1 клон 2, выделенный из линии R1 в нашей лаборатории.
Клетки высевали по 200 тысяч на 35 мм чашку, трансфекцию колоний ЭС клетки осуществляли через 24 часа после посева. Среду сливали до объема 1 мл и к клеткам добавляли прединкубированную смесь плазмидной ДНК и метафектена. На 35 мм чашку брали 7 мкг плазмидной ДНК, а соотношение ДНК-метафектен составило 1 к 2 (масса/объем). Стабильные трансфектанты отбирали на селективной среде с неомицином, 200 ед./мл.
Для изолирования индуцибельных клонов от линии pMT-NGF, проводилось клонирование. Для этого, клетки высевались на 96 луночные плашки, по 1-2 клетки на лунку в среду с добавкой LIF, и далее, клоны успешно формировавшие колонии, размножались на чашках, и рассевались параллельно - в присутствии, и в отсутствии индуктора. Индукция металлотионеинового промотора осуществлялась с помощью добавления в среду соли двухвалентного цинка, например ацетата, Zn(CH3COO)2 в концентрации 300 микромоль. Токсичность цинка в данной концентрации не проявлялось, что подтверждено данными подсчета клеток и МТТ-теста клетках исходной линии R1.
Пример 3.
ПЦР-анализ полученных линий ЭСК.
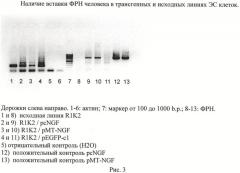
Из устойчивых линий ЭС клеток, трансфицированных pMT-NGF и pcNGF, выделялась геномная ДНК, и наличие интеграции трансгена в хромосомную ДНК определялось с помощью полимеразной цепной реакции с праймерами, комплементарными первым и последним 24 основаниям последовательности человеческого ФРН. Определение вставки трансгена в геномной ДНК из трансфицированных клеток и клеток исходной линии, приведено на рисунке 3.
Для оценки экспрессии трансгена из полученных линий выделяли тотальную мРНК. Для удаления возможной примеси геномной ДНК препараты обрабатывали 1 час ДНКазой-I (Fermentas). кДНК получали с помощью обратной транскриптазы M-MLV и неспецифического гексапраймера. Полученную кДНК использовали в качестве матрицы для ПЦР анализа. Условия ПЦР подбирались на кДНК из фибробластов легкого человека, экспрессирующих эндогенный ФРН. В качестве отрицательных контролей использовались образцы, с которыми проводились все те же операции, но при проведении обратной транскрипции не добавлялся фермент M-MLV. Определение экспрессии ФРН в клетках полученных трансгенных линиий и клетках исходной линии R1 приведено на рисунке 4. Представлены клоны с индуцибельной и конститутивной экспрессией.
Список цитированной литературы.
Promoter-activated expression of nerve growth factor for treatment of neurodegenerative diseases - Gene Therapy (1999) 6, 1648-1660 TC Wyman, CA Machida et al.
Gene transfer of trophic factors and stem cell grafting as treatments for Parkinson's disease - Neurology, (2006) 66: S89-S103 Dass B, Olanow CW, Kordower JH.
Neurotrophic growth factors for the treatment of amyotrophic lateral sclerosis: where do we stand? - Front Neurosci. (2010); 4: 32 Henriques A, Schneider A, et al.
Nerve growth factor control of neuronal expression of angiogenetic and vasoactive factors - PNAS (2001) 98 (7): 4160-4165 Laura Calzà, Rita Levi-Montalcini, et al.
A 12-base-pair DNA motif that is repeated several times in metallothionein gene promoters confers metal regulation to a heterologous gene. PNAS (1984); 81 (23): 7318-22. Stuart GW, Palmiter RD et al.
Expression of the beta-nerve growth factor gene correlates with the density of sympathetic innervation in effector organs PNAS (1984); 81: 7951-55, Shelton DL Reichaedt LF.
Directing the Differentiation of Embryonic Stem Cells to Neural Stem Cells - Dev Dyn. (2007) 236 (12): 3255-66. Chunyu Cat and Laura Grabel.
Expression of Nerve Growth Factor and trkA After Transient Focal Cerebral Ischemia in Rats - Stroke. (1998); 29: 1687-1697 - Tsong-Hai Lee; Yasuto Itoyama et al.
Induction of Midbrain Dopaminergic Neurons from Primate Embryonic Stem Cells by Coculture with Sertoli Cells - Stem Cells (2006); 24: 1695-1706. F Yue, К Sasaki et al.
Способ получения эмбриональных стволовых клеток млекопитающих, исключая человеческие, модифицированных геном фактора роста нервов человека, включающий культивирование эмбриональных стволовых клеток в среде аМЕМ с добавками глутамина, пирувата натрия, заменимых аминокислот, нуклеозидов, витаминов, меркаптоэтанола и гентамицина и 15% фетальной сыворотки коровы, рекомбинантного фактора ингибирующего лейкимию (LIF), посев клеток по 200 тысяч на 35 мм чашку, трансфекцию эмбриональных стволовых клеток векторами рМТ-NGF и pcNGF при помощи липосомального агента через 24 ч после посева, для чего среду сливают до объема 1 мл и к клеткам добавляют прединкубированную смесь 7 мкг плазмидной ДНК и метафектена, при этом соотношение ДНК-метафектен составляет 1:2 (мас./об.), и последующий отбор стабильных трансфектантов на селективной среде с неомицином, 200 ед./мл.