Способ получения рекомбинантного фрагмента плазминогена человека, обладающего антиангиогенным действием
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Предложен способ получения рекомбинантного полипептида, представляющего собой фрагмент плазминогена человека с 82 по 341 аминокислот, в клетках хозяина-подуцента E.coli. Способ позволяет получить высокий выход целевого продукта. Изобретение может быть использовано в медицинской промышленности для проведения антиангиогенной терапии. 3 з.п. ф-лы, 3 ил., 5 пр.
Реферат
Изобретение относится к области биотехнологии и представляет собой генетическую конструкцию, кодирующую биосинтез полипептида, представляющего собой фрагмент плазминогена человека с 82 по 341 аминокислоту, а также способы ренатурации и очистки этого полипептида.
Изобретение может быть использовано в медицинской промышленности для получения новых фармацевтических композиций для проведения антиангиогенной терапии.
Одной из неразрешенных проблем современной медицины остается проблема неконтролируемого клеточного роста, который приводит к развитию злокачественных опухолей. Несмотря на интенсивные исследования, в области противоопухолевой химиотерапии пока не достигнуто кардинальных успехов. Важным достижением последних лет, тем не менее, стало открытие ангиостатина - белка, способного подавлять образование кровеносной сети в солидных опухолях [O'Reilly M.S. et al. Cell, 79: 315-328 (1994)]. Важность этого процесса (ангиогенеза) для прогрессии и даже для существования солидных опухолей была экспериментально доказана Дж. Фолкманом [Folkman J. Nat Med, 1: 27-31 (1995)].
Ангиостатин позвоночных, специфический ингибитор ангиогенеза, представляет собой протеолитический фрагмент плазминогена - компонента системы фибринолиза, белка с молекулярной массой около 90 кДа. Одна из главных особенностей плазминогена - его структура, включающая пять так называемых крингл-доменов. Под крингл-доменом подразумевается особая структура полипептидной цепи, включающая около 80 аминокислотных остатков и поддерживаемая тремя дисульфидными связями. В молекуле плазминогена имеется пять таких структур, расположенных последовательно и обозначаемых номерами от 1 до 5. Ангиостатин, являясь фрагментом плазминогена, состоит из четырех крингл-доменов (К1-4); молекулярная масса его колеблется в пределах 37-42 кДа в зависимости от длины не входящих в состав крингл-доменов полипептидных группировок. Доказана мощная ингибирующая активность ангиостатина в отношении процессов, модулирующих прогрессию опухоли, и в отношении ряда типов злокачественных образований. In vitro ангиостатин ингибирует пролиферацию эндотелиальных клеток, причем проявляя специфичность, действуя лишь на эндотелиоциты сосудов, инфильтрирующие опухолевые ткани, а также ингибирует миграцию эндотелиальных клеток и образование кровеносных сосудов [Moser T.L. et al. Proc Nati Acad Sci USA, 96(6): 2811-6 (1999)]. In vivo ангиостатин вызывал значительную (90-100%) регрессию различных опухолей человека: первичные опухоли предстательной и молочной желез, опухоли толстого кишечника, при исследованиях в модельных экспериментах на мышах [O'Reilly M.S. etal. Nat Med, 2: 689-692 (1996)].
Нативный ангиостатин представляет собой продукт протеолиза плазминогена; поскольку расщеплять последний способны многие ферменты (эластаза, желатиназы А и В, стромелизин и др.), экспрессирующиеся в нормальных и особенно в непластических тканях, при протеолизе образуется не только ангиостатин, но и различные другие полипептидные фрагменты. При исследованиях их ингибирующего потенциала на культурах эндотелиальных клеток капилляров быка наибольшая ингибирующая активность была выявлена не у ангиостатина (крингл-домены 1-4, К1-4), а у фрагмента К1-3 и крингл-домена 5; однако, крингл-домен 5 имеет в сравнении с К1-3 значительно меньшее время полужизни in vivo, и поэтому мало пригоден в качестве лекарственного препарата [Cao Y. et al. J Biol Chem, 271(46): 29461-29467 (1996); Cao Y. and Xue L. Semin Thromb Hemostas, 30(1): 83-93 (2004)].
Таким образом, разработка методов получения К1-3 в достаточных для проведения доклинических испытаний количествах является важной задачей медицинской биотехнологии. Исходя из того, что получение нативного К1-3 требует значительных затрат на дорогостоящие реагенты, а также учитывая относительно высокие терапевтические дозы К1-3, представляется необходимым разработать приемлемый метод получения К1-3 с помощью генно-инженерных методов.
Однако, хотя к настоящему времени описаны системы экспрессии ангиостатина и К1-3 в бакуловирусе [Wu Z. et al. Biochem Biophys Res Commun, 236: 651-654 (1997)], дрожжах [Shepard S.R. et al. Protein Expr Purif, 20: 216-227 (2000)], эмбриональных клетках почек человека [Meneses P.L. et al. din Cancer Res, 5: 3689-3694 (1999)] и кишечной палочке [Young-Ae Joe et al. IntJ Cancer: 82: 694-699 (1999)], удовлетворительного решения данная проблема не получила. До сих пор не описано системы экспрессии, позволяющей получать биологически активный рекомбинантный К1-3 в больших количествах и в экономически целесообразной категории.
Наиболее близким по технической сущности к нашему изобретению является способ получения рекомбинатного К1-3 с помощью внедрения экспрессионного вектора рМЕТК1 в штамм-продуцент Е. coli [Young-Ae Joe et al. Int J Cancer: 82: 694-699 (1999)]. Однако при использовании данной методики был получен сравнительно низкий выход целевого протеина, а разработанная Y.-A. Joe и соавт. методика рефолдинга рекомбинантного К1-3 обеспечивает рефолдинг лишь доли продукта, что в итоге приводит к весьма низкому выходу биологически активного К1-3, что делает использование этой методики сложным и экономически невыгодным.
Изобретательской задачей является разработка способа получения рекомбинантного полипептида, представляющего собой фрагмент плазминогена человека с 82 по 341 аминокислоту и включающего крингл-домены 1-3 плазминогена человека, в клетках хозяина-продуцента (Е. coli).
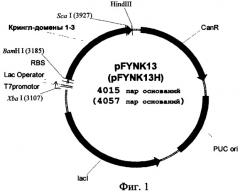
Изобретательская задача решается способом получения данного полипептида путем экспрессии его гена в в клетках Е. coli BL21 (DE3), причем экспрессию осуществляют в рекомбинантной плазмидной ДНК pFYNK13 либо в рекомбинантной плазмидной ДНК pFYNK13H в среде для роста Е. coli, сначала в отсутствие индуктора lac-промотора изопропилтио-β-D-галактопиранозида (IPTG), а по достижении мутности среды 0,4-0,6 OD - добавляя индуктор IPTG до концентрации 0,5 мМ и продолжая экспрессию под контролем индуцированного lac-промотора рекомбинантной плазмидной ДНК. Рекомбинантная плазмидная ДНК pFYNK13 имеет размер 4015 пар оснований и сдержит следующие основные элементы: ген целевого полипептида, ориджин репликации pUC ori, ген устойчивости к канамицину и ген, кодирующий lac-репрессор под контролем Т7-промотора. Рекомбинантная плазмидная ДНК pFYNK13H имеет размер 4057 пар оснований и содержит следующие основные элементы: ген целевого полипептида, ориджин репликации pUC ori, ген устойчивости к канамицину и ген, кодирующий lac-репрессор под контролем Т7-промотора, нуклеотидные последовательности, кодирующие последовательность шести остатков гистидина (His-tag) и сайт расщепления эндонуклеазой (энтерокиназой).
Схема генетических конструкций pFYNK13 и pFYNK13H представлена на фиг.1. Разработанные экспрессионные векторы несут ген, кодирующий белок, представляющий собой крингл-домены 1, 2 и 3 плазминогена человека с несколькими дополнительными аминокислотными остатками: 2 - с N-конца и 8 - с С-конца (аминокислотная последовательность представлена на фиг.2). Такая полипептидная последовательность точно соответствует аминокислотным остаткам Ser82-Glu341 плазминогена человека. В данных участках молекулы плазминогена находятся сайты протеолиза различными ферментами, в результате действия которых путем ограниченного протеолиза образуется нативный К1-3, обладающий описанной выше антипролиферативной биологической активностью; кроме того, такой выбор первичной последовательности антиангиогенного протеина обусловлен тем, что с остающимися аминокислотными «кончиками» (т.е. аминокислотными последовательностями, не формирующими структуру крингл-домена) можно проводить различные химические модификации: ковалентное присоединение антител к опухолеспецифическим антигенам, конъюгирование с противоопухолевыми антибиотиками и т.д.
Включив в состав этой генетической конструкции полинуклеотидную последовательность, связанную с геном К1-3 и кодирующую дополнительные шесть аминокислотных остатков гистидина в молекуле целевого белка (не показано на фиг.2), мы также получили рекомбинантную плазмидную ДНК, названную pFYNK13H. Такая модификация целевого белка позволяет облегчить его дальнейшую очистку, используя ионообменную хроматографию. В то же время в указанной генетической конструкции предусмотрено кодирование аминокислотной последовательности Asp-Asp-Asp-Asp-Lys в целевом белке (не показано на фиг.2), которая является сайтом протеолитического расщепления эндонуклеазой энтерокиназой, что позволяет отщеплять от очищенного с помощью ионообменной хроматографии протеина, полученного с помощью экспрессионного вектора pFYNK13H, аминокислотную последовательность из шести остатков гистидина, получая таким образом полипептид, структура которого соответствует нативному.
В рамках изобретения предлагается описание методов выделения телец включения, содержащих целевой полипептид, его ренатурации и очистки. Так, после ренатурации целевой полипептид подвергают предварительной очистке с помощью аффинной хроматографии на колонке с лизин-сефарозой, а дополнительную очистку проводят в зависимости от используемой встроенной рекомбинантной плазмидной ДНК. Дополнительную очистку целевого полипептида, полученного при культивировании клеток, трансформированных рекомбинантной плазмидной ДНК pFYNK13, осуществляют с помощью гельфильтрационной хроматографии. Дополнительную очистку целевого полипептида, полученного при культивировании клеток, трансформированных рекомбинантной плазмидной ДНК pFYNK13H, осуществляют с помощью последовательно применяемых стадий катионообменной хроматографии на агарозном носителе, ферментативного расщепления энтерокиназой и ионообменной хроматографии на сорбенте. Предлагаемый способ позволяет достичь высокого уровня экспрессии (около 65 мг целевого белка с 1 л культуральной среды) целевого полипептида.
Изобретение иллюстрируется следующими примерами
подчеркнутый фрагмент - сайт узнавания ферментом рестрикции BamHI, выделенный - HindIII.
Для создания экспрессионных векторов последовательности К13 и К13Н обрабатывали ферментами рестрикции BamHI и HindIII и лигировали с вектором pBSH2, который предварительно был обработан этими же рестриктазами. Полученные векторы назвали pFYNK13 и pFYNK13H (последний - в случае, когда целевой полипептид содержит шесть остатков гистидина).
Пример 2. Продукция целевого полипептида в штаммах Е. coli
Экспрессионный вектор pFYNK13, либо pFYNK13H, полученный как описано в примере 1, был инкорпорирован в штамм Е. coli BL-21/DE3. Для осуществления экспрессии целевого полипептида 30 мл трансфецированного штамма выдерживали при покачивании в течение 2-3 ч в среде LB при 37°С с добавлением канамицина (50 мкг/мл) и глюкозы (0,2%). Затем разбавляли эту культуру в 20 раз свежей средой LB, содержащей канамицин (40 мкг/мл) и наращивали 2-3 ч при покачивании. По достижении культуральной средой плотности OD280нм=0,5 вносили в нее изопропилтио-β-D-галактопиранозид (IPTG) до концентрации 0,5 мМ для индукции биосинтеза целевого полипептида. Затем инкубировали данную культуру около 5 ч при 37° при покачивании, центрифугировали при 10000 g в течение 15 мин, супернатант отбрасывали.
Пример 3. Ренатурация целевого полипептида
Осадок клеток, полученный как описано в примере 2, обрабатывали ультразвуком с помощью щелевого зонда в буфере А (50 мМ Трис, рН 8,0, 1 мМ ЭДТА). Полученную суспензию центрифугировали при 10000 g в течение 15 мин, супернатант отбрасывали. Осадок затем ресуспендировали в буфере Б (50 мМ Трис, рН 8,0, 1 мМ ЭДТА, 1 мМ дитиотреитол, 1% натрий N-лаурилсаркозин) и центрифугировали при 10000 g в течение 15 мин, супернатант отбрасывали. Осадок ресуспендировали в буфере В (20 мМ Трис, рН8,0, 2% натрий деоксихолат) и центрифугировали при 10000 g в течение 15 мин, супернатант отбрасывали; данную процедуру повторяли трижды. Затем полученный осадок телец включения, содержащих рекомбинантный целевой полипептид как основной компонент, растворяли в буфере Г (50 мМ трис, рН 8,0, 8 М гуанидин гидрохлорид, 70 мМ 2-меркаптоэтанол). После полного растворения осадка полученный раствор разбавляли буфером Д (50 мМ Трис, рН 8,0, 2 М мочевина, 2 мМ восстановленный глутатион, 300 мкМ окисленный глутатион, 5 мМ L-лизин гидрохлорид) в соотношении 1:30. Полученный раствор оставляли для прохождения ренатурации рекомбинантного целевого полипептида при 4°С на 24 ч. Затем раствор целевого полипептида помещали в диализные мешки с проницаемостью пор молекулярным весом 8 кДа и диализовали 8 ч против буфера Е (10 мМ натрий гидрофосфат, 15 мМ натрий хлорид, 0,02% натрий азид, рН 7,0); процедуру повторяли, сменив буфер Е.
Пример 4. Очистка целевого полипептида
Раствор целевого полипептида, полученный способом, описанным в примерах 2 и 3, наносили на хроматографическую колонку, заполненную сорбентом лизин-сефарозой, предварительно уравновешенную буфером Ж (50 мМ натрий гидрофосфат, рН 7,4). После нанесения раствора целевого белка колонку промывали двумя объемами буфера Ж, а затем буфером З (50 мМ натрий гидрофосфат, 0,15 М натрий хлорид, рН 7,4) до регистрации базовой линии. Затем элюировали рекомбинантный полипептид 0,2 М раствором ε-аминокапроновой кислоты в буфере 3. Фракции, содержащие целевой полипептид, собирали и концентрировали на мембране для ультрафильтрации (МW/=10кДа). Дальнейшую очистку целевого полипептида проводили двумя способами:
А) При очистке продукта, полученного из штамма-продуцента, трансфецированного экспрессионным вектором pFYNK13, сконцентрированные фракции наносили на хроматографическую колонку, заполненную сорбентом Sephacryl S-300 (Amersham Biosciences, USA), предварительно уравновешенную буфером И (10 мМ натрий гидрофосфат, 2,7 мМ калий хлорид, 0,137 М натрий хлорид, рН 7,4) (процедуру проводили при 4°С). Собирали фракции, содержащие очищенный целевой полипептид.
Б) При очистке продукта, полученного из штамма-продуцента, трансфецированного экспрессионным вектором pFYNK13H, к сконцентрированным фракциям добавляли натрий дигидрофосфат до конечной концентрации 20 мМ, натрий хлорид до конечной концентрации 200 мМ и имидазол до конечной концентрации 10 мМ. Очистку целевого полипептида проводили на хроматографическом сорбенте Ni-NTA-агарозе. Сорбент, помещенный в колонку, предварительно уравновешивался десятью объемами буфера К (30 мМ трис, рН 8.0, 20 мМ натрий дигидрофосфат, 30 мМ имидазол). Раствор целевого полипептида наносили на колонку и пропускали через нее буфер К до регистрации базовой линии, после чего начинали промывать колонку буфером Л (30 мМ Трис, рН 8.0, 20 мМ натрий дигидрофосфат, 150 мМ имидазол), также до регистрации базовой линии. Элюцию целевого белка проводили буфером М (30 мМ трис, рН 8.0, 20 мМ натрий дигидрофосфат, 300 мМ имидазол). Элюированные с колонки фракции, содержащие раствор целевого полипептида, концентрировали на мембране для ультрафильтрации и трижды диализовали против буфера И при 4° по 12 ч (всю описанную процедуру проводили при 4°С).
На последнем этапе проводили отщепление от целевого полипептида, полученного из штамма-продуцента, трансфецированного экспрессионным вектором pFYNK13H, аминокислотной последовательности из шести остатков гистидина. Для этого раствор с концентрацией белка инкубировали 6 ч с энтерокиназой в массовом соотношении белок:фермент=100000:1. Затем из реакционной смеси выделяли целевой полипептид, не содержащий 6×His, с помощью ионообменной хроматографии на сорбенте DEAE-Sepharose.
Пример 5. Определение биологической активности целевого полипептида
Определение биологической активности полученных препаратов целевого полипептида проводили путем оценки их способности ингибировать пролиферацию эндотелиальных клеток человека in vitro. Исследование пролиферации эндотелиальных клеток проводили описанным ранее методом [O'Reilly M. et al. Cell, 88: 277-285 (1997)]. Клетки HUVEC (эндотелиальные клетки пупочной вены человека) из монослоя трипсинизировали и ресуспендировали в среде M199, содержащей 5% фетальной бычьей сыворотки. Затем клетки рассеивали в 96-луночные планшеты, покрытые желатином, в плотности 5000 клеток в лунку. Через 24 ч добавляли раствор целевого полипептида в различных концентрациях. По прошествии 20 мин культуры клеток обрабатывались 5 нг/мл раствором основного фактора роста фибробластов (Life Technilogies Inc., USA) в присутствии гепарина (1 мкг/мл). Выживаемость клеток в контрольной и в обработанной раствором целевого полипептида группах определяли с помощью МТТ-теста через 72 ч инкубации. МТТ-тест эффективно определяет метаболитическую активность митохондрий, и его результат прямо коррелирует с числом живых клеток. Фиг.3 иллюстрирует выживаемость клеток линии HUVEC при инкубации с препаратами целевого полипептида. Как показано на фиг.3, препараты полученного целевого полипептида вызывали гибель эндотелиальных клеток человека дозозависимым образом.
1. Способ получения рекомбинантного полипептида, представляющего собой фрагмент плазминогена человека с 82 по 341 аминокислоту, заключающийся в экспрессии его гена в составе клеток Е. соli с последующим растворением полученных телец включения, ренатурацией и очисткой конечного продукта, при котором экспрессию осуществляют в клетках Е. coli BL21 (DE3), трансформированных рекомбинантными плазмидными ДНК pFYNK13 или pFYNK13H, содержащими ген целевого полипептида, ориджин репликации pUC ori, ген устойчивости к канамицину и ген, кодирующий lac-репрессор под контролем Т7-промотора, причем рекомбинантная плазмидная ДНК pFYNK13H дополнительно содержит аминокислотные последовательности НННННН (His-tag) и DDDDK (сайт расщепления энтерокиназой).
2. Способ получения рекомбинантного полипептида по п.1, заключающийся в том, что экспрессию гена осуществляют путем культивирования клеток в среде LB, содержащей 40-50 мкг/мл канамицина до уровня плотности 0,4-0,6 OD, затем продолжают культивирование в присутствии 0,5 мМ изопропилтио-β-D-галактопиранозида до накопления продукта, целевой полипептид, полученный из телец включения, подвергают ренатурации и предварительной очистке с помощью аффинной хроматографии на колонке с лизин-сефарозой, а дополнительную очистку проводят в зависимости от используемой встроенной рекомбинантной плазмидной ДНК.
3. Способ получения по пп.1 и 2, заключающийся в том, что дополнительную очистку целевого полипептида, полученного при культивировании клеток, трансформированных рекомбинантной плазмидной ДНК pFYNK13, осуществляют с помощью гельфильтрационной хроматографии с участием сорбента Sephacryl S-300.
4. Способ получения по пп.1 и 2, заключающийся в том, что дополнительную очистку целевого полипептида, полученного при культивировании клеток, трансформированных рекомбинантной плазмидной ДНК pFYNK13H, осуществляют с помощью последовательно применяемых стадий катионообменной хроматографии на агарозном носителе, ферментативного расщепления энтерокиназой и ионообменной хроматографии на сорбенте DEAE-Sepharose.