Способ количественного определения йода методом инверсионной вольтамперометрии
Иллюстрации
Показать всеИзобретение относится к электрохимическим методам анализа, а именно к катодному инверсионно-вольтамперометрическому способу определения йода в пищевых продуктах и продовольственном сырье, и может быть использовано в пищевой, медицинской, фармакологической промышленности и сельском хозяйстве. Способ количественного определения йода включает перевод из пробы в раствор всех форм йода в виде йодид-ионов и вольтамперометрическое определение, при этом накопление йодид-ионов в перемешиваемом растворе проводят на серебряном электроде в течение 10-20 с при потенциале электролиза Еэ, равном 0,00±0,05 В относительно хлоридсеребряных электродов на фоне 0,1 моль/дм3 раствора сернокислого гидразина с последующей регистрацией катодного пика в дифференциально-импульсном режиме съемки вольтамперограмм при скорости развертки потенциала 20 мВ/с, концентрацию йодид-ионов определяют по высоте пика в диапазоне потенциалов (-0,40±0,05)В методом добавок аттестованных смесей. Изобретение обеспечивает возможность применения электродов из нетоксичного материала и определение йодид-ионов методом катодной инверсионной вольтамперометрии в присутствии растворенного кислорода без дополнительного введения в фоновый электролит восстановителя. 1 ил., 1 табл., 2 пр.
Реферат
Изобретение относится к электрохимическим методам анализа, а именно к катодному инверсионно - вольтамперометрическому способу определения йода в пищевых продуктах и продовольственном сырье, и может быть использовано в пищевой, медицинской, фармакологической промышленности и сельском хозяйстве.
Известен способ (прототип) определения массовой концентрации йода в безалкогольных напитках; минеральных питьевых, лечебных, лечебно-столовых и природных столовых водах; дрожжах, хлебе и хлебобулочных изделиях; поваренной и лечебно-профилактической солях; молоке, кисломолочных и жировых продуктах методом инверсионной вольтамперометрии (ИВ) [ГОСТ Р 52689-2006. Продукты пищевые. Инверсионно-вольтамперометрический метод определения массовой концентрации йода. - М.: Стандартинформ, 2006, с.25]. Количественный химический анализ йода заключается в ИВ-измерении массовой концентрации йодид-ионов в растворе подготовленной пробы. Для перевода всех форм йода в электрохимически активную форму (йодид-ион) и устранения мешающего влияния присутствующих в пробе органических веществ проводят щелочное окислительное плавление с последующей нейтрализацией раствора и восстановлением аскорбиновой кислотой окисленных форм йода до йодида.
ИВ-измерения основаны на способности йодид-ионов накапливаться на поверхности ртутно-пленочного электрода в течение 30-180 с ( рН≈2-3) в виде малорастворимого соединения со ртутью (Hg2I2) при потенциале электролиза 0,0 В с последующим катодным восстановлением осадка при постоянно-токовом или дифференциально-импульсном режимах изменения потенциала со скоростью 20-30 мВ/с от 0,0 до минус 1,2 В. Аналитическим сигналом является величина катодного тока пика при потенциале (-0,30±0,05) В. В качестве вспомогательного электрода и электрода сравнения использованы хлоридсеребряные электроды (ХСЭ), а в качестве фонового электролита - 0,1 моль/дм3 раствор нитрата калия (рН 2-3) с добавкой 0,02 г сухого порошка аскорбиновой кислоты. Мешающее влияние растворенного кислорода устранено пропусканием через электролит инертного газа. Массовая концентрация йодид-ионов рассчитана по методу добавки аттестованной смеси йодид-ионов. Диапазон измерения массовых концентраций йода в различных типах вод от 0,005 до 1,5 мг/дм3 в продуктах более сложного состава от 0,05 до 100 мг/кг.
Предложенный в прототипе ртутно-пленочный электрод требует обновления или нанесения пленки ртути, что не только неудобно, но и не безопасно при проведении серийных анализов.
В литературе определению йодид-ионов методами вольтамперометрии уделяется большое внимание. Значительная доля работ выполнена на ртутном или ртутно-пленочном электродах, однако, токсичность ртути, особенно трудности с ее утилизацией, ставят перед аналитиками задачи поиска электродов из нетоксичных материалов.
Задачей заявленного изобретения является применение электродов из нетоксичного материала и определение йодид-ионов методом катодной инверсионной вольтамперометрии в присутствии растворенного кислорода без дополнительного введения в фоновый электролит восстановителя.
Поставленная задача достигается тем, что способ количественного определения йода включает перевод из пробы в раствор всех форм йода в виде йодид-ионов и вольтамперометрическое определение с использованием серебряного индикаторного электрода. При этом накопление йодид-ионов в перемешиваемом растворе проводят в течение 10-20 с при потенциале электролиза (0,0±0,05)В относительно хлоридсеребряных электродов на фоне 0,1 моль/дм3 раствора сернокислого гидразина с последующей регистрацией катодных пиков в дифференциально-импульсном режиме съемки вольтамперограмм при скорости развертки потенциала 20 мВ/с. Концентрацию йодид-ионов определяют по высоте пика в диапазоне потенциалов (-0,4±0,05) В методом добавок аттестованных смесей.
В аналогичных работах [Александрова Т.П., Клетеник Ю.Б. Прямая вольтамперометрия галогенид-ионов на обновляемых твердых электродах // Журн. аналит. Химии. 1998. Т.53, №7, с.744-748; Александрова Т.П., Клетеник Ю.Б. Инверсионная вольтамперометрия бромид- и йодид-ионов на обновляемом серебряном электроде // Журн. аналит. Химии. 2000. Т. 55, № 6, с. 655-658] описано определение йодид-ионов на серебряном электроде, обновляемом срезанием тонкого поверхностного слоя толщиной 0,5 мкм с помощью гексанитового ножа непосредственно в анализируемом растворе перед каждым наложением потенциала накопления. Авторами изучена возможность ИВ-определения йодид-ионов в различных фоновых электролитах: 0,05 М растворе H2S04, а также в 0,1 М растворах K2SO4, NaNO3, НСlO4, NaClO4, CH3COONa и NaOH без дополнительного добавления восстановителей. Раствор перед накоплением перемешивали потоком воздуха, направленным снизу на рабочую поверхность электрода. В качестве электрода сравнения использовали насыщенный каломельный или меркурсульфатный электроды, в качестве вспомогательного - графитовый стержень. Нужно отметить, что тип электрода сравнения оказывает влияние на потенциал пика йодид-ионов. Например, как показано в аналогах, на фоне 0,05 М раствора Н2SO4 при использовании меркурсульфатного электрода сравнения потенциал пика йодид-ионов равен минус 0,63 В, а для насыщенного каломельного электрода - минус 0,15 В.
В работе [Александрова Т.П., Скворцова Л., Кирюшов В.Н. Электрохимическое поведение гидразина на механически обновляемых твердых электродах // Журн. аналит. Химии. 2008. Т. 63, № 10, с. 1091-1096 ] методом анодной и циклической вольтамперометрии с линейной разверткой потенциала изучено окисление гидразина в фоновых растворах H2SO4, Na2SO4 и КОН на различных электродах, в том числе и на серебряном. Показано, что сигналы окисления гидразина обнаружены только в щелочных растворах.
В предлагаемом способе установлена способность йодид-ионов адсорбироваться и электровосстанавливаться на поверхности индикаторного серебряного электрода в виде AgI. В качестве электрода сравнения и вспомогательного электрода использованы хлоридсеребряные электроды. Подготовка серебряного электрода заключается в механической полировке на фильтровальной бумаге или, в исключительных случаях, погружением на 5-7 с в 1 М раствор азотной кислоты с последующей промывкой в дистиллированной воде. Перемешивание раствора осуществляется механической вибрацией электродов.
Абсолютной новизной является экспериментально установленный фоновый электролит - 0,1 моль/дм3 раствора сернокислого гидразина ( рН 2-3), который позволяет с хорошей воспроизводимостью проводить ИВ-измерения в присутствии растворенного кислорода без дополнительного введения восстановителя (в прототипе - аскорбиновая кислота).
Другим отличительным признаком является использование трех-электродной ячейки: индикаторный электрод - серебряный; вспомогательный и сравнения - хлоридсеребряные электроды. Предварительный электролиз при потенциале (0,0±0,05) В с последующим катодным растворением осадка позволяет регистрировать вольтамперограммы с четко выраженным максимумом при значении потенциала (-0,4±0,05)В, в прототипе (-0,30±0,05) В.
Предлагаемый вольтамперометрический способ позволил сократить количество используемых реактивов, исключить использование ртути и дополнительного введения восстановителя, а также проводить измерения в присутствии растворенного кислорода. Диапазон измерения массовых концентраций йода в различных типах вод от 0,003 до 1,5 мг/дм3, в продуктах более сложного состава от 0,05 до 100 мг/кг. Относительное стандартное отклонение (Sr) не более 20%.
Измерения проводили на компьютеризованных вольтамперометрических анализаторах СТА и СТА - элемент (OOO «ИТМ», г.Томск).
Определению не мешают вещества, присутствие которых возможно в водах, пищевых продуктах, кормах, кормовых добавках, фармпрепаратах и биологических объектах: Zn, Co, Ni, Pb, Cu, Hg, Fe в соизмеримых количествах.
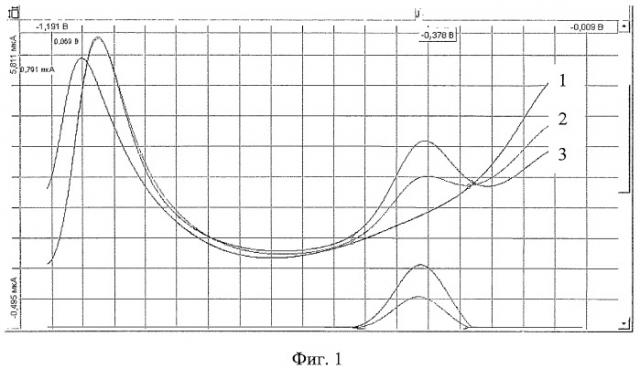
Пример 1. Определение содержания йодид-ионов на уровне 0,01 мг/дм3.
В кварцевый стаканчик вместимостью 25 см3 с помощью пипетки или дозатора вносят 10 см3 раствора фонового электролита, которым является раствор сернокислого гидразина молярной концентрации 0,1 моль/дм3. Стаканчик с раствором помещают в электролитическую ячейку. Опускают в раствор электроды (индикаторный - серебряный, вспомогательный и сравнения - хлоридсеребряные). Проводят электронакопление при потенциале (0,0±0,05)В в течение 10-20 с при перемешивании раствора. По окончании электролиза начинают регистрацию вольтамперограммы в диапазоне потенциалов от 0,0 до минус 1,2 В ( Фиг.1, график 1). Отсутствие пиков свидетельствует о чистоте фона. Затем добавляют 0,01 см3 стандартного раствора йодида калия концентрации 10 мг/дм и проводят электронакопление при потенциале (0,0±0,05)В в течение 10-20 с при перемешивании раствора с последующей регистрацией вольтамперограммы в диапазоне потенциалов от 0,0 до минус 1,2 В. Потенциал катодного пика йодид-ионов находится в диапазоне (-0,4±0,05) В (отн. ХСЭ) ( Фиг.1, график 2). Далее в стаканчик с анализируемым раствором с помощью дозатора вносят добавку аттестованной смеси йодид-иона в объеме 0,01 см3 концентрацией 10 мг/ дм3. Электронакопление и регистрацию аналитического сигнала проводят в тех же условиях (Фиг.1, график 3).
Расчет содержания йодид-ионов в анализируемой пробе проводится по формуле:
где:
X1 - массовая концентрация элемента в анализируемой пробе, мг/кг (мг/дм3)
C∂ - концентрация АС, из которой делается добавка к анализируемой пробе, мг/дм3;
V∂ - объем добавки АС элемента, см3;
I1 - величина максимального анодного (для мышьяка) или катодного (для селена) тока элемента в анализируемой пробе, А;
I2 - величина максимального катодного тока йодид-ионов в пробе с добавкой АС, А;
m - масса (объем) пробы, взятая для анализа, г (см3);
Vал - объем аликвоты, взятой для анализа из минерализата, см3;
Vмин - объем минерализата, полученного растворением золы в известном объеме растворителя, см3.
Если для анализа берется вся проба, то Vмин/Vал равно 1.
Пример 2. Определение содержания йода в биологически активной добавке «Гумитон».
Навеску (0,2±0,002) г тщательно перемешанной пробы помещают в кварцевый стаканчик объемом 25 см3, добавляют 1,0 см3 раствора гидроокиси калия или натрия концентрации 2,5 моль/дм3 и 2 см3 раствора калия азотнокислого молярной концентрации 0,5 моль/дм3. Пробу в стаканчике хорошо перемешивают стеклянной палочкой и помещают в комплекс пробоподготовки «Темос-экспресс» (OOO «ИТМ», г.Томск) с температурой 130°С до полного высушивания массы. После этого температуру увеличивают до 200°С, выдерживают при этой температуре в течение 10 мин, затем увеличивают до 300°С, выдерживая пробу 10 мин; и наконец до (480÷500)°С, выдерживая пробу при этой температуре 15 мин. Стаканчики с осадком вынимают и охлаждают, добавляют 9-10 см3 0,1 М раствора сернокислого гидразина, серной кислоты, доводят кислотность раствора до рН 2-3, контролируя по индикаторной бумаге.
Электронакопление и регистрацию аналитического сигнала проводят в тех же условиях. Содержания йодид-ионов в анализируемой пробе оценивают методом добавок аттестованных смесей, измеряя высоту катодных пиков по формуле (1). В таблице представлены результаты сравнения способов измерения количества йодид-ионов в биологической активной добавке из торфа «Гумитон» (P=0,95, n=3). Как видно из таблицы, совпадение результатов показывает, что предлагаемый способ измерения не уступает по точности измерения способу, изложенному в прототипе.
Предложенный способ прост, не требует большого количества реактивов и трудозатрат и может быть приемлем в любой химической лаборатории, особенно в настоящее время, когда налажен выпуск отечественной и зарубежной электроаппаратуры с контрольным управлением и обработкой данных (анализаторы типа СТА, ТА и др.). Предложенный способ может быть использован в фармацевтических исследованиях, пищевой промышленности, сельском хозяйстве для разработки методик анализа йодид-ионов в различных типах вод, биологических объектах и сложных многокомпонентных матрицах.
Способ количественного определения йода методом инверсионной вольтамперометрии
| Таблица | |
| Результаты вольтамперометрического определения йодид-ионов в обогащенной йодидом калия биологической активной добавке из торфа «Гумитон» (Р=0,95, n=3) | |
| Метод измерения | Содержание йодид-ионов, мг/кг |
| Прототип (ГОСТ Р 52689 - 2006) | 37±9 |
| Предлагаемый способ | 37±7 |
Способ количественного определения йода, включающий перевод из пробы в раствор всех форм йода в виде йодид-ионов и вольтамперометрическое определение, отличающийся тем, что накопление йодид-ионов в перемешиваемом растворе проводят на серебряном электроде в течение 10-20 с при потенциале электролиза Еэ, равном 0,00±0,05 В, относительно хлоридсеребряных электродов на фоне 0,1 моль/дм3 раствора серно-кислого гидразина с последующей регистрацией катодного пика в дифференциально-импульсном режиме съемки вольтамперограмм при скорости развертки потенциала 20 мВ/с, концентрацию йодид-ионов определяют по высоте пика в диапазоне потенциалов (-0,40±0,05)В методом добавок аттестованных смесей.